È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Trans-vivo Delayed Type Ipersensibilità Assay per Antigen regolamento specifico
In questo articolo
Riepilogo
Descriviamo un test diagnostico prezioso che potrebbe potenzialmente essere utilizzato per decidere il ritiro di immunosoppressione dopo trapianto senza elevato rischio di rigetto del trapianto. Il test utilizza i principi di ipersensibilità di tipo ritardato e fornisce una valutazione accurata del donatore risposte immunitarie effettrici e normativi specifici montati dai destinatari.
Abstract
Risposta di ipersensibilità di tipo ritardato (DTH) è un rapido in manifestazione in vivo della risposta immunitaria delle cellule T-dipendente ad un antigene estraneo (Ag), che il sistema immunitario ospite ha sperimentato nel recente passato. Reazioni DTH sono spesso divisi in una fase di sensibilizzazione, riferendosi all'esperienza iniziale antigene, e una fase sfida, che segue solitamente parecchi giorni dopo la sensibilizzazione. La mancanza di una risposta di ipersensibilità di tipo ritardato per un richiamo Ag dimostrato da test cutaneo è spesso considerato come una prova di anergia. Il dosaggio DTH tradizionale è stato usato efficacemente nel diagnosticare infezioni microbiche molti.
Nonostante la condivisione funzioni immunitarie simili come infiltrazione linfocitaria, edema e necrosi tissutale, il DTH diretto non è una tecnica diagnostica fattibile in pazienti trapiantati causa della possibilità di iniezione diretta conseguente sensibilizzazione ad antigeni donatori e perdita del trapianto. Per evitare questo problema, il ronziouno-a-mouse "trans-vivo" test DTH è stato sviluppato 1,2. Questo test è essenzialmente un trasferimento di test DTH, in cui il sangue cellule umane mononucleate periferiche (PBMC) e gli antigeni specifici sono stati iniettati per via sottocutanea nei padiglioni auricolari o zampa di un topo ingenua e DTH-come gonfiore viene misurata dopo 18-24 ore 3. La presentazione dell'antigene da cellule presentanti l'antigene umano come i macrofagi o DCS a cellule T nei tessuti altamente vascolare del mouse attiva la cascata infiammatoria e attrae le cellule immunitarie del mouse con conseguente risposte gonfiore. La risposta è antigene-specifici e richiede preventiva antigene sensibilizzazione. Una risposta DTH donatore-reattiva positiva nel test Tv-DTH riflette che il paziente trapiantato ha sviluppato una disposizione immunitaria pro-infiammatoria verso alloantigeni innesto.
La caratteristica più importante di questo saggio è che può anche essere utilizzato per rilevare le cellule T regolatorie, che causano la soppressione astanti. Soppressione di un astanteDTH risposta richiamo alla presenza di antigeni del donatore è caratteristica di trapianto di rene-accettati 2,4-14. Il monitoraggio dei pazienti trapiantati per alloreattività e regolazione con Tv-DTH può identificare un sottogruppo di pazienti che potrebbero trarre beneficio dalla riduzione di immunosoppressione senza elevato rischio di rigetto o di deterioramento della funzione renale.
Un'area promettente è l'applicazione del saggio Tv-DTH nel monitoraggio di autoimmunità 15,16 e anche in immunologia tumorale 17.
Protocollo
1. Preparazione di linfociti
- Prelevare il sangue in (acido citrato destrosio) tubi di ACD.
- Isolare PBMC da sangue periferico umano fresco utilizzando linfociti di separazione medio secondo metodi standard.
- Lavare le PBMC tre volte con PBS per rimuovere le piastrine contaminanti. Le piastrine sono risultati interferire con test DTH trans-vivo. Massima ammissibile di contaminazione delle piastrine di preparazione PBMC è ≤ 1x10 7 / iniezione.
- Se vi è una contaminazione del globulo rosso evidente, lisi dei globuli rossi utilizzando tampone di lisi ACK dopo primo lavaggio. Rimuovere il tampone ACK lavando due volte con PBS.
2. Preparazione di alloantigene
- Isolare PBMC dal sangue periferico del donatore utilizzando la procedura sopra riportata.
- Risospendere donatore PBMC in PBS ad una concentrazione di 120x10 6 cellule / ml (4x10 6 cellule / 30 microlitri).
- Aggiungere 1 mM PMSF alla miscela per impedire proteinedegradazione.
- Sonicare la sospensione cellulare con sette impulsi di 1 secondo con un mm-sonda Sonicatore 2. (Nota: Tenere il freddo materiale ed evitare bolle eccessive Se schiuma accade, lasciare la sospensione cellulare sedersi su ghiaccio per un 2-3 min.).
- Verificare l'interruzione del> 90% delle cellule utilizzando un emocitometro.
- Centrifugare la miscela a 14.000 rpm a 4 ° C per 20 min in microcentrifuga refrigerata.
- Trasferire il surnatante in una nuova provetta Safe-Lock 2.0 e determinare la concentrazione di proteine.
3. Preparazione delle cellule per preparazioni iniettabili
- Per ciascuna aliquota iniezione 7x10 6 PBMC in provette Safe-Lock da 2,0 ml.
- Centrifugare a 6000 rpm per un minuto in microcentrifuga e rimuovere il surnatante.
- Risospendere le cellule in PBS con o senza antigeni. Regolare il volume di iniezione di 35 ml con PBS. Il seguente schema è usato per le iniezioni:
Controllo negativo: PBMC + PBS
Controllo positivo: PBMC + TT / DT (25 & mu; G / iniezione)
Sperimentale Antigen Specific Risposta: PBMC + test di Ag (4-8 mg / iniezione)
Sperimentale Antigen regolamento specifico: PBMC + test di Ag + TT / DT
4. Pre-misura, iniezione e post-misurazione
- Anestetizzare CB17 SCID mouse con isoflurano. Misurare lo spessore zampa posteriore utilizzando una pinza a molla. Mettere pinza al centro del cuscinetto plantare, con un bordo di toccare l'ultimo pad camminata del piede, per fornire un punto di riferimento per mantenere il sito di misura costante. Spessore zampa è registrato quando manometro si è stabilizzata.
- Iniettare lentamente sospensioni cellulari per via sottocutanea nei cuscinetti plantari dei topi utilizzando ½ cc siringhe da insulina con ago 28-gauge. Eseguire l'iniezione con l'ago rivolto verso le dita dei piedi, e lo smusso rivolto verso l'alto. (Nota: assicurarsi che non ci siano perdite).
- 18-24 ore dopo l'iniezione, anestetizzare il mouse con la misura isoflurano e ripetizione della zampa gonfiore.
- Subtragire lo spessore di ogni zampa prima dell'iniezione dal valore dopo l'iniezione per ottenere il valore gonfiore zampa, esprime i dati in unità di 10 -4 pollici. Calcolare l'antigene-specifica gonfiore netta sottraendo il controllo footpad gonfiore (PBMC + PBS) dai valori gonfiore zampa ottenuti dai trattamenti (PBMC + donatore alloantigene, TT / DT, o donatore alloantigene + TT / DT). Una risposta positiva di controllo per richiamare l'antigene TT / DT di ≥ 25x10 pollici -4 oltre risposta di fondo a PBS è necessario per il test per essere considerato valido.
- Determinare l'inibizione di risposte di richiamo in presenza di antigeni donatori confrontando il gonfiore netto di ogni iniezione utilizzando la seguente formula:
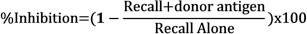
Risultati
1. Valutazione del trapianto di rene per la risposta antigene-specifica donatore utilizzando test Tv-DTH
Per testare il donatore-reattiva immunità cellulare nel trapianto di rene abbiamo iniettato PBMC di questi pazienti con antigeni del donatore da soli o con un richiamo antigene tossoide tetanico (TT). Come i pozzetti di controllo positivo sono stati iniettati con sola TT. Osserviamo tre modelli principali di ipersensibilità di tipo ritardato nei pazienti trapiantati (Figura 1).
Discussione
Il saggio DTH trans-vivo è un test diagnostico romanzo con un potenziale applicazione clinica nella valutazione risposte mediate da cellule nel trapianto, cancro e pazienti autoimmuni. E 'prezioso perché non solo è utile nel monitoraggio delle risposte effettrici richiamo T, ma anche in grado di rilevare le risposte T regolatorie. Un modo affidabile per rilevare regolamento DTH umano potrebbe predire la sicurezza di recesso dell'immunosoppressione in pazienti che sono candidati per studi clinici in monoterapi...
Divulgazioni
Gli autori di questo manoscritto non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Gli autori vorrebbero riconoscere i contributi di AM VanBuskirk allo sviluppo della nostra comprensione della risposta DTH regolamentato nei destinatari del trapianto. Questo lavoro è stato supportato sovvenzioni NIH PO1AI084853 e R01AI066219-06, e dalla UE sponsorizzato uno studio.
Materiali
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
Riferimenti
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon