JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
항원 특정 규제 트랜스 생체 지연 형 과민 분석
요약
우리는 잠재적으로 이식 거부의 높은 위험없이 이식 후 면역 억제제의 철수를 결정하는 데 사용할 수있는 유용한 진단 분석을 설명합니다. 분석은 지연 형 과민 반응의 원리를 사용하여받는 사람이 탑재 된 두 기증자 특정 이펙터 및 규제 면역 반응의 정확한 평가를 제공합니다.
초록
지연 형 과민 반응 (DTH)은 숙주 면역 시스템은 최근 과거에 경험있는 외국 항원 (자세)에 대한 T 세포 의존 면역 반응의 생체 징후의 급격한입니다. DTH 반응은 종종 일반적으로 감작 후 몇 일 뒤에 초기 항원 경험과 도전 단계를 참조 감작 단계로 구분됩니다. 피부 테스트에 의해 입증 리콜 AG의 지연 형 과민 반응의 부족은 종종 anergy의 증거로 간주됩니다. 기존의 DTH 분석을 효과적으로 많은 미생물 감염을 진단하는 데 사용되었습니다.
이러한 림프구 침윤, 부종 및 조직 괴사와 유사한 면역 기능을 공유에도 불구하고, 직접 DTH 때문에 기증자의 항원 및 이식 손실 감작의 결과로 직접 분사의 가능성 이식 환자에서 가능한 진단 기술이 아니다. 이 문제를 방지하려면, 험투 마우스 "트랜스 생체"DTH 분석은 1,2 개발되었다. 이 테스트는 인간의 말초 혈액 단핵 세포 (말초 혈액) 및 특정 항원 pinnae에 피하 주사 또는 순진 마우스와 DTH와 같은 부종의 노상 18-24 시간 후 3 측정 된에 기본적으로 전송 DTH 분석이다. 식세포 나 높은 혈관 마우스 조직에서 T 세포 수지상 인간 항원 제시 세포에 의해 항원 프레 젠 테이션 염증 폭포를 트리거하고 붓기 반응의 결과로 마우스 면역 세포를 끈다. 반응은 항원 특이하고 사전 항원 감작이 필요합니다. TV-DTH 분석에 긍정적 인 기증자 반응 DTH 반응은 이식 환자는 이식 alloantigens 향해 염증성 면역 처리를 개발했다고 반영합니다.
이 분석의 가장 중요한 기능은 또한 방관자 억제를 일으키는 원인이 규제 T 세포를 감지하는 데 사용할 수 있다는 것입니다. 의 방관자 억제기증자의 항원의 존재 DTH 리콜 응답 허용 이식 2,4-14와 이식의 특징입니다. TV-DTH에 의해 alloreactivity 및 규제에 대한 이식의 모니터링은 거부 또는 악화 신장 기능의 높은 위험없이 면역 억제제의 감소 혜택을 누릴 수있는 환자의 하위 집합을 식별 할 수 있습니다.
유망한 지역은자가 면역 15,16의 모니터링 또한 종양 면역학 17 TV-DTH 분석의 응용 프로그램입니다.
프로토콜
1. 림프구의 준비
- ACD (산성 구연산 포도당) 튜브에 혈액을 수집합니다.
- 표준 방법에 따라 림프구 분리 매체를 사용하여 신선한 인간의 말초 혈액에서 PBMC를 분리합니다.
- 오염 혈소판을 제거하는 PBS로 PBMC 세 번 씻으십시오. 혈소판은 트랜스 생체 DTH 분석을 방해 발견되었다. PBMC 준비의 최대 허용 혈소판 오염 ≤ 1X10 7 / 주입이다.
- 눈에 띄는 적혈구 오염이있는 경우, 첫 번째 세척 후 ACK 용해 버퍼를 사용하여 적혈구의 용해를 수행합니다. PBS로 2 회 세척하여 ACK 버퍼를 제거합니다.
2. Alloantigen의 준비
- 위와 같이 프로 시저를 사용하여 기증자의 말초 혈액에서 PBMC를 분리합니다.
- 120x10 6 세포 / ㎖의 농도 (4X10 6 세포 / 30 μL)에서 PBS에서를 Resuspend 기증자 PBMC.
- 단백질을 방지하기 위해 혼합물에 1 μM PMSF 추가분해.
- 2 MM-프로브 sonicator로 일곱 1 초 펄스를 사용하여 세포 현탁액을 초음파 처리. (주 : 물자 감기를 유지하고 과도한 거품을 방지 거품이 발생하면, 세포 현탁액은 2 ~ 3 분 동안 얼음에 앉아 보자..)
- 혈구를 사용하여 세포의> 90 %의 중단을 확인합니다.
- 냉장의 microfuge에서 20 분 동안 4 ° C에서 14,000 rpm으로 혼합물을 원심 분리기.
- 새로운 2.0 ML 안전 잠금 튜브에 뜨는을 전송하고 단백질 농도를 결정한다.
3. 주사에 대한 세포의 준비
- 2.0 ML 안전 잠금 튜브에 각각 주입 나누어지는 7X10 6 PBMC합니다.
- 의 microfuge에서 분 동안 6,000 rpm으로 원심 분리하여 그 상등액을 제거합니다.
- PBS에서 함께 또는 항원이없는 세포를 resuspend을. PBS로 35 μL를 주입 볼륨을 조정합니다. 다음 계획은 주사에 사용됩니다 :
부정적인 제어 : PBMC + PBS
긍정적 인 제어 : PBMC + TT / DT (25 & 무; G / 주입)
실험 항원 특정 응답 : PBMC + 시험 자세 (4-8 ㎍ / 주입)
실험 항원 특정 규정 : PBMC + 시험 자세 + TT / DT
4. 사전 측정, 주입 및 사후 측정
- isoflurane을 함께 CB17 SCID 마우스를 마취. 스프링 캘리퍼스를 사용하여 후면 발바닥의 두께를 측정한다. 측정 부위의 일관성을 유지하기 위해 벤치 마크를 제공하기 위해, 하나의 가장자리 다리의 마지막 산책 패드를 만지고, 발바닥의 중심에서 캘리퍼를 넣어. 게이지 판독 값이 안정 될 때 발바닥의 두께가 기록됩니다.
- 천천히 28 게이지 바늘 ½ CC 인슐린 주사기를 사용하여 쥐의 발바닥에 피하 세포 현탁액을 주입. 바늘 발가락 향하게하고, 경사가 위를 향하도록 주입을 수행합니다. (참고 : 누수가 없는지 확인).
- 주사 후 18 ~ 24 시간은, 발바닥 부종의 isoflurane을 반복 측정에 마우스를 마취.
- Subtr발바닥 부종 값을 가져 포스트 분사 값에서 주입 전 각 발바닥의 두께 행동, 10 -4 인치의 단위로 데이터를 표현한다. 치료 (PBMC + 기증자 alloantigen, TT / DT, 또는 기증자 alloantigen + TT / DT)에서 얻은 발바닥 부종 값에서 제어 발바닥 부종 (PBMC + PBS)를 뺀 항원 특이 그물 붓기를 계산합니다. PBS에 배경 응답을 통해 ≥ 25X10 -4 인치의 항원 TT / DT를 호출하는 긍정적 인 제어 응답이 유효한 것으로 간주되는 테스트가 필요합니다.
- 다음 공식을 사용하여 각 주사의 순 붓기를 비교하여 기증자의 항원의 존재 리콜 반응의 억제를 확인합니다 :
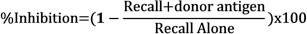
결과
1. TV-DTH 분석을 사용하여 기증자의 항원에 특정한 응답 신장 이식의 평가
신장 이식 기증자 반응 세포 성 면역을 테스트하기 위해 우리는 기증자의 항원 단독으로 또는 리콜 항원 파상풍 톡소이드 (TT)를 가진 환자의 PBMC를 주입했다. 양성 대조군 세포는 TT 형과 주입으로. 우리는 이식 지연 형 과민 반응의 세 가지 패턴 (그림 1)을 관찰합니다. 모든 환자는 자세 (TT)를...
토론
트랜스 생체 DTH 분석은 이식, 암,자가 면역 질환 환자에서 세포 매개 반응을 평가하는 잠재적 인 임상 응용 프로그램과 새로운 진단 테스트입니다. 이 리콜 T 이펙터 반응을 모니터링하는 데 유용뿐만 아니라 때문에 가치가있다,뿐만 아니라 그것은 T 규제 응답을 검색 할 수 있습니다. 인간의 DTH 규제를 감지하는 신뢰할 수있는 방법은 단독 요법 또는 내성 시험에 대한 후보자 환자에서 면역 억제 ?...
공개
이 논문의 저자가 공개하는 관심 없음 충돌이 없습니다.
감사의 말
저자는 이식 규제 DTH 반응에 대한 우리의 이해의 발전에 AM VanBuskirk의 기여를 인정하고 싶습니다. 이 작품은 NIH 보조금에게 PO1AI084853 및 R01AI066219-06을 지원하고, EU가 후원 한 연구가 있었다.
자료
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
참고문헌
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유