Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Antijen Özgül Düzenleme için Trans-vivo Gecikmeli Tip Aşırı Duyarlılık Testi
Bu Makalede
Özet
Biz potansiyel greft reddi yüksek riski olmadan nakli sonrası immünsüpresyonun sonlandırmaya karar için kullanılabilecek değerli bir tanı testi açıklar. Tahlil Gecikmeli Tip Aşırı duyarlılık ilkelerini kullanır ve alıcılar tarafından monte hem donör özel efektör ve düzenleyici immün yanıtın doğru bir değerlendirme sağlar.
Özet
Gecikmiş tip hipersensitivite cevabı (DTH) konak bağışıklık sistemi son geçmişte sahip olduğu, bir yabancı antijen (Ag), T hücre-bağımlı bağışıklık tepkisini in vivo tezahürü bir hızlıdır. DTH reaksiyonlar genellikle genellikle hassasiyete birkaç gün sonra aşağıdaki ilk antijen deneyim ve bir meydan okuma faz, atıfta, bir hassasiyete faz ayrılır. Deri testleri gösterdiği bir geri çağırma Ag için bir gecikmiş tip aşırı duyarlılık yanıt eksikliği genellikle anerji bir kanıtı olarak kabul edilir. Geleneksel DTH tahlilinde etkili birçok mikrobik enfeksiyonların teşhis kullanılmıştır.
Bu lenfosit infiltrasyonu, ödem ve doku nekrozu gibi benzer bağışıklık özellikleri paylaşan rağmen, doğrudan DTH çünkü donör antijenleri ve greft kaybına hassasiyete neden direkt enjeksiyon olasılığı nakli hastalarında uygun bir tanı yöntemidir değildir. Bu sorunu önlemek için, uğultubir-ile-fare "trans-vivo" DTH tahlilinde 1,2 geliştirilmiştir. Bu test, insan periferal kan tek-çekirdekli hücreleri (PBMC) ve özgül antijen memelerine harici deri altından enjekte edilmiş ya da saf bir fare ve DTH benzeri şişme ayak tabanına 18-24 saat sonra ölçülür 3 edildiği, esas olarak bir transfer DTH deneyidir. Makrofajlar ya da son derece vasküler dokuda fare T hücrelerine DC'ler gibi insan hücreleri tarafından antijen sunan antijen sunumu inflamatuar kademeli tetikler ve şişme yanıta sebep fare bağışıklık hücrelerinin çekmektedir. Tepkisi antijene özgü olan ve daha önceki antijen sensitizyonundan gerektirir. Tv-DTH tayininde pozitif donör-reaktif DTH yanıt nakli hasta organ antijenlerdir doğru bir pro-inflamatuar immün eğilim geliştirdiği yansıtır.
Bu testin en önemli özelliği, aynı zamanda bir seyirci baskılamaya neden düzenleyici T hücreleri tespit etmek için kullanılabilir olmasıdır. A seyirci bastırmaDonör antijen varlığında DTH hatırlama yanıt kabul allogreftler 2,4-14 ile nakli özelliğidir. Tv-DTH tarafından alloreaktivitesini ve düzenleme için nakli takibi reddine veya bozulan böbrek fonksiyonlarının yüksek riski olmadan immünsüpresyonun azalma yararlanabilecek hasta alt tanımlayabilir.
Ümit vaad eden bir alan otoimmünite 15,16 izlenmesi ve aynı zamanda tümör immünoloji 17 TV-DTH testinin uygulanmasıdır.
Protokol
1. Lenfositlerin hazırlanması
- ACD (Asit Sitrat Dekstroz) tüplere kan toplayın.
- Standart yöntemlere göre, lenfosit ayırma ortamı kullanılarak taze insan periferal kandan PBMC izole edin.
- Kirlenmesine trombosit çıkarmak için PBS ile PBMC üç kez yıkayın. Trombositler trans-vivo DTH tahlilinde müdahale bulunmuştur. PBMC hazırlık maksimum izin verilen trombosit kirlilik ≤ 1x10 7 / enjeksiyon.
- Farkedilir bir kırmızı kan hücresi kontaminasyon varsa, ilk yıkamadan sonra ACK lizis tamponu kullanarak kırmızı hücre parçalanma. PBS ile 2 kez yıkanarak ACK tamponu çıkarın.
2. Alloantigen hazırlanması
- Yukarıda gösterilen prosedür kullanılarak donör periferal kandan PBMC izole edin.
- 120x10 6 hücre / ml 'lik bir konsantrasyonda (4x10 6 hücre / 30 ul) PBS içerisinde yeniden süspanse donör PBMC.
- Protein önlemek için karışıma 1 uM PMSF eklemebozulması.
- 2 mm-prob sonikatör ile yedi 1 saniyelik bakliyat kullanarak hücre süspansiyonu sonikasyon. (Not: Malzemenin soğuk tutun ve aşırı kabarcıkları önlemek köpük oluşursa, hücre süspansiyonu 2-3 dakika buz üzerinde bekletin..)
- Hemasitometre kullanarak hücrelerin>% 90 bozulma doğrulayın.
- Soğutulmuş mikrofüj içinde 20 dakika boyunca 4 ° C'de 14,000 rpm'de karışım santrifüjleyin.
- Yeni bir 2.0 ml güvenli kilit tüp süpernatant aktarın ve protein konsantrasyonu belirler.
3. Enjeksiyonlar için Hücre Hazırlık
- 2.0 ml güvenli kilit tüpleri içine her enjeksiyon kısım 7x10 6 PBMC için.
- Mikrofuge'ye bir dakika 6.000 rpm'de santrifüj ve süpernatant kaldırmak.
- PBS içinde veya antijen olmaksızın süspansiyon hücreleri. PBS ile 35 ul enjeksiyon ses seviyesini ayarlayın. Aşağıdaki şema enjeksiyon için kullanılır:
Negatif Kontrol: PBMC + PBS
Pozitif Kontrol: PBMC + TT / DT (25 & mu, G / enjeksiyon)
Deneysel Antijen Özgül Tepki: PBMC + testi Ag (4-8 mg / enjeksiyon)
Deneysel Antijen Özgül Düzenleme: PBMC + testi Ag + TT / DT
4. Ön ölçüm, Enjeksiyon ve sonrası ölçüm
- Izofluran ile CB17 SCID fare anestezisi. Yaylı bir kumpas kullanarak arka haydut kalınlığını ölçün. Ölçüm sitesi tutarlı tutmak için bir kriter sağlamak için, bir kenar ayak son yürüyüş alanına basıldığında ile, ayak tabanına merkezinde yer kumpas koyun. Göstergesi okuma stabilize olduğunda Kapkaççı kalınlığı kaydedilir.
- Yavaş yavaş 28-gauge iğne ile yarım cc insülin şırıngası kullanılarak farelerin deri altından ayak yastıklarından hücre süspansiyonları enjekte edilir. Iğne ayak doğru bakacak ve konik yukarı bakacak şekilde enjeksiyon yapın. (Not: herhangi bir sızıntı olmadığından emin olun).
- Enjeksiyondan sonra 18-24 saat, haydut şişlik izofluran ve tekrar ölçüm ile fare uyutmak.
- Subtrayak tabanına şişme değeri elde etmek için enjeksiyondan değerinden daha sonra enjeksiyondan önce her bir ayak desteği kalınlığı hareket, 10 -4 inch verileri ifade eder. Tedaviler (hücre + donör alloantigen, TT / DT, ya da donör alloantigen + TT / DT) elde edilen ayak yastığı şişme değerlerinden kontrolü haydut şişme (hücre + PBS) çıkarılarak antijen spesifik net şişme hesaplayın. PBS arka plan yanıt üzerinde ≥ 25x10 -4 inç antijen TT / DT çağırmak için bir pozitif kontrol yanıtı geçerli dikkate alınması gereken test için gereklidir.
- Aşağıdaki formül kullanılarak her enjeksiyon arasında net şişme karşılaştırarak donör antijen varlığında hatırlama yanıtını inhibisyonunu belirlemek:
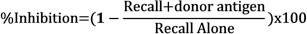
Sonuçlar
1. Tv-DTH testi kullanılarak donör antijen-spesifik yanıt için böbrek nakli Değerlendirilmesi
Böbrek nakli donör-reaktif hücresel bağışıklık test etmek için donör antijenleri tek başına ya da bir geri çağırma antijen tetanoz toksoid (TT) ile bu hastaların PBMC enjekte. Bir pozitif kontrol hücreleri TT tek başına enjekte edilmişlerdir. Biz nakli gecikmiş tip aşırı duyarlılık üç ana desenleri (Şekil 1) gözlemlemek. Tüm hastalar Ag (TT) Akla g?...
Tartışmalar
Trans-vivo DTH testi nakli, kanser ve otoimmün hastalarda hücre-aracılı yanıtları değerlendirirken potansiyel bir klinik uygulama ile yeni bir tanı testidir. Bu geri çağırma T efektör yanıtları izlemek yararlı değil, çünkü değerlidir, aynı zamanda T düzenleyici yanıtları algılayabilir. Insan DTH düzenleme algılamak için güvenilir bir yolu tek başına veya tolerans çalışmalar için aday olan hastalarda immün çekilme güvenliği tahmin olabilir.
TV-DTH MHC al...
Açıklamalar
Bu yazının Yazarlar ifşa etmek hiçbir çıkar çatışması var.
Teşekkürler
Yazarlar nakli düzenlenmiş DTH yanıt anlayışımızın gelişmesine AM VanBuskirk katkıları kabul etmek istiyorum. Bu çalışma NIH hibe PO1AI084853 ve R01AI066219-06 destekli ve AB destekli bir çalışma ile oldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
Referanslar
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır