Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Método fiable para evaluar la germinación de semillas, dormancia y mortalidad en condiciones de campo
En este artículo
Resumen
Aquí se presenta un protocolo para evaluar la supervivencia de semillas, germinación y la latencia en condiciones de campo utilizando enterrados, tiras de semillas etiquetadas y pruebas de viabilidad cloruro de tetrazolio (TZ).
Resumen
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
Introducción
El objetivo general de este método es evaluar de forma fiable la supervivencia de semillas con el tiempo en condiciones de campo.
Bancos de semillas son una reserva de semillas dispersadas, viables aún no germinadas distribuidos ya sea en la superficie del suelo, dentro de hojarasca superficial, o dentro del perfil del suelo, que pueden persistir de forma transitoria o durante muchos años 1,2. Cuando los métodos de enterramiento de semillas similares a los aquí presentados se aplicaron a un estudio de 17 años el uso de varias docenas de especies, se encontraron semillas viables en muchas de las especies ensayadas 3. Latencia de las semillas es un bloque de germinación de la semilla hasta que la combinación apropiada de las condiciones para la supervivencia de las plántulas surgen 4. Restante en estado latente puede permitir que las semillas para sobrevivir las duras condiciones, tales como las bajas temperaturas invernales, limitación de nutrientes, o la sequía estacional, hasta que un disparador externo para la latencia de liberación permite la germinación. Los disparadores para la latencia de liberación puede variar de la exposición al frío, compuestos izquierdo extendido por fira, o ataque físico en la cubierta de la semilla debido a la abrasión o el contacto con los ácidos del estómago de los animales 5. Como señales de germinación pueden ser géneros o especies específicas y, a menudo el resultado de la selección natural pasado, la germinación de semillas de mala adaptación es la que se produce en un momento inadecuado, y puede resultar en semillas o plántulas de mortalidad o pobre crecimiento de las plántulas. Mientras que la inactividad se ha clasificado en una serie de tipos basados en los mecanismos de liberación de la latencia (por ejemplo, la inactividad física, la latencia fisiológica), 6 latencia de las semillas sigue siendo uno de los menos entendidos en temas de biología vegetal. Por lo tanto, los estudios de campo que permiten la evaluación de la situación de las semillas o grupos de semillas en condiciones ecológicas pertinentes individuales tienen mayor poder explicativo que aquellos que simplemente se basan en las pruebas de germinación estándar en el laboratorio.
La explotación de las características conocidas de semillas puede proporcionar información sobre los mecanismos de latencia. Control de la latencia de las semillas es complex, incluyendo el control genético de los factores fisiológicos y morfológicos. Mientras que una comprensión completa de la amplitud de mecanismos de latencia aún no se ha dilucidado, un modelo general ha surgido, que implica una relación de retroalimentación entre las dos hormonas de la planta de ácido giberélico (GA) y ácido abscísico (ABA) 7. En este modelo generalizado para semillas con un componente fisiológico a su inactividad, GA sirve como señal para la liberación de la latencia, mientras que ABA sirve para mantener el estado latente. Efectos genéticos maternos, así como el entorno de crecimiento materna puede influir en la latencia y otros rasgos de las semillas, como el tamaño, a través de los tejidos generados por vía materna y señales de desarrollo 8. Maternalmente generada estructuras externas (o cubiertas de semillas), podrá conservar la latencia, a veces en combinación con las señales fisiológicas. Desde revestimientos de semillas de origen materno son controlados por genes de la planta madre, que no siempre son representativas real nuclear genética de la semilla. Nosotros nos tenemosed los aquenios Helianthus annuus de una serie de híbridos de cultivos silvestres cruza para desentrañar estos efectos genéticos de embriones vs. materna sobre características de las semillas 9,10. Por lo tanto, los diseños de estudio que incluyen diversas especies, tipos de cruz, o genotipos pueden recoger información sobre el ecología y genética de latencia de las semillas, germinación y supervivencia.
Un ejemplo importante de cómo la germinación de semillas y supervivencia fenotipos pueden afectar la dinámica de población se puede ver en zonas híbridas de cultivos silvestres. Selección durante la domesticación de plantas cultivadas elimina la mayor latencia y reduce la capacidad de una semilla para sobrevivir fuera de la temporada de crecimiento. Sin embargo, el flujo de genes, o hibridación, entre los tipos cultivadas y silvestres en zonas híbridas de cultivos silvestres pueden reintroducir alelos de los cultivos (o variantes genéticas) en una población silvestre, con posibles efectos sobre la dinámica del banco de semillas. Los híbridos entre parientes silvestres y cultivadas potencialmente encuentran en zonas híbridas de cultivos silvestres pueden poseeruna variedad de fenotipos intermedios de latencia, con sólo unos pocos fenotipos esperados para sobrevivir a condiciones fuera del cultivo (por ejemplo, los meses de invierno) 11.
El objetivo de este manuscrito es mostrar cómo, utilizando el método de la tira de enterramiento de semillas, podemos evaluar la germinación, latencia, y la supervivencia de una amplia gama de tipos de semillas en diferentes periodos de tiempo para investigar su variación natural en condiciones de campo. En nuestro ejemplo, se emplearon semillas de girasol de 15 tipos cruce híbrido de cultivos silvestres, ya que estamos interesados en los efectos genéticos maternos y de los embriones sobre características de las semillas.
Protocolo
1. Reunir Semillas de Especies Múltiples o cruces controlados de una sola especie
Nota: En este ejemplo se utiliza la semilla de 15 tipos cruzado dentro de la especie Helianthus annuus (girasol) usando salvaje, híbrido, y los tipos de cultivos como el (productores de semillas) matriz materna.
- Al final de la temporada de crecimiento, recoger cabezas de semillas maduras en bolsas etiquetadas. Semilla limpia de la paja y el lugar de semillas en sobres etiquetados con el tipo de cruz de los padres en formato estándar (es decir, x materna paterna).
- semillas a granel juntos en sobres grandes usando cantidades iguales de semilla de un número igual de tipos idénticos transversales de los padres. Por ejemplo, 100 semillas de 10 tipos cruzados con los mismos padres maternos y paternos. Etiquetar los sobres con la información de identificación (tipo cruzado). Estos sobres grandes son maestros de semillas para su uso en el llenado de las tiras de enterramiento en la Sección 2.
| Padres materna | |||
| Padres paterna | Salvaje: WXW | F 1: WxC | Cultivo: CxC |
| Salvaje: WXW | 0% WXW | 25% F 1 xW † | 50% cxw † |
| BC: WxF1 o F1xW | 12,5% WxBC | 37,5% de F 1 XBC | 62,5% CxBC |
| F 1: WxC | 25% wxf 1 † | 50% F 1 1 xF | 75% CxF 1 † |
| F 2: F 1 1 xF | 25% wxf 2 | 50% F 1 2 xF | 75% CxF 2 |
| Cultivo: CxC | 50% WxC † | 75% F 1 xC † | 100% CxC |
Tabla 1. parental cruz tipos producidos a partir de polinización manual. Girasol tipos cruce híbrido de cultivos silvestres fueron producidos con la polinización manual para su uso en el experimento de enterramiento de semillas. Para todos los tipos cruzados, el padre de la madre aparece en primer lugar y el padre paterno aparece en segundo lugar. tipos cruzados marcados con † son parte de pares de tipo cruz de reciprocidad con los mismos alelos% de los cultivos, pero diferentes padres maternos. Tabla ha sido publicado previamente en: Pace, BA et al. (2015) 15.
2. Crear las tiras de entierro de semillas personalizados
NOTA: Para este ejemplo, hemos tenido tres tratamientos fecha de remoción y 15 repeticiones, así que requerimos 45 tiras total. Este ejemplo utiliza 15 compartimentos por tira así, que requiere bastante tela de poliéster de malla fina o un mosquitero para albergar a 15, 7 x 10 cm compartimentos. Ver Figura 1.
- Comience por cortar una tira de 20 x 105 cm de tela para cada tira de semillas.
- Medir y marcar compartimentos, luego doble la tela por la mitad. El uso de un higpistola de pegamento h-temperatura, sellar un extremo corto (10 cm). Una vez que el pegamento se enfría un poco, pero no completamente, presione los lados de la tela juntos para crear un sello.
PRECAUCIÓN: pegamento y pegamento pistola para puntas de temperaturas altas pueden causar quemaduras si el contacto con la piel es prolongada. - líneas de cola desde el borde doblado de la parte corta abierta en cada marca compartimento. Presione los dos lados de la tela juntos a lo largo de las líneas de pegamento para asegurar juntas sin agujeros entre los compartimentos. Semillas que migran entre los compartimentos contribuyen a error experimental.
NOTA: Ahora que los compartimentos se han creado, el borde desplegada debe permanecer abierta y lista para recibir la semilla y su información de identificación (nombre de tipo cruz). - Al azar asignar tipos de semillas cruzadas en los diferentes compartimentos para cada tira.
- Llenar los compartimientos de semillas con un número uniforme de semillas (20 por cada compartimento se utilizan en este ejemplo). Para las etiquetas, utilice marcadores permanentes industriales de corte para el montaje dardos de jardín de plástico de modo que sean capaces desoportar el entierro.
NOTA: métodos de marcaje alternativos pueden ser utilizados. - Después de cada compartimiento se llena de semillas y su etiqueta, sellar el compartimento inmediatamente con la pistola de pegamento de alta temperatura. Continúe hasta que toda la tira de semillas está completamente sellado. Etiqueta de la tira en general en el primer compartimento con la réplica, bloquear y / o información sobre el tratamiento.
NOTA: Para nuestro estudio, ya que teníamos el traslado temporal, bloques, tiras y se replican dentro de los bloques, que incluye toda esta información. - Compruebe si hay huecos entre compartimentos y pegamento localmente según sea necesario antes de pasar a la siguiente tira.
- Llenar los compartimientos de semillas con un número uniforme de semillas (20 por cada compartimento se utilizan en este ejemplo). Para las etiquetas, utilice marcadores permanentes industriales de corte para el montaje dardos de jardín de plástico de modo que sean capaces desoportar el entierro.
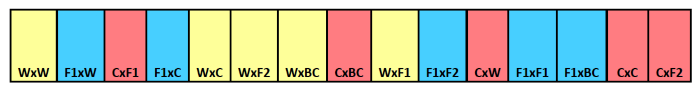
Figura 1. El entierro tira de semillas esquemática. Ejemplo de la tira que muestra el entierro de identificación de tipo cruz por compartimentos individuales. progenitor materno aparece en primer lugar con el progenitor paterno aparece segundo. Los colores indican diferentes filiación materna,con el amarillo de salvaje, azul para F 1 híbrido, y el rojo para los cultivos. Haga clic aquí para ver una versión más grande de esta figura.
3. Bury tiras semilla en el campo
- Cavar parcelas a la profundidad especificada a las tiras de las casas. Asignar tiras a los bloques individuales en los que las tiras están dispuestas al azar para permitir la fecha de retirada para ser utilizados como la trama principal y la identidad compartimento (en este ejemplo, tipo cruzado) como la subtrama en el análisis.
- Cubra tiras con tierra. Corte de tela metálica de malla metálica para ser 10 cm más grande que las parcelas y el lugar más tiras enterrados. Utilice U-pins para asegurar los bordes y los bordes de tela cubierta con tierra.
NOTA: Esta cubierta es de madriguera para excluir depredadores de semillas. Como otra opción, Mercer et al. 13 construidos y cajas de tela metálica que rodeaban las tiras de semillas debido a la presión intensa de Gopher en su loca campo enterradosción.) - Colocar banderas del topógrafo de color para distinguir la ubicación de Gaza y de eliminación de las fechas para complementar los registros escritos claros.
4. Excavar tiras y Evaluar Semilla
- Desenterrar tiras de semillas asignados a una fecha dada eliminación. Mantener las tiras en un ambiente húmedo y fresco hasta que llegan al laboratorio, donde se llevará a cabo la evaluación de la semilla. Esto puede lograrse envolviendo las tiras en papel de periódico mojado y colocarlos en un refrigerador para el transporte o envío de noche.
- Enjuague el barro y la suciedad de las tiras en agua hasta que las tiras son lo suficientemente limpia que los desechos externo semillas no oscuros.
- Use las tijeras para cortar abierto un compartimiento a la vez. Contar semillas germinadas y eliminarlos. Contar con claridad semillas muertas (por ejemplo, descomposición, o semillas podridas). Coloque las semillas germinadas en la etiqueta de papel secante, húmeda Petri de tamaño para distinguir aún más las semillas germinadas, latentes, y muertos.
- Colocar placas de Petri con sin germinarsemillas en un conjunto cámara de crecimiento durante las condiciones de germinación estándar: 25 ° C día / 10 ° C 12 hr / noche. Permitir que las semillas germinen una semana. Cualquiera que, contar estos como viable, pero sin germinar, ya que no germinan en condiciones de campo.
- Después del tratamiento cámara de crecimiento, prueba de semillas germinadas restante para la viabilidad usando cloruro de tetrazolio (TZ) 13. Para lograr esto, preparar una solución de TZ apropiada por ciento para las especies estudiadas utilizando el Manual de Pruebas de tetrazolio AOSA 14. Para este ejemplo, se utiliza una solución de 1%.
- Cortar las semillas germinadas por la mitad y colocar la mitad eran el embrión y el endospermo son visibles en una placa de Petri que contiene suficiente solución TZ para cubrir la semilla (semillas puedan flotar, esto está bien).
- Coloque los platos de Petri TZ en una incubadora a 30 ° C y espere 3 horas. Nota: Las temperaturas más altas darán como resultado una reacción más rápida, si se desea, pero la sobretinción es un riesgo.
- Eliminar placas de Petri de la incubadora y evaluar. Las semillas que han manchado rojo en sus embriones son germinar, mientras que las semillas no teñidas están muertas. Consultar el Manual de Pruebas de tetrazolio AOSA para más detalle en los casos marginales distintivas y especies particulares.
Resultados
Tipos cruzadas con variadas porcentaje de filiación y de los cultivos alelo materno (Tabla 1) diferían través de las fechas de eliminación en porcentaje germinó, sin germinar, y semillas muertas (Fig. 2 y 3). El uso de pruebas de semillas germinadas de TZ, hemos encontrado algunas semillas de verdad latentes en la segunda extracción (primavera) (Tabla 2), mientras que todas las semillas germinadas en la tercera ext...
Discusión
Aquí presentamos métodos para el uso de tiras de enterramiento de semillas para observar la germinación de semillas, la latencia y la mortalidad de las semillas diversas en períodos de tiempo preseleccionados en el campo. Las ventajas de usar las tiras en lugar de los paquetes individuales se encuentran en (1) la velocidad de la tira y la construcción compartimento sobre la creación de paquetes individuales; y (2) la facilidad y la velocidad de eliminación de múltiples compartimentos en un movimiento sin el peli...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
Materiales
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
Referencias
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados