Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zuverlässige Methode zur Beurteilung der Samenkeimung Dormanz und Mortalität unter Feldbedingungen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll für die Beurteilung der Samen überleben, Keimung und Dormanz unter Feldbedingungen mit begraben, markierten Samen Streifen und Tetrazoliumchlorid (TZ) Vitalitätstests.
Zusammenfassung
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
Einleitung
Das übergeordnete Ziel dieses Verfahrens ist es, zuverlässig Samen Überleben im Laufe der Zeit unter Feldbedingungen zu beurteilen.
Bodensamenbanken sind eine Reserve von verteilt, durchführbare noch nicht gekeimten Samen verteilt entweder auf der Bodenoberfläche, innerhalb von Oberflächen Streu oder innerhalb des Bodenprofils, das 1,2 transient oder für viele Jahre andauern kann. Bei der Saatgut Bestattung Methoden ähnlich denen hier vorgestellten einer Studie von 17 Jahren angewendet wurden mehrere Dutzend Arten verwendet wurden keimfähige Samen getestet 3 in viele der Arten gefunden. Samenruhe ist ein Block Keimung auf Saatgut , bis die entsprechende Kombination von Bedingungen für Sämling Überleben 4 entstehen. ruhend Rest können Samen lassen rauen Bedingungen, wie niedrigen Temperaturen im Winter, Nährstoffmangel, oder saisonale Trockenheit überleben, bis ein externer Trigger für Dormanz-Release für die Keimung ermöglicht. Auslöser für Dormanz-Freisetzung kann variieren von der Exposition gegenüber verlängert Kälte, Verbindungen, die durch f linksire oder physischen Angriff auf die Samenschale durch Abrieb oder Kontakt mit tierischen Magensäure 5. Als Keimung Cues können aus der Vergangenheit natürliche Selektion Gattungen oder Arten spezifisch und oft führen sein, maladaptive Keimung der Samen ist das, was zu einem ungünstigen Zeitpunkt erfolgt, und in Samen oder Sämling Sterblichkeit oder schlechte Sämlingwachstum führen kann. Während dormancy hat sich zu einer Reihe von Arten auf die Mechanismen der Dormanz Freisetzung (zB körperliche dormancy, physiologische Dormanz), 6 Samenruhe bleibt eine der am wenigsten verstandenen Themen in der Pflanzenbiologie basiert klassifiziert. So Feldstudien, die zur Beurteilung des Status der einzelnen Samen oder Gruppen von Saatgut unter relevanten ökologischen Bedingungen haben eine höhere Aussagekraft als die erlauben, die einfach auf Standard-Keimtests im Labor verlassen.
Ausnutzung von Saatguteigenschaften können Einblick in die Mechanismen der Ruhe bieten. Kontrolle der Keimruhe ist Complex, einschließlich der genetischen Kontrolle der physiologischen und morphologischen Faktoren. Während ein volles Verständnis der Breite der Dormanz Mechanismen noch aufgeklärt werden, hat ein allgemeines Modell entstanden, eine Rückkopplungsbeziehung zwischen den beiden Pflanzenhormone Gibberellinsäure (GA) und Abscisinsäure (ABA) 7 beteiligt sind . In diesem verallgemeinerten Modell für Saatgut mit einer physiologischen Komponente zu ihrem Schlummer, dient GA als Signal für dormancy Release, während ABA in den Ruhezustand zu halten dient. Maternal genetische Effekte sowie die mütterliche Wachstumsumgebung kann durch mütterlich erzeugte Gewebe und Entwicklungssignale 8 dormancy und andere Samen Merkmale wie Größe beeinflussen. Maternal erzeugt äußeren Strukturen (oder Samen Beläge) dormancy halten kann, mit physiologischer Signale manchmal in Kombination. Da maternalen Samen Beläge von der Mutterpflanze die Gene gesteuert werden, können sie spiegeln nicht die tatsächliche Kern genetische Make-up Samen. Wir haben unsed die Helianthus annuus achenes aus einer Reihe von Pflanzenwild Hybrid kreuzt diese mütterlichen gegen Embryo genetische Effekte auf Saatgut Eigenschaften 9,10. So , die verschiedene Spezies, Cross - Typen oder Genotypen gehören Entwürfe Studie herauszukitzeln über die auflesen kann Ökologie und Genetik von Samenruhe, die Keimung und das Überleben.
Ein wichtiges Beispiel dafür, wie die Keimung der Samen und das Überleben Phänotypen Populationsdynamik beeinflussen können im Pflanzen-Wildhybridzonen zu sehen. Auswahl während der Domestikation von Kulturpflanzen beseitigt die meisten dormancy und reduziert die Fähigkeit des Samen außerhalb der Vegetationsperiode zu überleben. Doch Genfluss oder Hybridisierung zwischen den Kultur- und Wildarten in Pflanzenwildhybridzonen können Ernte-Allele (oder genetische Varianten) in eine Wildpopulation, mit möglichen Auswirkungen auf die Samenbank Dynamik wieder einführen. Hybrids zwischen Kultur- und Wild Verwandten möglicherweise in Pflanzenwildhybridzonen gefunden besitzen kanneine Vielzahl von Zwischen Dormanz Phänotypen, mit nur wenigen Phänotypen erwarteten Bedingungen außerhalb der Kultivierung (zB Wintermonate) 11 , um zu überleben.
Das Ziel dieses Manuskript ist zu zeigen, wie die Samen Grabstreifenmethode verwenden, können wir die Keimung, Dormanz, und das Überleben einer Reihe von Samenarten zu unterschiedlichen Zeitperioden zu bewerten, um ihre natürliche Variation unter Feldbedingungen zu untersuchen. In unserem Beispiel verwendeten wir Sonnenblumenkerne aus 15 Pflanzenwildtypen Hybrid-Kreuzung, da wir daran interessiert, von Mutter und Embryo genetische Effekte auf die Samenmerkmale sind.
Protokoll
1. Sammeln Samen aus mehreren Arten oder kontrollierte Kreuze einer einzelnen Spezies
Hinweis: Dieses Beispiel verwendet Samen von 15 Kreuztypen innerhalb der Spezies Helianthus annuus (Sonnenblume) mit wilden, Hybrid- und Pflanzenarten wie die mütterliche (Saatgutvermehrungs) Eltern.
- Am Ende der Vegetationsperiode sammeln reifen Samenkapseln in etikettierte Tüten. Saubere Samen von Spreu und Ort Samen in Umschläge mit elterlicher Kreuztyp im Standardformat beschriftet (dh mütterliche x väterlicherseits).
- Bulk seed zusammen in großen Umschläge unter Verwendung gleicher Mengen von Saatgut aus einer gleichen Anzahl von identischen Elternquertypen. Zum Beispiel 100 Samen von 10 Cross-Typen mit den gleichen mütterlichen und väterlichen Eltern. Beschriften Sie die Umschläge mit Identifizierung (Kreuztyp). Diese großen Umschläge sind Samen Meister für die Verwendung bei der Besetzung von Grabstreifen in Abschnitt 2.
| Maternal Eltern | |||
| Väterliche Eltern | Wild: wXw | F 1: WXC | Crop: CxC |
| Wild: wXw | 0% wXw | 25% F 1 x B † | 50% CXW † |
| BC: WxF1 oder F1xW | 12,5% WxBC | 37,5% F 1 XBC | 62,5% CxBC |
| F 1: WXC | 25% WXF 1 † | 50% F 1 xF 1 | 75% CxF 1 † |
| F 2: F 1 xF 1 | 25% WXF 2 | 50% F 1 xF 2 | 75% CxF 2 |
| Crop: CxC | 50% WXC † | 75% F 1 xC † | 100% CxC |
Tabelle 1. Kinderkreuz tfür den Einsatz in der Saatgutgrab Experiment ypes von Hand hergestellt Bestäubung. Sunflower Ernte-Wild Hybrid - Kreuz - Typen wurden mit Handbestäubung hergestellt. Für alle Quertypen aufgelistet die mütterliche Eltern erste und die väterliche Eltern zweiten aufgeführt. Kreuztypen markiert mit † sind Teil der gegenseitigen Kreuztyp-Paare mit den gleichen% Crop-Allele, aber unterschiedliche mütterliche Eltern. Tabelle wurde zuvor veröffentlicht in: Pace, BA et al. (2015) 15.
2. Erstellen von benutzerdefinierten Seed Beerdigung Strips
HINWEIS: Für dieses Beispiel hatten wir drei Entnahmedatum Behandlungen und 15 Wiederholungen, so benötigt man 45 Streifen insgesamt. In diesem Beispiel werden 15 Fächer pro Streifen so, wir genug feinmaschigen Polyestergewebe oder Moskitonetz zu Haus 15, 7 x 10 cm Fächer erforderlich. Siehe Abbildung 1.
- Beginnen Sie mit einer 20 x 105 cm Stoffstreifen für jeden Samen Streifen schneiden.
- Messen und markieren Fächer, dann falten Sie den Stoff in zwei Hälften. Mit einem high Temperaturklebepistole, Siegel einen kurzen (10 cm) Ende. Sobald der Kleber leicht abkühlt, aber nicht vollständig, drücken Sie die Stoffseiten zusammen, um eine Dichtung zu schaffen.
VORSICHT: Hochtemperatur-Kleber und Klebepistole Tipps können Verbrennungen verursachen, wenn Berührung mit der Haut verlängert. - Klebelinien aus dem gefalteten Rand zum offenen kurzen Ende in jedem Fach-Marke. Drücken Sie die beiden Stoffseiten zusammen entlang der Leimfugen, um sicherzustellen, Dichtungen ohne Löcher zwischen den Kammern. Samen der Migration zwischen den Kammern tragen zur experimentellen Fehler.
HINWEIS: Nun, da die Fächer geschaffen wurden, sollte die ungefalteten Kante offen und bereit bleiben Samen und deren identifizierende Informationen (Cross-Name) zu empfangen. - Randomly Samen Quertypen Fächern für jeden Streifen zuordnen.
- Füllen seed Kompartimenten mit einer einheitlichen Anzahl von Samen (20 für jedes Fach werden in diesem Beispiel verwendet wird). Für Etiketten, verwenden industrielle Filzstiften auf cut-to-fit Kunststoff-Garten Darts, so dass sie in der Lage sindstandhalten Bestattung.
HINWEIS: Alternative Markierungsverfahren verwendet werden. - Nach jedem Fach mit Saatgut und dessen Etikett gefüllt ist, verschließen Sie das Fach sofort mit der Klebepistole Hochtemperatur. Gehen Sie, bis das gesamte Saatgut Streifen vollständig abgedichtet ist. Beschriften Gesamtband in der ersten Kammer mit replizieren, Block und / oder Behandlungsinformationen.
HINWEIS: Für unsere Studie, da wir zeitlich Umzüge hatten, Blöcke und replizieren Streifen innerhalb der Blöcke, enthalten wir alle diese Informationen. - Prüfen Sie, ob Lücken zwischen den Kammern und Spot Kleber nach Bedarf, bevor zum nächsten Streifen übergeht.
- Füllen seed Kompartimenten mit einer einheitlichen Anzahl von Samen (20 für jedes Fach werden in diesem Beispiel verwendet wird). Für Etiketten, verwenden industrielle Filzstiften auf cut-to-fit Kunststoff-Garten Darts, so dass sie in der Lage sindstandhalten Bestattung.
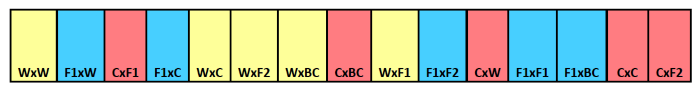
Abbildung 1. Burial schematische Samenstreifen. Beispiel Grabstreifen , die Quertyperkennung für einzelne Fächer. Maternal Eltern zuerst genannt mit dem väterlichen Eltern zweiten aufgeführt. Farben zeigen verschiedene mütterliche Abstammung,mit gelb für wild, blau für F 1 Hybrid und Rot für Ernte. Bitte hier klicken um eine größere Version dieser Figur zu sehen.
3. von Bury Seed-Streifen auf dem Gebiet
- Dig Plots auf die angegebene Tiefe zu Haus Streifen. Ordnen Sie Streifen zu einzelnen Blöcken, in denen Streifen zufällig angeordnet sind, zum Entfernen Datum zu ermöglichen, wie der Haupthandlung und Fach Identität (in diesem Beispiel Cross-Typ) als subplot in der Analyse verwendet werden soll.
- Abdeckleisten mit Erde. Cut Metallgewebe Metallgewebe 10 cm größer als Plots und Ort über begraben Streifen zu sein. Verwenden Sie U-Pins zu sichern Kanten und Abdeckung Tuch Kanten mit Erde.
HINWEIS: Diese Abdeckung ist für den Ausschluss Wühlen Samenprädatoren. Als weitere Option Mercer et al. 13 aufgebaut und Kisten mit Hardware-Tuch vergraben, die die Samenstreifen aufgrund des intensiven Gopher Druck in ihrem Bereich loca umgebention.) - Legen Sie farbige Vermessungs Flaggen Streifen Lage und Entfernung zu unterscheiden Daten klare schriftliche Aufzeichnungen zu ergänzen.
4. Excavate Strips und Seed Bewerten
- Dig Samenstreifen zugeordnet zu einer bestimmten Entfernung Datum. Pflegen Sie die Streifen in einem kühlen feuchten Umgebung, bis sie das Labor, in dem Samen Auswertung stattfinden wird erreichen. Dies kann durch Wickeln der Streifen in nassen Zeitung erreicht werden und sie in einem Kühler für den Transport oder Versand über Nacht platziert.
- Spülen Sie Schlamm und Boden aus dem Streifen in Wasser, bis Streifen wird nicht dunkel Samen sauber genug, dass äußere Ablagerungen sind.
- Mit einer Schere öffnen ein Fach zu einer Zeit, zu schneiden. Graf gekeimten Samen und entfernen. Graf klar toten Samen (zB Fäulnis oder verfaulten Samen). Legen Sie nicht gekeimten Samen auf markierten, nasse Petri-Größe Löschpapier weiter ungekeimter, ruhend, und toten Samen unterscheiden.
- Legen Sie Petrischalen mit gekeimtenSamen in einer Wachstumskammer für Normalkeimbedingungen: 25 ° C / 10 ° C 12 Stunden Tag / Nacht. Lassen Samen einer Woche keimen. Alle, die zu tun, diese als tragfähige zählen, aber nicht gekeimten, da sie nicht keimen unter Feldbedingungen.
- Nach der Wachstumskammer Behandlung verbleibenden Test nicht gekeimten Samen für die Lebensfähigkeit unter Verwendung von Tetrazolium Chlorid (TZ) 13. Um dies zu erreichen, eine prozentuale Lösung von TZ geeignet für die Studie Spezies mit dem AOSA Tetrazolium Testing Handbuch 14 bilden. Für dieses Beispiel wird eine 1% ige Lösung verwendet.
- Schneiden Sie die gekeimten Samen in der Mitte und legen Sie eine Hälfte waren der Embryo und Endosperm sichtbar sind in einer Petrischale mit genug TZ Lösung, um die Samen zu decken (Samen können schwimmen, das ist in Ordnung).
- Legen Sie TZ Petrischalen in einem Inkubator bei 30 ° C eingestellt und 3 Stunden warten. Hinweis: Höhere Temperaturen in einer schnelleren Reaktion führt, wenn gewünscht, aber overstaining ist ein Risiko.
- Entfernen Petrischalen aus dem Inkubator und zu bewerten. Samen, die in ihre Embryonen rot gefärbt haben, sind keimfähig, während ungefärbte Samen tot sind. Wenden Sie sich an AOSA Tetrazolium Testing Handbuch für weitere Einzelheiten über Scheidungsgrenzfällen und bestimmten Arten.
Ergebnisse
Kreuz - Typen mit unterschiedlichen mütterlichen Abstammungs und Ernte - Allels Prozentsatz (Tabelle 1) unterschied sich über die Entfernung Daten in Prozent gekeimt, gekeimten und toten Samen (Abb. 2 und 3). Mit TZ Prüfung von gekeimten Samen, fanden wir einige wirklich ruhenden Samen in der zweiten Entfernung (Frühjahr) (Tabelle 2), während alle durch die dritte Entfernung nicht gekeimten Samen (Feder) gefunden wu...
Diskussion
Hier präsentieren wir Methoden für die Verwendung von Saatgut Grabstreifen Keimung der Samen, Dormanz und Sterblichkeit von verschiedenen Saatgutvorräte zu vorgewählten Zeitperioden auf dem Gebiet zu beobachten. Die Vorteile der Verwendung von Streifen eher als einzelne Pakete liegen in (1) die Geschwindigkeit des Bandes und Fach Konstruktion über die Schöpfung der einzelnen Pakete; und (2) die Leichtigkeit und Geschwindigkeit des Entfernens von mehreren Fächern in einer Bewegung ohne die Gefahr eines Pakets Wegl...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
Materialien
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
Referenzen
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten