Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Reliable Méthode d'évaluation de la germination des graines, dormance, et la mortalité sous conditions de terrain
Dans cet article
Résumé
Nous présentons ici un protocole d'évaluation de la survie des semences, la germination et la dormance dans des conditions de terrain à l'aide enfouis, des bandes de semences étiquetées et chlorure de tétrazolium (TZ) les tests de viabilité.
Résumé
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
Introduction
L'objectif global de cette méthode est d'évaluer de façon fiable la survie des graines au fil du temps dans des conditions de terrain.
Les banques de semences du sol sont une réserve de graines dispersées, encore non germés viables distribués soit sur la surface du sol, dans la litière de surface, ou dans le profil du sol, qui peuvent persister ou transitoirement pendant de nombreuses années 1,2. Lorsque inhumation des méthodes similaires à celles présentées ici de semences ont été appliqués à une étude de 17 ans en utilisant plusieurs dizaines d' espèces, des graines viables ont été trouvées dans la plupart des espèces testées 3. La dormance des graines est un bloc à la germination des graines jusqu'à ce que la combinaison appropriée de conditions pour la survie des semis se pose 4. Restant en sommeil peut permettre à des graines pour survivre dans des conditions difficiles, telles que les basses températures de l'hiver, la limitation des nutriments, ou la sécheresse saisonnière, jusqu'à ce qu'un déclencheur externe pour la dormance libération permet à la germination. Déclencheurs de dormance libération peut varier d'une exposition à froid prolongées, composés laissés par fire, ou une attaque physique sur le manteau de la graine par abrasion ou contact avec les acides de l' estomac des animaux 5. Comme germination indices peuvent être genres ou espèces spécifiques et résultent souvent de la sélection naturelle passé, la germination des graines mésadapté est celle qui se produit à un moment inapproprié, et peut entraîner la mort des graines ou des semis ou la croissance des semis pauvres. Alors que la dormance a été classé dans un certain nombre de types basés sur les mécanismes de levée de dormance (par exemple, la dormance physique, dormance physiologique), 6 graines dormance reste l' un des moins compris les sujets en biologie végétale. Ainsi, les études sur le terrain qui permettent d'évaluer l'état des semences ou des groupes de semences dans des conditions écologiques pertinents individuels ont un pouvoir explicatif plus élevé que celles qui reposent simplement sur des tests de germination standard dans le laboratoire.
Exploitation des caractéristiques des semences connues peut donner un aperçu des mécanismes de dormance. Le contrôle de la dormance des graines est complex, y compris le contrôle génétique des facteurs physiologiques et morphologiques. Alors qu'une pleine compréhension de l'ampleur des mécanismes de dormance n'a pas encore été élucidé, un modèle général a émergé, impliquant une relation de rétroaction entre les deux hormones végétales acide gibbérellique (GA) et de l' acide abscissique (ABA) 7. Dans ce modèle généralisé pour les graines avec une composante physiologique de leur dormance, GA sert en tant que signal pour la levée de dormance, tandis que l'ABA sert à maintenir l'état de dormance. Effets génétiques maternels ainsi que l'environnement de la croissance maternelle peut influencer la dormance et d' autres traits de semences, telles que la taille, à travers les tissus générés maternellement et signaux de développement 8. généré maternellement structures externes (ou revêtements de semences) peut maintenir la dormance, parfois en combinaison avec des signaux physiologiques. Depuis revêtements de semences d'origine maternelle sont contrôlés par les gènes de la plante mère, ils peuvent ne pas refléter réelle génétique nucléaire de la graine. Nous nous avonsed l' intégralité des akènes Helianthus annuus d'un tableau d'hybride de culture sauvage traverse pour démêler ces effets génétiques maternels contre embryonnaires sur les caractéristiques des semences 9,10. Ainsi, les plans d'étude qui incluent diverses espèces, types croix, ou génotypes peuvent glaner des informations sur la l'écologie et de la génétique de la dormance des graines, la germination et la survie.
Un exemple important de la façon dont la germination des graines et la survie des phénotypes peuvent affecter la dynamique des populations peut être vu dans les zones hybrides cultures-sauvage. Sélection lors de la domestication des plantes cultivées élimine la plupart dormance et réduit la capacité d'une graine pour survivre en dehors de la saison de croissance. Pourtant, le flux de gènes, ou l'hybridation, entre les types cultivées et sauvages dans les zones hybrides culture sauvage peuvent réintroduire les allèles des cultures (ou variants génétiques) dans une population sauvage, avec des effets potentiels sur la dynamique de la banque de semences. Les hybrides entre parents cultivés et sauvages potentiellement trouvés dans les zones hybrides culture sauvage peut posséderune variété de phénotypes de dormance intermédiaires, avec seulement quelques phénotypes attendus pour survivre en dehors des conditions de la culture (par exemple, les mois d'hiver) 11.
Le but de ce manuscrit est de montrer comment, en utilisant la méthode de la bande d'enfouissement des semences, nous pouvons évaluer la germination, la dormance et la survie d'une gamme de types de semences à différentes périodes de temps pour étudier leur variation naturelle dans des conditions de terrain. Dans notre exemple, nous avons utilisé des graines de tournesol de 15 types hybrides croisés cultures sauvage depuis que nous sommes intéressés par les effets génétiques maternels et embryonnaires sur les caractéristiques des semences.
Protocole
1. Recueillir des semences à partir des espèces multiples ou croisements contrôlés d'une espèce unique
Note: Cet exemple semences utilisées à partir de 15 types croisées au sein du annuus Helianthus des espèces (de tournesol) en utilisant sauvage, hybride, et les types de cultures que la maternelle (productrice de semences) parent.
- À la fin de la saison de croissance, de recueillir des têtes de graines matures dans des sacs étiquetés. Nettoyer les graines de la balle et la place des semences dans des enveloppes étiquetées avec des parents de type croix en format standard (ie, x maternelle paternelle).
- graines en vrac ainsi que dans de grandes enveloppes en utilisant des quantités égales de semences à partir d'un nombre égal de types de croix parentales identiques. Par exemple, 100 graines de 10 types croisées avec les mêmes parents maternels et paternels. Etiqueter les enveloppes avec identifiant (type croisé) information. Ces grandes enveloppes sont maîtres de semences pour une utilisation dans le remplissage des bandes d'enterrement dans la section 2.
| Parent maternelle | |||
| Parent Paternal | Wild: wXw | F 1: WXC | Culture: CXC |
| Wild: wXw | 0% wXw | 25% F 1 xW † | 50% CXW † |
| BC: WxF1 ou F1xW | 12,5% WxBC | 37,5% de F 1 XBC | 62,5% CxBC |
| F 1: WXC | 25% WXF 1 † | 50% F 1 1 xF | 75% CxF 1 † |
| F 2: F 1 xF 1 | 25% WXF 2 | 50% F 1 2 xF | 75% CxF 2 |
| Culture: CXC | 50% WXC † | 75% F 1 xC † | 100% CXC |
Tableau 1. Parental croix types produites à partir de types de croix hybrides main pollinisation. tournesol culture sauvage ont été produites avec pollinisation manuelle pour une utilisation dans l' expérience de l' enfouissement des semences. Pour tous les types croisés, le parent maternel apparaît en premier et le parent paternel listé seconde. types Cross marqués † font partie des paires réciproques de type cross avec les mêmes allèles% des cultures, mais différents-parents maternels. Le tableau a été précédemment publié dans: Pace, BA et al. (2015) 15.
2. Créez des bandes personnalisées Burial de semences
NOTE: Pour cet exemple, nous avons eu trois traitements de la date d'enlèvement et 15 répétitions, donc nous avions besoin de 45 bandes au total. Cet exemple utilise 15 compartiments par bande, nous requis suffisamment de tissu de polyester à mailles fines ou des moustiquaires pour abriter 15, 7 x 10 cm compartiments. Voir Figure 1.
- Commencez par couper une bande de 20 x 105 cm de tissu pour chaque bande de semences.
- Mesurer et marquer les compartiments, puis plier le tissu en deux. En utilisant un high température pistolet à colle, sceller une courte (10 cm) fin. Une fois que la colle se refroidit légèrement, mais pas complètement, appuyez sur les côtés de tissu ensemble pour créer un joint.
ATTENTION: la colle et la colle des conseils d'armes à feu à haute température peuvent provoquer des brûlures en cas de contact avec la peau est prolongée. - lignes de colle à partir du bord plié à l'extrémité courte ouverte à chaque marque du compartiment. Appuyez sur les deux côtés de tissu ensemble le long des lignes de colle pour assurer des joints sans trous entre les compartiments. Graines migration entre les compartiments contribuent à l'erreur expérimentale.
NOTE: Maintenant que les compartiments ont été créés, le bord déplié doit rester ouvert et prêt à recevoir les semences et leurs informations d'identification (croix de nom de type). - Aléatoirement attribuer des types de traverses de semences à des compartiments pour chaque bande.
- Remplir les compartiments de semences avec un nombre uniforme de graines (20 pour chaque compartiment sont utilisés dans cet exemple). Pour les étiquettes, utiliser des marqueurs permanents industriels sur coupe à ajustement fléchettes de jardin en plastique de sorte qu'ils soient en mesure derésister à l'enterrement.
NOTA: Les méthodes d'étiquetage alternatifs peuvent être utilisés. - Après chaque compartiment est rempli de semences et son étiquette, sceller le compartiment immédiatement avec le pistolet à colle à haute température. Continuez jusqu'à ce que la bande de graine entière est complètement étanche. Etiqueter bande globale dans le premier compartiment avec répliquée, bloc et / ou des informations de traitement.
NOTE: Pour notre étude, puisque nous avons eu des absorptions temporelles, des blocs, et de reproduire des bandes dans des blocs, nous avons inclus toutes ces informations. - Vérifier les écarts entre les compartiments et place de la colle au besoin avant de passer à la bande suivante.
- Remplir les compartiments de semences avec un nombre uniforme de graines (20 pour chaque compartiment sont utilisés dans cet exemple). Pour les étiquettes, utiliser des marqueurs permanents industriels sur coupe à ajustement fléchettes de jardin en plastique de sorte qu'ils soient en mesure derésister à l'enterrement.
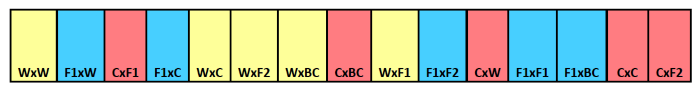
Figure 1. Burial bande de semences schématique. Exemple de bande d'enfouissement montrant l' identification de type croisé pour des compartiments individuels. parent maternelle apparaît en premier avec le parent paternel énumérés seconde. Les couleurs indiquent différentes filiation maternelle,jaune pour les sauvages, bleu pour hybride F 1, et rouge pour les cultures. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3. Enterrez bandes de semences dans le domaine
- Creusez parcelles à la profondeur spécifiée à des bandes de maison. Attribuer des bandes à des blocs individuels dans lesquels les bandes sont disposées de façon aléatoire pour permettre la date de retrait à utiliser comme l'intrigue principale et de l'identité du compartiment (dans cet exemple, type croisé) que l'intrigue secondaire dans l'analyse.
- Couvrir les bandes avec de la terre. Cut métal tissu de matériel de maille soit 10 cm plus grande que les parcelles et les placer sur les bandes enterrées. Utilisez U-goupilles pour fixer les bords et les bords de tissu de recouvrement avec de la terre.
NOTE: Ce revêtement est à l'exclusion de fouisseurs prédateurs de graines. Comme une autre option, Mercer et al. 13 construit et boîtes de tissu de matériel qui entouraient les bandes de graines dues à la pression de gopher intense dans leur loca de terrain enterréstion). - Placez les drapeaux d'arpenteur de couleur pour distinguer l'emplacement de la bande et de suppression des dates pour compléter les dossiers écrites claires.
4. Creuser Strips et évaluer semences
- Déterrez bandes de graines affectées à une date de retrait donné. Maintenir les bandes dans un environnement frais et humide jusqu'à ce qu'ils atteignent le laboratoire où l'évaluation des semences aura lieu. Ceci peut être réalisé en enroulant les bandes de papier journal humide et en les plaçant dans un dispositif de refroidissement pour le transport ou d'expédition jusqu'au lendemain.
- Rincer la boue et le sol à partir de bandes dans l'eau jusqu'à ce que les bandes sont assez propre que les débris externe graines non obscures.
- Utilisez des ciseaux pour couper ouvert un compartiment à la fois. Comptez les graines germées et les supprimer. Comptez les graines clairement mortes (par exemple, en décomposition, ou graines putréfiés). Placez les graines non germées sur étiquetés, papier buvard Petri taille humide pour mieux distinguer les graines non germées, dormantes, et morts.
- Placez des boîtes de Petri avec non germéesgraines dans un ensemble de chambre de croissance pour les conditions de germination standards: 25 ° C jour / 10 ° C 12 h / nuit. Laissez les graines d'une semaine à germer. Tout ne, compte en tant que viable, mais non germés, car ils ne germent pas dans des conditions de terrain.
- Après le traitement de la chambre de croissance, le test reste des graines non germées pour la viabilité en utilisant du chlorure de tétrazolium (TZ) 13. Pour ce faire , préparer une solution pour cent du TZ approprié pour les espèces étudiées à l' aide du manuel AOSA Testing tétrazolium 14. Dans cet exemple, une solution à 1% est utilisé.
- Couper les graines non germées en deux et placez une moitié étaient l'embryon et l'endosperme sont visibles dans une boîte de Pétri contenant une solution assez TZ pour couvrir les semences (graines peuvent flotter, cela est correct).
- Placez les plats TZ Petri dans un incubateur réglé à 30 ° C et attendre 3 heures. Note: Des températures plus élevées entraînent une réaction plus rapide, si on le souhaite, mais overstaining est un risque.
- Retirer des boîtes de Petri de l'incubateur et évaluer. Les graines qui ont souillé rouge dans leurs embryons sont germinatif, tandis que les semences non colorées sont morts. Consultez le tétrazolium Testing Handbook AOSA pour plus de détails sur les cas marginaux distinctifs et espèces particulières.
Résultats
Types Croix avec variés maternelle pourcentage filiation et culture allèle (tableau 1) différaient entre les dates de retrait en pour cent germée, non germés, et les semences mortes (Fig. 2 et 3). L' utilisation de tests de TZ de graines non germées, nous avons trouvé quelques graines vraiment dormantes au deuxième retrait (début du printemps) (tableau 2), alors que toutes les graines non germées par le tro...
Discussion
Nous présentons ici des méthodes d'utilisation des bandes d'enfouissement des semences pour observer la germination des graines, la dormance et la mortalité des stocks de semences diverses à des périodes de temps prédéterminés dans le domaine. Les avantages de l'utilisation des bandes plutôt que des paquets individuels se trouvent dans (1) la vitesse de la bande et la construction du compartiment sur la création de paquets individuels; et (2) la facilité et la rapidité d'élimination des comp...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
matériels
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
Références
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon