É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Método confiável para avaliar a germinação de sementes, dormência, e Mortalidade em condições de campo
Neste Artigo
Resumo
Aqui apresentamos um protocolo para avaliar a sobrevivência de sementes, germinação e dormência em condições de campo, utilizando enterrado, tiras de sementes rotuladas e testes de viabilidade cloreto de tetrazólio (TZ).
Resumo
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
Introdução
O objetivo geral deste método é avaliar de forma confiável sobrevivência de sementes ao longo do tempo em condições de campo.
Bancos de sementes do solo são uma reserva de sementes dispersas e viáveis ainda não germinadas distribuídas tanto na superfície do solo, dentro da maca superfície ou dentro do perfil do solo, que podem persistir transitoriamente ou por muitos anos 1,2. Quando os métodos de enterro de sementes semelhantes aos aqui apresentados foram aplicados a um estudo de 17 anos usando várias dezenas de espécies, sementes viáveis foram encontradas em muitas das espécies testadas 3. Dormência das sementes é um bloco para a germinação das sementes até a combinação apropriada de condições para a sobrevivência da muda surgem 4. Restante dormente pode permitir que sementes para sobreviver a condições adversas, tais como baixas temperaturas do inverno, limitação de nutrientes, ou seca sazonal, até que um gatilho externo para a dormência de libertação permite a germinação. Gatilhos para a dormência de libertação pode variar de exposição a estendidos frias, compostos deixadas por fire, ou ataque físico no revestimento de semente por abrasão ou de contacto com os ácidos do estômago de animais 5. Como pistas de germinação pode ser géneros ou espécies específicas e muitas vezes resultam da seleção natural passado, a germinação das sementes maladaptive é o que ocorre em um momento inadequado, e pode resultar em sementes ou mudas de mortalidade ou crescimento das mudas pobres. Enquanto dormência foi classificada em vários tipos com base nos mecanismos de liberação de dormência (por exemplo, dormência física, dormência fisiológica), 6 dormência de sementes continua a ser uma das menos compreendidas tópicos em biologia vegetal. Assim, estudos de campo que permitem a avaliação do estado de sementes ou grupos de sementes em condições ecológicas relevantes individuais têm maior poder explicativo do que aqueles que simplesmente confiar em testes de germinação em laboratório.
Exploração de sementes de características conhecidas podem fornecer insights sobre os mecanismos de dormência. Controle de dormência das sementes é complex, incluindo controle genético de fatores fisiológicos e morfológicos. Enquanto uma plena compreensão da amplitude de mecanismos de dormência ainda não foi elucidado, um modelo geral surgiu, envolvendo uma relação de retroalimentação entre os dois hormônios vegetais ácido giberélico (GA) e ácido abscísico (ABA) 7. Neste modelo generalizado de sementes com um componente fisiológico a sua dormência, serve como sinal de GA para a libertação de dormência, enquanto ABA serve para manter o estado de dormência. Efeitos genéticos materno bem como o ambiente de crescimento materna pode influenciar a dormência e outros traços de sementes, tais como tamanho, através de tecidos maternalmente gerados e sinais de desenvolvimento 8. Maternalmente gerado estruturas externas (ou revestimentos de sementes) podem manter a dormência, às vezes em combinação com sinais fisiológicos. Desde revestimentos de sementes de origem materna são controlados por genes da planta mãe, elas podem não refletir real nuclear composição genética da semente. Temos nósed aquênios Helianthus annuus de uma matriz de híbrido lavoura-selvagem cruza trazer à tona esses efeitos genéticos maternal vs. embrião sobre as características da semente 9,10. Assim, projetos de estudo que incluem diversas espécies, tipos de cruz, ou genótipos pode recolher informações sobre o ecologia e genética de dormência das sementes, germinação e sobrevivência.
Um exemplo importante de como germinação e sobrevivência de sementes fenótipos podem afetar a dinâmica da população pode ser visto nas zonas híbridas de culturas-selvagem. Seleção durante a domesticação de plantas cultivadas elimina a maioria de dormência e reduz a capacidade de uma semente de sobreviver fora da estação de crescimento. No entanto, o fluxo de genes, ou hibridação, entre os tipos de cultivo e selvagens nas zonas híbridas de culturas-selvagem pode reintroduzir alelos de culturas (ou variantes genéticas) em uma população selvagem, com potenciais efeitos na dinâmica do banco de sementes. Os híbrido entre parentes cultivadas e silvestres potencialmente encontrados em zonas híbridas de culturas-wild pode possuiruma variedade de fenótipos dormência intermediários, com apenas alguns fenótipos esperados para sobreviver a condições fora do cultivo (por exemplo, meses de inverno) 11.
O objetivo deste artigo é mostrar como, utilizando o método tira o enterro de sementes, podemos avaliar a germinação, dormência, e a sobrevivência de uma gama de tipos de sementes em diferentes períodos de tempo para investigar sua variação natural em condições de campo. No nosso exemplo, utilizamos sementes de girassol a partir de 15 tipos híbrido transversais de culturas-wild uma vez que estamos interessados em efeitos genéticos maternos e do embrião em sementes de características.
Protocolo
1. Reunir Semente de múltiplas espécies ou cruzamentos controlados de uma única espécie
Nota: Este exemplo de sementes utilizado, a partir de 15 tipos cruzadas no âmbito da annuus Helianthus espécies (girassol), utilizando selvagem, híbrido, e tipos de culturas como o maternal (produtoras de sementes) pai.
- No final da estação de crescimento, recolher cabeças de sementes maduras em sacos etiquetados. Sementes limpas do joio e local de sementes em envelopes etiquetados com o tipo de cruz parental no formato padrão (ou seja, maternal x paterna).
- sementes a granel juntos em grandes envelopes utilizando quantidades iguais de sementes de um número igual de tipos cruz parentais idênticos. Por exemplo, 100 sementes de 10 tipos cruzados com os mesmos pais maternos e paternos. Rotular os envelopes com a identificação (tipo cruzado) informações. Estes grandes envelopes são mestres de sementes para uso em preencher tiras de sepultamento na Seção 2.
| Pai materno | |||
| Pai paterna | Wild: WXW | F 1: WXC | Colheita: CXC |
| Wild: WXW | 0% WXW | 25% F 1 xW † | 50% CXW † |
| BC: WxF1 ou F1xW | 12,5% WxBC | 37,5% F 1 XBC | 62,5% CxBC |
| F 1: WXC | 25% WxF 1 † | 50% F 1 xF 1 | 75% CxF 1 † |
| F 2: F 1 1 xF | 25% 2 WxF | 50% F 1 xF 2 | 75% 2 CxF |
| Colheita: CXC | 50% WXC † | 75% F 1 x C † | 100% CXC |
Tabela 1. cruz t Parentalypes produzidos a partir de lado a polinização. girassol tipos cruz híbridos de culturas-selvagem foram produzidos com mão-de polinização para uso no experimento enterro de sementes. Para todos os tipos cruz, o pai materno listado primeiro eo pai paternal listada em segundo lugar. tipos Cruz marcados com † fazem parte de pares tipo cruzado recíprocas com os mesmos alelos% das culturas, mas os pais maternas diferentes. Tabela foi publicado anteriormente em: Pace, BA et al. (2015) 15.
2. Criar tiras costumam sepultar Semente
NOTA: Para este exemplo, nós tivemos três tratamentos data de remoção e 15 repetições, por isso, necessário 45 tiras total. Este exemplo usa 15 compartimentos por tira-lo, o que é necessário tecido de poliéster malha fina o suficiente ou mosquiteiro para abrigar 15, 7 x 10 cm compartimentos. Veja a Figura 1.
- Comece cortando a 20 x 105 centímetros tira de tecido para cada faixa de semente.
- Medir e marcar compartimentos, em seguida, dobre o tecido ao meio. Usando um higpistola de cola h temperatura, selar um curto (10 cm) end. Depois que a cola esfria um pouco, mas não completamente, pressione as laterais de tecido em conjunto para criar um selo.
CUIDADO: alta temperatura cola e cola dicas arma pode causar queimaduras se o contato com a pele é prolongada. - linhas de cola a partir da borda dobrada para a extremidade curta aberta em cada marca compartimento. Pressione os dois lados de tecido em conjunto ao longo das linhas de cola para garantir a vedação sem buracos entre os compartimentos. Sementes que migram entre compartimentos contribuir para erro experimental.
NOTA: Agora que os compartimentos foram criados, a borda desdobrado deve permanecer aberto e pronto para receber sementes e suas informações de identificação (cross nome do tipo). - Aleatoriamente atribuir tipos de cruz semente para compartimentos para cada faixa.
- Encha compartimentos de sementes com uma série uniforme de sementes (20 para cada compartimento são utilizados neste exemplo). Para etiquetas, use marcadores permanentes industriais em cut-to-fit dardos jardim de plástico de modo que eles são capazes desuportar o enterro.
NOTA: podem ser utilizados métodos de rotulagem alternativos. - Depois de cada compartimento é cheio com a semente e o seu rótulo, selar o compartimento imediatamente com a pistola de cola de alta temperatura. Continuar até que toda a tira de sementes é completamente selado. Rotular tira geral no primeiro compartimento com repetição, bloco e / ou informações sobre o tratamento.
NOTA: Para o nosso estudo, uma vez que tivemos remoções temporais, blocos, e replicar tiras dentro de blocos, incluímos todas essas informações. - Verifique se há lacunas entre os compartimentos e cola local, conforme necessário antes de passar para a próxima faixa.
- Encha compartimentos de sementes com uma série uniforme de sementes (20 para cada compartimento são utilizados neste exemplo). Para etiquetas, use marcadores permanentes industriais em cut-to-fit dardos jardim de plástico de modo que eles são capazes desuportar o enterro.
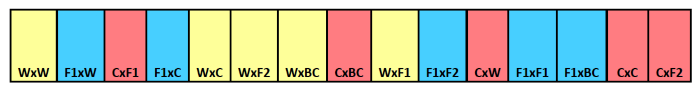
Figura 1. Enterro tira sementes esquemático. Exemplo de tira enterro mostrando identificação do tipo de cruz por compartimentos individuais. pai materno é listada primeiro com o pai paternal listada em segundo lugar. As cores indicam filiação materna diferente,com amarelo para selvagem, azul para F 1 híbrido, e vermelho para a cultura. Por favor clique aqui para ver uma versão maior desta figura.
3. Bury Tiras das sementes no campo
- Dig parcelas para a profundidade especificada para tiras de casas. Atribuir tiras para blocos individuais em que tiras são dispostas aleatoriamente para permitir data de remoção para ser usado como a trama principal e identidade compartimento (neste exemplo, tipo cruzado) como a subtrama em análise.
- Cubra com tiras de terra. Corte de metal pano de hardware malha a ser de 10 cm maior do que parcelas e coloque sobre tiras enterrados. Use U-pinos para fixar as bordas e arestas pano de cobertura com terra.
NOTA: Esta cobertura é para excluir escavadores predadores de sementes. Como outra opção, Mercer et al. 13 construídos e caixas de pano de hardware que rodeavam as tiras de sementes devido à pressão Gopher intensa em sua loca campo enterradoção.) - Coloque bandeiras de topografia coloridas para distinguir strip localização e remoção de datas para complementar registros escritas claras.
4. Excavate Tiras e Avaliar Semente
- Desenterrar tiras de sementes atribuídos a uma determinada data remoção. Manter as tiras em um ambiente úmido fresco até que eles atinjam o laboratório onde a avaliação de sementes terá lugar. Isto pode ser realizado por envolvimento das tiras no jornal molhado e colocando-os em um refrigerador para o transporte ou o envio durante a noite.
- Lavar lama e do solo a partir de tiras em água até tiras está limpo o suficiente que os detritos externos sementes não obscuros.
- Utilize uma tesoura para cortar um compartimento aberto de cada vez. Contagem de sementes germinadas e removê-los. Contagem sementes claramente mortos (por exemplo, em decomposição, ou sementes putrefied). Coloque as sementes não germinadas em rotulados, papel mata-borrão Petri porte molhada para distinguir ainda mais sementes não germinadas, dormentes e mortas.
- Coloque placas de Petri com não germinadassementes em um conjunto câmara de crescimento para as condições de germinação: 25 ° C dia / 10 ° C 12 horas / noite. Permitir que as sementes de uma semana para germinar. Tanto que, contá-las como viáveis, mas não germinadas, uma vez que não germinaram em condições de campo.
- Após o tratamento câmara de crescimento, ensaio remanescente sementes não germinadas para a viabilidade usando cloreto de tetrazólio (TZ) 13. Para conseguir isso, tornar-se uma solução por cento dos TZ adequado para a espécie de estudo usando o AOSA tetrazólio Testing Handbook 14. Para este exemplo, uma solução a 1% é utilizado.
- Corte as sementes não germinadas ao meio e coloque uma metade foram o embrião e endosperma são visíveis em uma placa de Petri contendo solução de TZ suficiente para cobrir a semente (sementes podem flutuar, isso é bom).
- Coloque pratos de Petri em TZ uma incubadora a 30 ° C e esperar 3 h. Nota: As temperaturas mais elevadas irão resultar numa reacção mais rápida, se desejado, mas overstaining é um risco.
- retirar os pratos de Petri da incubadora e avaliar. Sementes que manchados de vermelho em seus embriões são germinable, enquanto que as sementes não coradas estão mortos. Consulte o AOSA tetrazólio Testing Handbook para obter mais detalhes sobre os casos marginais distintivas e determinadas espécies.
Resultados
Tipos cruzadas com variada percentual de parentesco e cultura alelo materno (Tabela 1) diferiu através datas de remoção em percentagem germinadas, não germinadas, e semente morta (Fig. 2 e 3). Usando testes TZ das sementes não germinadas, encontramos algumas sementes verdadeiramente dormentes na segunda remoção (início da primavera) (Tabela 2), enquanto que todas as sementes não germinadas pela terceira remoçã...
Discussão
Aqui nós apresentamos métodos para usar tiras de enterro de sementes para observar a germinação das sementes, dormência e mortalidade de diversos stocks de sementes em períodos de tempo pré-selecionados no campo. As vantagens da utilização de tiras, em vez de pacotes individuais se encontram em (1) a velocidade da tira e a construção do compartimento sobre a criação de pacotes individuais; e (2) a facilidade e a velocidade de remoção de vários compartimentos em um movimento sem o perigo de omitir um paco...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
Materiais
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
Referências
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados