このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
フィールド条件の下で種子発芽、休眠、および死亡率を評価するための信頼性の高い方法
要約
ここでは、埋葬、標識されたシードストリップ及びテトラゾリウムクロリド(TZ)生存性テストを使用して、フィールド条件の下で種子生存率、発芽と休眠を評価するためのプロトコルを提示します。
要約
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
概要
この方法の全体的な目的は、確実に、フィールド条件下で経時的に種子の生存率を評価することです。
土壌シードバンクは、一過性または長年1,2持続し得るいずれかの土壌表面上に、表面のゴミの中、または土壌断面内に分散分散し、実行可能な、まだ未発芽種子の予備です。ここに提示されたものと同様のシード埋葬方法は数十種を使用して17年間の研究に適用されたときに、生存可能な種子は、3試験の種の多くで発見されました。種子休眠は生存実生のための条件の適切な組み合わせは、4を発生するまで、発芽をシードするブロックです。休眠リリースのための外部トリガが発芽することが可能になるまで休眠残って、種子がそのような低い冬の気温、栄養制限、または季節の干ばつなどの過酷な条件を、生き残るために許可することができます。休眠リリースのトリガーはfで左拡張寒さ、化合物への暴露から変化させることができます怒り、または動物の胃の酸5との磨耗や接触による種皮の物理攻撃。発芽手がかりは、属または種特異的であることと、多くの場合、過去の自然淘汰の結果でわかるように、不適応種子発芽が不適切なときに発生し、種子や苗木死亡または悪い苗の成長につながる可能性があることです。休眠は休眠リリース( 例えば 、物理的休眠、生理的休眠)のメカニズムに基づいて種類数に分類されてきたが、6種子休眠は、少なくともの1植物生物学のトピックを理解まま。したがって、個々の種または関連する生態学的条件の下で種子のグループの状態の評価を可能にするフィールドの研究は、単に実験室での標準的な発芽試験に依存しているものよりも高い説明力を持っています。
既知の種特性の搾取は休眠のメカニズムへの洞察を提供することができます。種子休眠の制御は共同です生理学的および形態学的要因の遺伝的制御を含むmplex、。休眠機構の幅を完全に理解するにはまだ解明されていないが、一般的なモデルは、2つの植物ホルモンジベレリン(GA)とアブシジン酸(ABA)7間のフィードバック関係を含む、浮上しています。 ABAは休眠状態を維持する働きをしながら、彼らの休眠に対する生理的成分を有する種子のためのこの一般化モデルでは、GAは、休眠解除のための信号となります。母性遺伝的影響だけでなく、母体の成長環境は母系生成組織と発生シグナル8を介して、休眠やサイズなどの他の種子の特性に影響を与えることができます。母性発生した外部構造体(または種子被覆材)は、生理的手がかりと組み合わせた時刻に、休眠を維持することができます。母体由来シード材が母植物の遺伝子によって制御されているので、彼らは、種子の実際の核の遺伝子構成を反映していない場合があります。私達は私達を持っていますED作物野生ハイブリッドの配列からヒマワリの1年生の痩果は9,10。このように、多様な種、十字型、または遺伝子型を含む研究デザインについての情報を収集することができますシードの特性上、これらの母体の対胚遺伝的影響を引き出すために交差します種子休眠、発芽および生存の生態と遺伝。
種子発芽および生存の表現型は、人口動態に影響を与えることができる方法の重要な例は、作物野生ハイブリッドゾーンで見ることができます。栽培植物の栽培時の選択はほとんど休眠性を排除し、成長期の外で生き残るために種子の能力を低下させます。しかし、作物の野生ハイブリッドゾーンの栽培と野生型間の遺伝子流動、またはハイブリダイゼーションは、種子バンクのダイナミクスの潜在的な影響で、野生集団に作物の対立遺伝子(または遺伝子変異体)を再導入することができます。栽培と近縁野生種間の雑種は、潜在的に有することができる作物野生ハイブリッドゾーンで発見しますわずか数栽培の外部条件を生き残るために期待される表現型( 例えば 、冬季)11との中間休眠の表現型の多様性、。
この原稿の目的は、私たちが現場条件の下で彼らの自然な変化を調査するために、異なる期間で発芽、休眠、および種子の種類の範囲の生存を評価することができるシード埋葬ストリップ法を使用して、方法を示すことです。私たちは種子の特性上、母体と胚遺伝的影響に興味を持っているので、この例では、15作物野生ハイブリッドクロスタイプからヒマワリの種を採用しました。
プロトコル
1.複数の種または単一の種の制御された交雑から種子を収集
注:母性(シード生成する)親として野生、ハイブリッド、および作物の種類を使用して、種ヒマワリの1年生内の15のクロスタイプ(ヒマワリ)から種子を使用この例。
- 生育期の終わりに、標識された袋に成熟種子の頭を収集します。標準形式での親のクロスタイプ( すなわち 、母性のx父方)で標識された封筒での籾殻と場所、種子からクリーンシード。
- 同一の親のクロスタイプの同数から種子の等量を使用して大規模な封筒で一緒にバルク種子。例えば、同じ母系と父系の両親と10のクロスタイプから100の種子。 (クロスタイプ)の情報を識別して封筒にラベルを付けます。これらの大きな封筒は、第2節に埋葬ストリップを充填で使用するためのシードマスターです。
| 母親の親 | |||
| 父方の親 | ワイルド:WxW | F 1:WXC | クロップ:CXC |
| ワイルド:WxW | 0%WxW | 25%F 1 XW† | 50%CXW† |
| BC:WxF1またはF1xW | 12.5%WxBC | 37.5%F 1 XBC | 62.5%CxBC |
| F 1:WXC | 25%WxF 1† | 50%F 1 XF 1 | 75パーセントのCxF 1† |
| F 2:F 1 XF 1 | 25%WxF 2 | 50%F 1 XF 2 | 75パーセントのCxF 2 |
| クロップ:CXC | 50%WXC† | 75%のF 1クロスシー† | 100%CXC |
表1.親のクロストン手受粉。ひまわりの作物野生ハイブリッドクロスタイプから生産YPESはシード埋葬実験で使用するための人工授粉を用いて製造されました。すべてのクロスタイプの場合、母体の親が最初にリストされ、父方の親は、第二記載されています。 †でマークされたクロス型は同じ%の作物の対立遺伝子が異なる母方の両親との相互クロスタイプのペアの一部です。ペース、BA ら :表は、以前に公開されています。 (2015)15。
2.カスタムシード埋葬ストリップを作成します。
注:この例では、3除去日付トリートメントや15の反復を持っていたので、我々は合計45ストリップを必要としました。この例では、ストリップあたり15区画はので、私たちは15、7×10cmの区画を収容するために十分な細かいメッシュのポリエステル布や蚊帳を必要と使用しています。 図1を参照してください。
- 各シードストリップのための布の20×10センチメートルのストリップを切断することによって起動します。
- その後、半分に生地を折る、測定し、区画をマーク。 HIGを使用しましたH-温度グルーガンは、1ショート(10センチメートル)の端をシールします。接着剤が少しではなく、完全に冷えたら、シールを作成するために一緒に生地の側面を押してください。
注意:皮膚との接触が延長される場合は高温接着剤や接着剤銃のヒントは、火傷を引き起こす可能性があります。 - 各区画マークで開いた短い方の端に折り畳まれた縁から、グルーライン。コンパートメント間の穴がないシールを確実にするために接着剤の線に沿って2つのファブリックの側面を押してください。コンパートメントの間の移行種子は実験誤差に寄与する。
注:今の区画が作成されていることを、折り畳まれていないエッジが開いて種子とその識別情報(クロスタイプ名)を受信する準備ままにしてください。 - ランダムに各ストリップのための区画にシードクロスタイプを割り当てます。
- 種子の背番号(各区画20は、この例で使用されている)でシードコンパートメントを埋めます。ラベルには、彼らがすることができるようにカットツーフィットプラスチックの庭のダーツに産業マーカーを使用埋葬に耐えます。
注意:代替的標識法を使用することができます。 - 各区画は、種子及びそのラベルで充填された後、高温の接着剤銃で直ちに区画をシール。全体シードストリップが完全に密封されるまで進みます。複製、ブロックおよび/または治療情報と第一の区画で、全体的なストリップにラベルを付けます。
注:私たちは時間的な除去、ブロックを持っていたし、ブロック内のストリップを複製するため、私たちの研究のために、私たちはこの情報のすべてが含まれていました。 - 次のストリップに移動する前に、必要に応じて区分し、スポット接着剤の間のギャップを確認してください。
- 種子の背番号(各区画20は、この例で使用されている)でシードコンパートメントを埋めます。ラベルには、彼らがすることができるようにカットツーフィットプラスチックの庭のダーツに産業マーカーを使用埋葬に耐えます。
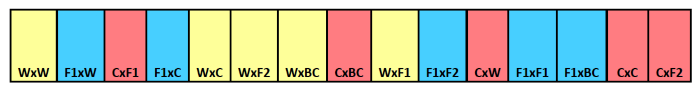
図1.埋葬シードストリップ概略図。個々の区画のためのクロスタイプ識別を示す埋葬ストリップの例。母親の親は、第二の列挙され父方の親と最初に表示されます。色は異なる母体の親子関係を示し、作物のためのF 1雑種のための青、野生の黄色、赤と。 この図の拡大版をご覧になるにはこちらをクリックしてください。
3.フィールドにシードストリップベリー
- 家のストリップに指定された深さにプロットを掘ります。分析におけるサブプロットとしてストリップはランダム除去日がメインプロットと区画IDとして使用されることを可能にするために配置された個々のブロック(この例では、十字型)にストリップを割り当てます。
- 地球とストリップをカバーしています。カット金属メッシュのハードウェア布が埋設されたストリップの上にプロットし、場所10cmよりも大きくなるように。地球とエッジとカバーの布端を固定するU-ピンを使用してください。
注:このカバーは穴を掘るシード捕食者を排除するためです。別の選択肢として、マーサーら 13を構築し、その分野のLOCAに強烈なゴーファーの圧力に起因するシードストリップを囲まれたハードウェア布の箱を埋める。) - ストリップの場所と除去の日付が明確に書かれたレコードを補完するために区別するために着色された測量のフラグを配置します。
4.ストリップを発掘し、種子を評価
- 与えられた除去の日付に割り当てられたシードストリップを掘ります。彼らは種子の評価が行われる実験室に到達するまでクールな湿った環境でストリップを維持します。これは、湿った新聞にストリップを包装及び輸送または翌日配達のためにクーラーに置くことによって達成することができます。
- ストリップは、外部破片があいまい種子ないことを十分にきれいになるまで水でストリップからの泥や土を洗い流してください。
- 一度にオープンつの区画をカットするはさみを使用してください。発芽した種子をカウントし、それらを削除します。明らかに死んだ種子( 例えば、腐敗、または腐敗の種子)をカウントします。さらに、未発芽休眠、および死んだ種を区別するために標識、濡れたペトリサイズ吸取紙に未発芽種子を置きます。
- 発芽してペトリ皿を置きます25°C / 10°C 12時間の昼/夜:標準的な発芽条件のための成長チャンバセットに種子。シード1週間が発芽することを許可します。でもそれ、彼らは野外条件下で発芽しなかったので、これらのような生存したが、未発芽をカウントします。
- 成長チャンバ処理後、試験はテトラゾリウムクロリド(TZ)13を用いて生存率を未発芽種子の残り。これを達成するために、AOSAテトラゾリウム試験ハンドブック14を用いた研究の種のためのTZの適切なのパーセント溶液を作ります。この例では、1%溶液が使用されます。
- 半分に未発芽種子をカットし、半分を置き、胚と胚乳は(種子が浮くことがあり、これは大丈夫です)種子をカバーするのに十分なTZ溶液を含むペトリ皿に表示されました。
- 30℃に設定したインキュベーターにTZペトリ皿を置き、3時間を待ちます。注:必要であれば、より高い温度は、より速い反応になりますが、過度染色は危険です。
- インキュベーターからペトリ皿を削除し、評価します。染色されていない種子が死んでいる一方で、その胚で赤色に染色されている種子は、発芽可能です。マージナル例および特定の種を区別について詳しくは、AOSAテトラゾリウムテストハンドブックを参照してください。
結果
多様母体の親子と作物の対立遺伝子の割合がクロスタイプ( 表1)は、パーセントで除去日付を横切って異なった未発芽、発芽、および死んだ種子( 図2及び3)。第三の除去(スプリング)により未発芽すべての種子が本当に休止状態であることが判明した一方で未発芽種子のTZテストを使用して、我々は、第二の除去(早春)(...
ディスカッション
ここでは、フィールド内の予め選択された期間での種子発芽、休眠および多様な種株式の死亡率を観察するために、シード埋葬ストリップを使用するための方法を提示します。個々のパケットは、個々のパケットの作成以上のストリップとコンパートメント構造の(1)の速度にあるのではなくストリップを使用することの利点。 (2)パケットを省略したり、意図せずにいずれかを除去する?...
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
資料
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
参考文献
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved