JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
이 필드 조건에서 종자 발아, 휴면 및 사망률을 평가하기위한 신뢰할 수있는 방법
요약
여기에서 우리는 장사 표시 씨 스트립 및 테트라 졸륨 클로라이드 (TZ) 생존 능력 테스트를 사용하여 필드 조건에서 종자 생존, 발아 및 휴면을 평가하기위한 프로토콜을 제시한다.
초록
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
서문
이 방법의 전체 목표는 안정적으로 현장 조건 하에서 시간이 지남에 따라 시드 생존율을 평가하는 것이다.
토양 종자 은행은 일시적으로 또는 몇 년 1,2 지속 수도 있고 토양 표면에, 표면 쓰레기 내에서, 또는 토양 프로필 내에서 분산 분산, 가능한 아직 발아 씨앗의 예약입니다. 여기에 제시된 것과 유사한 씨의 매장 방법은 수십 종을 사용하여 17 년간의 연구에 적용되었을 때, 가능한 씨앗 3 시험 종의 다양한에서 발견되었다. 종자 휴면 생존을 모종의 조건의 적절한 조합 4 발생할 때까지 발아 종자하는 블록이다. 휴면 출시에 대한 외부 트리거가 발아 수 있습니다 때까지 대기 남은 씨앗이 낮은 겨울 온도, 양분 제한, 또는 계절 가뭄 등의 가혹한 조건을 살아남을 허용 할 수 있습니다. 휴면 출시에 대한 트리거는 f를 왼쪽으로 확장 감기, 화합물에 노출 다를 수 있습니다분노, 또는 동물 위산 5 마모 또는 연락처를 통해 종피의 물리적 공격. 발아 큐는 장군 또는 특정 종 수 종종 과거의 자연 선택의 결과 바와 같이, 부적응 종자 발아는 부적절한 시간에 발생하고, 씨앗이나 모종 사망 또는 불량 묘목의 성장을 초래할 수있는 것입니다. 휴면이 휴면 해제 (예를 들어, 물리적 휴면 생리적 휴면)의 메커니즘에 기초한 유형들로 분류되었지만, 6 종 휴면는 적어도 하나의 식물 생물학 주제 이해 남아있다. 따라서, 개별 씨앗 또는 관련 생태 학적 조건에서 씨앗의 그룹의 상태 평가를 허용 현장 연구는 단순히 실험실에서 표준 발아 검사에 의존하는 것보다 더 높은 설명력을 가지고있다.
알려진 종자의 특성을 악용 수면의 메커니즘에 대한 통찰력을 제공 할 수 있습니다. 종자 휴면의 제어는 공동생리 학적 및 형태 학적 요인의 유전 적 제어를 포함 mplex. 휴면 메커니즘의 폭의 완벽한 이해는 아직 밝혀지지 하였지만, 일반적인 모델은 두 식물 호르몬 Gibberellic 산 (GA) 및 아브시 스산 (ABA) (7) 사이의 피드백 관계를 수반 나왔다. ABA는 휴면 상태를 유지하는 역할을하면서 수면에 대한 생리 학적 성분과 씨앗이 일반화 된 모델에서, GA는 휴면 릴리스에 대한 신호 역할을한다. 모성 유전 적 효과뿐만 아니라 모체 생성 조직과 발달 신호 (8)를 통해 휴면 및 크기와 같은 다른 종자 특성을, 영향을 미칠 수 모체 성장 환경을 제공합니다. 모계 생리 학적 단서와 함께 시간, 수면 상태를 유지할 수있다 외부 구조 (또는 종자 코팅)을 생성합니다. 모계 유래 된 종자 코팅은 어머니 식물의 유전자에 의해 제어되기 때문에, 그들은 씨의 실제 핵 유전 메이크업을 반영하지 않을 수 있습니다. 우리는 우리가에드 작물 야생 하이브리드의 배열에서 Helianthus의 annuus의 수과는 9,10. 따라서, 다양한 종, 크로스 타입, 또는 유전자형을 포함하는 연구 설계가에 대한 정보를 수집합니다 수 종자 특성에 이러한 산모 대 배아 유전 적 영향을 애타게 교차 생태와 종자 휴면, 발아과 생존의 유전학.
종자 발아 및 생존 표현형 인구 역학에 영향을 미칠 수있는 방법의 중요한 예는 작물 야생 하이브리드 영역에서 볼 수 있습니다. 재배 식물의 순화 동안 선택은 대부분의 휴면을 제거하고 성장시기 이외의 생존을 위해 시드의 능력을 감소시킨다. 그러나 작물 야생 하이브리드 영역에서의 재배와 야생 유형 간의 유전자 이동, 또는 하이브리드, 종자 은행 역학에 대한 잠재적 영향과, 야생 인구에 작물 대립 유전자 (또는 유전자 변형)을 재 도입 할 수 있습니다. 재배와 야생 친척 사이의 잡종은 잠재적으로 소유 할 수있다 작물 야생 하이브리드 영역에서 발견재배 (예를 들어, 겨울) (11)의 외부 조건을 살아남을 것으로 예상 몇 표현형과 중간 휴면 표현형의 다양한.
이 논문의 목적은 우리가 현장 조건 하에서 자연 변화를 조사하기 위해 상이한 시간 기간에서 발아 휴면 및 시드 유형의 범위의 생존을 평가할 수 시드 매장 스트립 방법을 사용하는 방법을 보여주고있다. 우리는 종자 특성에 산모와 태아 유전 적 영향에 관심이 있기 때문에 우리의 예에서 우리는 15 작물 야생 하이브리드 크로스 유형에서 해바라기 씨앗을 고용했다.
프로토콜
1. 여러 종 (種) 또는 단일 종의 제어 십자가에서 종자를 수집
참고 : 산모 (시드 일으키기) 부모 야생, 하이브리드, 작물 유형을 사용하여 종 Helianthus의 annuus (해바라기)에서 15 크로스 타입에서이 예를 사용 씨앗을.
- 성장시기의 끝에, 라벨 가방 성숙한 씨앗 머리를 수집합니다. 표준 형식 (즉, 산모 X의 아버지)에서 부모의 십자가 형으로 표시 봉투에 왕겨와 장소 씨앗에서 청소 씨.
- 동일한 부모의 크로스 유형의 같은 수의 씨앗 같은 양을 사용하여 큰 봉투에 함께 벌크 씨. 예를 들어, 같은 어머니와 아버지의 부모와 함께 10 크로스 타입 100 씨앗. 식별 (크로스 타입) 정보 봉투 레이블. 이 대형 봉투 2 장에 매장 스트립 작성에 사용 시드 주인입니다.
| 모자 부모 | |||
| 아버지의 부모 | 야생 : WxW | F 1 : WXC | 자르기 : CXC |
| 야생 : WxW | 0 % WxW | 25 % F 1 XW † | 50 % CXW † |
| BC : WxF1 또는 F1xW | 12.5 % WxBC | 37.5 % F 1 XBC | 62.5 % CxBC |
| F 1 : WXC | 25 % WxF 1 † | 50 % F 1 XF 1 | 75 % CXF 1 † |
| F 2 : F 1 XF 1 | 25 % WxF 2 | 50 % F 1 XF (2) | 75 % CXF 2 |
| 자르기 : CXC | 50 % WXC † | 75 % F 1 XC † | 100 % CXC |
표 1. 부모의 크로스 t손 수분. 해바라기 작물 야생 하이브리드 크로스 타입에서 생산 씨네마 스테이션은 시드 매장 실험에 사용하기 위해 손 수분으로 생산되었다. 모든 크로스 유형의 경우, 산모의 부모가 먼저 나열하고 아버지의 부모는 두 번째 목록. † 표시 크로스 유형은 동일한 % 작물 대립하지만 서로 다른 산모 부모와 함께 상호 교차 형 쌍의 일부입니다. 페이스, BA 등 표는 이전에 발표되었다. (2015) 15.
2. 사용자 지정 종자 매장 스트립 만들기
참고 :이 예를 들어, 우리는 세 가지 제거 날짜 트리트먼트와 15 복제가 있었다, 그래서 우리는 총 45 스트립이 필요합니다. 이 예는 스트립 당 15 구획 그래서, 우리는 15, 7 × 10cm 구획을 수용하기에 충분한 미세 메쉬 폴리 에스테르 직물 또는 모기장이 필요합니다. 그림 1을 참조하십시오.
- 각 씨 스트립에 대한 직물의 20 × 105cm 스트립을 절단하여 시작합니다.
- 다음 반으로 직물을 배, 측정 및 구획을 표시합니다. HIG를 사용하여시간 - 온도 접착제 총, 하나의 짧은 (10cm) 끝을 밀봉. 접착제가 약간 있지만 완전히 냉각되면, 시일을 생성하기 위해 함께 직물 측면을 누른다.
주의 : 피부와 접촉이 장기간 인 경우 고온 접착제 및 접착제 총 팁 화상을 입을 수 있습니다. - 각 구획 시점에서 개방 짧은 끝에 접힌 가장자리에서 접착제 라인. 구획 사이의 구멍없이 씰을 보장하기 위해 접착제 라인을 따라 함께 두 패브릭면을 누릅니다. 구획 사이에 이주 씨는 실험 오차에 기여한다.
참고 : 이제 구획이 만들어 졌는지, 펼쳐진 가장자리 씨와 자신의 식별 정보 (크로스 타입 이름)을받을 오픈 준비 남아 있어야한다. - 무작위로 각 스트립에 대한 구획 씨 크로스 유형을 지정합니다.
- 종자의 균일 한 수 (각 구획 20이 예에서 사용되는)과 종자 구획을 입력합니다. 그들이 할 수 있도록 라벨, 컷에 맞는 플라스틱 정원 다트에 산업 영구 마커를 사용매장을 견딜.
주 : 대체 라벨링 방법이 사용될 수있다. - 각 구획 시드 및 라벨로 채워진 후, 고온 접착제 총을 즉시 밀봉 구획. 전체 시드 스트립이 완전히 밀폐 될 때까지 진행합니다. 복제, 블록 및 / 또는 치료 정보 첫 번째 칸에 전체 스트립 레이블.
참고 : 우리는 시간 제거, 블록을 가지고 있었고, 블록 내에서 스트립을 복제하기 때문에 우리의 연구를 위해, 우리는이 모든 정보를 포함. - 다음 지구로 이동하기 전에 필요에 따라 구획 및 현장 접착제 사이의 간격을 확인합니다.
- 종자의 균일 한 수 (각 구획 20이 예에서 사용되는)과 종자 구획을 입력합니다. 그들이 할 수 있도록 라벨, 컷에 맞는 플라스틱 정원 다트에 산업 영구 마커를 사용매장을 견딜.
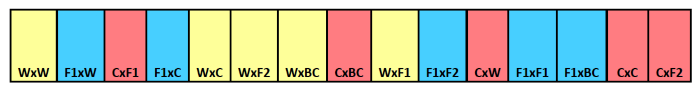
각 구획에 대한 크로스 타입 식별을 보여주는 매장 스트립의 그림 1. 매장 씨 스트립 개략도. 예. 산모의 부모는 두 번째 나와있는 아버지의 부모와 먼저 나열됩니다. 색상이 다른 산모의 혈통을 표시작물에 대한 F 1 하이브리드 블루, 야생 노란색 및 빨간색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 필드에서 시드 스트립 묻어
- 집 스트립 지정된 깊이 플롯을 파. 분석의 줄거리 등 (이 예에서, 크로스 타입) 메인 플롯 및 구획 ID로 사용되는 스트립은 임의로 삭제 날짜를 허용하도록 배열 된 개별 블록 스트립을 할당한다.
- 지구와 스트립을 커버. 컷 금속 메쉬 하드웨어 천에 묻혀 스트립을 통해 플롯과 장소보다 10cm 더 클 수 있습니다. 지구와 가장자리와 커버 천의 가장자리를 확보하기 위해 U 핀을 사용합니다.
참고 :이 덮개가내는 씨앗 포식자를 제외입니다. 또 다른 옵션으로, 머서 등. (13)는 건설 및 필드 삶을에 강한 고퍼 압력에 의한 종자 스트립을 포위 하드웨어 천 상자를 묻혀기.) - 스트립 위치 및 제거 날짜가 분명 서면 기록을 보완하기 위해 구분하는 색깔 측량의 플래그를 배치합니다.
4. 스트립을 발굴하고 종자를 평가
- 주어진 제거 날짜에 할당 씨 스트립을 발굴. 그들은 시드 평가가 진행됩니다 실험실에 도달 할 때까지 서늘하고 습한 환경에서 스트립을 유지한다. 이것은 젖은 신문에 스트립 포장 및 운송 또는 특급 배송 쿨러에 배치하여 수행 할 수 있습니다.
- 스트립 충분히 그 외부 이물질 것 모호하지 씨앗 깨끗해질 때까지 물에 스트립에서 진흙과 흙을 씻어.
- 한 번에 오픈 한 구획을 잘라 가위를 사용합니다. 발아 씨앗을 계산하고이를 제거합니다. 분명히 죽은 씨앗 (예를 들어, 부패, 또는 부패 씨앗)를 계산합니다. 또한, 발아 휴면, 죽은 씨앗을 구별하기 위해 표시, 젖은 페트리 크기 블로터 종이에 발아 씨앗을 놓습니다.
- 발아와 배양 접시를 놓습니다25 ° C / 10 ° C 12 시간 주 / 야간 : 표준 발아 조건에 대한 성장 챔버 세트에 씨앗. 씨앗 일주가 발아 할 수 있습니다. , 가능한 이러한 계산하지만, 현장 조건에서 발아하지 않았기 때문에 발아 않는 모든.
- 성장 챔버의 처리 후, 검사는 테트라 졸륨 클로라이드 (TZ) (13)를 사용하여 생존력에 대해 발아 종자 남아. 이를 위해 AOSA 테트라 졸륨 테스트 핸드북 (14)를 사용하여 연구 종에 대한 TZ 적절한의 퍼센트 솔루션을 구성한다. 예를 들어, 1 % 용액이 사용된다.
- 반으로 발아 씨앗을 잘라 절반을 배치 배아와 배젖은 씨앗을 충당하기에 충분한 TZ 솔루션을 포함하는 배양 접시에서 볼 수 있었다 (씨앗이 괜찮 떠있다).
- 30 ° C로 설정 인큐베이터에 TZ 배양 접시를 놓고 3 시간을 기다립니다. 원하는 경우 더 높은 온도, 빠른 반응 발생합니다,하지만 위험이 overstaining입니다 있습니다.
<리>는 인큐베이터에서 배양 접시를 제거하고 평가합니다. 흠 씨가 죽은하면서 배아에 빨간 염색 한 씨앗, germinable 있습니다. 구별 한계 케이스 및 특정 종에 대한 세부 사항에 대한 AOSA 테트라 졸륨 테스트 안내서를 참조하십시오.
결과
다양한 어머니의 혈통과 작물 대립 유전자 비율 (표 1)와 크로스 유형 %가, 발아 발아에서 제거 날짜에 걸쳐 차이, 죽은 씨앗 (그림. 2, 3). 세 번째 제거 (봄)에 의해 발아 모든 씨앗이 진정으로 휴면 것으로 밝혀졌다 동안 발아 씨앗 TZ 테스트를 사용하여, 우리는 두 번째 제거 (이른 봄) (표 2)에서 일부 진정으로 ...
토론
여기에서 우리는 현장에서 미리 선택된 기간에 종자 발아, 휴면 및 다양한 종자 주식의 사망률을 관찰 시드 매장 스트립을 사용하는 방법을 제시한다. 각각의 패킷은 개별 패킷의 생성을 통해 스트립 실 구조 (1)의 속도에 놓여보다는 스트립을 사용하는 장점; 및 (2)를 용이하게하고, 패킷을 생략 또는 실수를 제거하는 위험이없이 하나의 동작으로 복수의 구획을 제거하는 속도. 토양이 어려운 현?...
공개
The authors have nothing to disclose.
감사의 말
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
자료
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
참고문헌
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유