È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodo affidabile per valutare la germinazione dei semi, dormienza, e mortalità in normali condizioni operative
In questo articolo
Riepilogo
Qui vi presentiamo un protocollo per la valutazione sopravvivenza dei semi, la germinazione e la dormienza in condizioni di campo che utilizzano sepolti, strisce sementi etichettate di test vitalità cloruro di tetrazolio (TZ).
Abstract
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
Introduzione
L'obiettivo generale di questo metodo è quello di valutare in modo affidabile la sopravvivenza seme nel tempo in condizioni di campo.
Banche del seme del terreno sono una riserva di dispersi, semi non germinati ancora vitali distribuiti sia sulla superficie del suolo, all'interno lettiera di superficie o all'interno del profilo del suolo, che possono persistere transitoriamente o per molti anni 1,2. Quando i metodi di sepoltura di semi simili a quelli presentati qui sono stati applicati ad uno studio di 17 anni con diverse decine di specie, semi vitali sono stati trovati in molte delle specie testate 3. Seed dormienza è un blocco di germinazione dei semi fino a quando la combinazione appropriata delle condizioni per la sopravvivenza piantina nascono 4. Rimanendo dormiente può permettere semi di sopravvivere condizioni difficili, come ad esempio basse temperature invernali, la limitazione di nutrienti, o siccità stagionale, fino a quando un trigger esterno per la dormienza-release consente per la germinazione. Trigger per dormienza-release possono variare da esposizione al freddo estesi, composti lasciati da fire, o attacco fisico sul cappotto di seme per abrasione o il contatto con gli acidi dello stomaco degli animali 5. Come spunti di germinazione possono essere generi o specie specifici e spesso il risultato di oltre la selezione naturale, disadattivi germinazione dei semi è quella che si verifica in un momento inopportuno, e può causare la mortalità semi o piantine o scarsa crescita delle piantine. Mentre dormienza è stato classificato in un certo numero di tipi basati sui meccanismi di dormienza rilascio (ad esempio, dormienza fisica, dormienza fisiologica), 6 seme dormienza rimane una delle meno argomenti inteso in biologia vegetale. Così, gli studi sul campo che consentono di valutare lo stato dei singoli semi o gruppi di semi in condizioni ecologiche rilevanti hanno una maggiore capacità esplicativa di quelli che semplicemente si basano su prove di germinazione standard in laboratorio.
Lo sfruttamento delle caratteristiche del seme note in grado di fornire informazioni sui meccanismi di dormienza. Controllo di dormienza seme è complex, compreso il controllo genetico di fattori fisiologici e morfologici. Mentre una comprensione completa della larghezza di meccanismi dormienza è ancora stata chiarita, un modello generale è emersa, comportante un rapporto di feedback tra i due ormoni vegetali acido gibberellico (GA) e abscissico (ABA) 7. In questo modello generalizzato per semi con una componente fisiologica alla loro dormienza, GA serve come segnale di immissione dormienza, mentre ABA serve a mantenere lo stato dormiente. Effetti genetici materni, nonché l'ambiente di crescita materno può influenzare dormienza e altri tratti di semi, come la dimensione, attraverso i tessuti maternamente generati ei segnali di sviluppo 8. Maternamente generato strutture esterne (o rivestimenti di semi) può mantenere la dormienza, a volte in combinazione con spunti fisiologici. Dal rivestimenti di semi di origine materna sono controllati dai geni della pianta madre, essi potrebbero non riflettere reale make-up genetico nucleare del seme. Noi ci abbiamoEd i acheni Helianthus annuus da una serie di ibrido crop-wild attraversa per prendere in giro questi materna vs. embrione effetti genetici sulle caratteristiche del seme 9,10. Così, disegni di studio che includono diverse specie, i tipi di croce, o genotipi possono raccogliere informazioni circa la ecologia e genetica di semi di dormienza, la germinazione e la sopravvivenza.
Un importante esempio di come semi di germinazione e sopravvivenza fenotipi possono influenzare la dinamica delle popolazioni può essere visto in zone ibride colture-wild. Selezione durante la domesticazione delle piante coltivate elimina la maggior parte dormienza e riduce la capacità di un seme di sopravvivere al di fuori della stagione di crescita. Eppure flusso genico, o ibridazione, tra i tipi coltivate e selvatiche nelle zone ibride colture-wild possono reintrodurre alleli nel grano (o varianti genetiche) in una popolazione selvatica, con potenziali effetti sulle dinamiche della banca del seme. Ibridi tra parenti coltivate e selvatiche potenzialmente trovano in zone ibride colture-wild può possedereuna varietà di fenotipi dormienza intermedi, con pochi fenotipi attesi per sopravvivere condizioni di fuori della coltivazione (es mesi invernali) 11.
Lo scopo di questo manoscritto è quello di mostrare come, utilizzando il metodo della striscia di sepoltura seme, siamo in grado di valutare la germinazione, dormienza, e la sopravvivenza di una vasta gamma di tipologie di semi in diversi periodi di tempo per indagare la loro variazione naturale in condizioni di campo. Nel nostro esempio, abbiamo impiegato semi di girasole da 15 tipi di ibridi incrociati colture-wild dal momento che siamo interessati ad effetti genetici materni ed embrione sulle caratteristiche del seme.
Protocollo
1. Raccogliere seme da più specie o Croci controllata di una singola specie
Nota: Questo esempio del seme utilizzato da 15 tipi incrociate all'interno della annuus specie Helianthus (girasole) utilizzando selvaggio, ibrido, e tipi di colture come il genitore materno (che produce seme).
- Alla fine della stagione di crescita, raccogliere teste di semi maturi in sacchetti etichettati. Pulire seme dal loglio e luogo di semi in buste etichettati con dei genitori a croce in formato standard (ad esempio, materno x paterna).
- seme di massa insieme in grandi buste utilizzando la stessa quantità di seme da un numero uguale di identici tipi trasversali dei genitori. Ad esempio, 100 semi da 10 tipi incrociate con gli stessi genitori materni e paterni. Etichettare le buste con l'identificazione (tipo incrociato) le informazioni. Queste buste grandi sono maestri di sementi da utilizzare nella compilazione strisce sepoltura nella sezione 2.
| Parent materna | |||
| Parent Paternal | Wild: wXw | F 1: WXC | Crop: CxC |
| Wild: wXw | 0% wXw | 25% F 1 xW † | 50% CXW † |
| BC: WxF1 o F1xW | 12,5% WxBC | 37,5% F 1 XBC | 62,5% CxBC |
| F 1: WXC | 25% wxf 1 † | 50% F 1 xF 1 | 75% CxF 1 † |
| F 2: F 1 xF 1 | 25% wxf 2 | 50% F 1 xF 2 | 75% CxF 2 |
| Crop: CxC | 50% WXC † | 75% F 1 xC † | 100% CxC |
Tabella 1. parentale croce tIPI prodotte dalla mano impollinazione. girasole tipi incrociati ibride colture-wild sono state prodotte con la mano l'impollinazione per l'uso in esperimento di semi di sepoltura. Per tutti i tipi di fondo, il genitore materno elencato per primo e il genitore paterna elencato secondo. tipi Croce contrassegnati con † fanno parte di reciproci coppie di tipo trasversale con gli stessi alleli% del raccolto, ma diversi genitori materni. La tabella è stata precedentemente pubblicata in: Pace, BA et al. (2015) 15.
2. Creare personalizzate strisce Burial Seed
NOTA: In questo esempio, abbiamo avuto tre trattamenti data di uscita e 15 replicati, quindi abbiamo richiesto 45 strisce totale. Questo esempio utilizza 15 scomparti per striscia così, abbiamo richiesto abbastanza tessuto di poliestere a maglia fine o zanzariere per ospitare 15, 7 x 10 cm scomparti. Vedere la Figura 1.
- Inizia dal taglio di una striscia di 20 x 105 centimetri di tessuto per ogni striscia di semi.
- Misurare e segnare scomparti, quindi piegare il tessuto a metà. Utilizzando un higpistola per colla h-temperatura, guarnizione uno corto (10 cm) fine. Una volta che la colla si raffredda leggermente, ma non completamente, premere i lati del tessuto insieme per creare una tenuta.
ATTENZIONE: ad alta temperatura colla e colla punte pistola può provocare ustioni se il contatto con la pelle è prolungata. - linee di colla dal bordo ripiegato della breve estremità aperta ad ogni segno di comparto. Premere le due parti di tessuto insieme lungo le linee di colla per garantire guarnizioni senza fori tra i compartimenti. I semi che migrano tra i compartimenti contribuiscono a errore sperimentale.
NOTA: Ora che sono stati creati i comparti, il bordo spiegato dovrebbe rimanere aperto e pronto a ricevere semi e le loro informazioni di identificazione (nome croce tipo). - Casualmente assegnare i tipi di croce seme di scomparti per ogni striscia.
- Riempire compartimenti seme con un unico numero di semi (20 per ciascun comparto sono utilizzati in questo esempio). Per le etichette, usare marcatori permanenti industriali sul cut-to-fit freccette da giardino in plastica in modo che siano in grado diresistere sepoltura.
NOTA: i metodi di etichettatura alternative possono essere utilizzati. - Dopo ogni scomparto è riempita con semi e la sua etichetta, chiudere il vano immediatamente con la pistola colla ad alta temperatura. Proseguire fino a quando l'intera striscia di seme è completamente sigillato. Etichettare striscia complessiva nel primo compartimento con replicare, blocco e / o informazioni sul trattamento.
NOTA: Per il nostro studio, dato che abbiamo avuto traslochi temporali, blocchi, e si replicano le strisce all'interno di blocchi, abbiamo incluso tutte queste informazioni. - Verificare la presenza di spazi tra compartimenti e colla posto come necessario prima di passare al successivo strip.
- Riempire compartimenti seme con un unico numero di semi (20 per ciascun comparto sono utilizzati in questo esempio). Per le etichette, usare marcatori permanenti industriali sul cut-to-fit freccette da giardino in plastica in modo che siano in grado diresistere sepoltura.
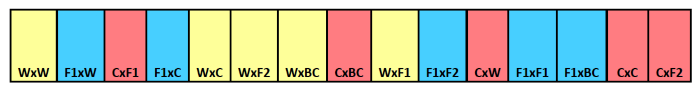
Figura 1. sepoltura striscia seme schematica. Esempio di striscia sepoltura mostrando identificazione del tipo di croce per i singoli comparti. genitore materno è nominata per prima con il genitore paterna elencati secondo. I colori indicano diversa discendenza materna,con il giallo per il selvaggio, blu per F 1 ibrido, e rosso per il raccolto. Cliccate qui per vedere una versione più grande di questa figura.
3. Bury strisce seme nel campo
- Scavare trame alla profondità specificata per le strisce di casa. Assegnare strisce a singoli blocchi in cui strisce sono disposte in modo casuale per consentire la data di uscita da utilizzare come trama principale e l'identità vano (in questo esempio, di tipo incrociato) come sottotrama in analisi.
- Coprire le strisce con la terra. Tagliare il metallo panno hardware di maglie, da 10 cm più grande di trame e posto oltre le strisce sepolti. Utilizzare U-pin per proteggere i bordi e gli spigoli della copertura del panno con la terra.
NOTA: Questo rivestimento è di escludere che scavano i predatori di semi. Come ulteriore opzione, Mercer et al. 13 costruito e scatole di stoffa hardware che circondavano le strisce di sementi a causa della forte pressione Gopher nel loro campo loca sepoltizione.) - Mettere bandiere di geometra colorato per distinguere posizione strip e rimozione date per completare record chiaro scritte.
4. Scavare strisce e valutare Seed
- Scavare le strisce di semi assegnati a una certa data rimozione. Mantenere le strisce in un ambiente umido fresco fino a raggiungere il laboratorio in cui la valutazione del seme avrà luogo. Questo può essere realizzato avvolgendo strisce in giornali bagnati e metterli in un dispositivo di raffreddamento per il trasporto o il trasporto di notte.
- Risciacquare fango e terreno da strisce in acqua fino a quando le strisce sono abbastanza pulite che i detriti esterni saranno non oscuri i semi.
- Usare le forbici per tagliare aperto uno scomparto alla volta. Conte semi germinati e rimuoverli. Conte semi chiaramente morti (ad esempio, Marcio, o semi putrefatti). Mettere i semi non germinati in etichetta, carta assorbente umida Petri dimensioni per distinguere ulteriormente i semi non germinati, dormienti, e morti.
- Posizionare piastre di Petri con non germinato schiacciatosemi in un set di camera di crescita per le condizioni di germinazione standard: 25 ° C / 10 ° C 12 ore giorno / notte. Consentire semi una settimana di germinare. Qualsiasi che, contare questi come valida, ma non germinati dal momento che non germinano in condizioni di campo.
- Dopo il trattamento camera di crescita, prova rimanendo semi non germinati per la vitalità usando Tetrazolium cloruro (TZ) 13. Per fare questo, costituiscono una soluzione per cento di TZ adatti alla specie di studio utilizzando il AOSA Tetrazolium Testing Handbook 14. Per questo esempio, si usa una soluzione 1%.
- Tagliare i semi non germinati a metà e porre una metà erano l'embrione e endosperma sono visibili in una capsula di Petri contenente soluzione abbastanza TZ per coprire il seme (semi possono galleggiare, questo è bene).
- Posizionare i piatti TZ Petri in un incubatore a 30 ° C e attendere 3 ore. Nota: Le temperature più elevate si ottengono una reazione più veloce, se desiderato, ma overstaining è un rischio.
- Rimuovere piastre di Petri dal termostato e valutare. I semi che si sono macchiati rosso nei loro embrioni sono germinabili, mentre i semi non colorati sono morti. Consultare il manuale Tetrazolium Testing AOSA per maggiori dettagli su casi marginali distintivi e particolari specie.
Risultati
Tipi incrociate con vario materna percentuale di parentela e delle colture allele (Tabella 1) differivano tra le date di rimozione in percentuale germinato, non germinato schiacciato, e semi di morti (Fig. 2 e 3). Utilizzando test TZ di semi non germinati, abbiamo trovato alcuni semi dormienti veramente al secondo rimozione (inizio primavera) (Tabella 2), mentre tutti i semi non germinati dalla terza rimozione (primavera...
Discussione
Qui vi presentiamo i metodi per l'utilizzo di strisce di semi di sepoltura per osservare la germinazione del seme, dormienza e la mortalità delle scorte di sementi diverse in periodi di tempo preselezionato nel campo. I vantaggi di usare strisce anziché singoli pacchetti giacciono in (1) la velocità del nastro e la costruzione compartimento sul creazione di singoli pacchetti; e (2) la facilità e la velocità di rimozione comparti multipli in un unico movimento, senza il pericolo di omettere un pacchetto o la rim...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
Materiali
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
Riferimenti
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon