A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דרך אמין להערכת זרע נביטה, תרדמת, ותמותה בתנאי שדה
In This Article
Summary
כאן אנו מציגים פרוטוקול להערכת שאירים זרע, נביטה תרדמת בתנאי שדה באמצעות קבור, רצועות זרע שכותרתו כלוריד tetrazolium בדיקות כדאיות (ט"ז).
Abstract
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
Introduction
המטרה הכללית של שיטה זו היא להעריך הישרדות זרע ובמהימנות לאורך זמן בתנאי שדה.
בנק זרעי קרקע הם עתודה התפזרו, זרעי קיימא עדיין ungerminated מופצים גם על פני הקרקע, בתוך חול משטח, או בתוך פרופיל הקרקע, אשר עשוי להימשך זמני או במשך שנים רבות 1,2. כאשר שיטות קבורות זרע דומה לזו המוצגת כאן יושמו מחקר 17 שנים באמצעות כמה עשרות מינים, זרעי קיימא נמצאו רבי מהמינים נבדקו 3. תרדמת זרעים היא לחסום זרע נביטה עד השילוב המתאים של תנאי שתיל הישרדות להתעורר 4. נותרים רדומים יכול להרשות זרעים לשרוד בתנאים קשים, כגון טמפרטורות חורף נמוכות, הגבלה מזינה, או בצורה עונתית, עד טריגר חיצוני עבור תרדמת שחרור מאפשר נביטה. מפעיל עבור שחרור תרדמת יכול להשתנות כתוצאה מחשיפת תרכובות קרות, הוארכו שהותירו fזעמם, או תקיפה פיזית על קליפת הזרע דרך שחיקה או במגע עם חומצות הקיבה חיה 5. כרמזי נביטה יכולים להיות סוגים או מינים ספציפיים לעתים קרובות תוצאה של ברירה טבעית בעבר, נביטת זרעים הסתגלותי הוא המתרחש בזמן לא מתאים, ועלול לגרום לתמותת זרע או שתיל או צמיחת שתיל מסכנה. בעוד תרדמת סווגה למספר סוגים על פני המנגנונים של שחרור תרדמת (למשל, תרדמת גופנית, תרדמת פיזיולוגית), 6 תרדמת זרעים נשארת אחד לפחות הבין נושאים בביולוגית צמח. לכן, מחקרים בתחום המאפשרים הערכה על המצב של זרעים בודדים או קבוצות של זרעים בתנאים אקולוגיים רלוונטיים יש כוח הסבר גבוה יותר מענפים פשוט לסמוך על בדיקות נביטת תקן במעבדה.
ניצול של מאפייני זרע ידועים יכול לספק תובנה לתוך המנגנונים של תרדמת. פיקוח על תרדמת זרעים הוא שיתוףmplex, לרבות הבקרה הגנטית של גורמים פיזיולוגיים מורפולוגיים. בעוד הבנה מלאה של הרוחב של מנגנוני תרדמת טרם הובהרה, מודל כללי התפתח, מעורב מערכת יחסים היזון חוזר בין שני ההורמונים הצמחיים Gibberellic החומצה (GA) ו abscisic חומצה (ABA) 7. במודל כללי זו לזרעים עם מרכיב פיסיולוגי התרדמת שלהם, GA משמש אות לשחרור תרדמת, בעוד ABA משמש כדי לשמור על במצב הרדום. השפעות גנטיות אימהיות כמו גם בסביבת הגידול האימהית יכול להשפיע תרדמת ותכונות זרע אחרות, כגון גודל, דרך רקמות שנוצרו אימהי ו -8 אותות התפתחותיים. אימהי שנוצר מבנים חיצוניים (או כיסויי זרע) תהא רשאית להותיר תרדמת, לעיתים בשילוב עם רמזים פיזיולוגיים. מאז כיסויי זרע נגזר אימהי נשלטים על ידי הגנים של הצמח האם, הם עלולים שלא לשקף את ההרכב הגנטי הגרעיני בפועל של הזרע. אנחנו צריכים אותנואד achenes annuus Helianthus מתוך מערך של היברידית יבול-בר חוצה כדי להקניט את השפעות גנטיות העובר לעומת אימהי אלה על מאפייני זרע 9,10. לפיכך, עיצובי מחקר הכוללים מינים שונים, סוגי צלב, או גנוטיפים יכולים ללקט מידע על אקולוגיה וגנטיקה של זרע תרדמת, נביטה והישרדות.
דוגמא חשובה של כמה פנוטיפים נביטה והישרדות זרע יכולים להשפיע דינמיקה באוכלוסייה ניתן לראות אזורי כלאי יבול-בר. בחירה במהלך הביות של צמחי מעובדים תבטל את רוב התרדמת ומפחיתה את יכולתו של זרע לשרוד מחוץ עונת הגידול. עם זאת זרימת גנים, או הכלאה בין הסוגים המעובדים ופרועים באזורים היברידיים יבול-בר יכולה לחדש אללים יבול (או וריאנטים גנטיים) לתוך אוכלוסייה בטבע, עם השפעות אפשריות על דינמיקת בנק זרעים. כלאיים בין קרובים טפחו ופרוע נמצאים פוטנציאל אזורי כלאיים-בר יבול עשוי להחזיקמגוון של פנוטיפים תרדמת ביניים, עם רק כמה פנוטיפים צפויים לשרוד בתנאים מחוץ הטיפוח (למשל, בחודשי החורף) 11.
מטרת כתב היד הזה היא להראות כיצד, בשיטת רצועת קבורת הזרע, אנחנו יכולים להעריך נביטה, תרדמת, והישרדות של מגוון רחב של זני זרעים בתקופות זמן שונים כדי לחקור השונות הטבעיות שלהם בתנאי שדה. בדוגמא שלנו, העסקנו גרעינים מ -15 סוגי צומח פרה היברידי צלב מאז אנו מעוניינים השפעות גנטיות אימהיות העוברות על מאפייני זרע.
Protocol
1. לאסוף זרע ממינים מרובים או מבוקרת צלבים של מין יחיד
הערה: זה זרע למשל בשימוש מ 15 סוגים הדדית בתוך annuus המינים Helianthus (חמניות) באמצעות פרא, היברידי, וסוגי יבול כמו (המייצר זרע) האימהי ההורה.
- בסוף עונת הגידול, לאסוף ראשי זרע בוגרים בשקיות שכותרתו. זרע נקי מזרע מוץ ומניחים מעטפות שכותרתו עם סוג צלב הורי בפורמט סטנדרטי (דהיינו אב x האימהית).
- זרע גורף יחד במעטפות גדולות באמצעות כמויות שווות של זרע ממספר שווה של סוגי צלב הוריים זהים. לדוגמה, 100 זרעים מתוך 10 סוגים צלב עם אותם הורים אימהי ואבהי. לייבל המעטפות עם זיהוי (סוג צלב) מידע. מעטפות גדולות אלו הם אדונים זרע לשימוש במילוי רצועות קבורה בסעיף 2.
| האם אימהי | |||
| האם אבהי | Wild: WxW | F 1: WXC | יבול: CXC |
| Wild: WxW | 0% WxW | 25% F 1 XW † | 50% CxW † |
| BC: WxF1 או F1xW | 12.5% WxBC | 37.5% F 1 xBC | 62.5% CxBC |
| F 1: WXC | 25% WxF 1 † | 50% F 1 XF 1 | 75% CXF 1 † |
| F 2: F 1 XF 1 | 25% WxF 2 | 50% F 1 XF 2 | 75% CXF 2 |
| יבול: CXC | 50% WXC † | 75% F 1 XC † | 100% CXC |
טבלה 1. t צלב הוריםypes המופק אבקה ביד. סוגי צלב היברידיים יבול-בר חמניות יוצרו עם אבקה ביד לשימוש בניסוי קבורת זרע. מתאים לכל סוגי הצלב, ההורה האימהי המפורטים ראשון וההורה האבהי מפורט שני. סוגי צלב מסומנים † הם חלק זוגות סוג צלב גומלין עם אללים יבול באותה% אבל הורים אימהיים שונים. לוח שפורסם בעבר ב: פייס, BA et al. (2015) 15.
2. יצירת רצועות קבורות זרע מותאמים אישית
הערה: בדוגמא זו, היו לנו שלושה טיפולים להסרת תאריך 15 משכפל, כך אנו נדרשים 45 רצועות כוללות. דוגמה זו משתמשת ב -15 תאים לכל רצועת כך, אנו נדרשים מספיק בד או וכילה פוליאסטר מרושת בסדר לשכן 15, 7 x 10 תאים ס"מ. ראה איור 1.
- התחל על ידי חיתוך 20 x 105 ס"מ רצועת בד עבור כל רצועה זרע.
- מדוד וסמן תאים, ואז לקפל את הבד לשניים. שימוש בפוh-טמפרטורה אקדח דבק, לאטום אחד קצר (10 ס"מ) בסוף. לאחר הדבק מתקרר מעט, אבל לא לגמרי, לחץ על הצדדים הבד יחד כדי ליצור חותם.
זהירות: טיפים אקדח דבק ודבק בטמפרטורה גבוהה יכול לגרום לכוויות אם במגע עם העור הוא ממושך. - קווי דבק מהקצה המקופל בקצה הקצר הפתוח בכל סימן תא. לחץ על שני הצדדים הבד יחד לאורך קווי דבק על מנת להבטיח חותמות ללא חורים בין תאים. זרעים הנודדים בין התאים לתרום שגיאה ניסיונית.
הערה: עכשיו כי תאים נוצרו, בקצה פרש צריך להישאר פתוח ומוכן לקבל זרע, וכן פרטים מזהים שלהם (שם סוג צלב). - אקראי להקצות סוגי צלב זרע תאים עבור כל רצועה.
- מלאו תאי זרע עם מספר אחיד של זרעים (20 לכל תא משמשים בדוגמה זו). עבור מדבקות, השתמש סמנים קבעו תעשייתיים על חתך ל-בכושר חצי גן הפלסטיק, כך שהם מסוגליםלעמוד קבורה.
הערה: שיטות תיוג חלופיות יכולות לשמש. - לאחר כל תא מתמלא זרע התווית שלו, לאטום את תא מיד עם אקדח דבק בטמפרטורה גבוהה. המשך עד הרצועה לזרע כולו אטומה לחלוטין. לייבל רצועה הכוללת בתא הראשון עם לשכפל, לחסום ו / או מידע טיפול.
הערה: לצורך המחקר שלנו, מאז נאלצנו להסיר את הזמני, בלוקים, ולשכפל רצועות בתוך בלוקים, כללנו את כל המידע הזה. - בדקו אם פערים בין תאים ודבקים במקום לפי צורך לפני שעברתי לרצועה הבאה.
- מלאו תאי זרע עם מספר אחיד של זרעים (20 לכל תא משמשים בדוגמה זו). עבור מדבקות, השתמש סמנים קבעו תעשייתיים על חתך ל-בכושר חצי גן הפלסטיק, כך שהם מסוגליםלעמוד קבורה.
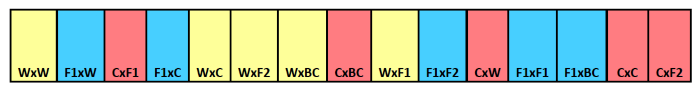
איור 1. סכמטי זרע רצועת קבורה. דוגמה של רצועת קבורה מראה זיהוי סוג צלב לסלוני הפרט. ההורה אימהי מופיע ראשון עם ההורה האבהי המפורט שני. צבעים מצביעים הורות אימהית שונה,עם צהוב פראי, כחול היברידי F 1, ואדום לזריעה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
3. Bury רצועות זרע בתחום
- לחפור מגרשים לעומק שצוין רצועות הבית. הקצאת רצועות לבלוקי פרט בו רצועות מסודרות באופן אקראי כדי לאפשר תאריך ההסרה לשמש כזהות עלילת תא הראשית (בדוגמא זו, סוג הצלב) כמו עלילת המשנה בניתוח.
- מכסים רצועות עם האדמה. בד חומרת רשת מתכת Cut להיות 10 סנטימטר גדול יותר מגרשים ומניחים על גבי רצועות קבורות. השתמש U-סיכות כדי לאבטח בקצות קצות בד כיסוי בעפר.
הערה: כיסוי זה מיועד למעט אוכלי זרעים מתחפרים. בתור אפשרות נוספת, מרסר et al. 13 נבנו קבור תיבות של בד חומרה שהקיפו את רצועות הזרע עקב לחץ גופר אינטנסיבי loca בתחומםtion.) - מניח דגלים של המודד צבעוני, להבדיל רצועת תאריכי מיקום והסרה כדי להשלים רשומים כתובים וברור.
4. לחפור רצועות ולהעריך זרע
- לחפור רצועות זרע שהוקצו תאריך הסרה נתון. לשמור על הרצועות בסביבת לחה מגניבה עד שהם מגיעים למעבדה שבה הערכת הזרע תתקיים. ניתן להשיג זאת על ידי לפפה את רצועות העיתון הרטוב והצבתם צידנית על הובלה או משלוח בין לילה.
- שטוף בץ ואדמה מן הרצועות במים עד רצועות נקיות מספיק שברים הללו חיצוניים לא זרעים מעורפלים.
- השתמש במספריים לחתוך תא אחד פתוח בכל פעם. רוזן זרעים מונבטים ולהסיר אותם. רוזן בבירור זרעים מתים (למשל, נרקבו, או זרעים רקוב). מניח זרעי ungerminated על שכותרתו, נייר סופג רטוב פטרי בגודל נוסף להבחין זרעי ungerminated, רדומים, ומתים.
- מניחים צלחות פטרי עם ungerminatedזרעים לתוך מערכת תא צמיחת תנאי נביטה סטנדרטיות: 25 ° C / 10 ° C 12 שעות יום / הלילה. אפשר זרעי שבוע לנבוט. כל זה עושה, ולמנות אותן כפי קיימא, אבל ungerminated מאז הם לא נובטים בתנאי שדה.
- לאחר הטיפול הקאמרי הצמיחה, מבחן הנותר זרעי ungerminated עבור כדאיות באמצעות כלוריד tetrazolium (ט"ז) 13. כדי להשיג זאת, להמציא פתרון אחוז המתאים TZ עבור מין המחקר באמצעות Handbook AOSA tetrazolium בדיקת 14. בדוגמה זו, פתרון 1% משמש.
- חותכים את הזרעים ungerminated לשניים ומניחים מחצית היו העובר האנדוספרם גלויים בצלחת פטרי המכילה פתרון מספיק TZ לכסות את הזרע (זרעים עשויים לצוף, זה בסדר).
- מניחים מנות TZ פטרי לתוך להגדיר באינקובטור ב 30 מעלות צלזיוס ולחכות 3 שעות. הערה: טמפרטורות גבוהות תגרומנה לתגובה מהירה יותר, אם ירצו בכך, אבל overstaining סיכון.
- סר צלחות פטרי מן החממה ולהעריך. זרעים אשר מוכתם אדום בעוברים שלהם הם germinable, בעוד זרעים בלא כתם מתים. התייעץ עם מדריך בדיקת AOSA tetrazolium לקבלת פרטים נוספים על מקרים גבוליים מבדיל ומינים בפרט.
תוצאות
סוגים צלב עם אחוז אלל הורות ועל היבול אימהי מגוון (טבלה 1) שונים ברחבי תאריכי הסרה באחוזים מונבטים, ungerminated, וזרעים מתים (איור. 2 ו -3). באמצעות בדיקות TZ של זרעי ungerminated, מצאנו כמה זרעים רדומים באמת על סילוקו השני (בתחילת האביב)
Discussion
כאן אנו מציגים שיטות באמצעות רצועות קבורת הזרע להתבונן זרע נביטה, תרדמת ותמותה של מלאי מקור מגוונים בתקופות זמן שנבחרו מראש בתחום. היתרונות של שימוש רצועות ולא מנות בודדות לשכב (1) מהירות רצועה ובניית תא על בריאה של מנות בודדות; ו (2) הקלות והמהירות של הסרת תאים מרובים ב...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
Materials
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
References
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved