Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Надежный метод оценки всхожести семян, пок, и смертности в полевых условиях
В этой статье
Резюме
Здесь мы приводим протокол для оценки семян живучесть, прорастание и покоем в полевых условиях с использованием погребен, меченых семян полоски и хлорида тетразолия (TZ) тестирование жизнеспособности.
Аннотация
We describe techniques for approximating seed bank dynamics over time using Helianthus annuus as an example study species. Strips of permeable polyester fabric and glue can be folded and glued to construct a strip of compartments that house seeds and identifying information, while allowing contact with soil leachate, water, microorganisms, and ambient temperature. Strips may be constructed with a wide range of compartment numbers and sizes and allow the researcher to house a variety of genotypes within a single species, different species, or seeds that have experienced different treatments. As opposed to individual seed packets, strips are more easily retrieved as a unit. While replicate packets can be included within a strip, different strips can act as blocks or can be retrieved at different times for observation of seed behavior over time. We used a high temperature glue gun to delineate compartments and sealed the strips once the seed and tags identifying block and removal times were inserted. The seed strips were then buried in the field at the desired depth, with the location marked for later removal. Burrowing animal predators were effectively excluded by use of a covering of metal mesh hardware cloth on the soil surface. After the selected time interval for burial, strips were dug up and seeds were assessed for germination, dormancy and mortality. While clearly dead seeds can often be distinguished from ungerminated living ones by eye, dormant seeds were conclusively identified using a standard Tetrazolium chloride colorimetric test for seed viability.
Введение
Общая цель этого метода состоит в том надежно оценивать выживаемость семян в течение долгого времени в полевых условиях.
Семенные почвы банки являются резервом распылении, жизнеспособных семян еще непроросших распределенных либо на поверхности почвы, в пределах поверхности подстилки, или в пределах почвенного профиля, которые могут сохраняться или скоротечно в течение многих лет 1,2. Когда методы захоронения семян , похожие на те , представленные здесь , были применены к исследованию 17-летнего периода с использованием нескольких десятков видов, жизнеспособные семена были обнаружены во многих из испытанных видов 3. Семенной заторможенность представляет собой блок для прорастания семян до тех пор , соответствующее сочетание условий для рассады выживания не возникает 4. Оставаясь в состоянии покоя может позволить семена, чтобы выжить тяжелых условиях, таких как низкие зимние температуры, ограничение питательных веществ, или сезонной засухи, пока внешний триггер для спячки-релиз не позволяет для прорастания. Триггеры для спячки-релиз может варьироваться от воздействия холода, протяженных соединений, оставленных FIRE, или физическое нападение на семенной кожуры через ссадины или контакта с животным желудка кислотами 5. Поскольку прорастание сигналы могут быть или роды на конкретные виды и часто являются результатом прошедшего естественного отбора, неприспособленным прорастание семян то, что происходит в неподходящее время, и может привести к семян или всходов или плохой рост проростков. В то время как заторможенность была классифицирована на несколько типов , основанных на механизмах высвобождения покоя (например, физические покоя, физиологического покоя), 6 покой семян остается одним из наименее понятных тем в биологии растений. Таким образом, полевые исследования, которые позволяют для оценки состояния отдельных семян или групп семян в соответствующих экологических условиях имеют более высокую объясняющую способность, чем те, которые просто полагаются на стандартные тесты всхожести в лабораторных условиях.
Эксплуатация известных характеристик семян может дать представление о механизмах дремоты. Контроль покоя семян совместноmplex, включая генетический контроль физиологических и морфологических факторов. В то время как полное понимание широты механизмов неактивности еще предстоит выяснить, общая модель возникла, включая отношения обратной связи между двумя фитогормонов Гиббереллиновая кислота (ГК) и АБК (ABA) 7. В этой обобщенной модели для семян с физиологическим компонентом их дремоты, GA служит сигналом для высвобождения спячки, в то время как ABA служит для поддержания состояния покоя. Материнские генетические эффекты, а также окружающей среды материнский рост может влиять на покоем и другие семенные черты, такие как размер, через матерински генерируемых сигналов тканей и развития 8. По материнской линии генерируется внешние структуры (или семенные покрытия) может поддерживать дремоту, иногда в сочетании с физиологическими репликами. Так как матерински полученные семена покрытия находятся под контролем генов материнского растения, они могут не отражать фактический ядерный генетический состав семени в. У нас есть с намиЭ.Д. подсолнечник однолетний семянки из массива культур-дикого гибрид пересекает чесать эти генетические эффекты матери против эмбриона по семенному характеристикам 9,10. Таким образом, исследование конструкции , которые включают в себя различные виды, типы, кросс или генотипы можно почерпнуть информацию об операторе экология и генетика покоя семян, всхожесть и выживаемость.
Важным примером того, как прорастание семян и выживаемости фенотипа может повлиять на динамику популяции можно увидеть в гибридных зонах на полях дикорастущие. Выбор во время одомашнивания культурных растений устраняет большинство покоем и снижает способность семени, чтобы выжить вне сезона выращивания. Тем не менее, поток генов, или гибридизация между культивируемых и диких видов в гибридных зонах на полях дикорастущие может вновь ввести культур аллели (или генетические варианты) в дикой популяции, с возможным воздействием на динамику банка семян. Гибриды между культивируемых и диких родственников потенциально найдены в гибридных зонах на полях дикорастущие могут обладатьмножество промежуточных фенотипов неактивности, лишь несколько фенотипов ожидается , чтобы выжить условий за пределами культивирования (например, зимние месяцы) 11.
Цель этой рукописи, чтобы показать, как с помощью семян метод захоронения полосы, мы можем оценить всхожесть, пок, и выживание целого ряда видов семян в разные периоды времени, чтобы исследовать их естественные колебания в полевых условиях. В нашем примере мы использовали семена подсолнечника с 15-культур дикого гибридного кросс-типов, так как мы заинтересованы в матери и эмбриона генетических эффектов на семенных характеристик.
протокол
1. Сбор семян из нескольких видов или контролируемыми крестов одного вида
Примечание: В этом примере используется семя от 15 поперечных типов в пределах вида подсолнечник однолетний (подсолнечник) , используя дикий, гибрид, и типы культур как (семян производящий) родителя матери.
- В конце вегетационного периода, собирают зрелых семенах головы в маркированных мешках. Чистое семя от плевел и место семян в конвертах , помеченных родительского перекрестного типа в стандартном формате (то есть материнский х отцовской).
- Насыпная семена вместе в больших конвертов с использованием равного количества семян из равного числа идентичных родительских перекрестными типов. Например, 100 семян из 10 поперечных типов с одинаковыми материнскими и отцовскими родителей. Этикетка конверты с идентифицирующей (перекрестного типа) информации. Эти большие конверты семени мастера для использования в заполнении захоронения полос в разделе 2.
| Материнский родитель | |||
| Отцовский родитель | Дикий: WXw | F 1: WXC | Crop: CxC |
| Дикий: WXw | 0% WXw | 25% F 1 XW † | 50% CXW † |
| BC: WxF1 или F1xW | 12,5% WxBC | 37,5% F 1 XBC | 62,5% CxBC |
| F 1: WXC | 25% WxF 1 † | 50% F 1 Xf 1 | 75% CxF 1 † |
| F 2: F 1 Xf 1 | 25% WxF 2 | 50% F 1 2 Xf | 75% CxF 2 |
| Crop: CxC | 50% WXC † | 75% F 1 хс † | 100% CxC |
Таблица 1. Родительское крест тypes , полученные из рук опыление. подсолнечника урожая-дикого перекрестными типов гибридных были произведены с помощью ручного опыления для использования в захоронении семян эксперимента. Для всех типов кросс, материнский родитель первым в списке и отцовская указанный родитель второй. Перекрестные типы, отмеченные † являются частью взаимных пар перекрестного типа с теми же% урожая аллели, но разные матери родителей. Таблица была ранее опубликована в: Пейс, BA и др. (2015) 15.
2. Создание пользовательских Похоронные Полоски Seed
Примечание: Для этого примера, у нас было три процедуры удаления даты и 15 повторов, поэтому нам требовалось 45 полос общей сложности. В этом примере используется 15 отсеков в полосе так, что и требовалось достаточно узкопетлистый полиэфирной ткани или москитной сеткой, чтобы дом 15, 7 х 10 см отсеков. Смотри рисунок 1.
- Начните путем разрезания 20 х 105 см полоску ткани для каждой полосы семян.
- Измерьте и отметьте отсеки, а затем сложить ткань пополам. Использование HIGч температуры клей пистолет, печать один короткий (10 см) конец. После того, как клей остынет немного, но не полностью, при этом боковые ткани вместе, чтобы создать уплотнение.
ВНИМАНИЕ: Высокотемпературные клей и клей советы пистолет может вызвать ожоги, если контакт с кожей затягивается. - Клеевые линии от сложенного края к открытой короткой стороне на каждой отметке отсека. Нажмите на две стороны вместе ткани вдоль линий клея для обеспечения уплотнения без отверстий между отсеками. Семена, мигрирующие между отсеками способствуют погрешности эксперимента.
Примечание: Теперь, когда отсеки были созданы, развернутая край должен оставаться открытым и готов к приему семян и их идентификационную информацию (имя типа кросс). - Случайным назначить кросс семян типов отсеков для каждой полосы.
- Заполните семенные отсеки с равномерным количеством семян (20 для каждого отделения используются в данном примере). Для этикеток, используют промышленные постоянные маркеры на разрезе к монтажу пластиковые садовые дартс, так что они способнывыдерживают захоронение.
Примечание: Альтернативные методы маркировки могут быть использованы. - После того, как каждый отсек заполнен семенами и этикеткой, загерметизировать отсек непосредственно с клеевой пистолет высокой температуры. Продолжайте, пока вся полоса Семя не полностью герметична. Добавьте общую полосу в первом отсеке с блоком репликации и / или информации о лечении.
ПРИМЕЧАНИЕ: Для нашего исследования, так как у нас были временные абсорбцию, блоки и реплицировать полосы в пределах блоков, мы включили всю эту информацию. - Проверьте наличие зазоров между отсеками и пятна клея по мере необходимости, прежде чем перейти к следующей полосе.
- Заполните семенные отсеки с равномерным количеством семян (20 для каждого отделения используются в данном примере). Для этикеток, используют промышленные постоянные маркеры на разрезе к монтажу пластиковые садовые дартс, так что они способнывыдерживают захоронение.
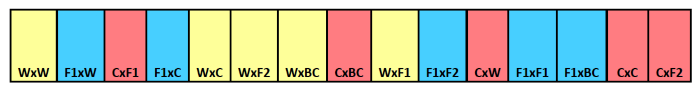
Рисунок 1. Захоронение семян полосы схематичными. Пример захоронения полосы с указанием идентификации перекрестного типа для отдельных отсеков. Материнский родитель первым в списке с отцовской родителем, перечисленных второй. Цвета указывают на различную материнскую происхождение,с желтым для дикой природы, синий для F 1 гибрид, и красный для урожая. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
3. Бери Seed Полоски в области
- Dig участков на заданную глубину до дома полос. Назначают полосы на отдельные блоки, в которых полосы расположены случайным образом, чтобы на дату удаления, которые будут использоваться в качестве основного сюжета и идентичности купе (в данном примере, кросс типа) в качестве подзаговоре в анализе.
- Накладками с землей. Вырезать металлической сетки ткани аппаратных средств, чтобы быть на 10 см больше, чем участки и места над заглубленных полос. Используйте U-образные штифты, чтобы закрепить края и края крышки ткани с землей.
Примечание: Это покрытие для исключения роющих семян хищников. В качестве другого варианта, Мерсер и др. 13 построены и похоронил коробки ткани аппаратных средств , которые окружали семенные полосы из - за сильного давления суслик в поле их Locaции.) - Поместите флаги цветные землемера различать даты определения местоположения полосы и удаление в дополнение к четкие письменные записи.
4. выкопать Полоски и оценка Seed
- Выкопайте семенных полос, назначенных на определенную дату удаления. Поддерживать полоски в прохладном влажной среде, пока они не достигают лаборатории, где оценка семян будет иметь место. Это может быть достигнуто путем обертывания полосы в мокрую газету и помещая их в холодильнике для транспортировки или ночь судоходства.
- Промойте грязь и почву от полос в воде до тех пор, пока полоски достаточно чистыми, что внешние обломки не затеняет семена.
- Используйте ножницы, чтобы разрезать одно отделение за раз. Граф пророщенные семена и удалить их. Граф ясно мертвые семена (например, гниения, или разложившийся семена). Поместите непроросших семена на маркированный мокрой Петри размера промокательной бумаги для того чтобы отличать непроросших, спящие, и мертвые семена.
- Поместите чашки Петри с непроросшихсемена в набор камеры роста для стандартных условий проращивания: 25 ° C / 10 ° C 12 ч день / ночь. Разрешить семена одну неделю, чтобы прорасти. Любые, которые, учитывать их в качестве жизнеспособной, но непроросших, так как они не прорастали в полевых условиях.
- После обработки камеры роста, испытания оставшиеся непроросших семена для жизнеспособности с использованием хлорида тетразолия (TZ) 13. Для достижения этой цели , составляют процентный раствор TZ подходящих для данного вида исследования с использованием AOSA тетразолия тестирования Руководство 14. Для этого примера, используют 1% -ный раствор.
- Вырезать непроросших семена пополам и положите половину были зародыш и эндосперм открыты в чашке Петри, содержащей достаточное количество раствора TZ, чтобы покрыть семена (семена могут плавать, это нормально).
- Поместите TZ чашки Петри в инкубатор при температуре 30 ° C и подождать 3 часа. Примечание: Более высокие температуры приведут к более быструю реакцию, если это желательно, но overstaining риск.
- Удалить чашки Петри из инкубатора и оценить. Семена, которые окрашивается в красный цвет в их эмбрионов germinable, в то время как неокрашенные семена мертвы. Обратитесь к AOSA Справочник тетразолии тестирования для более детальной информации о отличительного предельных случаях и отдельных видов.
Результаты
Перекрестные типы с разнообразными отцовство и растениеводство аллеля процент материнской (таблица 1) различалась даты удаления в процентах проращивают, непроросших, и мертвых семян (рис. 2 и 3). Используя TZ тестирование непроросших семян, мы...
Обсуждение
Здесь мы представляем методы использования семян погребальные полосок для наблюдения прорастание семян, покоем и смертности разнообразных запасов семян в предварительно выбранных периодов времени в полевых условиях. Преимущества использования полос, а не отдельные пакеты лежат в (1)...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by Biotech Risk Assessment Grant Program competitive grand no. 2006-39454-17438 to A. Snow, K. Mercer, and H. Alexander from the United States Department of Agriculture, National Institute of Food and Agriculture. Experiments using this method were conducted at and supported by the University of Kansas Field Station, a research unit of the Kansas Biological Survey and the University of Kansas. The authors would like to thank P. Jourdan and E. Regnier for helpful reviews on earlier versions of this manuscript. Additionally, this work was aided by the contributions of the staff at the University of Kansas Field Station, Waterman Farm at the Ohio State University (OSU), the USDA Ornamental Plant Germplasm Center at OSU, and the Seed Biology Lab in the Department of Horticulture and Crop Science at OSU, especially E. Renze, S. Stieve, A. Evans, and E. Grassbaugh, for technical support.
Материалы
| Name | Company | Catalog Number | Comments |
| Small coin envelopes | Any | ||
| Large coin envelopes | Any | ||
| fine meshed polyester mosquito netting | Any | ||
| high-temperature glue gun | Any | ||
| high-temperature glue stick refills | Any | ||
| Industrial permenant markers | Any | ||
| plastic garden labels | Any | ||
| scissors | Any | ||
| Shovel | Any | ||
| Metal mesh hardward cloth | Any | ||
| Surveyor's flags, multiple colors | Any | ||
| Wet newspaper | Any | ||
| cooler | Any | ||
| blotter paper | Any | ||
| petri dishes | Any | ||
| Temp. controlled growth chamber | Any | ||
| razor blades | Any | ||
| Petri dishes | Any | ||
| Tetrazolium chloride | Any | ||
| water | Any | ||
| heat incubator | Any |
Ссылки
- Walck, J. L., Baskin, J. M., Baskin, C. C., Hidayati, S. N. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns. Seed Sci Res. 15 (3), 189-196 (2005).
- Alexander, H. A., Schrag, A. M. Role of soil seed banks and newly dispersed seeds in population dynamics of the annual sunflower. Helianthus annuus. J Ecol. 91, 987-998 (2003).
- Burnside, O. C., Wilson, R. G., Weiseberg, S., Hubbard, K. Seed longevity of 41 weed species buried 17 years in eastern and western. Weed Sci. 44 (1), 74-86 (1996).
- Baskin, C. C., Baskin, J. M. . Seeds: Ecology, biogeography, and evolution of dormancy and Germination. , (2001).
- Finch-Savage, W. E., Leubner-Metzger, G. Seed dormancy and the control of germination. New Phytol. 171, 501-523 (2006).
- Baskin, J. M., Baskin, C. C. A classification system for seed dormancy. Seed Sci Res. 14 (1), 1-16 (2004).
- Donohue, K., et al. Environmental and genetic influences on the germination of Arabidopsis thaliana in the field. Evolution. 54 (4), 740-757 (2005).
- Roach, D. A., Wulff, R. D. Maternal effects in plants. Ann Rev Ecol Syst. 18, 209-235 (1987).
- Pace, B. A., Alexander, H. M., Emry, J. D., Mercer, K. L. Seed fates in crop-wild hybrid sunflower: crop allele and maternal effects. Evol Appl. 8 (2), 121-132 (2015).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 101 (7), 1176-1188 (2014).
- Stewart, N. C., Matthew, J., Halfhill, D., Warwick, S. I. Transgene introgression from genetically modified crops into their wild relatives. Genetics. 4, 806-817 (2003).
- Mercer, K. L., Shaw, R. G., Wyse, D. L. Increased germination of diverse crop-wild hybrid sunflower seeds. Ecol Appl. 16, 845-854 (2006).
- Delouche, J. C., Still, T. W., Rapset, M., Lienhard, M. The tetrazolium test for seed viability. Mississippi Sta Uni Ag Exp Sta Techn Bull. 51, 1-63 (1962).
- Association of Official Seed Analysts. . Tetrazolium Testing Handbook. , (2010).
- Alexander, H. M., Emry, D. J., Pace, B. A., Kost, M. A., Sparks, K. A., Mercer, K. L. Roles of maternal effects and nuclear genetic composition change across the life cycle of crop-wild hybrids. Am J Bot. 10 (7), 1176-1188 (2014).
- Weiss, A. N., Primer, S. B., Pace, B. A., Mercer, K. L. Maternal effects and embryo genetics: germination and dormancy of crop-wild sunflower hybrids. Seed Sci Res. 23, 241-255 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены