Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En Vivo La proyección de imagen multimodal y análisis del modelo de neovascularización coroidea inducida por láser Mouse
En este artículo
Resumen
Presentamos la utilidad de la proyección de imagen longitudinal en vivo en el seguimiento de los cambios morfológicos del neovascularization coroides laser-inducida en ratones.
Resumen
Inducida por láser del neovascularization coroides (CNV) es un modelo bien establecido para imitar la forma húmeda de la degeneración macular senil (DMS). En este protocolo, nuestro objetivo es guiar al lector no sólo a través de las consideraciones técnicas de generación de las lesiones inducidas por láser para desencadenar procesos de neovascular, sino más bien centrarse en la poderosa información que puede obtenerse de multimodal longitudinal en vivo proyección de imagen durante el periodo de seguimiento.
El ratón inducida por láser modelo de la CNV se generó por una administración de láser de diodo. Multimodal en vivo las técnicas de imagen fueron utilizadas para controlar la inducción de la CNV, progresión y regresión. Primero, se realizó tomografía de coherencia óptica de dominio espectral (SD-OCT) inmediatamente después de la lasering para verificar una rotura de la membrana de Bruch. Posterior en vivo la proyección de imagen usando la angiografía de la fluoresceína (FA) confirmaron éxito daño de la membrana de Bruch de la serie imágenes adquiridas a nivel de coroides. Seguimiento longitudinal de la CNV proliferación y regresión en los días 5, 10 y 14 después de la lasering fue realizado usando la SD-OCT y FA. Se presentan simple y confiable de fugas leasions CNV de imágenes de FA. Segmentación automática para la medición del grosor retiniano total, combinado con aplicación manual calibre para la medición del espesor retiniano en los sitios de la CNV, permiten la evaluación objetiva de la presencia de edema. Finalmente, la verificación histológica de la CNV se realiza utilizando proteína GS IB4 manchas en la coroides flatmounts. La tinción es thresholded, y se calcula el área de proteína-positivas con ImageJ.
Este protocolo es especialmente útil en estudios de terapéutica que requieren alta-rendimiento-como proyección de la patología de la CNV como rápido, permite multimodal y clasificación fiable de CNV patología y retinianas, edema. Además, la SD-OCT de alta resolución permite la grabación de otras características patológicas, como la acumulación de líquido subretinal o intrarretiniana. Sin embargo, este método no proporciona una posibilidad para automatizar análisis de volumen CNV de imágenes SD-OCT, que deberá llevarse a cabo manualmente.
Introducción
La primera tentativa acertada para imitar la patología de la NVC humano en roedores se demostró hace casi tres décadas con un láser de criptón de ratas Long-Evans1. Después de eso, se utilizó un láser de criptón para romper la membrana de Bruch en la cepa de ratón más popular, C57BL/6J2,3,4. La tasa de éxito de la inducción de la CNV se verificó con FA y tintes histológicos. Un rápido desarrollo de modalidades de imágenes no invasivas, tales como OCT, fomentó el crecimiento del campo de modelos preclínicos de roedores. La capacidad para monitorear cambios morfológicos en la retina en varios puntos del tiempo en el mismo ojo significativamente contribuye a la reducción del uso de animales y aumenta la eficacia en estudios experimentales. La evaluación histológica de las lesiones de NVC es bastante sencilla y requiere etiquetado de crecimiento vascular anormal alrededor del sitio de administración de láser, adquisición de imágenes y estimación de superficie/volumen mediante un software de análisis de imagen. En cambio, las modalidades en vivo imágenes introducen más complejos análisis de patología de la CNV y su interpretación.
Aquí presentamos un método sencillo y relativamente rápido para la inducción de grado, la progresión y la regresión de la CNV con FA, SD-OCT, y el método de la segmentación automatizada en el ratón inducida por láser CNV modelo.
Protocolo
Todos los animales fueron tratados con arreglo a la declaración de ARVO para el uso de animales en oftálmica e investigación de la visión y la Directiva 86/609/CEE para los experimentos en animales, usando protocolos aprobados y supervisados por la Junta Directiva de experimento Animal de Finlandia.
1. inducida por láser ratón CNV modelo 5
- Inspeccione los ojos del animal macroscópico para cualquier anormalidad.
- Peso del ratón.
- Calcular y preparar una cantidad adecuada de anestesia a utilizar, basado en el peso del animal, por ejemplo, una mezcla de medetomidina (1 mg/kg), ketamina (75 mg/kg) y agua destilada (solución de NaCl 0.9%) en una relación de 1:1.5:2.5 o ketamina (40-75 mg/kg), xilacina (5 mg/kg) y agua destilada (solución de NaCl 0.9%) en una proporción de 1: 2. 5:1; para un ratón de 20 g, inyectar 0,1 mL de mezcla.
- Inyectar el anestésico por vía intraperitoneal.
- Coloque el ratón en la jaula y esperar hasta que el animal está anestesiado. Confirmar que el ratón correctamente está anestesiado por la falta de un reflejo pedal.
- Garantizar el uso de equipo de protección personal de seguridad láser.
- Encienda una lámpara de hendidura y un láser de diodo de 532 nm.
- Quitar el ratón de la jaula y el lugar de la almohada.
- Aplique una gota de tropicamida para la dilatación pupilar. Espere 3-5 min para la dilatación pupilar completa (3 mm).
- Coloque el ratón en el escenario de la lámpara de hendidura.
- Coloque una gota de gel líquido oftálmica en un cubreobjetos applanate la córnea.
- Oriente el ojo de ratón con la cabeza del nervio óptico en el centro.
- Ajustar la potencia del láser a 100 mW, la duración a 100 ms y el tamaño del spot a 50 μm.
- El rayo láser se centran en el epitelio retiniano del pigmento (RPE).
- Hacer tres disparos de láser en un ojo evitando los vasos sanguíneos retinianos en el 4, 8 y 12:00 posiciones alrededor del nervio óptico, respectivamente. Inspeccione el fondo del ojo después de todo laser tiros por ausencia de hemorragias retinianas. El ojo contralateral sirve como un control no con láser.
- Deseche el ratón cubreobjetos y lugar nuevo en la almohada.
- Aplique una gota de PEG gel gotas en ambos ojos.
2. SD-OCT 6,7
- Coloque el ratón en la etapa de alineación roedor e inmovilizar la cabeza.
- Alinear la lente del sistema SD-OCT (p. ej., Bioptigen/Leica Envisu R2200) hacia el ojo en vivo imagen utilizando controladores de fase X y Y.
- Realizar análisis de la SD-OCT para verificar roturas de la membrana de Bruch: una vez que la SD-OCT escanea el ojo entero, mueva manualmente la línea de referencia en los sitios lasered. Roturas de la membrana de Bruch deben ser claramente visibles en áreas lasered (ver figura 1).
3. fluoresceína angiografía 7,8,9
- Quite el ratón con el titular y coloque en el sistema de FA (p. ej., Heidelberg Spectralis HRA2).
- Enfoque en laser quemar zonas del fondo del ojo a modo de reflectancia en el infrarrojo con la cabeza del nervio óptico en el centro de la ventana de visualización.
- Inyectar 0.1 mL de sal de sodio de la fluoresceína de 5% para un ratón de 20 g por vía subcutánea o intraperitoneal.
- Se centran en el nivel de la coroides.
- Tomar una imagen desde el nivel de enfoque coroides.
- Volver a centrar a nivel retiniano y tomar una imagen.
- Esperar 30 s y repetir los pasos 3.4-3.6.
- Retire el ratón del soporte y colocar en la almohada.
- Invertir anestesia α2-antagonista de medetomidina, atipamezole (0.5 mg/kg, i.p.) o esperar para la recuperación de animales de la anestesia.
- Repita en vivo SD-OCT y FA imágenes en animales anestesiados en el seguimiento días 5, 10 y 14.
4. CNV clasificación
- Grado el daño de la membrana de Bruch de imágenes de OCT y coroides FA inmediatamente después lasering en el día 0 como siguiendo:
0 - no fue dañada la membrana de Bruch
1 - éxito daño de la membrana de Bruch - Grado de la presencia de CNV de lasered puntos que tenía fugas como se observa al comparar la dinámica de la señal de fluoresceína en una serie de imágenes retinianas de FA como siguiendo:
0 - apariencia normal de la retina
coloración débil 0.5 - de fuga
1.0 - zonas con fugas de CNV
Nota: Utilice la imagen de OCT para la confirmación adicional de la NVC o en FA cuestionable que sugeriría la presencia de líquido intrarretiniana en imágenes de OCT CNV clasificación.
5. mediciones del espesor retina
- Utilizar un software de segmentación automatizada para mediciones del espesor retiniano. Asegúrese de que el grosor retiniano total se considera, como el espesor de todas las capas de la capa de fibras nerviosas a RPE (sitios de medida saludable), o a una línea imaginaria que conecta RPE alrededor del sitio del daño (lasered sitios) (vea la figura 7).
Resultados
Una burbuja o subretinal sangrado inmediatamente después lasering no siempre es visible. Por lo tanto, la SD-OCT es particularmente importante para verificar el daño de la membrana de Bruch. La figura 1 muestra un ejemplo de proyección de imagen de OCT en diferentes momentos después de la administración de láser.
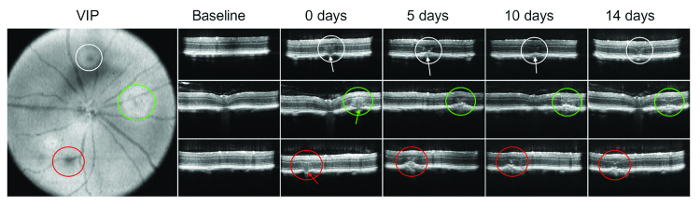 <...
<...
Discusión
La proyección de imagen multimodal ofrece valiosas herramientas para la evaluación de patología CNV. Aquí presentamos un protocolo de imagen consisten en FA, SD-OCT y segmentación automática para la evaluación rápida, reproducible y confiable de la patología de la CNV. Una rotura de la membrana de Bruch después de la administración de láser fue confirmada. Además, el uso de la SD-OCT en esta etapa también permitió la visualización inmediata de posibles hemorragias intrarretinianas y subretinales, que pued...
Divulgaciones
El autor Symantas Ragauskas, pH.d. es un empleado (investigador) y accionista de Experimentica Ltd. que ofrece contratar los servicios de investigación que emplean el modelo preclínico de la CNV en este artículo.
El autor Eva Kielczewski es un empleado (Ingeniero de aplicaciones de investigación, OCT) de Leica Microsystems que produce sistemas de SD-OCT utilizados en este artículo.
El autor Joseph Vance es un empleado (OCT NA Director de ventas) de Leica Microsystems que produce sistemas de SD-OCT utilizados en este artículo. Joseph Vance es también Presidente y director general de respectivos, LLC.
El autor Simon Kaja, pH.d. es Consultor Director científico y accionista de Experimentica Ltd., una contrato preclínico organización de investigación que ofrece contratar los servicios de investigación, incluyendo el modelo preclínico de CNV utilizado en este artículo. Simon Kaja, pH.d. es también CEO de K & P Scientific LLC, una empresa, consultora del Ciencias de la vida y sirve como el Dr. John P. y Teresa E. Mulcahy dotado profesor de Oftalmología en la Universidad Chicago de Loyola, escuela de Stritch de la medicina. Los términos de este acuerdo han sido revisados y aprobadas por la Loyola University Chicago conformidad con su política de conflicto de intereses.
El autor Giedrius Kalesnykas, pH.d. es un empleado (CEO) y accionista de Experimentica Ltd. que ofrece contratar los servicios de investigación que emplean el modelo preclínico de la CNV en este artículo.
Agradecimientos
Los autores desean agradecer a Yuliya Naumchuk (Loyola University de Chicago) y Agne Žiniauskaitė (Experimentica Ltd.) de excelente soporte técnico y videográfico. Programa de investigación del Dr. Kaja es apoyado por el Dr. John P. y Teresa E. Mulcahy dotado Cátedra de Oftalmología en la Universidad Chicago de Loyola.
Materiales
| Name | Company | Catalog Number | Comments |
| Medetomidine (commercial name Domitor) | Orion | Vnr 01 56 02 | Anesthesia |
| Ketamine | Intervet | Vnr 51 14 85 | Anesthesia |
| 0,9% NaCl | B Braun | 357 0340 | Anesthesia |
| Xylazine (commercial name Rompun vet) | Bayer | vnr 14 89 99 | Anesthesia |
| Tropicamide | Santen | Vnr 04 12 36 | Mydriatic agent |
| Viscotears | Alcon | Vnr 44 54 81 | Lubricant |
| Systane | Alcon | - | Lubricant |
| 5% Fluorescein sodium salt | Sigma Aldrich | F6377-100G | Fluoresent agent |
| Atipamezole (commercial name Antisedan) | Orion | Vnr 47 19 53 | Anesthesia |
Referencias
- Dobi, E. T., Puliafito, C. A., Destro, M. A new model of experimental choroidal neovascularization in the rat. Arch. Ophthalmol. Chic. Ill 1960. 107, 264-269 (1989).
- Tobe, T., et al. Evolution of neovascularization in mice with overexpression of vascular endothelial growth factor in photoreceptors. Invest. Ophthalmol. Vis. Sci. 39, 180-188 (1998).
- Seo, M. S., et al. Dramatic inhibition of retinal and choroidal neovascularization by oral administration of a kinase inhibitor. Am. J. Pathol. 154, 1743-1753 (1999).
- Grossniklaus, H. E., Kang, S. J., Berglin, L. Animal models of choroidal and retinal neovascularization. Prog. Retin. Eye Res. 29, 500-519 (2010).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A Mouse Model for Laser-induced Choroidal Neovascularization. J Vis Exp. (106), e53502 (2015).
- Giani, A., et al. In vivo evaluation of laser-induced choroidal neovascularization using spectral-domain optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 52, 3880-3887 (2011).
- Gong, Y., et al. Optimization of an Image-Guided Laser-Induced Choroidal Neovascularization Model in Mice. PloS One. 10, e0132643 (2015).
- Sheets, K. G., et al. Neuroprotectin D1 attenuates laser-induced choroidal neovascularization in mouse. Mol. Vis. 16, 320-329 (2010).
- Hoerster, R., et al. In-vivo and ex-vivo characterization of laser-induced choroidal neovascularization variability in mice. Graefes Arch. Clin. Exp. Ophthalmol. Albrecht Von Graefes Arch. Klin. Exp. Ophthalmol. 250, 1579-1586 (2012).
- Sulaiman, R. S., et al. A Simple Optical Coherence Tomography Quantification Method for Choroidal Neovascularization. J. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. 31, 447-454 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados