Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Vivo Multimodal görüntüleme ve fare lazer kaynaklı Choroidal neovaskülarizasyon Model analizi
Bu Makalede
Özet
Burada, boyuna vivo içinde görüntüleme kullanışlılığı lazer kaynaklı choroidal neovaskülarizasyon farelerde morfolojik değişiklikler takip içinde mevcut.
Özet
Choroidal neovaskülarizasyon (KNV) lazer kaynaklı yaşa bağlı makula dejenerasyonu (AMD) ıslak şeklinde taklit etmek için köklü bir modeldir. Bu protokol için amacımız neovasküler süreçleri, ama oldukça multimodal boyuna elde edilebilir güçlü bilgi odaklanmak tetiklemek için değil, sadece teknik konuları lazer kaynaklı lezyonlar oluşturma üzerinden okuyucu rehberlik etmek içinde vivo takip süresi görüntüleme.
Lazer kaynaklı fare KNV modeli bir diyot lazer yönetim tarafından oluşturuldu. Multimodal vivo içinde görüntüleme teknikleri KNV indüksiyon, ilerleme ve gerileme izlemek için kullanılmıştır. İlk, spektral etki alanı optik Koherens tomografi (SD-Ekim) gerçekleştirilen hemen Bruch'ın membran bir mola doğrulamak için lasering sonra. Floresein anjiyografi (FA) kullanarak sonraki vivo içinde görüntüleme Bruch'ın membran choroidal düzeyinde alınan seri görüntüleri üzerinden başarılı hasarı doğruladı. KNV yayılması ve regresyon lasering sonra gün 5, 10 ve 14 boyuna takip SD-Ekim ve SK kullanılarak gerçekleştirildi. Basit ve güvenilir sızan KNV leasions SK görüntülerden, sınıflandırma sunulur. Otomatik bölümleme için KNV sitelerdeki retina kalınlığı ölçümü için el ile kalibre uygulama ile birlikte toplam retina kalınlık ölçüm yapılmasına izin ödem varlığı tarafsız değerlendirilmesi. Son olarak, histolojik KNV doğrulanması isolectin GS-IB4 choroidal flatmounts boyama kullanılarak gerçekleştirilir. Boyama thresholded ve isolectin-pozitif alan ImageJ ile hesaplanır.
Bu iletişim kuralı gibi hızlı, multimodal sağlar yüksek üretilen iş gibi tarama KNV patoloji gerektiren tedavi çalışmaları ve güvenilir KNV patoloji ve retina ödem sınıflandırılması özellikle yararlıdır. Buna ek olarak, yüksek çözünürlük SD-Ekim subretinal veya intraretinal sıvı birikimi gibi diğer patolojik işaretlerinden kayıt sağlayan. Ancak, bu yöntem bir olasılık el ile gerçekleştirilecek olan KNV cilt analizi SD-Ekim görüntüleri, otomatikleştirmek için sağlamaz.
Giriş
Başarılı ilk insan KNV Rodents patoloji taklit girişimi neredeyse otuz yıl önce uzun-Evans fareler1Kripton lazer ile gösterilmiştir. Bundan sonra bir Kripton lazer Bruch'ın membran en popüler fare gerginliği, C57BL/6J2,3,4kırmak için kullanıldı. KNV indüksiyon başarı oranını SK ve histolojik lekeleri ile doğrulandı. EKM gibi noninvaziv görüntüleme yöntemleri, hızlı bir gelişme alanı kemirgen Preklinik modellerin büyüme destekledi. Aynı göz içinde birden çok kez noktalarda retina morfolojik değişiklikler önemli ölçüde izleme olanağı hayvan kullanımı azaltma için katkıda bulunur ve deneysel çalışmalarda verimliliği artırır. KNV lezyonların histolojik değerlendirme oldukça basittir ve anormal damar büyüme lazer yönetim, resim alma ve alan/hacim tahmini bir görüntü analiz yazılımı kullanarak site etrafında etiketleme gerektirir. Buna ek olarak, daha karmaşık analizleri KNV patoloji ve onun yorumunu vivo içinde görüntüleme yöntemleri tanıtmak.
Burada SK, SD-Ekim, kullanarak sınıf indüksiyon, ilerleme ve gerileme KNV nispeten hızlı ve basit bir yöntem mevcut ve fare otomatik bölümleme yöntem lazer kaynaklı KNV modeli.
Protokol
Bütün hayvanlar göre ARVO bildirimi kullanım, onaylanmış ve Finlandiya hayvan deney Yönetim Kurulu tarafından izlenen protokolleri kullanarak hayvanlar için Ophthalmic ve vizyon araştırma ve EC Direktifi 86/609/EEC hayvan deneyleri için tedavi edildi.
1. lazer kaynaklı fare KNV modeli 5
- Hayvan macroscopically için herhangi bir anormallik gözünde bakarak kontrol edin.
- Fare tartın.
- Hesaplamak ve anestezi kullanmak için uygun bir miktarda hayvan, örneğin medetomidine (1 mg/kg), ketamin (75 mg/kg) ve distile su (% 0.9 NaCl çözüm) 1:1.5:2.5 veya ketamin (40-75 mg/kg), bir oranında karışımı ağırlık temel hazırlamak xylazine (5 mg/kg) ve 1:2. 5:1 oranında, distile su (% 0.9 NaCl çözüm); 20 g fare için 0.1 mL karışımı enjekte.
- Anestezi intraperitoneally enjekte et.
- Hayvan anestezi kadar yer fare geri içine belgili tanımlık kafes ve bekle. Fare düzgün bir pedal refleks eksikliğinden anestezi onaylayın.
- Lazer güvenlik kişisel koruyucu ekipman kullanımı olun.
- Slit lamba ve 532 nm diode lazer açın.
- Kafes ve Isıtma yastığını üzerinde yer fareyi kaldırın.
- Tropicamide bir damla Gözbebeği genişlemesi için geçerlidir. Tam (3 mm) Gözbebeği genişlemesi için 3-5 dk beklemeye.
- Fare slit lamba sahnesinde yerini.
- Bir damla göz sıvı jel bir coverslip için applanate kornea üzerine yerleştirin.
- Fare göz Merkezi görme sinirine kafasıyla gelecek şekilde yönlendirin.
- Lazer güç 100'e ayarlamak mW, süresi 100 MS ve nokta boyutu 50 µm için.
- Lazer ışını retina pigment epiteli (RPE) odaklanmak.
- Üç lazer atış bir göz retina damarları 4, 8 ve 12 yönünde konumlarını optik sinir, etrafında, ideal olarak sırasıyla kaçınarak olun. Sonra tüm çekimleri retinal kanama olmaması için lazer göz fundus inceleyin. Kontralateral göz sigara lazerle denetimi olarak hizmet vermektedir.
- Coverslip ve yer fare geri Isıtma yastığını atmak.
- PEG jel damla bir damla her iki gözde uygulanır.
2. SD-Ekim 6,7
- Fare kemirgen hizalama sahne içine yerleştirin ve baş hareketsiz.
- SD-Ekim (örneğin, Bioptigen/Leica Envisu R2200) göz yüz sistem objektif vivo içinde görüntüleme için X ve Y-seviyeli denetleyicilerini kullanarak hizalayın.
- Bruch'ın membran sonları doğrulamak için SD-Ekim taramalar: SD-Ekim bütün göz tarar kez lazerle sitelerinde başvuru satırı el ile taşımak. Bruch'ın membran sonları (bkz. şekil 1) lazerle alanlarda açıkça görünür olmalıdır.
3. floresein anjiyografi 7,8,9
- Fare ile sahibi çıkarın ve SK sisteminde (örneğin, Heidelberg Spectralis HRA2) yerleştirin.
- Lazer odak optik sinir izleme pencerenin ortasında başkanı ile kızılötesi yansıma modunu kullanarak göz fundus alanlarında yakmak.
- 0.1 mL % 5 fluoresein sodyum tuz 20 gr fare subkutan veya intraperitoneally enjekte.
- Choroidal düzeyde odak.
- Fotoðraf choroidal odak seviyesinden.
- Retina düzeyinde yeniden odaklanın ve fotoðraf.
- 30 s ve Yinele adımları için 3,4-3.6 bekleyin.
- Fare sahibinden çıkarın ve Isıtma yastığını yerleştirin.
- Ters anestezi tarafından α2-antagonisti medetomidine, atipamezole (0.5 mg/kg, IP) veya anestezi hayvan kurtarma için bekleyin.
- In vivo SD-Ekim ve SK görüntüleme imzalat hayvanlarda takip günlerini 5, 10 ve 14 üzerinde yineleyin.
4. KNV sınıflandırma
- Sınıf Bruch'ın membran OCT görüntüleri ve choroidal SK görüntüleri hemen aşağıdaki gibi gün 0 lasering sonra alınan hasar:
0 - Bruch'ın membran hasar değil
1 - Bruch'ın membran başarılı hasar - Sınıf KNV varlığı gibi bir dizi retina SK resmi olarak aşağıdaki floresein sinyal dinamikleri karşılaştırarak sızıntı vardı lazerle noktalardan:
0 - retina normal görünüm
0.5 - zayıf boyama kaçağı
1.0 - Sızıntılı KNV alanları
Not: OCT görüntüleme ek onay KNV veya şüpheli SK nerede OCT görüntülerde intraretinal sıvı varlığını KNV sınıflandırma öneririz kullanın.
5. retina kalınlığı ölçümleri
- Bir otomatik bölümleme yazılımı retina kalınlığı ölçümleri için kullanın. Toplam retina kalınlık, Sinir lifi tabakası RPE (sağlıklı ölçüm siteler) veya hayali bir çizgi RPE hasar (lazerle siteler) sitenin etrafına bağlanan tüm katmanlardan kalınlığı olarak kabul edilir sağlamak (Ayrıca bkz: Şekil 7).
Sonuçlar
Kabarcık veya subretinal hemen lasering sonra kanama her zaman görünür değil. Bu nedenle, SD-Ekim Bruch'ın membran hasar doğrulamak özellikle önemlidir. Şekil 1 lazer yönetim sonra farklı zaman noktalarda OCT görüntüleme bir örneği gösterilir.
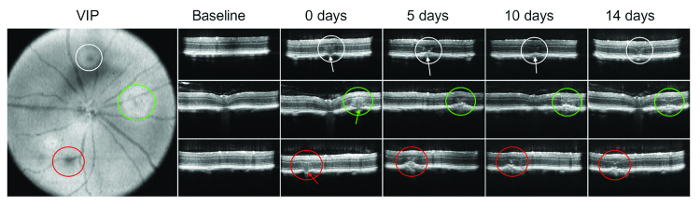
Resim 1 : OCT tr y...
Tartışmalar
Multimodal görüntüleme KNV patoloji değerlendirme için değerli araçlar sunar. Burada SK, oluşan bir görüntüleme Protokolü sunulan SD-Ekim ve KNV patoloji hızlı, tekrarlanabilir ve güvenilir değerlendirilmesi için otomatik bölümleme. Lazer yönetim doğrulandı sonra Bruch'ın membran bir mola. Buna ek olarak, SD-Ekim bu aşamada da sonuçları yorumu yıkmak olası intraretinal ve subretinal kanama hemen görselleştirme izin. Retina sızıntıları floresein sinyal SK görüntülerden göre kademeli. ...
Açıklamalar
Yazar Symantas Ragauskas, doktora bir çalışan (bilim) ve hissedar Teklifler araştırma hizmetleri bu makalede kullanılan preklinik KNV modeli istihdam sözleşme Experimentica Ltd. ' dir.
Eva Kielczewski bir çalışan (araştırma uygulamaları mühendis, OCT) Bu makalede kullanılan SD-Ekim sistemleri üretir Leica Mikrosistemlerin temelleri yazarıdır.
Yazar Joseph Vance'in bir çalışandır (NA OCT satış direktörü) Bu makalede kullanılan SD-Ekim sistemleri üretir Leica Mikrosistemlerin temelleri. Joseph Vance'in Başkan ve yönetim müdürü Spective, LLC da.
Yazar Simon Kaja, doktora Danışmanı Scientific Müdürü ve hissedar, Experimentica Ltd., teklifler araştırma hizmetleri, sözleşme preklinik sözleşme araştırma kuruluşu preklinik KNV modeli bu makalede kullanılan dahil olduğunu. Simon Kaja, doktora da CEO K & bilimsel P, LLC, danışmanlık firması, Yaşam Bilimleri ve Dr. John s. ve Therese E. Mulcahy donatılmış Profesör Chicago Loyola Üniversitesi, Stritch tıp Fak., Oftalmoloji olarak hizmet vermektedir. Bu düzenleme koşulları incelenmeli ve çıkar çatışması politikasına uygun olarak Chicago Loyola Üniversitesi tarafından onaylanmalıdır.
Yazar Giedrius Kalesnykas, doktora bir çalışan (CEO) ve teklifler araştırma hizmetleri bu makalede kullanılan preklinik KNV modeli istihdam sözleşme Experimentica Ltd. hissedarı olduğunu.
Teşekkürler
Yazarlar için mükemmel teknik ve videographic destek Yuliya Naumchuk (Chicago Loyola Üniversitesi) ve Agne Žiniauskaitė (Experimentica Ltd) teşekkür etmek istiyorum. Dr. Kaja'nın araştırma programı Dr John P. ve Therese E. Mulcahy donatılmış profesörlük Oftalmoloji, Chicago Loyola Üniversitesi tarafından desteklenir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Medetomidine (commercial name Domitor) | Orion | Vnr 01 56 02 | Anesthesia |
| Ketamine | Intervet | Vnr 51 14 85 | Anesthesia |
| 0,9% NaCl | B Braun | 357 0340 | Anesthesia |
| Xylazine (commercial name Rompun vet) | Bayer | vnr 14 89 99 | Anesthesia |
| Tropicamide | Santen | Vnr 04 12 36 | Mydriatic agent |
| Viscotears | Alcon | Vnr 44 54 81 | Lubricant |
| Systane | Alcon | - | Lubricant |
| 5% Fluorescein sodium salt | Sigma Aldrich | F6377-100G | Fluoresent agent |
| Atipamezole (commercial name Antisedan) | Orion | Vnr 47 19 53 | Anesthesia |
Referanslar
- Dobi, E. T., Puliafito, C. A., Destro, M. A new model of experimental choroidal neovascularization in the rat. Arch. Ophthalmol. Chic. Ill 1960. 107, 264-269 (1989).
- Tobe, T., et al. Evolution of neovascularization in mice with overexpression of vascular endothelial growth factor in photoreceptors. Invest. Ophthalmol. Vis. Sci. 39, 180-188 (1998).
- Seo, M. S., et al. Dramatic inhibition of retinal and choroidal neovascularization by oral administration of a kinase inhibitor. Am. J. Pathol. 154, 1743-1753 (1999).
- Grossniklaus, H. E., Kang, S. J., Berglin, L. Animal models of choroidal and retinal neovascularization. Prog. Retin. Eye Res. 29, 500-519 (2010).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A Mouse Model for Laser-induced Choroidal Neovascularization. J Vis Exp. (106), e53502 (2015).
- Giani, A., et al. In vivo evaluation of laser-induced choroidal neovascularization using spectral-domain optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 52, 3880-3887 (2011).
- Gong, Y., et al. Optimization of an Image-Guided Laser-Induced Choroidal Neovascularization Model in Mice. PloS One. 10, e0132643 (2015).
- Sheets, K. G., et al. Neuroprotectin D1 attenuates laser-induced choroidal neovascularization in mouse. Mol. Vis. 16, 320-329 (2010).
- Hoerster, R., et al. In-vivo and ex-vivo characterization of laser-induced choroidal neovascularization variability in mice. Graefes Arch. Clin. Exp. Ophthalmol. Albrecht Von Graefes Arch. Klin. Exp. Ophthalmol. 250, 1579-1586 (2012).
- Sulaiman, R. S., et al. A Simple Optical Coherence Tomography Quantification Method for Choroidal Neovascularization. J. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. 31, 447-454 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır