Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In Vivo Imagerie multimodale et analyse du modèle de néovascularisation choroïdienne souris induite par Laser
Dans cet article
Résumé
Nous présentons ici l’utilité de longitudinal en vivo imagerie dans le suivi des modifications morphologiques de la néovascularisation choroïdienne induite par laser chez les souris.
Résumé
Induite par laser de néovascularisation choroïdienne (NVC) est un modèle bien établi pour imiter la forme humide de la dégénérescence maculaire liée à l’âge (DMLA). Dans ce protocole, notre objectif est de guider le lecteur non pas simplement par le biais de considérations techniques de générer des lésions induites par le laser pour déclencher des processus néovasculaire, mais plutôt se concentrer sur l’information puissants qui peut être obtenue au multimodal longitudinale in vivo imagerie tout au long de la période de suivi.
La souris induite par laser modèle CNV a été générée par une administration de laser de diode. Techniques d’imagerie multimodale en vivo ont été utilisés pour surveiller l’induction, la progression et la régression CNV. Tout d’abord, tomographie à cohérence optique domaine spectral (SD-OCT) ont été effectuée immédiatement après la lasering pour vérifier une rupture de la membrane de Bruch. Subséquent en vivo imagerie utilisant l’angiographie à la fluorescéine (FA) a confirmé des dommages réussi de la membrane de Bruch de série images acquises au niveau choroïdienne. Suivi longitudinal de la prolifération de la CNV et régression sur 5, 10 et 14 jours après le lasering a effectué un SD-OCT et FA. Simple et fiable de classement de leaky leasions CNV d’images de FA sont présenté. Segmentation automatique pour la mesure de l’épaisseur totale de rétine, combinée avec application de calibre manuel pour le mesurage de l’épaisseur rétinienne aux sites de la CNV, permettent une évaluation impartiale de la présence de le œdème. Enfin, vérification histologique du CNV est effectuée à l’aide d’isolectine GS-IB4 coloration sur flatmounts choroïdienne. La coloration est binariser, et la zone isolectine-positif est calculée avec ImageJ.
Ce protocole est particulièrement utile dans les études thérapeutiques nécessitant haut-débit comme dépistage de pathologie de la CNV, car elle permet de vite, multimodal et classification fiable de l’oedème de pathologie et de la rétine CNV. En outre, haute résolution SD-OCT permet l’enregistrement d’autres caractéristiques pathologiques, tels que l’accumulation de liquide sous-rétinienne ou remaniements. Cependant, cette méthode n’offre pas la possibilité d’automatiser CNV volume analyse des images SD-OCT, qui doit être effectuée manuellement.
Introduction
La première tentative réussie pour imiter la pathologie de la CNV humaine chez les rongeurs a été démontrée il y a près de trois décennies avec un laser krypton de rats Long-Evans1. Par la suite, un laser krypton servait à rompre la membrane de Bruch dans la souche de souris plus populaire, C57BL/6J2,3,4. Le taux de réussite de l’induction de la CNV a été vérifié avec FA et taches histologiques. Un développement rapide des modalités d’imagerie non invasives, tels que les PTOM, favorisé la croissance du champ des modèles précliniques de rongeurs. La capacité de surveiller les changements morphologiques dans la rétine à plusieurs moments dans l’oeil même significativement contribue à la réduction de l’utilisation des animaux et augmente l’efficacité dans des études expérimentales. Une évaluation histologique des lésions de la CNV est plutôt simple et exige le marquage de la croissance vasculaire anormale autour du site d’administration de laser, acquisition d’images et estimation de surface/volume à l’aide d’un logiciel d’analyse image. En revanche, les modalités d’imagerie in vivo introduisent des analyses plus complexes de la pathologie de la CNV et son interprétation.
Nous présentons ici une méthode simple et relativement rapide d’induction de grade, la progression et la régression de la CNV à l’aide de la FA, SD-OCT, et la méthode de segmentation automatique chez la souris laser-induced CNV modèle.
Protocole
Tous les animaux ont été traités conformément à la déclaration d’ARVO sur l’utilisation des animaux ophtalmique et Vision Research et la Directive européenne 86/609/CEE pour l’expérimentation animale, à l’aide de protocoles approuvé et contrôlé par le Conseil finlandais Animal Experiment.
1. induite par laser souris CNV modèle 5
- Inspecter les yeux de l’animal macroscopiquement pour toute anomalie.
- Peser la souris.
- Calculer et préparer une quantité appropriée d’anesthésiques à utiliser, basé sur le poids de l’animal, par exemple un mélange de médétomidine (1 mg/kg), la kétamine (75 mg/kg) et l’eau distillée (solution de NaCl à 0,9 %) dans un rapport de 1:1.5:2.5, ou la kétamine (40 à 75 mg/kg), xylazine (5 mg/kg) et l’eau distillée (solution de NaCl à 0,9 %) à un ratio de 1 : 2. 5:1 ; pour une souris de 20 g, injecter 0,1 mL du mélange.
- Injecter par voie intrapéritonéale anesthésique.
- Replacez les souris dans la cage et d’attendre jusqu'à ce que l’animal est anesthésié. Confirmer que la souris est correctement anesthésiée par manque d’un réflexe de pédale.
- Assurer l’utilisation des équipements de protection individuelle sécurité laser.
- Allumer une lampe à fente et un laser à diode 532 nm.
- Retirer la souris de la cage et le déposer sur le coussin chauffant.
- Appliquer une goutte de Tropicamide pour la dilatation pupillaire. Attendre 3-5 min pour la dilatation pupillaire intégral (3 mm).
- Placez votre souris sur la scène de la lampe à fente.
- Placez une goutte de gel liquide ophtalmique sur un lamelle couvre-objet pour applanate la cornée.
- Orienter l’oeil de la souris avec la tête du nerf optique au centre.
- La valeur de la puissance du laser à 100 mW, la durée à 100 ms et la taille de tache à 50 µm.
- Concentrer le faisceau laser sur l’épithélium pigmentaire rétinien (RPE).
- Faire trois coups de laser dans un œil en évitant les vaisseaux sanguins rétiniens idéalement à la 4, 8 et 12:00 positions autour du nerf optique, respectivement. Après tous les coups pour absence d’hémorragie de la rétine au laser, vérifier le fond de le œil. Le œil controlatéral sert un contrôle non retiré.
- Jeter la souris lamelle couvre-objet et la place sur le coussin chauffant.
- Appliquez une goutte de gouttes de gel PEG sur les deux yeux.
2. SD-OCT 6,7
- Placez la souris dans l’étape de l’alignement de rongeurs et immobiliser la tête.
- Aligner l’objectif du système SD-OCT (p. ex., Bioptigen/Leica Envisu R2200) pour faire face à l’oeil pour l’imagerie in vivo à l’aide de contrôleurs X - et Y-étape.
- Effectuer des analyses pour vérifier les ruptures de la membrane de Bruch SD-OCT : une fois que le SD-OCT scanne l’oeil entier, déplacer manuellement la ligne de référence sur les sites lasered. Ruptures de la membrane de Bruch doivent être clairement visibles dans les zones lasered (voir Figure 1).
3. fluorescéine angiographie 7,8,9
- Retirer les souris avec le titulaire et placez-le sur le système de FA (p. ex., Heidelberg Spectralis HRA2).
- Focus au laser brûler les zones de le œil de le œil en utilisant le mode de réflectance infrarouge avec la tête du nerf optique au milieu de la fenêtre de visualisation.
- Injecter 0,1 mL de sel de sodium 5 % fluorescéine pour une souris de 20 g par voie sous-cutanée ou intrapéritonéale.
- Mettre l’accent sur le niveau de la choroïde.
- Prendre une image par rapport au niveau de la choroïde se concentrer.
- Recentrer au niveau rétinien et prendre la photo.
- Attendre 30 s et répéter les étapes 3,4 à 3,6.
- Retirez la souris du support et placez-la sur le coussin chauffant.
- Inverser l’anesthésie par α2-antagoniste de la médétomidine, Atipamézole (0,5 mg/kg, i.p.) ou attente de relance animale de l’anesthésie.
- Répéter en vivo SD-OCT et FA imagerie chez des animaux anesthésiés les jours suivi de 5, 10 et 14.
4. CNV classement
- Catégorie des dommages de la membrane de Bruch d’images OCT et choroïdienne FA prise immédiatement après le lasering au jour J0 comme suit :
0 - la membrane de Bruch n’était pas endommagée
1 - succès dommage de la membrane de Bruch - Note la présence de NVC de taches lasered ayant une fuite observée en comparant la dynamique du signal de fluorescéine dans une série d’images rétiniennes de FA comme suit :
0 - aspect normal de la rétine
0,5 - coloration pâle de fuite
1.0 - zones CNV qui fuites
Remarque : Utilisez l’imagerie OCT pour une confirmation supplémentaire de CNV ou en FA douteux où la présence de remaniements liquide en images OCT suggère CNV classement.
5. mesures d’épaisseur rétinienne
- Utiliser un logiciel de segmentation automatique pour des mesures d’épaisseur rétinienne. S’assurer que l’épaisseur totale de rétine est considéré, comme l’épaisseur de toutes les couches de la couche de fibres nerveuses à RPE (stations de mesure en bonne santé), ou à une ligne imaginaire reliant RPE autour du site de dommages (sites lasered) (voir aussi la Figure 7).
Résultats
Une bulle ou subretinal saignement immédiatement après lasering n’est pas toujours visible. SD-OCT est donc particulièrement important pour vérifier les dommages de la membrane de Bruch. Figure 1 montre un exemple de l’imagerie OCT à des moments différents après l’administration de laser.
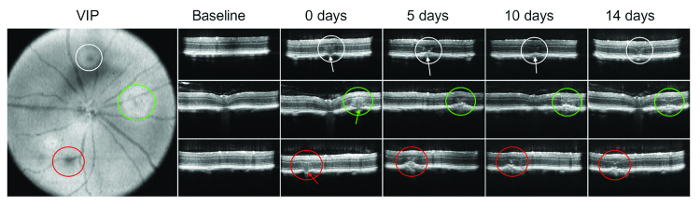
Discussion
Imagerie multimodale offre des outils précieux pour l’évaluation de pathologie CNV. Ici, nous avons présenté un protocole d’imagerie consistant en FA, SD-OCT et segmentation automatique pour l’évaluation rapide, reproductible et fiable de la pathologie de la CNV. Une rupture de la membrane de Bruch après que administration de laser a été confirmée. En outre, l’utilisation du SD-OCT à ce stade a également permis une visualisation immédiate de possibles hémorragies remaniements et sous-rétinienne, qui...
Déclarations de divulgation
L’auteur Symantas Ragauskas, Ph.d. est employé (chercheur) et actionnaire de Experimentica Ltd. qui offre du contrat de services de recherche en utilisant le modèle préclinique de CNV utilisé dans cet Article.
L’auteur Eva Kielczewski est employé (ingénieur de recherche des applications, OCT) de Leica Microsystems qui produit des systèmes de SD-OCT utilisés dans cet Article.
L’auteur Joseph Vance est un employé (OCT NA Sales Director) de Leica Microsystems qui produit des systèmes de SD-OCT utilisés dans cet Article. Joseph Vance est également le Président et directeur général de sidération, LLC.
L’auteur Simon Kaja, Ph.d. est conseiller scientifique en chef et actionnaire de Experimentica Ltd., précliniques contrat organisme de recherche qui offre du contrat de services de recherche, y compris le modèle préclinique de la CNV utilisé dans cet article. Simon Kaja, Ph.d. est également CEO de K & P scientifique, LLC, un cabinet, sciences de la vie et sert pour le Dr John P. et Thérèse E. Mulcahy doué professeur en ophtalmologie à Loyola University Chicago Stritch School of Medicine. Les termes de cet arrangement ont été revus et approuvés par Loyola University Chicago conformément à sa politique de conflit d’intérêts.
L’auteur Giedrius Kalesnykas, Ph.d. est employé (CEO) et actionnaire de Experimentica Ltd. qui offre du contrat de services de recherche en utilisant le modèle préclinique de CNV utilisé dans cet Article.
Remerciements
Les auteurs voudrais remercier Yuliya Naumchuk (Loyola University Chicago) et Agne Žiniauskaitė (Experimentica Ltd.) pour l’excellent soutien technique et vidéographique. Programme de recherche du Dr Kaja est pris en charge par le Dr John P. et E. de Therese Mulcahy doué professeur en ophtalmologie à Loyola University Chicago.
matériels
| Name | Company | Catalog Number | Comments |
| Medetomidine (commercial name Domitor) | Orion | Vnr 01 56 02 | Anesthesia |
| Ketamine | Intervet | Vnr 51 14 85 | Anesthesia |
| 0,9% NaCl | B Braun | 357 0340 | Anesthesia |
| Xylazine (commercial name Rompun vet) | Bayer | vnr 14 89 99 | Anesthesia |
| Tropicamide | Santen | Vnr 04 12 36 | Mydriatic agent |
| Viscotears | Alcon | Vnr 44 54 81 | Lubricant |
| Systane | Alcon | - | Lubricant |
| 5% Fluorescein sodium salt | Sigma Aldrich | F6377-100G | Fluoresent agent |
| Atipamezole (commercial name Antisedan) | Orion | Vnr 47 19 53 | Anesthesia |
Références
- Dobi, E. T., Puliafito, C. A., Destro, M. A new model of experimental choroidal neovascularization in the rat. Arch. Ophthalmol. Chic. Ill 1960. 107, 264-269 (1989).
- Tobe, T., et al. Evolution of neovascularization in mice with overexpression of vascular endothelial growth factor in photoreceptors. Invest. Ophthalmol. Vis. Sci. 39, 180-188 (1998).
- Seo, M. S., et al. Dramatic inhibition of retinal and choroidal neovascularization by oral administration of a kinase inhibitor. Am. J. Pathol. 154, 1743-1753 (1999).
- Grossniklaus, H. E., Kang, S. J., Berglin, L. Animal models of choroidal and retinal neovascularization. Prog. Retin. Eye Res. 29, 500-519 (2010).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A Mouse Model for Laser-induced Choroidal Neovascularization. J Vis Exp. (106), e53502 (2015).
- Giani, A., et al. In vivo evaluation of laser-induced choroidal neovascularization using spectral-domain optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 52, 3880-3887 (2011).
- Gong, Y., et al. Optimization of an Image-Guided Laser-Induced Choroidal Neovascularization Model in Mice. PloS One. 10, e0132643 (2015).
- Sheets, K. G., et al. Neuroprotectin D1 attenuates laser-induced choroidal neovascularization in mouse. Mol. Vis. 16, 320-329 (2010).
- Hoerster, R., et al. In-vivo and ex-vivo characterization of laser-induced choroidal neovascularization variability in mice. Graefes Arch. Clin. Exp. Ophthalmol. Albrecht Von Graefes Arch. Klin. Exp. Ophthalmol. 250, 1579-1586 (2012).
- Sulaiman, R. S., et al. A Simple Optical Coherence Tomography Quantification Method for Choroidal Neovascularization. J. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. 31, 447-454 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon