È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In Vivo Imaging multimodale e l'analisi di Mouse indotta da Laser modello di Neovascularization coroidico
In questo articolo
Riepilogo
Qui, presentiamo l'utilità di longitudinale in vivo imaging nel follow-up dei cambiamenti morfologici del neovascularization coroidico laser-indotta in topi.
Abstract
Indotta da laser il neovascularization coroidico (CNV) è una modella ben affermata per imitare la forma umida di degenerazione maculare senile (AMD). In questo protocollo, ci proponiamo di guidare il lettore non semplicemente attraverso le considerazioni tecniche di generare lesioni indotte da laser per innescare processi neovascolare, ma piuttosto concentrarsi sulle informazioni potenti che possono essere ottenute da multimodal longitudinale in vivo imaging durante tutto il periodo di follow-up.
Il topo indotta da laser modello CNV è stato generato da un'amministrazione di laser del diodo. Tecniche di imaging multimodale in vivo sono stati utilizzati per monitorare la CNV induzione, progressione e regressione. Primo, tomografia a coerenza ottica dominio spettrale (SD-OCT) è stata effettuata immediatamente dopo la lavorazione laser per verificare una rottura della membrana di Bruch. Successivi in vivo imaging mediante angiografia della fluorescina (FA) ha confermato il successo danno della membrana di Bruch da seriale immagini acquisite a livello della coroide. Follow-up longitudinale di proliferazione di CNV e regressione nei giorni 5, 10 e 14 dopo la lavorazione laser è stato effettuato usando sia SD-OCT e FA. Semplice e affidabile di classificazione di leasions di CNV che perde da FA immagini è presentato. Segmentazione automatizzata per la misurazione dello spessore retinico totale, combinato con applicazione manuale calibro per la misurazione dello spessore retinico a siti CNV, consentire la valutazione imparziale della presenza dell'edema. Infine, verifica istologica di CNV viene eseguita utilizzando isolectin GS-IB4 colorazione sul flatmounts coroidico. La colorazione è con soglia, e viene calcolata l'area isolectin-positivi con ImageJ.
Questo protocollo è particolarmente utile negli studi di terapeutica che richiedono alta-velocità di trasmissione-come proiezione di patologia CNV quanto consente veloce, multimodale e affidabile classificazione dell'edema di patologia e retinico CNV. Inoltre, ad alta risoluzione SD-OCT consente la registrazione di altre caratteristiche patologiche, come l'accumulazione di liquido subretinal o intraretinico. Tuttavia, questo metodo non fornisce la possibilità di automatizzare l'analisi di volume CNV da immagini SD-OCT, che deve essere eseguita manualmente.
Introduzione
Il primo tentativo riuscito di imitare la patologia di CNV umana nei roditori è stato dimostrato quasi tre decenni fa con un laser di krypton a lungo Evans ratti1. Da allora in poi, un laser di krypton è stato utilizzato per rompere la membrana di Bruch nel ceppo più popolare del mouse C57BL/6J2,3,4. Il tasso di successo dell'induzione di CNV è stato verificato con FA e macchie istologiche. Un rapido sviluppo di modalità di imaging non invasivo, ad esempio OCT, ha favorito la crescita del campo di modelli preclinici del roditore. La possibilità di monitorare i cambiamenti morfologici nella retina a più punti di tempo nello stesso occhio significativamente contribuisce alla riduzione dell'uso di animali e aumenta l'efficienza negli studi sperimentali. La valutazione istologica delle lesioni CNV è piuttosto semplice e richiede etichettatura di crescita vascolare anormale intorno al sito di amministrazione di laser, acquisizione di immagini e stima di superficie/volume utilizzando un software di analisi di immagine. Al contrario, la modalità di imaging in vivo introdurre più complesse analisi di CNV patologia e sua interpretazione.
Qui presentiamo un metodo semplice e relativamente veloce per induzione di grado, la progressione e regressione di CNV utilizzando FA, SD-OCT, e il metodo di segmentazione automatizzata nel topo indotta da laser CNV modello.
Protocollo
Tutti gli animali sono stati trattati in conformità con la dichiarazione di ARVO per l'uso degli animali in oftalmica e Vision Research e CE direttiva 86/609/CEE per gli esperimenti sugli animali, utilizzando protocolli approvati e monitorati dal Consiglio esperimento animale della Finlandia.
1. indotto da laser mouse CNV modello 5
- Ispezionare gli occhi dell'animale in modo macroscopico per eventuali anomalie.
- Pesare il mouse.
- Calcolare e preparare un'appropriata quantità di anestetici da utilizzare, in base al peso dell'animale, ad esempio una miscela di medetomidina (1 mg/kg), ketamina (75 mg/kg) e acqua distillata (soluzione di NaCl 0,9%) a un rapporto di 1:1.5:2.5, o ketamina (40-75 mg/kg), xilazina (5 mg/kg) e acqua distillata (soluzione di NaCl 0,9%) a un rapporto di 1:2. 5:1; per un mouse 20g, iniettare 0,1 mL della miscela.
- Iniettare anestetico per via intraperitoneale.
- Posizionare il mouse nuovamente dentro la gabbia e aspettare fino a quando l'animale è anestetizzato. Confermare che il mouse è adeguatamente anestetizzato dalla mancanza di una reflex pedale.
- Garantire l'uso di dispositivi di protezione individuale sicurezza laser.
- Accendere una lampada a fessura e un laser a diodo 532 nm.
- Rimuovere il mouse dalla gabbia e posto il termoforo.
- Applicare una goccia di Tropicamide per dilatazione pupillare. Attendere 3-5 min per la dilatazione pupillary pieno (3 mm).
- Posizionare il mouse sul palco della lampada a fessura.
- Depositare una goccia di gel liquido opthalmic su un vetrino coprioggetto per applanate la cornea.
- Orientare l'occhio del mouse con la testa del nervo ottico nel centro.
- Impostare la potenza del laser a 100 mW, la durata di 100 ms e la dimensione dello spot a 50 µm.
- Focalizzare il fascio laser sull'epitelio pigmentato retinico (RPE).
- Fare tre colpi di laser in un occhio evitando vasi sanguigni retinici idealmente a 4, 8 e 12 posizioni intorno al nervo ottico, rispettivamente. Ispezionare il fondo dell'occhio dopo tutti i laser scatti per assenza di emorragia retinica. L'occhio controlaterale serve come controllo non laserato.
- Scartare il mouse vetrino coprioggetti e posto indietro il termoforo.
- Applicare una goccia di PEG gel gocce su entrambi gli occhi.
2. SD-OCT 6,7
- Posizionare il mouse in fase di allineamento del roditore e immobilizzare la testa.
- Allineare la lente del sistema SD-OCT (ad es., Bioptigen/Leica Envisu R2200) ad affrontare l'occhio per l'imaging in vivo utilizzando controller X - e Y-stage.
- Eseguire scansioni di SD-OCT per verificare rotture della membrana di Bruch: una volta che il SD-OCT scansiona l'intero occhio, spostare manualmente la linea di riferimento sui siti laserati. Rotture della membrana di Bruch devono essere chiaramente visibile nelle aree laserate (Vedi Figura 1).
3. fluoresceina angiografia 7,8,9
- Rimuovere il mouse con il titolare e posizionarlo sul sistema FA (ad es., Heidelberg Spectralis HRA2).
- Messa a fuoco laser masterizzare aree del fondo dell'occhio utilizzando la modalità a raggi infrarossi riflettanza con la testa del nervo ottico al centro della finestra di visualizzazione.
- Iniettare 0,1 mL di sale di sodio di 5% della fluorescina per un mouse di 20 g per via sottocutanea o per via intraperitoneale.
- Concentrarsi sul livello della coroide.
- Prendere un'immagine dal livello di messa a fuoco della coroide.
- Rimettere a fuoco a livello della retina e prendere un'immagine.
- Attendere per 30 s e ripetere passaggi 3.4-3.6.
- Rimuovere il mouse dal supporto e posizionarlo sul rilievo di riscaldamento.
- Invertire l'anestesia α2-antagonista per medetomidina, atipamezolo (0,5 mg/kg, i.p.) o attesa per animale recupero dall'anestesia.
- Ripetere in vivo SD-OCT e FA imaging in animali anestetizzati sui giorni di follow-up 5, 10 e 14.
4. CNV classificazione
- Grado il danno della membrana di Bruch da immagini di ottobre e coroidica FA immagini scattate subito dopo la lavorazione al laser il giorno 0 come segue:
0 - membrana di Bruch non è stata danneggiata
1 - successo danno della membrana di Bruch - Grado la presenza di CNV da laserata macchie che aveva perdite come osservato confrontando la dinamica del segnale della fluorescina in una serie di immagini retiniche FA come segue:
0 - aspetto normale della retina
0,5 - macchiatura debole di perdita
1.0 - aree CNV che perde
Nota: Utilizzare l'imaging OCT per ulteriore conferma di CNV o in discutibile FA dove la presenza di liquido intraretinico in immagini di ottobre vorrei suggerire CNV classificazione.
5. misure di spessore retinico
- Utilizzare un software di segmentazione automatizzata per le misurazioni dello spessore retinico. Assicurarsi che lo spessore totale della retina è considerato, come lo spessore degli strati tutti da strato delle fibre nervose di RPE (siti di misura sano) o di una linea immaginaria che collega RPE intorno al sito di danno (laserate siti) (Vedi anche Figura 7).
Risultati
Una bolla o subretinal sanguinamento immediatamente dopo lavorazione laser non è sempre visibile. Pertanto, SD-OCT è particolarmente importante per verificare il danno della membrana di Bruch. Figura 1 Mostra un esempio di formazione immagine OCT a tempi diversi dopo la somministrazione di laser.
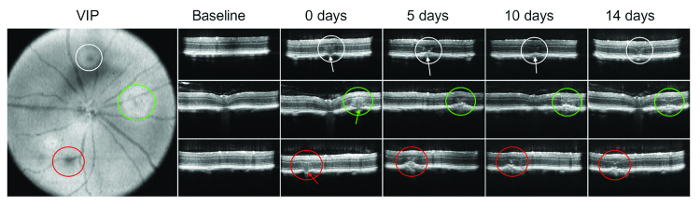
Discussione
Imaging multimodale offre preziosi strumenti per la valutazione di patologia CNV. Qui abbiamo presentato un protocollo imaging composto da FA, SD-OCT e segmentazione automatica per la valutazione rapida, riproducibile e affidabile di patologia CNV. Una rottura della membrana di Bruch dopo amministrazione del laser è stato confermato. Inoltre, l'uso di SD-OCT in questa fase anche ha permesso la visualizzazione immediata delle possibili emorragie intraretiniche e subretinal, che può confondere l'interpretazione dei risul...
Divulgazioni
L'autore Symantas Ragauskas, pH.d. è un dipendente (ricercatore) e azionista di Experimentica Ltd. che offre servizi di ricerca che impiegano il modello preclinico di CNV utilizzato in questo articolo del contratto.
L'autore Eva Kielczewski è un impiegato (Ricerca applicazioni engineer, OCT) di Leica Microsystems che produce sistemi di SD-OCT utilizzati in questo articolo.
L'autore Joseph Vance è un dipendente (NA OCT direttore vendite) di Leica Microsystems che produce sistemi di SD-OCT utilizzati in questo articolo. Joseph Vance è anche Presidente e amministratore delegato di spettiva, LLC.
L'autore Simon Kaja, pH.d. è consulente Chief Scientific Officer e azionista di Experimentica Ltd., un'organizzazione di ricerca preclinica contratto che offre servizi di ricerca, contraggono incl. il modello preclinico di CNV utilizzato in questo articolo. Simon Kaja, pH.d. è anche CEO di K & P scientifica, LLC, una consulenza, Scienze della vita e serve come il Dr. John P. e Therese E. Mulcahy dotato professore di Oftalmologia presso la Loyola University Chicago, Stritch School of Medicine. I termini di questo accordo sono stati esaminati e approvati dal Loyola University Chicago in conformità alla sua politica di conflitto di interessi.
L'autore Giedrius Kalesnykas, pH.d. è un dipendente (CEO) e azionista di Experimentica Ltd. che offre servizi di ricerca che impiegano il modello preclinico di CNV utilizzato in questo articolo del contratto.
Riconoscimenti
Gli autori vorrei ringraziare Yuliya Naumchuk (Loyola University Chicago) e Agne Žiniauskaitė (Experimentica Ltd.) per un eccellente supporto tecnico e videografiche. Programma di ricerca del Dr. Kaja è supportato dal Dr. John P. e Therese E. Mulcahy dotato Professorship in Oftalmologia presso la Loyola University di Chicago.
Materiali
| Name | Company | Catalog Number | Comments |
| Medetomidine (commercial name Domitor) | Orion | Vnr 01 56 02 | Anesthesia |
| Ketamine | Intervet | Vnr 51 14 85 | Anesthesia |
| 0,9% NaCl | B Braun | 357 0340 | Anesthesia |
| Xylazine (commercial name Rompun vet) | Bayer | vnr 14 89 99 | Anesthesia |
| Tropicamide | Santen | Vnr 04 12 36 | Mydriatic agent |
| Viscotears | Alcon | Vnr 44 54 81 | Lubricant |
| Systane | Alcon | - | Lubricant |
| 5% Fluorescein sodium salt | Sigma Aldrich | F6377-100G | Fluoresent agent |
| Atipamezole (commercial name Antisedan) | Orion | Vnr 47 19 53 | Anesthesia |
Riferimenti
- Dobi, E. T., Puliafito, C. A., Destro, M. A new model of experimental choroidal neovascularization in the rat. Arch. Ophthalmol. Chic. Ill 1960. 107, 264-269 (1989).
- Tobe, T., et al. Evolution of neovascularization in mice with overexpression of vascular endothelial growth factor in photoreceptors. Invest. Ophthalmol. Vis. Sci. 39, 180-188 (1998).
- Seo, M. S., et al. Dramatic inhibition of retinal and choroidal neovascularization by oral administration of a kinase inhibitor. Am. J. Pathol. 154, 1743-1753 (1999).
- Grossniklaus, H. E., Kang, S. J., Berglin, L. Animal models of choroidal and retinal neovascularization. Prog. Retin. Eye Res. 29, 500-519 (2010).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A Mouse Model for Laser-induced Choroidal Neovascularization. J Vis Exp. (106), e53502 (2015).
- Giani, A., et al. In vivo evaluation of laser-induced choroidal neovascularization using spectral-domain optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 52, 3880-3887 (2011).
- Gong, Y., et al. Optimization of an Image-Guided Laser-Induced Choroidal Neovascularization Model in Mice. PloS One. 10, e0132643 (2015).
- Sheets, K. G., et al. Neuroprotectin D1 attenuates laser-induced choroidal neovascularization in mouse. Mol. Vis. 16, 320-329 (2010).
- Hoerster, R., et al. In-vivo and ex-vivo characterization of laser-induced choroidal neovascularization variability in mice. Graefes Arch. Clin. Exp. Ophthalmol. Albrecht Von Graefes Arch. Klin. Exp. Ophthalmol. 250, 1579-1586 (2012).
- Sulaiman, R. S., et al. A Simple Optical Coherence Tomography Quantification Method for Choroidal Neovascularization. J. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. 31, 447-454 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon