É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Na Vivo Imagiologia multimodal e análise do modelo de neovascularização coroide de induzida por Laser de Mouse
Neste Artigo
Resumo
Aqui, apresentamos a utilidade da imagem longitudinal na vivo na sequência de alterações morfológicas da neovascularização de coroide do laser-induzida em camundongos.
Resumo
Induzida por laser a neovascularização de coroide (CNV) é um modelo bem estabelecido para imitar a forma úmida da degeneração macular relacionada à idade (DMRI). Neste protocolo, nosso objetivo é orientar o leitor não simplesmente através das considerações técnicas de gerar lesões induzida por laser para desencadear processos neovascular, mas prefiro focar a informação poderosa que pode ser obtida multimodal longitudinal vivo em de imagem durante todo o período de seguimento.
O mouse laser-induzida modelo CNV foi gerado por uma administração de laser de diodo. Multimodal no vivo técnicas de imagem foram utilizadas para monitorar CNV indução, progressão e regressão. Primeiro, a tomografia de coerência óptica de domínio espectral (SD-OCT) foi realizada imediatamente após o lasering para verificar uma ruptura da membrana de Bruch. Subsequentes na vivo imagens usando angiografia fluoresceína (FA) confirmaram sucesso dano da membrana de Bruch da série imagens adquiridas a nível da coroide. Acompanhamento longitudinal da proliferação de CNV e regressão nos dias 5, 10 e 14 após o lasering foi realizado usando SD-OCT e FA. Simples e confiável de classificação de leasions de CNV com vazamento de imagens de FA é apresentado. Segmentação automatizada para medição da espessura total da retina, combinada com a aplicação manual calibre para medição da espessura da retina em sites CNV, permitir uma avaliação imparcial da presença de edema. Finalmente, verificação histológica da CNV é executada usando isolectin GS-IB4 mancha na flatmounts da coroide. A coloração é thresholded, e a área de isolectin-positivo é calculada com o ImageJ.
Este protocolo é especialmente útil em estudos de terapêutica que exigem alta taxa de transferência-como triagem de patologia CNV como rápido, permite multimodal e classificação confiável de edema de patologia e retinal CNV. Além disso, a alta resolução SD-OCT permite a gravação de outras características patológicas, tais como o acúmulo de fluido subretinal ou intraretinal. No entanto, este método não oferece a possibilidade de automatizar a análise de volume CNV de imagens SD-OCT, que tem de ser executada manualmente.
Introdução
A primeira tentativa bem sucedida para imitar a patologia humana CNV em roedores foi demonstrada há quase três décadas com um laser de krypton em Long-Evans ratos1. Depois disso, um laser de krypton foi usado para invadir a cepa de rato mais popular, C57BL/6J2,3,4a membrana de Bruch. A taxa de sucesso da indução CNV foi verificada com FA e manchas histológicas. Um rápido desenvolvimento de modalidades de imagem não-invasivos, como OCT, estimulou o crescimento do campo de roedores modelos pré-clínicos. A capacidade de monitorar mudanças morfológicas na retina em múltiplos pontos de tempo no mesmo olho significativamente contribui para a redução do uso de animais e aumenta a eficiência em estudos experimentais. Avaliação histológica das lesões CNV é bastante simples e exige a rotulagem de crescimento vascular anormal ao redor do local de administração do laser, aquisição de imagem e estimativa de área/volume usando um software de análise de imagem. Em contraste, na vivo modalidades de imagem apresentar análises mais complexas de patologia CNV e sua interpretação.
Aqui nós apresentamos um método simples e relativamente rápido para indução de grau, progressão e regressão de CNV usando FA, SD-OCT, e o método de segmentação automatizada no mouse laser-induzida CNV modelo.
Protocolo
Todos os animais foram tratados em conformidade com a instrução de ARVO para o uso de animais em oftalmologia e Vision Research e a CE Directiva 86/609/CEE para experiências em animais, usando protocolos aprovados e monitorados pelo Conselho da Finlândia experimento Animal.
1. induzida por laser rato CNV modelo 5
- Inspecione os olhos do animal macroscopicamente para qualquer anormalidade.
- Pese o mouse.
- Calcular e preparar uma quantidade apropriada de anestésicos para utilizar, com base no peso do animal, por exemplo, uma mistura de medetomidina (1 mg/kg), ketamina (75 mg/kg) e água destilada (solução de NaCl 0,9%) na proporção de 1:1.5:2.5, ou cetamina (40-75 mg/kg), xilazina (5 mg/kg) e água destilada (solução de NaCl 0,9%) na proporção de 1:2. 5:1; para um mouse de 20g, injete 0,1 mL da mistura.
- Injete o anestésico intraperitonealmente.
- Posicione o mouse volta para a gaiola e espere até o animal é anestesiado. Confirme que o mouse é devidamente anestesiado pela falta de um pedal reflexo.
- Garantir o uso de equipamento de proteção pessoal da segurança do laser.
- Ligue a lâmpada de fenda e um laser de díodo 532 nm.
- Remova o rato da gaiola e coloque sobre a almofada de aquecimento.
- Aplique uma gota de tropicamida para dilatação da pupila. Espere 3-5 min para dilatação pupilar completo (3 mm).
- Posicione o mouse no palco da lâmpada de fenda.
- Coloque uma gota de gel líquido thoughtful sobre uma lamela de applanate da córnea.
- Oriente o olho do rato com a cabeça do nervo óptico no centro.
- Definir a potência do laser a 100 mW, a duração de 100 ms e o tamanho de ponto para 50 µm.
- Focar o feixe de laser o epithelium retinal do pigment (RPE).
- Fazer três tiros de laser em um olho, evitando os vasos da retina idealmente na 4, 8 e 12:00 posições em torno do nervo óptico, respectivamente. Inspecione o fundo do olho, depois todos tiros por ausência de hemorragia retiniana a laser. O olho contralateral serve como um controle de não-com laser.
- Descarte o mouse lamela e lugar volta sobre a almofada de aquecimento.
- Aplique uma gota de gotas de gel de PEG em ambos os olhos.
2. SD-OCT 6,7
- Coloque o mouse para a fase de alinhamento de roedores e imobilizar a cabeça.
- Alinhe a lente do sistema SD-OCT (por exemplo, Bioptigen/Leica Envisu R2200) para enfrentar o olho para a imagem latente com na vivo usando controladores de X - e Y-estágio.
- Realizar exames de SD-OCT para verificar se a quebra da membrana de Bruch: uma vez que o SD-OCT examina o olho inteiro, Mova manualmente a linha de referência nos sites lasered. Quebras de membrana de Bruch devem ser claramente visíveis em áreas lasered (ver Figura 1).
3. fluoresceína angiografia 7,8,9
- Remover o rato com o titular e coloque-o sobre o sistema de FA (por exemplo, Heidelberg Spectralis HRA2).
- Foco para laser queimar áreas do fundo do olho usando o modo de reflectância de infravermelho com a cabeça do nervo óptico, no meio da janela de visualização.
- Injete 0,1 mL de sal de sódio 5% fluoresceína para um rato de 20 g por via subcutânea ou intraperitonealmente.
- Concentre-se no nível da coroide.
- Leve uma imagem do nível de foco da coroide.
- Re-focar a nível da retina e uma imagem.
- Espere por 30 s e repita etapas 3.4-3.6.
- Remova o mouse do suporte e coloque-o sobre a almofada de aquecimento.
- Reverta anestesia por α2-antagonista de medetomidina, atipamezole (0,5 mg/kg, i.p.) ou espera para animal recuperação da anestesia.
- Repita em vivo SD-OCT e FA imagiologia em animais anestesiados sobre os acompanhamento dias 5, 10 e 14.
4. CNV classificação
- Classe os danos da membrana de Bruch da OCT imagens e imagens de FA da coroide tomadas imediatamente após o lasering no dia 0 como seguindo:
0 - membrana de Bruch não foi danificado
1 - sucesso dano da membrana de Bruch - Classe a presença de CNV de lasered manchas que tinha vazamento, como observado, comparando a dinâmica do sinal de fluoresceína em uma série de imagens da retina de FA como seguindo:
0 - aparência normal da retina
0,5 - fraco coloração de escapamento
1.0 - áreas CNV gotejantes
Nota: Use a imagem da OCT para confirmação adicional de CNV ou em FA questionável onde a presença de fluido intraretinal em imagens OCT sugeriria CNV classificação.
5. medições de espessura retina
- Use um software automatizado de segmentação para medições de espessura da retina. Certifique-se de que a espessura total da retina é considerada, como a espessura de todas as camadas da camada de fibras nervosas RPE (sites de medição saudável), ou para uma linha imaginária ligando RPE em torno do local do dano (lasered sites) (ver também Figura 7).
Resultados
Uma bolha ou apresentam sangramento imediatamente após lasering nem sempre é visível. Portanto, o SD-OCT é particularmente importante para verificar os danos da membrana de Bruch. A Figura 1 mostra um exemplo de imagem OCT em pontos diferentes de tempo após a administração do laser.
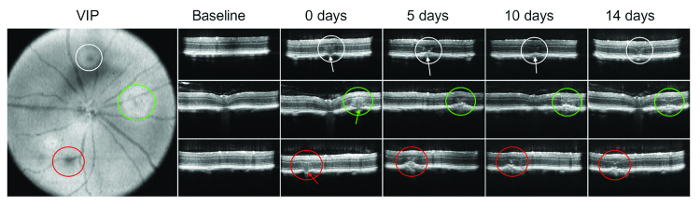
Figura...
Discussão
Imagiologia multimodal oferece valiosas ferramentas para avaliação de patologia CNV. Aqui apresentamos um protocolo de imagem consistindo de FA, SD-OCT e segmentação automática para a avaliação rápida, reprodutível e confiável de patologia CNV. Uma ruptura da membrana de Bruch após administração do laser foi confirmada. Além disso, o uso de SD-OCT nesta fase também permitiu a visualização imediata dos possíveis hemorragias intraretinal e subretinal, que pode confundir a interpretação dos resultados. V...
Divulgações
O autor Symantas Ragauskas, pH.d. é um funcionário (cientista) e acionista do Ltd. de Experimentica que oferece contrato de serviços de pesquisa empregando o modelo CNV pré-clínicos usado neste artigo.
O autor Eva Kielczewski é um empregado (engenheiro de aplicações de pesquisa, OCT) da Leica Microsystems que produz sistemas de SD-OCT usados neste artigo.
O autor Joseph Vance é um empregado (at OCT Sales Director) da Leica Microsystems que produz sistemas de SD-OCT usados neste artigo. Joseph Vance também é presidente e diretor executivo da leção, LLC.
O autor Simon Kaja, pH.d. é consultor Chief Scientific Officer e acionista da Experimentica Ltd., uma contrato pré-clínicos pesquisa organização que oferece contrato de serviços de pesquisa, incl. modelo de CNV pré-clínicos usado neste artigo. Simon Kaja, pH.d. é também CEO da K & P científica, LLC, das Ciências da vida, consultoria e atua como o Dr. John P. e Therese E. Mulcahy dotado Professor em oftalmologia na Loyola University Chicago Stritch School of Medicine. Os termos desse acordo foram revistos e aprovados pela Loyola University Chicago, em conformidade com sua política de conflito de interesses.
O autor Giedrius Kalesnykas, pH.d. é um funcionário (CEO) e acionista do Ltd. de Experimentica que oferece contrato de serviços de pesquisa empregando o modelo CNV pré-clínicos usado neste artigo.
Agradecimentos
Os autores gostaria de agradecer a Yuliya Naumchuk (Loyola University Chicago) e Žiniauskaitė Agne (Experimentica Ltd.), pelo excelente apoio técnico e videográfico. Programa de pesquisa do Dr. Kaja é suportado pelo Dr. John P. e Therese E. Mulcahy dotado Professorship em oftalmologia na Loyola University Chicago.
Materiais
| Name | Company | Catalog Number | Comments |
| Medetomidine (commercial name Domitor) | Orion | Vnr 01 56 02 | Anesthesia |
| Ketamine | Intervet | Vnr 51 14 85 | Anesthesia |
| 0,9% NaCl | B Braun | 357 0340 | Anesthesia |
| Xylazine (commercial name Rompun vet) | Bayer | vnr 14 89 99 | Anesthesia |
| Tropicamide | Santen | Vnr 04 12 36 | Mydriatic agent |
| Viscotears | Alcon | Vnr 44 54 81 | Lubricant |
| Systane | Alcon | - | Lubricant |
| 5% Fluorescein sodium salt | Sigma Aldrich | F6377-100G | Fluoresent agent |
| Atipamezole (commercial name Antisedan) | Orion | Vnr 47 19 53 | Anesthesia |
Referências
- Dobi, E. T., Puliafito, C. A., Destro, M. A new model of experimental choroidal neovascularization in the rat. Arch. Ophthalmol. Chic. Ill 1960. 107, 264-269 (1989).
- Tobe, T., et al. Evolution of neovascularization in mice with overexpression of vascular endothelial growth factor in photoreceptors. Invest. Ophthalmol. Vis. Sci. 39, 180-188 (1998).
- Seo, M. S., et al. Dramatic inhibition of retinal and choroidal neovascularization by oral administration of a kinase inhibitor. Am. J. Pathol. 154, 1743-1753 (1999).
- Grossniklaus, H. E., Kang, S. J., Berglin, L. Animal models of choroidal and retinal neovascularization. Prog. Retin. Eye Res. 29, 500-519 (2010).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A Mouse Model for Laser-induced Choroidal Neovascularization. J Vis Exp. (106), e53502 (2015).
- Giani, A., et al. In vivo evaluation of laser-induced choroidal neovascularization using spectral-domain optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 52, 3880-3887 (2011).
- Gong, Y., et al. Optimization of an Image-Guided Laser-Induced Choroidal Neovascularization Model in Mice. PloS One. 10, e0132643 (2015).
- Sheets, K. G., et al. Neuroprotectin D1 attenuates laser-induced choroidal neovascularization in mouse. Mol. Vis. 16, 320-329 (2010).
- Hoerster, R., et al. In-vivo and ex-vivo characterization of laser-induced choroidal neovascularization variability in mice. Graefes Arch. Clin. Exp. Ophthalmol. Albrecht Von Graefes Arch. Klin. Exp. Ophthalmol. 250, 1579-1586 (2012).
- Sulaiman, R. S., et al. A Simple Optical Coherence Tomography Quantification Method for Choroidal Neovascularization. J. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. 31, 447-454 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados