Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In Vivo Multimodale Bildgebung und Analyse der laserinduzierten choroidale Neovaskularisation Mausmodell
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen die Nützlichkeit der längs in-Vivo Bildgebung bei der Nachbereitung der morphologischen Veränderungen der laserinduzierten choroidale Neovaskularisation bei Mäusen.
Zusammenfassung
Laserinduzierte choroidale Neovaskularisation (CNV) ist ein etabliertes Modell die feuchte Form der altersbedingten Makula-Degeneration (AMD) zu imitieren. Wir wollen in diesem Protokoll führen den Leser nicht einfach durch die Überlegungen der Generierung von Laser-induzierte Läsionen auslösen neovaskulären Prozesse, sondern auf die mächtigen Informationen, die Multimodal längs- beigezogen werden kann konzentrieren in-vivo Bildgebung in der Folgezeit.
Die Laser-induzierte Maus CNV Modell wurde durch eine Diode Laser Verwaltung generiert. Multimodale in Vivo bildgebenden Verfahren wurden verwendet, um CNV Induktion, Progression und Regression zu überwachen. Erste, spectral-Domain optische Kohärenztomographie (SD-OCT) erfolgte unmittelbar nach der Laserung um zu überprüfen, eine Pause von Bruch Membran. Nachfolgende in-Vivo Bildgebung mit Fluorescein-Angiographie (FA) bestätigt erfolgreiche Beschädigung der Bruch Membran aus seriellen Bildern auf der Aderhaut Ebene erworben. Longitudinal Follow-up von CNV Verbreitung und Regression auf 5, 10 und 14 Tage nach dem Lasern erfolgte mittels SD-OCT und FA. Einfache und zuverlässige Einstufung des undichten CNV Leasions von FA Bilder präsentiert. Automatische Segmentierung zur Messung der Netzhaut Gesamtdicke, kombiniert mit manueller Kaliber Anwendung zur Messung der Netzhautdicke CNV Standorten ermöglichen objektive Bewertung der Anwesenheit von Ödemen. Schließlich wird die histologischen Überprüfung der CNV mit Isolectin GS-IB4 Flecken auf choroidale Flatmounts durchgeführt. Die Färbung ist thresholded und Isolectin-positiven Bereich mit ImageJ berechnet wird.
Dieses Protokoll eignet sich besonders in Therapeutika Studien erfordern hohen Durchsatz wie Screening von CNV Pathologie, da es schnell, multimodale erlaubt und zuverlässige Klassifizierung von CNV Pathologie und Netzhaut Ödem. Hoher Auflösung SD-OCT ermöglicht darüber hinaus die Aufnahme von anderen pathologischen Merkmale wie die Ansammlung von subretinalen oder intraretinalen Flüssigkeit. Diese Methode bietet jedoch keine Möglichkeit um CNV-Volumen-Analyse von SD-OCT Bilder zu automatisieren, die manuell durchgeführt werden.
Einleitung
Der erste erfolgreiche Versuch, die Pathologie der menschlichen CNV bei Nagetieren zu imitieren wurde vor fast drei Jahrzehnten mit einer Krypton-Laser in Long-Evans Ratten1demonstriert. Danach wurde ein Krypton-Laser verwendet, um Bruch Membran in den beliebtesten Maus-Stamm C57BL/6J2,3,4zu brechen. Die Erfolgsquote der CNV Induktion wurde mit FA und histologischen Flecke verifiziert. Eine rasante Entwicklung der nicht-invasive bildgebende Verfahren wie OCT, förderte das Wachstum im Bereich der Nager präklinischen Modellen. Die Möglichkeit, morphologische Veränderungen in der Netzhaut zu mehreren Zeitpunkten auf den gleichen Auge deutlich überwachen trägt zur Verringerung von Tierversuchen und steigert die Effizienz in experimentellen Studien. Histologische Auswertung der CNV Läsionen ist relativ einfach und erfordert Kennzeichnung von abnormen Gefäßwachstum auf dem Gelände des Laser-Verwaltung, Bildaufnahme und Fläche/Volumen Schätzung mit einer Bildanalyse-Software. Im Gegensatz dazu stellen in Vivo bildgebender Verfahren komplexere Analysen der CNV Pathologie und seine Auslegung.
Hier präsentieren wir Ihnen eine einfache und relativ schnelle Methode, um Grade Induktion, Progression und Regression von CNV mit FA, SD-OCT, und die automatische Segmentierung Methode in der Maus Laser-induzierte CNV Modell.
Protokoll
Alle Tiere wurden gemäß der ARVO-Erklärung für die Verwendung von Tieren in Ophthalmic und Vision Research und der EG-Richtlinie 86/609/EWG für Tierversuche, unter Verwendung von Protokollen genehmigt und überwacht durch das Tier Experiment Board of Finland behandelt.
(1) Laser-induced Maus CNV Modell 5
- Die Augen des Tieres makroskopisch für alle mögliche Abweichungen zu überprüfen.
- Wiegen Sie die Maus.
- Berechnen Sie und bereiten Sie einen angemessenen Betrag von Anästhetika zu bedienen, bezogen auf das Gewicht des Tieres, z. B. eine Mischung aus Medetomidine (1 mg/kg), Ketamin (75 mg/kg) und destilliertes Wasser (0,9 % NaCl-Lösung) in einem Verhältnis von 1:1.5:2.5 oder Ketamin (40-75 mg/kg), Xylazin (5 mg/kg) und destilliertes Wasser (0,9 % NaCl-Lösung) in einem Verhältnis von 5:1 1:2.; Spritzen Sie für eine 20 g Maus 0,1 mL der Mischung.
- Intraperitoneal injizieren Sie Betäubungsmittel.
- Legen Sie Maus zurück in den Käfig und warten Sie, bis Tier betäubt ist. Bestätigen Sie, dass die Maus durch Mangel an einem Pedal Reflex richtig betäubt ist.
- Den Einsatz von Laser-Sicherheit persönlicher Schutzausrüstung zu gewährleisten.
- Aktivieren Sie eine Spaltlampe und einem 532 nm Diodenlaser.
- Entfernen Sie die Maus aus dem Käfig und auf das Heizkissen.
- Geben Sie einen Tropfen Tropicamid für Pupillen Dilatation. Warten Sie ca. 3-5 min für Pupillen Dilatation voll (3 mm).
- Platzieren Sie den Mauszeiger auf der Bühne an der Spaltlampe.
- Legen Sie einen Tropfen des Opthalmic liquid Gel auf ein Deckglas, Applanate der Hornhaut.
- Richten Sie das Maus-Auge mit dem Sehnerv Kopf in der Mitte.
- Legen Sie die Laserleistung auf 100 mW, die Dauer bis 100 ms und die Punktgröße bis 50 µm.
- Den Laserstrahl auf das retinale Pigmentepithel (RPE) konzentrieren.
- Machen Sie drei Laserschüsse in einem Auge Netzhautgefäße idealerweise auf die 4, 8 und 12:00 Positionen rund um den Sehnerv bzw. zu vermeiden. Den Fundus des Auges zu inspizieren, nachdem alle Aufnahmen für Abwesenheit von retinalen Blutungen laser. Der kontralaterale Auge dient als Kontrolle nicht gelasert.
- Entsorgen Sie die Deckglas und Ort Maus wieder auf das Heizkissen.
- Ein Tropfen von PEG Gel Tropfen auf beide Augen auftragen.
2. SD-OCT 6,7
- Platzieren Sie den Mauszeiger in das Nagetier Ausrichtung Stadium, und immobilisieren Sie den Kopf zu.
- Richten Sie das Objektiv von der SD-OCT-System (z. B.Bioptigen/Leica Envisu R2200) vor das Auge für die in-Vivo Bildgebung mit X - und Y-Stage Controller.
- SD-OCT Scans überprüfen, bricht der Bruch Membran durchführen: Sobald die SD-OCT das ganze Auge scannt, manuell verschieben die Betreff-Zeile auf den gelaserten Seiten. Bricht der Bruch Membran sollte in gelaserten Bereichen deutlich sichtbar sein (siehe Abbildung 1).
(3) Fluorescein Angiographie 7,8,9
- Entfernen Sie Maus mit dem Halter zu, und legen Sie es auf das FA-System (z.B.Heidelberg Spectralis HRA2).
- Fokus auf Laser brennen Bereichen des Augenhintergrundes des Auges mit Infrarot-Reflexionsvermögen-Modus mit dem Kopf des Sehnervs mitten in das Sichtfenster.
- Injizieren Sie 0,1 mL 5 % Fluorescein Natrium-Salz für eine 20 g-Maus, subkutan oder intraperitoneal.
- Im Mittelpunkt der Aderhaut Ebene.
- Nehmen Sie ein Bild von der Aderhaut Fokus-Ebene.
- Neuausrichtung auf die Netzhaut Ebene und nehmen Sie ein Bild.
- Warten Sie, bis 30 s und wiederholen Sie Schritte 3.4-3.6.
- Entfernen Sie die Maus aus der Halterung, und legen Sie es auf das Heizkissen.
- Umgekehrte Anästhesie durch α2-Antagonist für Medetomidine, Atipamezol (0,5 mg/kg, i.p.) oder warten Sie auf tierische Erholung aus der Narkose.
- Wiederholen Sie in Vivo SD-OCT und FA Bildgebung bei narkotisierten Tieren an den weiteren Tagen 5, 10 und 14.
(4) CNV Verschneidung
- Grad der Beschädigung der Bruch Membran aus OCT-Bildern und Aderhaut FA-Aufnahmen unmittelbar nach dem Lasern am Tag 0 wie folgt:
0 - Bruch Membran nicht beschädigt
1 - erfolgreiche Beschädigung der Bruch Membran - Grade das Vorhandensein von CNV von gelaserten stellen, die Leckage wie durch den Vergleich der Dynamik von Fluorescein-Signal in einer Reihe von retinalen FA Bilder wie folgt festgestellt:
0 - normaler Auftritt der Netzhaut
0,5 - schwache Anfärbung der Leckage
1.0 - undichte CNV-Bereiche
Hinweis: Verwenden der OCT-Bildgebung für zusätzliche Bestätigung der CNV oder fragwürdige FA wo würde das Vorhandensein intraretinalen Flüssigkeitsansammlungen im OCT Bilder vorschlagen CNV Verschneidung.
5. die Netzhautdicke Messungen
- Verwenden Sie eine automatische Segmentierung-Software zur Messung der Netzhautdicke. Sicherzustellen, dass die Netzhaut Gesamtdicke als die Dicke der alle Schichten von Nervenfaserschicht RPE (gesunde Messstellen) oder einer imaginären Verbindungslinie RPE rund um den Ort des Schadens (gelaserten Seiten) gilt (siehe auch Abbildung 7).
Ergebnisse
Eine Blase oder subretinalen Blutungen sofort nach dem Lasern ist nicht immer sichtbar. SD-OCT ist daher besonders wichtig, um Schäden der Bruch Membran zu überprüfen. Abbildung 1 zeigt ein Beispiel der OCT-Bildgebung zu verschiedenen Zeitpunkten nach der Laser-Verabreichung.
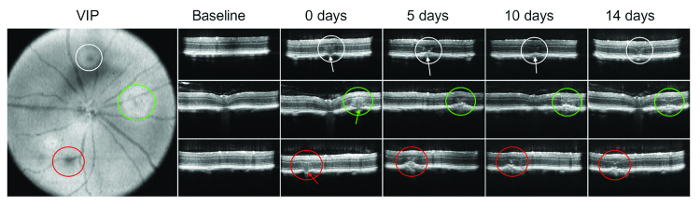
Abbildung 1
Diskussion
Multimodale Bildgebung bietet wertvolle Werkzeuge für CNV Pathologie Bewertung. Hier präsentierten wir eine bildgebende Protokoll bestehend aus FA, SD-OCT und automatische Segmentierung für die schnelle, reproduzierbare und zuverlässige Bewertung der CNV Pathologie. Ein Bruch des Bruchs Membran nach Laser Verwaltung bestätigt wurde. Darüber hinaus erlaubt die Verwendung von SD-OCT in diesem Stadium auch sofortige Visualisierung der möglichen intraretinalen und subretinalen Blutungen, die die Interpretation der Erg...
Offenlegungen
Der Autor Symantas Ragauskas, Ph.d. ist ein Mitarbeiter (wissenschaftlicher Mitarbeiter) und Gesellschafter der Experimentica GmbH, die Angebote Recherchediensten beschäftigen die präklinische CNV-Modell in diesem Artikel verwendeten Vertrag.
Die Autorin Eva Kielczewski ist ein Mitarbeiter (Forschung Anwendungstechniker, OCT) von Leica Microsystems, die in diesem Artikel verwendeten SD-OCT-Systeme produziert.
Der Autor Joseph Vance ist ein Mitarbeiter (NA OCT Sales Director) von Leica Microsystems, die in diesem Artikel verwendeten SD-OCT-Systeme produziert. Joseph Vance ist auch Präsident und managing Director von Perspektive, LLC.
Der Autor Simon Kaja, Ph.d. ist Berater Chief Scientific Officer und Gesellschafter der Experimentica GmbH, eine präklinische Vertrag Forschungseinrichtung, die Angebote Vertrag Recherchedienste, inkl. der präklinische CNV-Modell in diesem Artikel verwendet. Simon Kaja, Ph.d. ist auch CEO von K & P Scientific, LLC, einer consulting-Firma, Biowissenschaften und dient als Dr. John P. und Therese E. Mulcahy ausgestattet Professor für Augenheilkunde an der Loyola University Chicago, Stritch School of Medicine. Die Bedingungen dieser Vereinbarung haben überprüft und genehmigt von Loyola University Chicago im Einklang mit seinen Interessenkonflikt Politik wurde.
Der Autor Giedrius Kalesnykas, Ph.d. ist ein Mitarbeiter (CEO) und Gesellschafter der Experimentica GmbH, die Angebote Recherchediensten beschäftigen die präklinische CNV-Modell in diesem Artikel verwendeten Vertrag.
Danksagungen
Die Autoren möchten danke Yuliya Naumchuk (Loyola University Chicago) und Agne Žiniauskaitė (Experimentica GmbH), für hervorragende technische und videographische Unterstützung. Dr. Kaja Forschungsprogramm wird von Dr. John P. und Therese E. Mulcahy dotierte Professur für Augenheilkunde an der Loyola University Chicago unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Medetomidine (commercial name Domitor) | Orion | Vnr 01 56 02 | Anesthesia |
| Ketamine | Intervet | Vnr 51 14 85 | Anesthesia |
| 0,9% NaCl | B Braun | 357 0340 | Anesthesia |
| Xylazine (commercial name Rompun vet) | Bayer | vnr 14 89 99 | Anesthesia |
| Tropicamide | Santen | Vnr 04 12 36 | Mydriatic agent |
| Viscotears | Alcon | Vnr 44 54 81 | Lubricant |
| Systane | Alcon | - | Lubricant |
| 5% Fluorescein sodium salt | Sigma Aldrich | F6377-100G | Fluoresent agent |
| Atipamezole (commercial name Antisedan) | Orion | Vnr 47 19 53 | Anesthesia |
Referenzen
- Dobi, E. T., Puliafito, C. A., Destro, M. A new model of experimental choroidal neovascularization in the rat. Arch. Ophthalmol. Chic. Ill 1960. 107, 264-269 (1989).
- Tobe, T., et al. Evolution of neovascularization in mice with overexpression of vascular endothelial growth factor in photoreceptors. Invest. Ophthalmol. Vis. Sci. 39, 180-188 (1998).
- Seo, M. S., et al. Dramatic inhibition of retinal and choroidal neovascularization by oral administration of a kinase inhibitor. Am. J. Pathol. 154, 1743-1753 (1999).
- Grossniklaus, H. E., Kang, S. J., Berglin, L. Animal models of choroidal and retinal neovascularization. Prog. Retin. Eye Res. 29, 500-519 (2010).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A Mouse Model for Laser-induced Choroidal Neovascularization. J Vis Exp. (106), e53502 (2015).
- Giani, A., et al. In vivo evaluation of laser-induced choroidal neovascularization using spectral-domain optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 52, 3880-3887 (2011).
- Gong, Y., et al. Optimization of an Image-Guided Laser-Induced Choroidal Neovascularization Model in Mice. PloS One. 10, e0132643 (2015).
- Sheets, K. G., et al. Neuroprotectin D1 attenuates laser-induced choroidal neovascularization in mouse. Mol. Vis. 16, 320-329 (2010).
- Hoerster, R., et al. In-vivo and ex-vivo characterization of laser-induced choroidal neovascularization variability in mice. Graefes Arch. Clin. Exp. Ophthalmol. Albrecht Von Graefes Arch. Klin. Exp. Ophthalmol. 250, 1579-1586 (2012).
- Sulaiman, R. S., et al. A Simple Optical Coherence Tomography Quantification Method for Choroidal Neovascularization. J. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. 31, 447-454 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten