A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אין ויוו הדמיה עם מודאלים מרובים וניתוח של עכבר לייזר המושרה חיבור כורוידאלית דגם
In This Article
Summary
כאן, אנו מציגים את התועלת של האורך ויוו הדמיה מעקב אחר שינויים מורפולוגיים של לייזר המושרה neovascularization כורוידאלית בעכברים.
Abstract
לייזר המושרה neovascularization כורוידאלית (CNV) היא דוגמנית ומבוססת לחקות את צורת רטוב הקשורות לגיל ניוון מקולרי (AMD). ב פרוטוקול זה, אנו שואפים מדריך את הקורא לא פשוט על-ידי השיקולים הטכניים של יצירת נגעים לייזר המושרה להנעת תהליכים neovascular, אבל מעדיף להתמקד במידע רב עוצמה ניתן להשיג יחידנית או משולבת האורך אין ויוו הדמיה לאורך כל תקופת המעקב.
עכבר לייזר המושרה CNV המודל נוצר על ידי המינהל לייזר דיודה. עם מודאלים מרובים ויוו טכניקות הדמיה שימשו כדי לפקח CNV אינדוקציה, התקדמות, רגרסיה. ראשית, תחום ספקטרלי טומוגרפיה אופטית קוהרנטית (SD-אוקטובר) בוצע מיד לאחר lasering כדי לוודא הפסקה של הממברנה של ברוך. לאחר מכן ויוו הדמיה באמצעות fluorescein מסתמים (FA) אישר נזק מוצלחת של הממברנה של ברוך מתמונות טורי רכשה באותה רמת חיבור. מעקב האורך של התפשטות CNV ו רגרסיה בימים 5, 10 ו- 14 לאחר lasering בוצעה באמצעות הפא ו- SD-אוקטובר. פשוטה ואמינה לדירוג של דולף leasions CNV מתמונות פא מוצג. פילוח אוטומטיים למדידת עובי הרשתית הכולל, בשילוב עם קליבר ידנית יישום למדידת עובי הרשתית באתרים CNV, לאפשר הערכה לא משוחדת של הנוכחות של בצקת. לבסוף, אימות היסטולוגית של CNV מתבצעת באמצעות isolectin GS-IB4 מכתים על flatmounts חיבור. ההכתמה היא thresholded, אזור isolectin-חיוביות מחושבת עם ImageJ.
פרוטוקול זה שימושי במיוחד לימודי הרפוי הדורשים דמויי תפוקה גבוהה הקרנת CNV פתולוגיה, שכן היא מאפשרת מהר, עם מודאלים מרובים, סיווג אמין של בצקת רשתית לפתולוגיה CNV. בנוסף, רזולוציה גבוהה SD-OCT מאפשר ההקלטה של המחפשים פתולוגיים אחרים, כגון הצטברות נוזלים subretinal או intraretinal. עם זאת, שיטה זו אינה מספקת אפשרות להפיכת ניתוח אמצעי האחסון CNV מתמונות SD-אוקטובר, אשר חייב להתבצע באופן ידני.
Introduction
הניסיון המוצלח הראשון לחקות הפתולוגיה של האדם CNV בחולדות הודגם לפני כמעט שלושה עשורים עם לייזר קריפטון לונג-אוונס חולדות1. לאחר מכן, שימש לייזר קריפטון לפרוץ קרום של ברוך המתח העכבר הפופולרי ביותר,3,2,C57BL/6J4. שיעור ההצלחה של אינדוקציה CNV אומתה עם הפא וכתמים היסטולוגית. התפתחות מהירה של שיטות הדמיה לא פולשנית, כגון OCT, תמכה את הצמיחה של השדה של מכרסמים במודלים פרה. היכולת לעקוב אחרי שינויים מורפולוגיים הרשתית בנקודות זמן מרובים בעיניים אותו משמעותית תורם צמצום הניצול של בעלי החיים ומגביר את יעילות במחקרים ניסיוני. הערכה היסטולוגית של נגעים CNV הוא די פשוט, ודורש תיוג צמיחת כלי דם נורמלי סביב האתר של המינהל לייזר, ייבוא תמונות/שטח בנפח הערכה באמצעות תוכנת ניתוח של התמונה. לעומת זאת, אין ויוו שיטות הדמיה להציג ניתוחים מורכבים יותר של פתולוגיה CNV והפרשנות שלה.
כאן אנו מציגים שיטה פשוטה ומהירה יחסית כיתה אינדוקציה, התקדמות של רגרסיה של CNV באמצעות הפא, SD-אוקטובר, ואת שיטת פילוח אוטומטית העכבר לייזר המושרה CNV מודל.
Protocol
כל החיות טופלו לפי המשפט ארוו עבור שימוש של חיות לרפואת עיניים, ומחקר החזון של EC Directive 86/609/EEC לניסויים בבעלי חיים, באמצעות פרוטוקולים אישרה, בפיקוח של חיות ניסוי לוח של פינלנד.
1. לייזר המושרה העכבר CNV דגם 5
- לבדוק את העיניים של החיה בעין בלתי מזוינת על חריגות.
- שוקלים את העכבר.
- לחשב ולהכין כמות מספקת של חומרי הרדמה לשימוש, בהתבסס על המשקל של החיה, למשל תערובת של medetomidine (1 מ"ג/ק"ג), קטמין (75 מ"ג/ק"ג), מים מזוקקים (0.9% NaCl פתרון) ביחס של 1:1.5:2.5, או קטמין (40-75 מ"ג/ק"ג), חריגות השירותים הווטרינריים (5 מ"ג/ק"ג), מים מזוקקים (0.9% NaCl פתרון) ביחס של 1:2. 5:1; עכבר 20 גרם, מזריקים 0.1 מ"ל של תערובת.
- להזריק הרדמה intraperitoneally.
- הנח את העכבר בחזרה לתוך הכלוב. חכה עד חיה. הוא מורדם. לאשר שהעכבר הוא מורדם כראוי על ידי חוסר רפלקס פדלים.
- להבטיח את השימוש בלייזר בטיחות ציוד מגן אישי.
- הפעל מנורה שסע ואת 532 ננומטר דיודת לייזר.
- הסר את העכבר הכלוב ואת המקום על כרית חימום.
- החל טיפה אחת של Tropicamide עבור התרחבות האישון. המתן 3-5 דקות על התרחבות האישון מלא (3 מ"מ).
- הנח את העכבר על הבמה מנורת סדק.
- במקום טיפה אחת של ג'ל נוזלי עיניים על coverslip כדי applanate הקרנית.
- אוריינט את העין העכבר עם ראש עצב הראייה במרכז.
- להגדיר את עוצמת הלייזר עד 100 מגה-וואט, המשך ל-100 מילישניות, והגודל ספוט 50 מיקרומטר.
- מתמקדים קרן הלייזר אפיתל הפיגמנט ברשתית (RPE).
- עושים שלוש יריות לייזר לתוך עין אחת על ידי הימנעות כלי הדם ברשתית ממוקם באופן אידיאלי ב- 4, 8 ו 12 o ' שעון עמדות סביב עצב הראייה, בהתאמה. בדוק את הפונדוס של העין לאחר כל לייזר יריות להיעדרות מדימום ברשתית. העין contralateral משמש פקד ללא lasered.
- למחוק את העכבר coverslip ומקום חזרה על כרית החימום.
- החל טיפה אחת של פג ג'ל טיפות על שתי העיניים.
2. SD-אוקטובר 6,7
- למקם את העכבר הבמה יישור מכרסמים, לשתק את הראש.
- יישר את העדשה של מערכת SD-אוקטובר (למשל, Envisu R2200 Bioptigen/Leica) להתמודד עם העין עבור ויוו הדמיה באמצעות בקרי X ו- Y-שלב.
- לבצע סריקות SD-OCT כדי לוודא הפסקות של הממברנה של ברוך: לאחר ה-SD-OCT סריקות לעין כל, להעביר באופן ידני את קו הפניה באתרים lasered. הפסקות של הממברנה של ברוך צריך להיות בבירור באזורים lasered (ראה איור 1).
3. fluorescein מסתמים 7,8,9
- להסיר את העכבר עם בעל, ומניחים אותו על מערכת ה-FA (למשל, היידלברג Spectralis HRA2).
- ההתמקדות ב לייזר לצרוב תחומי הפונדוס של העין באמצעות מצב השתקפות אינפרא-אדום עם ראש עצב הראייה באמצע החלון הצפייה.
- מזריקים 0.1 מ"ל של 5% fluorescein מלח נתרן עכבר 20 גרם subcutaneously או intraperitoneally.
- מתמקדים רמת חיבור.
- קחו תמונה רמת המיקוד חיבור.
- מחדש להתמקד ברמת הרשתית, לקחת תמונה.
- המתן 30 s וחזור על צעדים 3.4-3.6.
- להסיר את העכבר ממחזיק והנח אותו על משטח חימום.
- הפוך הרדמה על ידי α2-אנטגוניסט עבור medetomidine, atipamezole (0.5 מ"ג/ק"ג, i.p.) או לחכות בעלי חיים ההתאוששות מן ההרדמה.
- חזור ב vivo SD-אוקטובר ו- FA הדמיה בבעלי חיים ומורדמת בימים מעקב 5, 10 ו- 14.
4. CNV לדירוג
- כיתה הנזק של הממברנה של ברוך OCT תמונות ותמונות פא חיבור נלקח מיד לאחר lasering ביום 0 כדלקמן:
0 - הממברנה של ברוך לא נפגע
1 - נזק מוצלח של הממברנה של ברוך - ציון הנוכחות של CNV מאתרי lasered שהיה זליגת כפי שנצפה על ידי השוואת הדינמיקה של האות fluorescein בסדרה של תמונות פא ברשתית להלן:
0 - מראה נורמלי של הרשתית
0.5 - להתעלף מכתים של דליפה
1.0 - אזורים CNV דולפים
הערה: השתמש ההדמיה OCT לאישור נוסף של CNV או בספק פא היכן הנוכחות של נוזל intraretinal בתמונות OCT מציע CNV לדירוג.
5. מדידות עובי הרשתית
- השתמש תוכנה פילוח אוטומטיות עבור מדידות עובי הרשתית. להבטיח כי נחשב את עובי הרשתית הכולל, כמו העובי של כל השכבות משכבת סיבי עצב RPE (מידה בריאה אתרים), או קו דמיוני המחבר RPE סביב האתר של נזק (אתרים lasered) (ראה גם איור 7).
תוצאות
בועה או subretinal דימום מיד לאחר lasering אינו תמיד גלוי. לכן, SD-אוקטובר חשוב במיוחד לוודא נזק של הממברנה של ברוך. איור 1 מראה דוגמה של OCT הדמיה בנקודות זמן שונות לאחר לייזר המינהל.
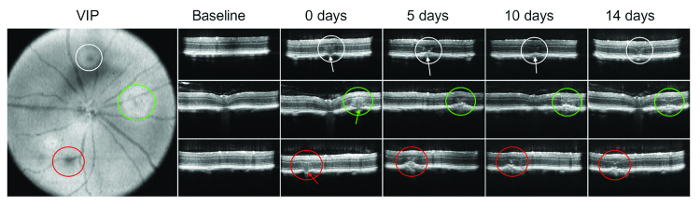
Discussion
הדמיה עם מודאלים מרובים מציע כלי רב ערך עבור הערכה פתולוגיה CNV. כאן הצגנו פרוטוקול הדמיה המורכב של הפא, SD-אוקטובר, פילוח אוטומטית על הערכה מהירה, לשחזור ואמין של הפתולוגיה CNV. הפסקה של הממברנה של ברוך לאחר לייזר הניהול אושר. בנוסף, השימוש SD-אוקטובר בשלב זה מותר גם מיידית החזיית אפשרי שטפי intrare...
Disclosures
המחבר, Symantas Ragauskas, Ph.d. הוא עובד (מדען מחקר) מניות של Experimentica בע מ מציע החוזה שירותי מחקר העסקת המודל CNV פרה להשתמש במאמר זה.
הסופר אווה Kielczewski הוא עובד (מהנדס מחקר יישומי, OCT) של Microsystems לייקה מפיקה מערכות SD-אוקטובר להשתמש במאמר זה.
הסופר ג'וזף ונס הוא עובד (OCT נה מנהל מכירות) של Microsystems לייקה מפיקה מערכות SD-אוקטובר להשתמש במאמר זה. ג'וזף ונס היא גם נשיא, מנכ של Spective, LLC.
הסופר סיימון Kaja, Ph.d. הוא יועץ והמדען הראשי ובעל מניות של Experimentica בע מ, פרה חוזה מחקר ארגון אשר מציע חוזה שירותי מחקר, כולל דגם CNV פרה להשתמש במאמר זה. סיימון Kaja, Ph.d. הוא גם מנכ של K & מדעי P, LLC, מדעי החיים לייעוץ, ומשמש ד ר ג'ון פ ואת תרז אי Mulcahy ניחן פרופסור ברפואת עיניים Stritch הספר לרפואה, אוניברסיטת לויולה שיקגו. תנאי ההסדר הזה יש כבר נבדקו ואושרו על-ידי אוניברסיטת לויולה שיקגו בהתאם למדיניות שלה ניגוד אינטרסים.
המחבר, Giedrius Kalesnykas, Ph.d. הוא עובד (מנכ"ל) מניות של Experimentica בע מ מציע החוזה שירותי מחקר העסקת המודל CNV פרה להשתמש במאמר זה.
Acknowledgements
המחברים רוצה להודות Yuliya Naumchuk (אוניברסיטת לויולה שיקגו), כוכבה משעלי Žiniauskaitė (Experimentica בע מ) עבור תמיכה טכנית, videographic מצוינת. תכנית המחקר של ד ר Kaja נתמך על ידי ד ר ג'ון עמ' תרז אי Mulcahy ניחן כפרופסור במכון עיניים ב אוניברסיטת לויולה שיקגו.
Materials
| Name | Company | Catalog Number | Comments |
| Medetomidine (commercial name Domitor) | Orion | Vnr 01 56 02 | Anesthesia |
| Ketamine | Intervet | Vnr 51 14 85 | Anesthesia |
| 0,9% NaCl | B Braun | 357 0340 | Anesthesia |
| Xylazine (commercial name Rompun vet) | Bayer | vnr 14 89 99 | Anesthesia |
| Tropicamide | Santen | Vnr 04 12 36 | Mydriatic agent |
| Viscotears | Alcon | Vnr 44 54 81 | Lubricant |
| Systane | Alcon | - | Lubricant |
| 5% Fluorescein sodium salt | Sigma Aldrich | F6377-100G | Fluoresent agent |
| Atipamezole (commercial name Antisedan) | Orion | Vnr 47 19 53 | Anesthesia |
References
- Dobi, E. T., Puliafito, C. A., Destro, M. A new model of experimental choroidal neovascularization in the rat. Arch. Ophthalmol. Chic. Ill 1960. 107, 264-269 (1989).
- Tobe, T., et al. Evolution of neovascularization in mice with overexpression of vascular endothelial growth factor in photoreceptors. Invest. Ophthalmol. Vis. Sci. 39, 180-188 (1998).
- Seo, M. S., et al. Dramatic inhibition of retinal and choroidal neovascularization by oral administration of a kinase inhibitor. Am. J. Pathol. 154, 1743-1753 (1999).
- Grossniklaus, H. E., Kang, S. J., Berglin, L. Animal models of choroidal and retinal neovascularization. Prog. Retin. Eye Res. 29, 500-519 (2010).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A Mouse Model for Laser-induced Choroidal Neovascularization. J Vis Exp. (106), e53502 (2015).
- Giani, A., et al. In vivo evaluation of laser-induced choroidal neovascularization using spectral-domain optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 52, 3880-3887 (2011).
- Gong, Y., et al. Optimization of an Image-Guided Laser-Induced Choroidal Neovascularization Model in Mice. PloS One. 10, e0132643 (2015).
- Sheets, K. G., et al. Neuroprotectin D1 attenuates laser-induced choroidal neovascularization in mouse. Mol. Vis. 16, 320-329 (2010).
- Hoerster, R., et al. In-vivo and ex-vivo characterization of laser-induced choroidal neovascularization variability in mice. Graefes Arch. Clin. Exp. Ophthalmol. Albrecht Von Graefes Arch. Klin. Exp. Ophthalmol. 250, 1579-1586 (2012).
- Sulaiman, R. S., et al. A Simple Optical Coherence Tomography Quantification Method for Choroidal Neovascularization. J. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. Ther. Off. J. Assoc. Ocul. Pharmacol. 31, 447-454 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved