Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Potenciación de la eficacia del anticuerpo contra el cáncer por fármacos antineoplásicos: detección de anticuerpos-droga sinergia utilizando la ecuación de índice de combinación
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe cómo evaluar sinergismo entre un anticuerpo contra el cáncer y fármacos antineoplásicos en modelos preclínicos mediante la ecuación de índice de combinación de Chou y Talalay.
Resumen
Potenciación de la hostiles anticuerpos monoclonales (mAb) por agentes quimioterapéuticos constituye una estrategia valiosa para el diseño de una terapia eficaz y segura contra el cáncer. Aquí proporcionamos un protocolo para identificar una combinación racional en la etapa preclínica. En primer lugar, se describe un ensayo basado en células para evaluar el sinergismo entre mAb contra el cáncer y las drogas citotóxicas, que utiliza la ecuación de índice de combinación de Chou y Talalay1. Esto incluye la medición del tumor celular drogas y anticuerpos-sensibilidad usando un análisis MTT, seguido de un análisis automatizado de la computadora para calcular los valores de índice (CI) de combinación. Valores de CI de < 1 indican sinergismo entre mAbs probado y agentes citotóxicos1. Para corroborar la en vitro resultados en vivo, además se describe un método para evaluar la eficacia del régimen de combinación en un modelo de xenoinjerto tumoral. En este modelo, el régimen combinado retrasa significativamente el crecimiento del tumor, que se traduce en una significativa supervivencia extendida en comparación con controles de agente único. Lo importante es la experimentación en vivo revela que el régimen de combinación es bien tolerado. Este protocolo permite la evaluación eficaz de combinaciones de fármacos contra el cáncer en modelos preclínicos y la identificación de una combinación racional para evaluar en ensayos clínicos.
Introducción
El enfoque convencional en el tratamiento de un gran número de diferentes tipos de cáncer se basaba en monoterapia. Aunque todavía se utiliza en muchos casos, este método reunieron varios obstáculos lleva a optar por terapias combinadas2. Particularmente, las células cancerosas son más susceptibles a desarrollar resistencia cuando se tratan con un solo medicamento por inducir supervivencia alternativos mecanismos3, resultando en fracaso terapéutico de pacientes4. Por otra parte, en monoterapia, medicamentos generalmente son administrados en una dosis alta. Esta situación a menudo resulta en la ocurrencia de fuertes efectos secundarios de dosis dependiente que puede ser intolerable y obligar a los médicos para detener el tratamiento2. Por estas razones, la Asociación de moléculas contra el cáncer ahora es preferido a la monoterapia.
Combinaciones de medicamentos ideal serían las que actúan en sinergia contra células tumorales, sin aumento de la toxicidad contra las células normales. Sinergia se refiere a la interacción de dos o más medicamentos que produce un efecto terapéutico mayor que la suma de cada droga individual actuando por separado. Estas interacciones pueden resultar en mayor eficacia terapéutica clínica2. Límites de la resistencia al tratamiento, aumenta la eficacia y también puede reducir la toxicidad2. De hecho, puede reducirse la dosis de cada medicamento para disminuir sus efectos secundarios apuntando a distintas vías. Además, una de las moléculas también puede servir como un agente de sensibilización contra las células cancerosas. El efecto de la segunda droga puede mejorarse en las células sensibilizadas y menos de la dosis puede ser utilizado5.
La terapia combinada puede incluir dos o más medicamentos quimioterapéuticos o biológicos, como anticuerpos monoclonales6. Estos mAbs apuntar específicamente las células que expresaban un antígeno de superficie de la célula de interés y son capaces de matar células tumorales a través de vías inmunológicas incluyendo la citotoxicidad mediada por células dependiente de anticuerpo (ADCC), con la participación de las células efectoras inmunes 7y la citotoxicidad dependiente del complemento (CDC)6. También puede actuar a través de un mecanismo no inmunológico mediado por apoptosis8,9,10,11. En este caso, la inducción del proceso de muerte celular programada puede sensibilizar las células de cáncer, debilitan su función y hacer el fármaco quimioterápico asociado más eficaz en una dosis más baja. Como tal, proapoptotic mAb son buenos candidatos para el diseño de regímenes de combinación con fármacos antineoplásicos.
Se han descrito diferentes modelos matemáticos para evaluar sinergismo de drogas; uno de ellos se basa en la combinación del método de índice1. Este método se basa en el principio de efecto mediano desarrollado por Chou1. La ecuación de la mediana-efecto correlaciona la dosis de droga y el efecto de la droga como sigue.
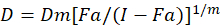
Aquí, D es la dosis de la droga; DM es la dosis mediana-efecto; FA es la fracción afectada por la dosis; m es un exponente que indica la forma de la dosis-efecto parcela1. La dosis mediana de efecto se utiliza para calcular la dosis de Dx de un fármaco que inhibe o mata a "x" por ciento de las células. Luego se calcula el valor de CI para evaluar el efecto aditivo de la combinación de drogas, de la siguiente manera1.
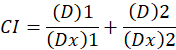
CI el valor de 1 indica un efecto aditivo y un valor de CI de < 1 indica un efecto sinérgico, mientras que un valor de CI de > 1 indica antagonismo1. La aplicación de este método se facilita aún más la disponibilidad de un programa de computadora, CompuSyn, que determina el sinergismo y el antagonismo en las dosis o los niveles de efecto simularon automáticamente12.
Nuestro grupo ha desarrollado el mAb 8B6 específico del antígeno O-acetil-GD2 para neuroblastoma gangliósido (OAcGD2)13 y otros demostraron que esta mAb es capaz de inducir la muerte celular con atributos de apoptosis11. Para probar si mAb 8B6 puede sensibilizar las células del neuroblastoma en el topotecán agente antineoplásico, adaptamos el método antedicho, desarrollado por Chou1. En primer lugar, determinamos los dosis efectiva 50 (ED50) los valores de mAb 8B6 y topotecán. A continuación, las células de neuroblastoma con equipotente relaciones de los dos compuestos basados en ED50 valores están expuestas para determinar los valores de CI con el software de simulación antes mencionados. Este método nos permite demostrar sinergismo entre mAb 8B6 y topotecan in vitro. A continuación, se describe un protocolo para evaluar aún más la potencia y la seguridad de esta combinación régimen en vivo. Este protocolo se puede aplicar fácilmente para seleccionar combinaciones de agente quimioterapéutico y mAb anticáncer potente y seguro en estudios preclínicos. Una representación esquemática de este estudio se proporciona en la figura 1.
Protocolo
Alojamiento de los animales y procedimiento experimental fueron aprobados por el gobierno francés (acuerdos #C44-278 y #APAFIS 03479.01). Procedimientos y cuidado de los animales se realizaron bajo Directiva UE 2010/63/UE y ley #2013-118 sobre la protección de los animales utilizados para fines científicos.
1. evaluación de la interacción entre el medicamento mAb 8B6 y Topotecan In Vitro
- preparación de la muestra de 96 pocillos
PRECAUCIÓN: Consulte con la Comisión de salud y seguridad de la institución y reglas de regulación local relacionados con la seguridad en el laboratorio. Revise la información Material y ficha de seguridad antes de trabajar con los medios de comunicación, líneas celulares o reactivos. Utilizar técnica estéril adecuada y trabajar en campana de flujo laminar. Todas soluciones/equipos que se utilizan para manipular las células deben ser estériles.
Nota: El siguiente protocolo fue diseñado para uso con las células adherentes. Modificaciones están obligadas a aplicar el método a nonadherent células en suspensión; Este protocolo utiliza cuadruplicado para cada condición experimental.- Crecen las células IMR5 en un matraz T75.
- En el primer día (día 0), observar el cultivo de células bajo un microscopio para verificar la confluencia celular. Aspire el medio celular del frasco, lavar con 5 mL de solución salina tamponada con fosfato (PBS) y añadir 3 mL de 0.05% ácido etilendiaminotetracético (EDTA) / solución de PBS. Vuelva el matraz a la incubadora por 3 min (37 ° C, 5% CO2).
- Examinar la cultura de célula bajo el microscopio para la separación de la célula.
Nota: Si es necesario, retomar la cubeta de la incubadora durante un min de 3 a 5 adicional, dependiendo del tipo de tumor de la célula. - Añadir 10 mL de medio completo celular al matraz y transferir la suspensión de células a un tubo cónico de 15 mL estéril. Centrifugar las células durante 5 min a 300 x g. Contar las células usando un hemocitómetro.
- Retire y descarte el sobrenadante. Resuspender el precipitado de células en el medio de cultivo completo. Ajustar el volumen del medio para obtener una concentración final de 1 x 105 células/mL.
- Pozos de una placa de cultivo de 96 pocillos con 104 células cada uno, que es 100 μl de suspensión celular de semillas 84. Seguir el diseño experimental que se muestra en la figura 2.
- Incube las células durante 18 horas en la incubadora de la célula (37 ° C, 5% CO2).
- Preparación de la solución de droga
Nota: Para los estudios de sensibilización de drogas/mAb, modificar el tiempo, la longitud y el tratamiento de la concentración a la droga/mAb particular en cuestión. Tenga en cuenta que la concentración inicial es 3 x la concentración final.- A la mañana siguiente (día 1), preparar las siguientes soluciones de drogas utilizando medio de cultivo completo.
-
preparación de solución de mAb
- Diluir el mAb en 500 μl de medio de cultivo completo para obtener una solución de trabajo de anticuerpos con una concentración de mAb de 240 μg/mL.
- Realizar cinco diluciones dobles en serie como se indica en la figura 2.
-
Preparación de solución de topotecán
- Diluido, como arriba, la droga en 500 μl de medio de cultivo completo para obtener una solución de trabajo de medicamentos con una concentración final de 120 nM.
- Realizar cinco diluciones dobles en serie como se indica en la figura 2.
-
Preparación de solución de anticuerpo y medicamento
- Diluir las soluciones de drogas y mAb en 500 μl de medio de cultivo completo para obtener una solución de 120 drogas de nM y mAb de 240 μg/mL (solución de trabajo).
- Realizar cinco diluciones dobles en serie como se indica en la figura 2.
-
preparación de solución de mAb
- Para llegar a la concentración final, transferir 50 μl de cada solución de la droga en los pocillos correspondientes, como se indica en el diseño experimental ( figura 2).
Nota: Transferir 50 μl del medio de cultivo completo en los pocillos de untreated de la célula, como se indica en la figura 2. - Incube las células durante 72 h en la incubadora (37 ° C, 5% CO2).
- A la mañana siguiente (día 1), preparar las siguientes soluciones de drogas utilizando medio de cultivo completo.
- Ensayo MTT
- Añadir 10 μl de solución de reactivo MTT en cada pozo.
- Incubar a 37 ° C por 4 h.
- Añada 100 μl de solución de lisis (10% SDS en 0.01 M HCl) en cada pocillo, utilizando una pipeta multicanal y homogeneizar mediante pipeteo.
- Incubar a 37 ° C por 4 h en una cámara humidificada (95% de humedad).
- Leer la absorbancia a 570 nm (un570) y 620 nm (un620) utilizando un espectrofotómetro.
Nota: Mezcle cada muestra otra vez transfiriendo antes de leer la absorbancia; absorbancia a 620 nm permite la corrección de los valores de fondo no específicas. - Calcular la absorbancia corregida: corregida absorbancia = un570- A620.
- Calcular la viabilidad celular como sigue: viabilidad celular = 100 x (promedio de absorbancia corregida de la muestra / absorbancia media corregida de control).
- Calcular los valores afectados por la fracción (Fa) mediante la siguiente ecuación: 1 - (absorbancia media corregida de la muestra / absorbancia media corregida de control).
- Software de simulación análisis de interacción de drogas individual y estudios de la combinación de medicamentos
- Ejecute el software de simulación para abrir la ventana de inicio.
- Haga clic en el botón Nuevo experimento para abrir la ventana principal .
- Escriba el nombre del experimento en la ventana de nombre .
Nota: Puede añadirse una fecha en la ventana de fecha . - Haga clic en el botón Nueva droga sola .
- Escriba el nombre en la ventana de Nombre completo .
- Escriba la abreviatura en la ventana de la abreviatura .
- Escriba la unidad de concentración de droga en la ventana unidades .
- Introduzca Datos punto 1 dosis y el valor de Fa, presione entrar.
- Repita este paso hasta que todos los puntos de datos se introducen.
- Haga clic en el botón terminado .
- Siga los mismos pasos para introducir puntos de datos de mAb.
Nota: Utilice la misma unidad de concentración utilizada por droga. - Haga clic en el botón de Nuevo una combinación de medicamentos .
- Seleccione medicamentos y mAb.
- Seleccione la Constante relación y haga clic en Aceptar.
- Escriba el nombre en la ventana de Nombre completo .
- Escriba la abreviatura en la ventana de la abreviatura .
- Escriba la relación droga/mAb en la ventana de relación .
- Introduzca Datos punto 1 dosis y presiona Enter.
Nota: El programa calculará automáticamente las dosis de mAb y Combo. - Introduzca el valor de Datos punto 1 Fa y presiona Enter.
- Repita este paso hasta que todos los puntos de datos se introducen.
- Haga clic en el botón terminado y, a continuación, haga clic en el botón Generar informe .
- Seleccione medicamentos y mAb y, a continuación, haga clic en Aceptar.
- Seleccione el Combo y, a continuación, haga clic en Aceptar.
- Seleccione encabezado, tabla de CIy cuadro resumen. A continuación, haga clic en Aceptar.
- Escriba el nombre de archivo del archivo de análisis y haga clic en Guardar para generar el informe.
Nota: Después de hacer clic en Aceptar, el informe se abrirá automáticamente en el explorador de web predeterminado de la computadora. - Para imprimir el informe, elija Imprimir del menú de archivo del navegador web. El informe contiene una sección de la tabla resumen que incluye título, fecha, nombre del archivo, Descripción Nota, parámetros (m, Dm y r), ED50 para cualquier agente utilizado en monoterapia o en combinación y la tabla de CI para cada combinación en ED50, ED 75, ED90y ED95.
Nota: Un CI valor de < 1 indica sinergismo, CI valor = 1 indica la aditividad y un valor de CI de > 1 indica que el antagonismo.
2. generación de xenoinjertos de Neuroblastoma humano en ratones de Scid Gamma Nonobese NOD diabética (NSG ratones)
Nota: Excluye cualquier contaminación de la cultura de célula. Puesto que la matriz de la membrana del sótano forma un gel por encima de 5 ° C, todos los cultureware o los medios de comunicación entre en contacto con el reactivo de la matriz de la membrana del sótano deben ser prechilled/ice-cold. Mantener la matriz de la membrana del sótano en el hielo durante todo el proceso.
-
Preparación de la suspensión de células de IMR5
- Descongelar el reactivo de la matriz de la membrana del sótano una noche sumergiendo el frasco en el hielo en un refrigerador de 4 ° C antes de usar.
- En el día 0, cosecha las IMR5 células cultivadas como se detalla arriba.
- Transferir las células a un tubo cónico de 15 mL y centrifugar a 300 x g durante 5 minutos.
- Deseche el sobrenadante. Lavar las células 2 x con 15 mL de PBS helado y preparar una suspensión de 5 x 107 células/mL en PBS helado.
Nota: Si es necesario, transferir la suspensión de células a un tubo de microcentrífuga de 1,5 mL. - Agitar el frasco de la matriz de la membrana del sótano.
Nota: El reactivo de la matriz de la membrana del sótano debe ser descongelado y dispersos. - Añadir un volumen de reactivo de la matriz de la membrana del sótano y mezclar mediante pipeteo para obtener una suspensión de 2.5 x 107 células /mL.
- Mantener la suspensión de células en el hielo.
-
Preparación de los ratones
Nota: Los ratones deben ser de seis a siete semanas de edad.- Mantener los ratones bajo la condición de libre de patógenos específica.
- Permitir un período de aclimatación de tres a cinco días después de han llegado los ratones.
- En el día de la inoculación, afeitarse el flanco donde la inyección será (ver paso 2.3.6).
-
Preparación de la inyección de células de tumor
Nota: Mantenga la suspensión de células de matriz de la membrana del sótano helado aséptica durante el procedimiento.- Mezcle las células y extraer cuidadosamente la suspensión de células en una jeringa de 1 mL con una aguja de 21 G.
- Verifique para asegurarse que no hay ninguna burbuja de aire en la jeringa.
- Desinfectar la zona de inoculación del ratón con una solución antiséptica.
- Apriete suavemente la piel del ratón en el flanco entre los dedos, en el sitio de inyección.
- Inserte la aguja exactamente en el pliegue de la piel. No coloque la aguja en el tejido para asegurar una inyección subcutánea.
- Inyectar 100 μl de suspensión de células de IMR5 (es decir, 2.5 x 106 células) por vía subcutánea en el flanco derecho más bajo de los ratones.
- Rotar la jeringa para evitar la fuga y retirar la aguja.
-
Monitoreo de cambios de peso y crecimiento del tumor
- Medir la longitud (A) y el ancho (B) del tumor con una pinza.
- Calcular el volumen del tumor mediante la fórmula (A x B2) x 0.5.
- Iniciar el tratamiento cuando los tumores han alcanzado un volumen promedio de ~ 50-60 mm3.
3. drogas y la administración de anticuerpos en ratones
-
Administración intravenosa de mAb 8B6
- Cuidadosamente llene una jeringa de 1 mL con una aguja de 25 G con solución de mAb.
- Coloque el ratón bajo una lámpara de calor durante 10 minutos dilatar la vena de la cola.
- Refrenar el ratón en un limitador de roedor.
- Desinfectar la zona de inoculación del ratón con una solución antiséptica.
- Inserte la aguja paralela a la vena de la cola, penetrante 2-4 mm en la luz, manteniendo el bisel de la cara de la aguja hacia arriba (Figura 3A).
- Inyectar 100 μl de solución de anticuerpos por vía intravenosa (i.v.).
- Una vez terminada la inyección, presionar suavemente el sitio de la inyección para prevenir el sangrado.
-
Administración intraperitoneal de topotecán
- Extraer la solución de la droga en una jeringa de 1 mL con una aguja de 25 G.
- Mantenga el ratón en una posición supina, con su extremo posterior levemente elevada.
- Desinfectar la zona de inoculación del ratón con una solución antiséptica.
- Busque la línea media del abdomen del ratón y mentalmente divida el abdomen en cuadrantes. Localizar el sitio de inyección en el cuadrante inferior derecho o izquierdo (figura 3B).
- Inserte la aguja en el abdomen (5 mm de profundidad) en ángulo de ~ 10°, en el cuadrante inferior derecho o izquierdo.
- Inyectar 100 μl de solución de droga por vía intraperitoneal (i.p.).
- Desinfectar el sitio de inoculación.
Resultados
Los resultados representativos y las figuras se adaptan con el permiso de trabajo anteriormente publicado14.
Anti-OAcGD2 mAb 8B6 aumenta sinérgicamente los efectos inhibitorios de topotecán en crecimiento de línea de células de Neuroblastoma:
Establecer el fármaco y las concentraciones de anticuerpo que se utilizará para l...
Discusión
Para predecir el efecto de la interacción con otros medicamentos, pueden utilizarse tres métodos: la metodología de isobologram17, la mezcla no lineal modelo18y la combinación índice1. Análisis de índice de combinación es el más comúnmente utilizado ya que su aplicación se simplifica por la disponibilidad de un programa informático fácil de usar. Para ello, primero hemos caracterizado la respuesta de dosis-efecto de cada agente utilizado...
Divulgaciones
S.Fa., J.F. y S.B. se señalan como inventores de pendientes patentes que cubren la aplicación clínica de anticuerpos terapéuticos anti-O-acetil-GD2.
Agradecimientos
Concesión de la ayuda: Fondation de Projet de L 'Université de Nantes, les Bagouz' à Manon, La Ligue contre le cáncer comité de Loire-Atlantique, comité de Morbihan y comité de Vendée, une rose pour S.A.R.A.H, L'Etoile de Martin y la Société Française de Lutte contre les Los cánceres et les leucémies de l ' enfant et de L'adolescent (SFCE). M.B. y J.F. son apoyados por La Ligue Contre Le cáncer. Los autores agradecen a la UTE-instalación de la estructura Fédérative de Recherche François Bonamy. Los autores también agradecen el Dr. S. Suzin (Inserm, París) para proporcionar las células IMR5 y Sra. H. Estéphan su asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referencias
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: "Postoperative validation of bone-anchored implants in the single-sided deafness population." Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Cancer Research. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Cancer Research. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados