Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Potentialisation des anticorps anticancéreux efficacité par les médicaments anticancéreux : détection des anticorps-médicament synergie à l’aide de l’équation d’indice de combinaison
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit comment évaluer les synergies entre un anticorps anticancéreux et médicaments anticancéreux dans les modèles précliniques en utilisant l’équation d’indice de combinaison de Chou et Talalay.
Résumé
Potentialisation de l’hostile des anticorps monoclonaux (ACM) par des agents chimiothérapeutiques constitue une stratégie utile pour concevoir un traitement efficace et sûr contre le cancer. Ici, nous fournissons un protocole pour identifier une combinaison rationnelle à l’étape préclinique. Tout d’abord, nous décrivons un essai afin d’évaluer la synergie entre mAb anticancéreux et médicaments cytotoxiques, qui utilise l’équation d’indice de combinaison de Chou et Talalay1cellule. Cela inclut la mesure de tumeur médicament et anticorps-sensibilité cellulaire à l’aide d’un test MTT, suivi d’une analyse informatique automatisé pour calculer les valeurs d’index (CI) de combinaison. Les valeurs de CI de < 1 indiquent la synergie entre mAbs testés et agents cytotoxiques1. Pour corroborer l’in vitro résultats in vivo, nous décrivons plus loin une méthode pour évaluer l’efficacité de traitement de combinaison dans un modèle de xénogreffe de tumeur. Dans ce modèle, le schéma thérapeutique combiné retarde significativement la croissance tumorale, qui se traduit par une survie prolongée significative par comparaison monothérapie témoins. Ce qui est important, l’expérimentation in vivo révèle que le régime de la combinaison est bien toléré. Ce protocole permet l’évaluation efficace des combinaisons de médicaments anticancéreux dans les modèles précliniques et l’identification d’une combinaison rationnelle d’évaluer dans les essais cliniques.
Introduction
L’approche conventionnelle dans le traitement d’un grand nombre de différents types de cancer reposait en monothérapie. Même si elle est encore utilisée dans de nombreux cas, cette méthode rencontre plusieurs obstacles menant à opter pour des thérapies combinées2. En particulier, les cellules cancéreuses sont plus susceptibles de développer une résistance lorsque traités avec un médicament unique en induisant la survie alternative mécanismes3, entraînant un échec thérapeutique dans les patients4. En outre, en monothérapie, médicaments sont généralement administrés à fortes doses. Souvent, cette situation se traduit par l’apparition de forts effets secondaires de dose-dépendante pouvant être intolérable et forcer les médecins à arrêter le traitement2. Pour ces raisons, l’association de molécules anticancéreuses est désormais préféré à une monothérapie.
Combinaisons de médicaments idéal serait ceux qui agissent en synergie contre les cellules tumorales, sans toxicité accrue contre les cellules normales. Synergie se réfère à l’interaction de deux ou plusieurs médicaments qui produit un effet thérapeutique supérieur à la somme de chaque médicament agissant séparément. Ces interactions peuvent entraîner de meilleure efficacité thérapeutique clinique2. Il limite la résistance au traitement, augmente l’efficacité et permet également de réduire la toxicité2. En fait, la dose de chaque médicament peut être réduite pour diminuer leurs effets secondaires en ciblant les différentes voies. En outre, une des molécules peut servir aussi comme un agent sensibilisant contre les cellules cancéreuses. L’effet de la deuxième drogue peut encore être amélioré sur les cellules sensibilisées et dosages moins peuvent être utilisé5.
Thérapie combinée peut inclure deux ou plusieurs médicaments chimiothérapeutiques et/ou des produits biologiques, tels que les anticorps monoclonaux6. Ces mAbs ciblent spécifiquement les cellules exprimant un antigène de surface de cellules d’intérêt et sont capables de tuer les cellules tumorales par des voies immunologiques, y compris la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC), avec la participation de cellules effectrices immunitaire 7et6de la cytotoxicité dépendante du complément (CDC). Ils peuvent également agir par un mécanisme non immunologiques médié par apoptose8,9,10,11. Dans ce cas, l’induction du processus de mort cellulaire programmée peut sensibiliser les cellules cancéreuses, affaiblir leur fonction et accroître l’efficacité du médicament chimiothérapeutique associé à une posologie plus faible. Par conséquent, pro-apoptotique mAb sont de bons candidats pour la conception de schémas de combinaison avec des médicaments antinéoplasiques.
Différents modèles mathématiques ont été décrites pour évaluer la synergie de la drogue ; l’un d’eux repose sur la combinaison indice méthode1. Cette méthode repose sur le principe de la médiane-effet développé par Chou1. L’équation de la médiane-effet met en corrélation la dose de médicament et l’effet de la drogue comme suit.
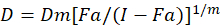
Ici, D est la dose de médicament ; DM est la dose médiane-effet ; Fa est la fraction affectée par la dose ; m est un exposant qui signifie la forme de la relation dose-effet tracé1. La dose médiane-effet est utilisée pour calculer la dose Dx d’un médicament qui inhibe ou tue «x» pour cent des cellules. La CI est ensuite calculée pour évaluer l’effet additif de la combinaison de médicaments, comme suit :1.
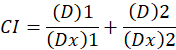
CI la valeur 1 indique un effet additif et la valeur CI < 1 indique un effet synergique, tandis qu’une valeur de CI de > 1 indique l’antagonisme1. L’application de cette méthode est facilitée par la disponibilité d’un programme d’ordinateur, CompuSyn, qui détermine la synergie et l’antagonisme à toutes les doses ou concentrations simulant automatiquement12.
Notre groupe a développé le mAb 8B6 spécifique pour O-acétyl-GD2 ganglioside (OAcGD2) neuroblastome antigène13 et encore démontré que cette mAb est capable d’induire la mort cellulaire avec les attributs de l’apoptose,11. Pour tester si mAb 8B6 peut sensibiliser les cellules de neuroblastome au topotécan agent antinéoplasique, nous avons adapté la méthode susmentionnée, développée par Chou1. Tout d’abord, nous déterminons les dose efficace 50 (ED50) valeurs mAb 8B6 et topotécan. Ensuite, les cellules de neuroblastome équipotentes ratios des deux composés selon ED50 valeurs sont exposées pour déterminer les valeurs de CI à l’aide du logiciel de simulation mentionnés ci-dessus. Cette méthode nous permet de démontrer la synergie entre mAb 8B6 et topotécan in vitro. Ensuite, les auteurs décrivent un protocole pour évaluer plus précisément la puissance et la sécurité de cette combinaison régime in vivo. Ce protocole peut être facilement appliqué pour sélectionner le mAb anticancéreux puissant et sûr et combinaisons agent chimiothérapeutique dans les études précliniques. Une représentation schématique de la présente étude est fournie à la Figure 1.
Protocole
Logement des animaux et la procédure expérimentale ont été approuvées par le gouvernement Français (accords #C44-278 et #APAFIS 03479.01). Soins des animaux et des procédures ont été menées en vertu de la directive européenne 2010/63/UE et droit Français #2013-118 sur la protection des animaux utilisés à des fins scientifiques.
1. évaluation de l’Interaction médicamenteuse entre mAb 8B6 et le topotécan In Vitro
- préparation des échantillons de 96 puits
Attention : Consulter le Comité de santé et de sécurité de l’institution et suivre les règles locales liées à la sécurité en laboratoire. Lisez les informations de matériel et de la fiche signalétique avant de travailler avec n’importe quel média, lignées cellulaires ou réactifs. Utiliser une technique stérile adaptée et travailler sous une hotte à flux laminaire. Toutes les solutions/matériel qui sont utilisés pour manipuler des cellules doivent être stériles.
Remarque : Le protocole suivant a été conçu pour être utilisé avec les cellules adhérentes. Modifications sont tenues d’appliquer la méthode de cellules non adhérentes cultivées en suspension ; ce protocole utilise quatre exemplaires pour chaque condition expérimentale.- La croissance de cellules IMR5 dans une fiole de T75.
- Le premier jour (jour 0), observer la culture de cellules au microscope pour vérifier la confluence de la cellule. Aspirez le milieu cellulaire du flacon, lavez-le avec 5 mL d’une solution saline tamponnée au phosphate (PBS) et ajouter 3 mL de 0.05 % l’acide éthylènediaminetétraacétique (EDTA) / solution de PBS. Retourner le flacon dans l’étuve pendant 3 min (37 ° C, 5 % de CO2).
- Examiner la culture de cellules au microscope pour le détachement cellulaire.
Remarque : Si nécessaire, remettez la fiole dans l’incubateur pour une supplémentaire de 3 à 5 min, selon le type de cellules de tumeur. - Ajouter 10 mL de milieu cellulaire complet dans le ballon et transférer la suspension cellulaire dans un tube conique stérile de 15 mL. Centrifuger les cellules pendant 5 min à 300 x g. Compter les cellules à l’aide d’un hémocytomètre.
- Retirer et jeter le surnageant. Resuspendre le culot de cellules dans un milieu de croissance complète. Ajuster le volume sonore moyen pour obtenir une concentration finale de 1 x 105 cellules/mL.
- Puits d’une plaque de 96 puits de culture avec 104 cellules chacun, qui est de 100 µL de suspension cellulaire de semences 84. Suivez le schéma expérimental figurant dans la Figure 2.
- Incuber les cellules pendant 18 h dans l’incubateur de cellules (37 ° C, 5 % de CO2).
- Préparation de la solution
NOTE : Pour les études de sensibilisation drogue/mAb, modifier le calendrier, la durée et le traitement de la concentration en fonction de la drogue/mAb particulier en question. Notez que la concentration initiale est 3 fois la concentration finale.- Le lendemain matin (jour 1), préparer les solutions suivantes de la drogue à l’aide de milieu de culture complet.
-
préparation de solutions de mAb
- Diluer le mAb dans 500 µL de milieu de culture complet pour obtenir une solution de travail des anticorps avec une concentration de mAb de 240 µg/mL.
- Effectuer des dilutions sériées de cinq double comme indiqué dans la Figure 2.
-
Préparation de la solution topotécan
- Diluer, comme ci-dessus, la drogue en 500 µL de milieu de culture complet pour obtenir une solution de travail de médicament avec une concentration finale de 120 nM.
- Effectuer des dilutions sériées de cinq double comme indiqué dans la Figure 2.
-
Préparation de la solution anticorps et drogues
- Diluer les solutions drogue et mAb dans 500 µL de milieu de culture complet pour obtenir une solution à 120 drogue nM et mAb 240 µg/mL (solution de travail).
- Effectuer des dilutions sériées de cinq double comme indiqué dans la Figure 2.
-
préparation de solutions de mAb
- Pour arriver à la concentration finale, transférer 50 µL de chaque solution médicamenteuse dans les puits correspondantes, comme indiqué au schéma expérimental ( Figure 2).
NOTE : Transférer 50 µL de milieu de culture complet dans les puits de cellule non traitées, comme il est indiqué dans la Figure 2. - Incuber les cellules pendant 72 h dans l’incubateur (37 ° C, 5 % de CO2).
- Le lendemain matin (jour 1), préparer les solutions suivantes de la drogue à l’aide de milieu de culture complet.
- Analyse de MTT
- Ajouter 10 µL de la solution de réactif MTT dans chaque puits.
- Incuber à 37 ° C pendant 4 h.
- Ajouter 100 µL de solution de lyse (10 % SDS dans 0,01 M HCl) dans chaque puits, à l’aide d’une pipette multicanaux et bien mélanger en pipettant également.
- Incuber à 37 ° C pendant 4 h dans une chambre humidifiée (95 % d’humidité).
- Lire l’absorbance à 570 nm (une570) et 620 nm (un620) à l’aide d’un spectrophotomètre.
NOTE : Mélanger chaque échantillon à nouveau en pipettant également, avant de lire l’absorbance ; absorbance à 620 nm permet la correction des valeurs de fond non spécifique. - Calculer l’absorption corrigée : corrigé absorbance = une570- un620.
- Calculer la viabilité cellulaire comme suit : viabilité cellulaire = 100 x (moyenne corrigée absorbance de l’échantillon / contrôle moyenne d’absorption corrigée).
- Calculer les valeurs touchées par fraction (Fa) selon l’équation suivante : 1 - (moyenne corrigée absorbance de l’échantillon / contrôle moyenne d’absorption corrigée).
- Logiciel de simulation analyse d’interaction de drogue simple et études de combinaison de médicaments
- Exécutez le logiciel de simulation pour ouvrir la fenêtre de démarrage.
- Cliquez sur le bouton Nouvelle expérience pour ouvrir la fenêtre principale .
- Tapez le nom de l’expérience dans la fenêtre nom .
Remarque : Une date peut être ajoutée dans la fenêtre de Date . - Cliquez sur le bouton Nouveau médicament seul .
- Tapez le nom dans la fenêtre Nom et prénom .
- Tapez l’abréviation dans la fenêtre Abbrev .
- Tapez l’unité de concentration du médicament dans la fenêtre unités .
- Entrez Données Point 1 Dose et la valeur de Fa, appuyez sur entrée.
- Répétez cette étape jusqu'à ce que tous les Points de données sont saisies.
- Cliquez sur le bouton terminé .
- Suivez les mêmes étapes pour entrer dans les Points de données de mAb.
Remarque : Utilisez la même unité de concentration qui est utilisé par la drogue. - Cliquez sur le bouton Nouveau Combo de drogue .
- Sélectionnez le médicament et mAb.
- Sélectionnez Un rapport Constant et cliquez sur OK.
- Tapez le nom dans la fenêtre Nom et prénom .
- Tapez l’abréviation dans la fenêtre Abbrev .
- Tapez le ratio drogue/mAb dans la fenêtre de rapport .
- Entrez des Données Point 1 Dose et appuyez sur entrée.
NOTE : Le programme calculera automatiquement les doses de mAb et Combo. - Entrez la valeur de Données Point 1 Fa et appuyez sur entrée.
- Répétez cette étape jusqu'à ce que tous les Points de données sont saisies.
- Cliquez sur le bouton terminé et, ensuite, cliquez sur le bouton Générer le rapport .
- Sélectionnez le médicament et mAb et puis cliquez sur OK.
- Sélectionnez la liste déroulante et puis cliquez sur OK.
- Sélectionnez en-tête, CI tableauet tableau récapitulatif. Puis cliquez sur OK.
- Tapez le nom de fichier du fichier analyse, puis cliquez sur enregistrer pour générer le rapport.
Remarque : Après avoir cliqué sur OK, le rapport s’ouvre automatiquement dans le navigateur de l’ordinateur par défaut. - Pour imprimer le rapport, choisissez Imprimer du menu fichier du navigateur web. Le rapport contient une Section de Table de résumé qui inclut le titre, date, nom de fichier, description Nota, paramètres (m, Dm et r), ED50 pour chaque agent utilisé en monothérapie ou en combinaison et la table CI pour chaque combinaison à ED50, ED 75, ED90et ED95.
Nota : Une valeur de CI de < 1 indique la synergie, la valeur CI = 1 indique l’additivité et la valeur CI > 1 indique l’antagonisme.
2. génération des xénogreffes de neuroblastome humain chez les souris Scid Gamma non obèses diabétiques NOD (NSG souris)
NOTE : Exclut toute contamination de la culture cellulaire. Étant donné que la matrice de la membrane basale forme un gel au-dessus de 5 ° C, tout matériel ou médias entrant en contact avec le réactif de matrice de membrane basale doit être prérefroidies/glace-froid. Garder la matrice de la membrane basale sur glace durant tout le processus.
-
Préparation de la suspension de cellules IMR5
- Décongeler le réactif de matrice de membrane basale du jour au lendemain en immergeant le flacon dans la glace dans un réfrigérateur de 4 ° C avant utilisation.
- Jour 0, récolter les cellules de IMR5 cultivées comme détaillé ci-dessus.
- Transférer les cellules dans un tube conique de 15 mL et centrifuger à 300 x g pendant 5 min.
- Jeter le surnageant. Laver les cellules 2 x 15 ml de PBS glacee et préparer une suspension de cellules de 5 x 107 cellules/mL dans du PBS glacée.
Remarque : Si nécessaire, transférer la suspension de cellules dans un tube de microtubes de 1,5 mL. - Agiter le flacon de matrice de membrane basale.
Remarque : Le réactif de matrice de membrane basale doit être décongelé et dispersé. - Ajouter un volume de réactif de matrice de membrane basale et mélangez-le en pipettant également, pour obtenir une suspension de cellules de 2,5 x 107 cellules/ml.
- Garder la suspension cellulaire sur la glace.
-
Préparation des souris
Remarque : Les souris doivent être âgés de six à sept semaines.- Maintenir la souris sous condition exempts d’agents pathogènes spécifique.
- Permettre une période d’acclimatation de trois à cinq jours après que les souris sont arrivés.
- Le jour de l’inoculation, raser le flanc où l’injection sera (voir l’étape 2.3.6).
-
Préparation de l’injection de cellules tumorales
Remarque : Maintenir la suspension de cellules de matrice glacee membrane basale aseptique tout au long de la procédure.- Mélanger les cellules et tracer soigneusement la suspension cellulaire dans une seringue de 1 mL montée avec une aiguille de 21 G.
- S’assurer qu’il n’y a pas de bulles d’air dans la seringue.
- Désinfecter la zone de l’inoculation de la souris avec une solution antiseptique.
- Presser doucement la peau de la souris sur le flanc entre les doigts, au point d’injection.
- Insérez l’aiguille exactement dans le pli de la peau. Ne pas placer l’aiguille dans le tissu afin d’assurer une injection sous-cutanée.
- Injecter 100 µL de la suspension de cellules IMR5 (c.-à-d., 2. 5 x 106 cellules) par voie sous-cutanée dans le flanc inférieur droit des souris.
- Faire pivoter la seringue pour éviter les fuites et retirer l’aiguille.
-
Surveillance des changements de poids corporel et la croissance tumorale
- Mesurer la longueur (A) et la largeur (B) de la tumeur avec un pied à coulisse.
- Calculer le volume de la tumeur à l’aide de la formule (A x B2) x 0,5.
- Démarrer le traitement lorsque les tumeurs ont atteint un volume moyen de ~ 50-60 mm3.
3. les drogues et l’Administration d’anticorps chez la souris
-
Administration intraveineuse de mAb 8B6
- Remplissez soigneusement une seringue de 1 mL montée avec une aiguille 25 G avec solution de mAb.
- Placez votre souris sous une lampe chauffante pendant 10 min à se dilater la veine caudale.
- Immobiliser la souris dans une drisse de rongeur.
- Désinfecter la zone de l’inoculation de la souris avec une solution antiseptique.
- Insérer l’aiguille parallèle à la veine caudale, pénétrant 2 à 4 mm dans la lumière tout en gardant le biseau de la face de l’aiguille vers le haut (Figure 3 a).
- Injecter 100 µL de solution d’anticorps par voie intraveineuse (i.v.).
- Une fois l’injection terminée, doucement la pression au site d’injection pour prévenir les saignements.
-
Administration intrapéritonéale du topotécan
- Dessiner la solution médicamenteuse dans une seringue de 1 mL montée avec une aiguille 25 G.
- Maintenez le pointeur de la souris dans une position en décubitus dorsal, avec son extrémité postérieure légèrement surélevée.
- Désinfecter la zone de l’inoculation de la souris avec une solution antiseptique.
- Localisez la médiane du ventre de la souris et mentalement diviser l’abdomen en quadrants. Localiser le site d’injection dans le quadrant inférieur droit ou gauche (Figure 3 b).
- Introduire l’aiguille dans l’abdomen (5 mm de profondeur) en position ~ 10 °, dans le quadrant inférieur droit ou gauche.
- Injecter 100 µL de solution médicamenteuse par voie intrapéritonéale (i.p.).
- Désinfecter le site de l’inoculation.
Résultats
Les résultats représentatifs et les chiffres sont adaptées avec la permission du plus tôt de le œuvre publiée14.
Anti-OAcGD2 mAb 8B6 synergétique les effets inhibiteurs de topotécan sur la croissance de ligne cellulaire neuroblastome :
Pour établir la drogue et les concentrations d’anticorps à utiliser pour évaluer...
Discussion
Pour prévoir l’effet des interactions médicamenteuses, trois méthodes peuvent être utilisées : la méthodologie d’isobologram17, le mélange non linéaire modèle18et la combinaison de l’index1. L’analyse d’index combinaison est le plus couramment utilisé parce que son application est simplifiée par l’existence d’un programme informatique facile à utiliser. À cette fin, nous avons d’abord caractérisé la réponse dose-effet...
Déclarations de divulgation
S.Fa., J.F. et S.B. sont désignés comme inventeurs de brevets couvrant l’application clinique des anticorps thérapeutiques anti-O-acétyl-GD2.
Remerciements
Accorder un soutien : Fondation de Projet de L 'Université de Nantes, les Bagouz » à Manon, La Ligue contre le Cancer comité de Loire-Atlantique, comité du Morbihan et comité de Vendée, une rose verser S.A.R.A.H, de L'Etoile de Martin et de la Société Française de Lutte contre les Les cancers et les leucémies de l’enfant et de l’adolescent (FSEA). M.B. et J.F. sont pris en charge par La Ligue Contre Le Cancer. Les auteurs remercient l’UTE-installation de la Structure Fédérative de Recherche Bonamy François. Les auteurs remercient également le Dr S. Suzin (Inserm, Paris) pour fournir les cellules IMR5 et Mme H. Estéphan pour son aide technique.
matériels
| Name | Company | Catalog Number | Comments |
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Références
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: "Postoperative validation of bone-anchored implants in the single-sided deafness population." Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Cancer Research. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Cancer Research. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon