É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Potenciação da eficácia de anticorpos anticâncer por fármacos antineoplásicos: deteção de sinergismo de anticorpo-droga usando a equação de índice de combinação
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve como avaliar o sinergismo entre um anticorpo anticâncer e medicamentos antineoplásicos em modelos pré-clínicos, usando a equação de índice de combinação de Chou e Talalay.
Resumo
Potencialização dos hostis antibodies monoclonal (mAb) por agentes quimioterápicos constitui uma estratégia valiosa para a concepção de terapia eficaz e segura contra o câncer. Aqui nós fornecemos um protocolo para identificar uma combinação racional na etapa pré-clínica. Primeiro, nós descrevemos um baseada em célula de ensaio para avaliar o sinergismo entre mAb anticâncer e drogas citotóxicas, que utiliza a equação de índice de combinação de Chou e Talalay1. Isso inclui a medição de tumor celular droga-anticorpo-sensibilidade e usando um ensaio de MTT, seguido por uma análise automatizada de computador para calcular os valores de índice (CI) de combinação. Valores de CI de < 1 indicar sinergismo entre mAbs testado e agentes citotóxicos1. Para corroborar o em vitro achados na vivo, descrevemos mais um método para avaliar a eficácia do regime de combinação em um modelo de tumor de enxerto. Neste modelo, o regime combinado significativamente atrasa o crescimento do tumor, o que resulta em uma significativa sobrevivência prolongada em comparação com controles de único agente. Importante, a experimentação na vivo revela que o regime de combinação é bem tolerado. Este protocolo permite a avaliação eficaz das combinações de drogas anticâncer em modelos pré-clínicos e a identificação de uma combinação racional de avaliar em ensaios clínicos.
Introdução
A abordagem convencional no tratamento de um grande número de diferentes tipos de câncer foi baseada em monoterapia. Mesmo que ainda é usado em muitos casos, este método encontrou vários obstáculos levando a optar por terapias combinadas2. Particularmente, as células cancerosas são mais suscetíveis a desenvolver resistência quando tratados com uma única droga através da indução de sobrevivência alternativa mecanismos3, resultando em falha terapêutica em pacientes4. Além disso, em monoterapia, drogas são administradas geralmente em uma dose alta. Essa situação geralmente resulta da ocorrência de fortes efeitos colaterais de dose-dependente que pode ser intolerável e forçar os médicos a parar o tratamento2. Por estas razões, a associação de moléculas anticâncer é agora preferiu em monoterapia.
Combinações de drogas ideal seriam aqueles que agem em sinergia contra células tumorais, sem maior toxicidade contra células normais. Sinergismo refere-se a interação de duas ou mais drogas que produz um efeito terapêutico maior que a soma de cada fármaco individual agindo separadamente. Tais interações podem resultar em maior eficácia terapêutica clínica2. Isso limita a resistência de tratamento aumenta a eficácia e também pode reduzir a toxicidade2. Na verdade, a dose de cada fármaco pode ser reduzida para diminuir seus efeitos colaterais, orientando caminhos diferentes. Além disso, uma das moléculas também pode servir como um agente de sensibilização contra células cancerosas. O efeito da segunda droga pode ser melhorado em células sensibilizadas e menos dosagens podem ser usado5.
Terapia combinada pode incluir dois ou mais quimioterápicos e/ou produtos biológicos, tais como anticorpos monoclonais6. Esses mAbs voltados especificamente para as células expressando um antígeno de superfície celular de interesse e são capazes de matar células tumorais através de vias imunológicas, incluindo a citotoxicidade mediada por células do anticorpo-dependente (ADCC), com a participação de células imunes efetoras 7e citotoxicidade complemento-dependente (CDC)6. Eles também podem atuar através de um mecanismo não-imunológica mediado por apoptose8,9,10,11. Neste caso, a indução do processo de morte celular programada pode sensibilizar as células cancerosas, enfraquecer sua função e que a droga associada quimioterápico mais eficazes em uma dosagem mais baixa. Como tal, proapoptotic mAb são bons candidatos para a concepção de regimes de combinação com fármacos antineoplásicos.
Diferentes modelos matemáticos têm sido descritos para avaliar sinergismo de drogas; um deles é baseado na combinação índice método1. Este método baseia-se no princípio da mediana-efeito desenvolvido por Chou1. A equação da mediana-efeito correlaciona a dose da droga e o efeito de drogas como segue.
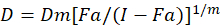
Aqui, D é a dose de drogas; DM é a dose mediana-efeito; FA é a fração que afetaram a dose; m é um expoente que significa a forma do dose-efeito trama1. A dose de mediana-efeito é usada para calcular a dose Dx de uma droga que inibe ou mata "x" por cento das células. O valor de CI é então calculado para avaliar o efeito aditivo da combinação de drogas, da seguinte forma1.
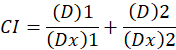
CI o valor 1 indica um efeito aditivo e um valor de CI de < 1 indica um efeito sinérgico, enquanto um valor de CI de > 1 indica o antagonismo1. A aplicação deste método é facilitada pela disponibilidade de um programa de computador, CompuSyn, que determina o sinergismo e antagonismo em todas as doses ou níveis de efeito automaticamente simularam12.
O nosso grupo desenvolveu o mAb 8B6 específico para O-acetil-GD2 gangliosídeos (OAcGD2) neuroblastoma antígeno13 e ainda mais demonstrado que este mAb é capaz de induzir a morte celular com atributos de apoptosis11. Para testar se o mAb 8B6 pode sensibilizar as células de neuroblastoma de Topotecano o agente antineoplásicos, adaptamos o método acima mencionado, desenvolvido por Chou1. Primeiro, vemos a dose efetiva 50 (ED50) valores de mAb 8B6 e Topotecam. Em seguida, as células de neuroblastoma com equipotent rácios dos dois compostos com base nos valores de50 ED são expostas para determinar os valores de CI usando o software de simulação acima mencionados. Este método nos permite demonstrar sinergismo entre mAb 8B6 e Topotecano em vitro. Em seguida, descreveremos um protocolo para avaliar a potência e a segurança desta combinação regime na vivo. Este protocolo pode ser facilmente aplicado para selecionar mAb anticâncer potente e seguro e agente quimioterapêutico combinações em estudos pré-clínicos. Uma representação esquemática deste estudo é fornecida na Figura 1.
Protocolo
Alojamento dos animais e procedimento experimental foram aprovados pelo governo francês (acordos #C44-278 e #APAFIS 03479.01). Procedimentos e cuidados com animais foram conduzidos sob a Directiva UE 2010/63/CE e Lei n ° 2013 #-118 relativa à protecção dos animais utilizados para fins científicos.
1. avaliação da interação de droga entre mAb 8B6 e Topotecano In Vitro
- preparação da amostra de 96 poços
Atenção: Consultar a Comissão de saúde e segurança da instituição e seguir as regras do regulamento local relacionadas a segurança do laboratório. Reveja as informações de Material e a ficha de dados de segurança antes de trabalhar com qualquer mídia, linhas celulares ou reagentes. Utilizar técnica asséptica adequada e trabalho em uma capa de fluxo laminar. Todas as soluções/equipamentos que são usados para manipular as células devem ser estéreis.
Nota: O seguinte protocolo foi projetado para uso com células aderentes. As modificações são necessárias para aplicar o método de células crescendo em suspensão; Este protocolo usa quatro exemplares para cada condição experimental.- Desenvolvem-se células de IMR5 num balão T75.
- No primeiro dia (dia 0), observe a cultura de células sob um microscópio para verificar a confluência de célula. Aspire o meio celular do frasco, lave-o com 5 mL de tampão fosfato salino (PBS) e adicionar 3 mL de 0,05% o ácido etilenodiaminotetracético (EDTA) / solução de PBS. Retorne o frasco para a incubadora por 3 min (37 ° C, 5% CO2).
- Examine a cultura de células sob um microscópio para o destacamento de célula.
Nota: Se necessário, retorne o frasco para a incubadora para um adicional 3 a 5 min, dependendo do tipo de células do tumor. - Adicionar 10 mL de meio de célula completa no balão e transferir a suspensão de células para um tubo cônico estéril 15 mL. Centrifugar as células durante 5 min à 300 x g. Conte as células usando um hemocytometer.
- Remover e descartar o sobrenadante. Resuspenda o pellet de células em um meio completo. Ajuste o volume médio para obter uma concentração final de 1 x 105 células/mL.
- Poços de semente 84 de uma placa de cultura de 96 poços com 104 células cada, que é de 100 µ l de suspensão de células. Siga o layout experimental mostrado na Figura 2.
- Incube as celulas para 18 h na incubadora celular (37 ° C, 5% CO2).
- Preparação da solução medicamentosa
Nota: Para estudos de sensibilização de drogas/mAb, modifica a altura, o comprimento e o tratamento de concentração de acordo com o droga/mAb específico em questão. Observe que a concentração inicial é de 3 x a concentração final.- Na manhã seguinte (dia 1), prepare as seguintes soluções de drogas usando o meio de crescimento completo.
-
preparação de solução do mAb
- Dilua o mAb em 500 µ l do meio de cultura completo para obter uma solução de trabalho de anticorpo com uma concentração de mAb 240 µ g/ml.
- Realize cinco diluições de série duas vezes, como indicado na Figura 2.
-
Preparação de solução de Topotecano
- Diluído, como acima, a droga em 500 µ l do meio de cultura completo para obter uma solução de trabalho de drogas com uma concentração final de 120 nM.
- Realize cinco diluições de série duas vezes, como indicado na Figura 2.
-
Preparação de solução anticorpo e drogas
- Dilua as soluções de drogas e mAb em 500 µ l do meio de cultura completo para obter uma solução em 120 nM droga e mAb 240 µ g/mL (solução de trabalho).
- Realize cinco diluições de série duas vezes, como indicado na Figura 2.
-
preparação de solução do mAb
- Para obter a concentração final, transferi 50 µ l de cada solução de drogas para os poços correspondentes, conforme indicado no layout experimental ( Figura 2).
Nota: Transferi 50 µ l de meio de cultura completo para os poços de célula não tratada, conforme indicado na Figura 2. - Incube as celulas para 72 h na incubadora (37 ° C, 5% CO2).
- Na manhã seguinte (dia 1), prepare as seguintes soluções de drogas usando o meio de crescimento completo.
- Ensaio de MTT
- Adicione 10 µ l de solução de reagente MTT em cada poço.
- Incube a 37 ° C por 4 h.
- Adicione 100 µ l de solução de lise (10% SDS em 0,01 M HCl) em cada poço, usando uma pipeta multicanal e misture bem por pipetagem.
- Incube a 37 ° C por 4 horas em uma câmara umidificada (95% de umidade).
- Ler a absorvância a 570 nm (570) e 620 nm (620), utilizando um espectrofotômetro.
Nota: Misturar cada amostra novamente pipetando antes de ler a absorvância; absorvância a 620 nm permite a correção dos valores de fundo inespecífica. - Calcular a absorbância corrigida: corrigido absorbância = um570- um620.
- Calcular a viabilidade celular da seguinte maneira: viabilidade celular = 100 x (média corrigida absorvância da amostra / controle de média de absorbância corrigida).
- Calcular os valores afetados por fração (Fa) usando a seguinte equação: 1 - (média corrigida absorvância da amostra / controle de média de absorbância corrigida).
- Software de simulação analítica de interação de droga para single e estudos de combinação de drogas
- Execute o software de simulação para abrir a janela de início.
- Clique no botão para abrir a janela principal de Nova experiência .
- Digite o nome do experimento na janela de nome .
Nota: A data pode ser adicionada na janela Data . - Clique no botão Nova droga única .
- Digite o nome na janela Nome completo .
- Digite a abreviatura na janela abrev .
- Digite a unidade de concentração de droga na janela unidades .
- Inserir Dados ponto 1 Dose e valor de Fa, pressione Enter.
- Repita este passo até que todos os pontos de dados são inseridos.
- Clique no botão terminado .
- Siga os mesmos passos para inserir pontos de dados do mAb.
Nota: Use a mesma unidade de concentração como é usado por droga. - Clique no botão Nova combinação de drogas .
- Selecione a droga e mAb.
- Selecione a Relação constante e clique no Okey.
- Digite o nome na janela Nome completo .
- Digite a abreviatura na janela abrev .
- Digite a relação de drogas/mAb na proporção da janela.
- Insira Dados ponto 1 Dose e pressione Enter.
Nota: O programa automaticamente irá calcular as doses de mAb e Combo. - Insira o valor de Dados ponto 1 Fa e pressione Enter.
- Repita este passo até que todos os pontos de dados são inseridos.
- Clique no botão concluído e, em seguida, clique no botão Gerar relatório .
- Selecione a droga e mAb e, clique em Okey.
- Selecione o Combo e, clique em Okey.
- Selecione o cabeçalho, CI tabelae quadro-resumo. Em seguida, clique em Okey.
- Digite o nome do arquivo do arquivo de análise e clique em salvar para gerar o relatório.
Nota: Depois de clicar Okey, o relatório será aberto automaticamente no navegador de web padrão do computador. - Para imprimir o relatório, escolha Imprimir no menu arquivo do navegador da web. O relatório contém uma seção de tabela de resumo que inclui título, data, nome do arquivo, nota de descrição, parâmetros (m, Dm e r), ED50 para qualquer agente usado em monoterapia ou em combinação e a tabela de CI para cada combinação de ED50, ED 75, ED90e ED95.
Nota: Um CI valor de < 1 indica sinergismo, um valor de CI de = 1 indica a aditividade e um valor de CI de > 1 indica o antagonismo.
2. geração de Xenografts humanos Neuroblastoma em obesos diabéticos NOD Gamma Scid Mice (NSG ratos)
Nota: Exclui qualquer contaminação da cultura de pilha. Desde que a matriz da membrana basal forma um gel acima de 5 ° C, todos os cultureware ou entrar em contato com o reagente de matriz de membrana basal de mídia deve ser prechilled/gelo-frio. Manter a matriz da membrana basal no gelo durante todo o processo.
-
Preparação da suspensão de células de IMR5
- Descongele o reagente de matriz de membrana basal durante a noite, submergindo o frasco no gelo em um frigorífico de 4 ° C antes do uso.
- No dia 0, colha as IMR5 pilhas cultivadas como detalhado acima.
- Transferi as células para um tubo cônico de 15 mL e centrifugar x g por 5 min.
- Desprezar o sobrenadante. Lavar as células 2 x com 15 mL de PBS gelado e preparar uma suspensão de células de 5 x 107 células/mL de PBS gelado.
Nota: Se necessário, transferi a suspensão de células para um tubo de microcentrifugadora de 1,5 mL. - Agite o frasco de matriz de membrana basal.
Nota: O reagente de matriz de membrana basal deve ser descongelado e dispersos. - Adicionar um volume de reagente de matriz da membrana basal e misture pipetando para obter uma suspensão de células de 2.5 x 107 células /mL.
- Manter a suspensão de células no gelo.
-
Preparação dos ratos
Nota: Os ratos devem ser seis ou sete semanas de idade.- Manter os ratos sob uma condição específica de agentes patogénicos.
- Permita um período de aclimatação de três a cinco dias depois chegaram os ratos.
- No dia da inoculação, raspar o flanco onde será a injeção (consulte a etapa 2.3.6).
-
Preparação da injeção de células de tumor
Nota: Manter a suspensão de células de matriz gelada da membrana basal asséptica durante o procedimento.- Misture as células e cuidadosamente desenhar a suspensão de células em uma seringa de 1 mL, montada com uma agulha 21G.
- Verifique se que não há nenhuma bolha de ar na seringa.
- Desinfete a área de inoculação do mouse com uma solução anti-séptica.
- Aperte suavemente a pele do rato no flanco entre os dedos, no local da injeção.
- Insira a agulha exatamente a dobra de pele. Não coloque a agulha profundamente no tecido para garantir uma injeção subcutânea.
- Injete 100 µ l de suspensão de células IMR5 (ou seja, 2,5 x 106 células) por via subcutânea no flanco direito inferior dos ratos.
- Gire a seringa para evitar fugas e retirar a agulha.
-
Monitoramento de alterações de peso do corpo e o crescimento do tumor
- Medir o comprimento (A) e a largura (B) do tumor com uma pinça.
- Calcule o volume do tumor usando a fórmula (A x B2) x 0,5.
- Inicie a terapia quando os tumores têm alcançado um volume médio de ~ 50-60 mm3.
3. drogas e administração de anticorpos em ratos
-
Administração intravenosa de mAb 8B6
- Com cuidado, encha uma seringa de 1 mL, montada com uma agulha 25g com solução do mAb.
- Coloque o mouse sob uma lâmpada de calor por 10 min dilatar a veia da cauda.
- Contenha o mouse em uma retenção de roedor.
- Desinfete a área de inoculação do mouse com uma solução anti-séptica.
- Insira a agulha paralelamente a veia da cauda, penetrante 2-4 mm para o lúmen, mantendo o bisel da face de agulha para cima (Figura 3A).
- Injetar 100 µ l de solução de anticorpos por via intravenosa (i.v.).
- Terminada a injeção, suavemente, pressão no local da injeção para prevenir hemorragias.
-
Administração intraperitoneal de Topotecano
- Desenhe a solução de drogas em uma seringa de 1 mL, montada com uma agulha de 25 G.
- Segure o mouse na posição supina, com a extremidade posterior ligeiramente elevada.
- Desinfete a área de inoculação do mouse com uma solução anti-séptica.
- Localize a linha mediana de abdômen do rato e mentalmente, dividir o abdome em quadrantes. Localize o local da injeção no quadrante inferior direito ou esquerdo (Figura 3B).
- Insira a agulha no abdômen (5 mm de profundidade) em ângulo de ~ 10°, no quadrante inferior direito ou esquerdo.
- Injetar 100 µ l de solução de fármaco intraperitonealmente (i.p.).
- Desinfecte o local da inoculação.
Resultados
Os resultados representativos e figuras são adaptadas com a permissão de trabalho anteriormente publicado14.
Anti-OAcGD2 mAb 8B6 sinergicamente aumenta os efeitos inibitórios de Topotecano no crescimento de linha de células de Neuroblastoma:
Para estabelecer a droga e as concentrações de anticorpos deve ser usado para aval...
Discussão
Para prever o efeito de interações medicamentosas, podem ser usados três métodos: a metodologia de isobologram17, a mistura não-linear modelo18e a combinação do índice1. Análise do índice de combinação é o mais comumente usado porque sua aplicação é simplificada pela disponibilidade de um programa de computador user-friendly. Para esta finalidade, nós primeiro caracteriza a resposta de dose-efeito de cada agente usado sozinho ou em c...
Divulgações
S.Fa., J.F. e S.B. são designados como inventores do pendente patentes cobrindo a aplicação clínica de anticorpos terapêuticos anti-O-acetil-GD2.
Agradecimentos
Conceder apoio: Fondation de Projet de L 'Université de Nantes, les Bagouz' à Manon, Ligue La contre le Cancer Comitê de Loire-Atlantique, comité du Morbihan e Comitê de Vendée, une rosa pour S.A.R.A.H., L'Etoile de Martin e la Société Française de Lutte contre les Cânceres et les leucémies de L'enfant et de L'adolescent (SFCE). M.B. e J.F. são suportados pela La Liga Contre Le Cancer. Os autores graças a UTE-facilidade da estrutura Fédérative de Recherche François Bonamy. Os autores também agradecer o Dr. S. Suzin (Inserm, Paris) para fornecer as células IMR5 e a Sra. H. Estéphan para a assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referências
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: "Postoperative validation of bone-anchored implants in the single-sided deafness population." Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Cancer Research. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Cancer Research. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados