Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Потенцирование эффективности противоопухолевой антитела, противоопухолевые препараты: обнаружение антител наркотиков синергизм с помощью комбинации индекс уравнения
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает как оценивать синергизм между противоопухолевой антитела и противоопухолевые препараты в доклинических моделях, используя сочетание индекс уравнение Чжоу и Талалай.
Аннотация
Потенцирование враждебных моноклональных антител (МАБ), химиотерапевтические агенты представляет собой ценный стратегию для разработки эффективных и безопасных терапия против рака. Здесь мы предоставляем протокол для выявления рациональное сочетание на доклинических шаг. Во-первых мы расскажем на основе ячеек пробирного оценивать синергизм между противоопухолевой МАБ и цитостатическими препаратами, который использует сочетание индекс уравнение Чу и Талалай1. Это включает в себя измерение из опухолевых клеток наркотиков - и антитела чувствительность с помощью MTT assay, следуют анализ автоматизированной компьютерной для вычисления значения индекса (CI) сочетание. CI значений < 1 указывают синергизм между протестированных mAbs и цитотоксических агентов1. Для подтверждения в vitro выводы в естественных условиях, мы далее описания метода оценить эффективность режима комбинации в модели ксенотрансплантата опухоли. В этой модели комбинированные препараты значительно задерживает рост опухоли, что приводит к значительным расширенной выживания по сравнению с одного агента управления. Важно отметить, что эксперименты в естественных условиях показывает, что сочетание режим хорошо переносится. Этот протокол позволяет эффективной оценки комбинации противоопухолевых препаратов в доклинических моделях и выявление рациональное сочетание для оценки в клинических испытаниях.
Введение
Обычный подход в лечении большого числа различных типов рака была основана на монотерапии. Даже если он по-прежнему используется во многих случаях, этот метод встретились несколько препятствий, ведущих к выбирают для комбинированной терапии-2. В частности раковые клетки более чувствительны к развивать устойчивость при обработке одного препарата, вызывая альтернативных выживания механизмы3, что приводит к терапевтической неудачи в больных4. Кроме того в монотерапии, препараты обычно управляются в высокой дозе. Эта ситуация часто приводит к возникновению сильного дозозависимый побочных эффектов, которые могут быть нетерпимым и силы врачей, чтобы остановить лечение2. По этим причинам, Ассоциация противораковые молекул является теперь предпочитают монотерапия.
Идеальные наркотики комбинации будут те, которые действуют в синергии против опухолевых клеток, без увеличения токсичности против нормальных клеток. Синергизм относится к взаимодействию двух или более препаратов, что терапевтический эффект больше, чем сумма каждого индивидуального наркотиков, действуя отдельно. Такое взаимодействие может привести к расширенной клинических терапевтическую эффективность2. Это ограничивает лечение сопротивления, увеличивает эффективность и может также уменьшить токсичность2. В самом деле дозировка каждого препарата может уменьшиться до снижения их побочные эффекты по ориентации различных путей. Кроме того один из молекул может также служить информирования агент против раковых клеток. Действие второго препарата может быть повышена на сенсибилизированных клеток и меньше дозах может быть использоваться5.
Комбинированная терапия может включать два или более химиотерапевтических препаратов и/или биопрепаратов, например моноклональные антитела6. Эти mAbs конкретно клетки, выражая клеток поверхностного антигена интереса и способны убить опухолевые клетки иммунологической путями, включая клеточный цитотоксичности антител зависимые (ADCC), с участием иммунных эффекторных клеток 7и дополнения зависимой цитотоксичности (CDC)6. Они также могут действовать через механизм-иммунологические, посредничестве апоптоз8,9,10,11. В этом случае индукции процесс запрограммированной смерти клетки могут информирования раковые клетки, ослабляют их функции и сделать более эффективным связанные химикотерапевтическое лекарство в нижней дозировке. Таким образом МАБ проапоптотических являются хорошими кандидатами для проектирования схемы комбинации с противоопухолевые препараты.
Были описаны различные математические модели для оценки синергизма наркотиков; один из них основан на комбинации индекс метод1. Этот метод основан на принципе медиана эффект, разработанная Чжоу1. Медиана эффект уравнение коррелирует дозу препарата и наркотический эффект следующим образом.
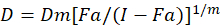
D здесь, доза препарата; DM -медиана эффекта доза; Фа — часть пострадавших от дозы; m является экспонента, что означает форму доза эффект участок1. Медиана эффекта дозу используется для расчета дозы Dx препарат, который подавляет или убивает «x» % клеток. Значение CI затем вычисляется для оценки аддитивный эффект препарата комбинации, следующим1.
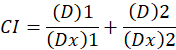
Значение CI 1 указывает аддитивный эффект и CI значение < 1 указывает синергетический эффект, в то время как значение CI > 1 указывает антагонизм1. Применение этого метода также способствует наличие компьютерной программы, CompuSyn, который определяет синергизм и антагонизм при всех дозах или уровни воздействия имитируемых автоматически12.
Наша группа разработала конкретные 8B6 МАБ для O-ацетил GD2 Ганглиозиды (OAcGD2) нейробластома антигена13 и далее показал, что этот МАБ способны вызвать смерть клетки с атрибутами апоптоз11. Чтобы проверить ли МАБ 8B6 может информировать нейробластома клетки Топотекан противоопухолевого агента, мы адаптировали вышеупомянутый метод, разработанный Чжоу1. Во-первых мы определить значения эффективной дозы 50 (50Эд) МАБ 8B6 и Топотекан. Далее нейробластома клетки с равномощного соотношением двух соединений, основанной на ценностях50 Эд подвергаются для определения CI значений с помощью вышеупомянутых моделирования программного обеспечения. Этот метод позволяет нам продемонстрировать синергизм между 8B6 и Топотекан МАБ в пробирке. Далее мы опишем протокол для дальнейшей оценки потенции и безопасность этой комбинации режим в естественных условиях. Этот протокол может легко применяться для выбора комбинации химиотерапевтического агента и мощным и безопасным противораковые МАБ в доклинических исследованиях. Схематическое представление этого исследования приводится на рисунке 1.
протокол
Животных и экспериментальной процедуры были утверждены правительством Франции (соглашений #C44-278 и #APAFIS 03479.01). Уход за животными и процедуры были проведены согласно директиве ЕС 2010/63/ЕС и французский закон #2013-118 по защите животных, используемых для научных целей.
1. Оценка наркотиков взаимодействие между 8B6 МАБ и Топотекан In Vitro
- 96-луночных пробоподготовки
Предупреждение: Консультации Комитета института охраны здоровья и безопасности и следовать правилам местные правила, связанные с безопасностью лаборатории. Просмотрите сведения о материала и лист данным по безопасности перед началом работы с СМИ, клеточных линий или реагенты. Используя стерильную методику и работать в Ламинарный шкаф. Все решения/оборудование, которые используются для манипулирования клетки должны быть стерильными.
Примечание: Следующий протокол был разработан для использования с адэрентных клеток. Изменения требуется применить этот метод к nonadherent клеткам, растущих в подвески; Этот протокол использует составленном для каждого экспериментальные условия.- Растут IMR5 клетки в колбе T75.
- В первый день (день 0) соблюдайте культуру клеток под микроскопом, чтобы проверить confluency клеток. Аспирационная средой клеток из колбы, промойте его с 5 мл физиологического раствора фосфатного буфера (PBS) и добавить 3 мл 0,05% Этилендиаминтетрауксусная кислота (ЭДТА) / PBS решения. Возвращение колбу в инкубатор для 3 мин (37 ° C, 5% CO2).
- Изучение культуры клеток под микроскопом для ячейки отряда.
Примечание: В случае необходимости, вернуть настой инкубатора для дополнительных 3-5 мин, в зависимости от типа клеток опухоли. - Добавить 10 мл среднего полного клеток в колбу и передать стерильные 15 мл конические суспензию клеток. Центрифуга клетки для 5 мин на 300 x g. Подсчет количества ячеек с помощью Горяева.
- Снимите и выбросьте супернатант. Ресуспензируйте Пелле клеток в полный рост среднего. Средняя громкость для получения конечной концентрации 1 х 105 клеток/мл.
- Уэллс семян 84 96-луночных культуры плиты с 104 ячейки, которая является 100 мкл суспензии клеток. Следуйте экспериментальной макета показан на рисунке 2.
- Инкубируйте клетки для 18 h в инкубаторе клеток (37 ° C, 5% CO2).
- Подготовка раствора препарата
Примечание: Для исследования наркотиков/МАБ сенсибилизации, изменения сроков, продолжительности и лечения концентрация для удовлетворения конкретных наркотиков/МАБ в вопросе. Обратите внимание, что начальной концентрации 3 x конечной концентрации.- На следующее утро (день 1), подготовить следующие решения наркотиков, используя полный рост среднего.
-
МАБ приготовления раствора
- Разбавьте МАБ в 500 мкл полный рост средних для получения антител рабочего раствора с концентрацией МАБ по 240 мкг/мл.
- Выполните пять серийных разведений два раза, как указано на рисунке 2.
-
Топотекан приготовления раствора
- Разбавить, как выше, препарата в 500 мкл полный рост средних для получения рабочего раствора препарата с конечной концентрации 120 Нм.
- Выполните пять серийных разведений два раза, как указано на рисунке 2.
-
Антитела и наркотиков приготовления раствора
- Развести препарат и МАБ решения в 500 мкл полный рост средних и получить решение в 120 Нм наркотиков и МАБ 240 мкг/мл (рабочий раствор).
- Выполните пять серийных разведений два раза, как указано на рисунке 2.
-
МАБ приготовления раствора
- Приехать в конечной концентрации, передачи 50 мкл раствора каждого препарата в соответствующие ячейки, как указано в экспериментальной макет ( рис. 2).
Примечание: Передачи 50 мкл среднего полного роста в необработанной ячейки скважины, как указано на рисунке 2. - Инкубируйте клетки для 72 h в инкубатор (37 ° C, 5% CO2).
- На следующее утро (день 1), подготовить следующие решения наркотиков, используя полный рост среднего.
- MTT пробирного
- Добавьте 10 мкл раствора реагента МТТ в каждой скважине.
- Инкубируйте при 37 ° C в течение 4 ч.
- Добавить 100 мкл раствора (10% SDS в 0,01 М HCl) лизиса в каждой скважине, используя многоканальные пипетки и тщательно перемешать, закупорить.
- Инкубируйте при 37 ° C для 4 h в камере увлажненные (95% влажность).
- Читайте поглощения в 570 Нм (570) и 620 Нм (620) с помощью спектрофотометра.
Примечание: Mix каждый образец снова закупорить перед чтением поглощения; поглощения в 620 Нм позволяет коррекции неспецифических фоновых значений. - Рассчитать исправленные поглощения: исправлены поглощения =570-620.
- Рассчитать следующим образом жизнеспособность клеток: клетки жизнеспособность = 100 x (образец означает исправленный поглощения / управления означает исправленный поглощения).
- Рассчитать часть пострадавших значения (ФА), используя следующее уравнение: 1 - (образец означает исправленный поглощения / управления означает исправленный поглощения).
- Наркотиков взаимодействия аналитического моделирования программного обеспечения для сингла и наркотиков сочетание исследования
- Запустите программное обеспечение моделирования, чтобы открыть окно начать.
- Нажмите на кнопку Новый эксперимент , чтобы открыть главное окно.
- В окне имя введите имя эксперимента.
Примечание: Может быть добавлено в окне даты . - Нажмите на кнопку Новый одного препарата .
- Введите имя в поле Полное имя .
- Введите сокращение в окне Abbrev .
- Введите единица концентрации препарата в окне единицы .
- Введите Данные точки 1 доза и Fa значение, нажмите клавишу Enter.
- Повторите этот шаг для всех точек данных вводятся.
- Нажмите на кнопку Готово .
- Выполните те же шаги для ввода точки данных МАБ.
Примечание: Используйте тот же блок концентрации как используется наркотиков. - Нажмите на кнопку Новый препарат комбо .
- Выбор препарата и МАБ.
- Постоянный коэффициент и нажать на кнопку ОК.
- Введите имя в поле Полное имя .
- Введите сокращение в окне Abbrev .
- Введите коэффициент наркотиков/МАБ в окне отношение .
- Введите Данные точки 1 доза и нажмите Enter.
Примечание: Программа будет автоматически вычислять дозы МАБ и комбо. - Введите значение Данных точки 1 фа и нажмите клавишу Enter.
- Повторите этот шаг для всех точек данных вводятся.
- Нажмите на кнопку Готово , а затем нажмите на кнопку Создать отчет .
- Выберите наркотиков и МАБ и затем нажмите кнопку ОК.
- Выберите комбо и затем нажмите кнопку ОК.
- Выберите заголовок, CI таблицаи Сводная таблица. Затем нажмите кнопку ОК.
- Введите имя файла, анализ файла и нажмите кнопку сохранить для создания отчета.
Примечание: После нажатия кнопки OK, отчет автоматически откроется в веб-браузере на компьютере по умолчанию. - Чтобы напечатать отчет, выберите Печать из меню файл веб-браузера. В докладе содержится резюме раздел таблицы, которая включает в себя название, Дата, имя файла, к сведению описание, параметры (m, Dm и r), Эд50 для агента либо в монотерапии или в комбинации и в таблице CI для каждой комбинации Эд50, Эд 75, Эд90и95Эд.
Примечание: CI значение < 1 указывает синергизм, значение CI = 1 указывает аддитивности и значение CI > 1 означает антагонизм.
2. поколение человеческой нейробластомы ксенотрасплантатов Nonobese Диабетическая NOD Scid гамма мышей (ГЯП мышей)
Примечание: Исключите любое загрязнение клеточной культуры. Поскольку матрица базальной мембраны образует гель выше 5 ° C, все cultureware или СМИ, контактирующих базальной мембраны матрица Реагент должен быть prechilled /-ледяной. Держите базальной мембраны матрицы на льду во время всего процесса.
-
Приготовление суспензии клеток IMR5
- Оттепель на ночь реагент матрица базальной мембраны, погрузив флакона в лед в холодильнике 4 ° C перед использованием.
- В день 0 урожай культивировали IMR5 клетки как описано выше.
- Передать клетки 15 мл Конические трубки и центрифуги на 300 x g за 5 мин.
- Выбросите супернатант. Вымыть клетки 2 x 15 мл ледяной PBS и готовят суспензию клеток 5 x 107 клеток/мл в ледяной PBS.
Примечание: При необходимости, передавать суспензию клеток пробки microcentrifuge 1,5 мл. - Вихрем флакона матрица базальной мембраны.
Примечание: Реагент матрица базальной мембраны следует разморозить и разошлись. - Добавить один объем реагента матрица базальной мембраны и смешайте его закупорить для получения суспензии клеток 2,5 x 107 клеток/мл.
- Держите суспензию клеток на льду.
-
Подготовка мышей
Примечание: Мышей должно быть шесть-семь недель.- Сохранить мыши под условие конкретного возбудителя бесплатно.
- Разрешить период акклиматизации три - пять дней после того, как прибыли мышей.
- В день прививки, брить фланге, где будет инъекции (см. шаг 2.3.6).
-
Подготовка инъекции клеток опухоли
Примечание: Держите суспензию клеток матрицы ледяной базальной мембраны асептики во всей процедуре.- Сочетание клетки и аккуратно нарисуйте суспензию клеток в 1 мл шприц с иглой 21 G.
- Проверьте, чтобы убедиться, что есть нет пузырьков воздуха в шприц.
- Лечить области прививка мыши с антисептическим раствором.
- Осторожно выжмите мыши кожи на фланге между пальцами, в месте инъекции.
- Вставьте иглу точно в складке кожи. Не устанавливайте иглы глубоко в ткани, чтобы обеспечить подкожных инъекций.
- Inject 100 мкл суспензии клеток IMR5 (т.е., 2,5 х 106 клеток), подкожно в нижнем правом фланге мышей.
- Вращайте для предотвращения утечки и снять иглу шприца.
-
Мониторинг изменения веса тела и роста опухоли
- Измерьте длину (A) и (B) Ширина опухоли с суппортом.
- Рассчитайте объем опухоли, по формуле (A x B2) x 0.5.
- Начало терапии при опухоли достигли средний объем3~ 50-60 мм.
3. наркотиков и администрации антитела у мышей
-
Внутривенное МАБ 8B6
- Внимательно заполните 1 мл шприц, монтируется с 25 G иглой с МАБ решения.
- Поместите курсор мыши под лампой тепла за 10 мин до расширяются вены хвост.
- Останови мыши в грызунов фиксатор.
- Лечить области прививка мыши с антисептическим раствором.
- Вставьте иглу параллельно хвост вен, проникая 2-4 мм в просвет при сохранении скос иглы лицом вверх (рис. 3A).
- Придать 100 мкл антител раствора внутривенно (и.в.).
- По завершении инъекции нежно давление инъекции для предотвращения кровотечения.
-
Внутрибрюшинное администрация топотекан
- Нарисуйте раствор препарата в 1 мл шприц, монтируется с помощью иглы, 25 G.
- Удерживайте кнопку мыши в лежачем положении, с ее задний конец слегка повышен.
- Лечить области прививка мыши с антисептическим раствором.
- Найдите средней линии живота мыши и мысленно разделить квадрантов брюшной полости. Найдите место инъекции в правом или левом нижнем квадранте (рис. 3B).
- Вставьте иглу в брюшную полость (5 мм в глубину) на ~ 10° угол, в правом или левом нижнем квадранте.
- Придать внутрибрюшинно 100 мкл раствора препарата (и.п.).
- Лечить сайт прививка.
Результаты
Представитель результаты и показатели приспособлены с разрешения из ранее опубликованных работ14.
Анти-OAcGD2 МАБ 8B6 синергически повышает ингибирующее воздействие Топотекан на нейробластома рост клеток линии:
Обсуждение
Для прогнозирования эффекта лекарственных взаимодействий, могут использоваться три метода: методология isobologram17, модель нелинейной смесь18и сочетание индекса1. Сочетание индекс анализ наиболее часто используется потому, что его применение являет?...
Раскрытие информации
S.Fa., J.F. и с.б. обозначаются как изобретатели ожидании патентов, охватывающих клиническое применение терапевтических антител анти O-ацетил GD2.
Благодарности
Предоставить поддержку: Фондасьон де Projet де L 'Université de Nantes, les Bagouz» меню Манон, Кубка французской лиги против le рак comité de Loire-Atlantique, Комитет дю Morbihan и Комитет де Вандея, une Роза залить S.A.R.A.H, Мартин де л ' Этуаль и la Société Française de Lutte contre les Раки et les leucémies de L'Enfant et de просвещение (SFCE). М.б. и J.F. поддерживаются Ла Лига Contre Le рака. Авторы благодарят ют объекта структуры Fédérative де Recherche Bonamy Франсуа. Авторы также поблагодарить д-р S. Сузин (Inserm, Париж) для обеспечения IMR5 клеток и г-жа H. Estéphan за ее технической помощи.
Материалы
| Name | Company | Catalog Number | Comments |
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Ссылки
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: "Postoperative validation of bone-anchored implants in the single-sided deafness population." Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Cancer Research. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Cancer Research. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены