Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Antikanser antikor etkinliğinin Antineoplastic uyuşturucu tarafından kullanılmasının muhtemelen: antikor-uyuşturucu Synergism kombinasyon Dizin denklem kullanılarak tespiti
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu iletişim kuralı, antikanser bir antikor ve antineoplastic ilaçlar içinde Preklinik modelleri arasında synergism Chou ve Talalay birlikte Dizin denklemi kullanarak değerlendirmek açıklar.
Özet
Düşman monoklonal antikor (mAb) kemoterapötik ajanlar tarafından kullanılmasının muhtemelen kansere karşı etkili ve daha güvenli tedavi tasarlamak için değerli bir strateji kabul ettiğiniz anlamına gelir. Burada preklinik adım da rasyonel bir arada tanımlamak için bir protokol sağlar. İlk olarak, Chou ve Talalay1kombinasyonu Dizin denklemi kullanır synergism antikanser mAb ve sitotoksik ilaçlar arasında değerlendirmek için bir hücre tabanlı tahlil açıklar. Bu ölçüm, tümör hücre uyuşturucu ve antikor-kombinasyon dizin (CI) değerlerini hesaplamak için bir otomatik bilgisayar Analizi tarafından takip bir ÇMT tahlil kullanarak duyarlılığı içerir. CI değerlerini < 1 belirtmek synergism test mAbs ve sitotoksik ajanlar1arasında. Vitro bulgular vivoteyit için daha fazla kombinasyon rejimi etkinliğini xenograft tümör modelindeki değerlendirmek için bir yöntem açıklar. Bu modelde, kombine rejimi önemli ölçüde önemli bir genişletilmiş hayatta kalma tek ajan denetimleri ile karşılaştırıldığında sonuç tümör büyüme geciktirir. Önemlisi, in vivo deneyler kombinasyon rejimi iyi tolere edilir ortaya koymaktadır. Bu iletişim kuralı preklinik modelleri kombinasyonlarda antikanser ilaç etkili değerlendirilmesi ve klinik deneylere değerlendirmek için rasyonel birleşimini tanımlaması sağlar.
Giriş
Çok sayıda farklı kanser tedavisinde geleneksel yaklaşım üzerinde tedavinin dayanıyordu. Hala birçok durumda kullanılır olsa bile, bu yöntem kombine tedaviler2için gözle ilgili için önde gelen çeşitli engeller tanıştım. Özellikle, kanser hücrelerinin alternatif hayatta kalma mekanizmaları3hastalar4terapötik başarısızlıkla sonuçlanan, inducing tarafından tek bir ilaç ile tedavi ederken direnç geliştirmek daha yatkındır. Ayrıca, tedavinin içinde uyuşturucu genellikle yüksek bir doz idare. Bu durum genellikle dayanılmaz ve doktorlar tedavi2durdurmak için kuvvet güçlü doz bağımlı yan etkileri oluşumu içinde sonuçlanır. Bu nedenlerden dolayı antikanser molekülleri şimdi birliğidir tedavinin için tercih etti.
İdeal uyuşturucu kombinasyonları Bu sinerji tümör hücreleri, normal hücrelere karşı artan toksisite olmadan karşı hareket olacaktır. Synergism tedavi edici etkiye ayrı ayrı hareket her bireysel uyuşturucu toplamından daha büyük üreten iki veya daha fazla ilaç etkileşimi gösterir. Bu tür etkileşimler geliştirilmiş klinik tedavi etkinliğinin2' de neden olabilir. Tedavi direnci sınırlar, etkinliğini artırır ve ayrıca toksisite2azaltabilir. Aslında, her ilaç dozu farklı yollar hedefleyerek yan etkileri azaltmak için azaltılabilir. Buna ek olarak, bir moleküller de kanser hücrelerinin karşı duyarlılığı bir ajan olarak hizmet edebilir. İkinci ilacın etkisi duyarlilasmis hücreleri üzerinde gelişmiş ve daha az dozlarda kullanılan5olabilir.
Kombine tedavi iki veya daha fazla kemoterapötik ilaçlar ve/veya monoklonal antikorlar6gibi destekte içerebilir. Bu mAbs özellikle faiz ve immünolojik yollar dahil antikor bağımlı sitotoksisite (CCDA), hücre-aracılı ile tümör hücreleri öldürmek mümkün olan bir hücre yüzey antijeni ifade hücreleri hedef hücreleri bağışıklık efektör katılımı ile 7ve tamamlayıcı bağımlı sitotoksisite (CDC)6. Onlar da üzerinden apoptosis8,9,10,11tarafından aracılı immünolojik olmayan bir mekanizma hareket edebilir. Bu durumda, indüksiyon işleminin programlı hücre ölümü kanser hücrelerinin duyarlı, işlevlerine zayıflatmak ve ilişkili kemoterapötik ilaç daha düşük bir doz daha verimli hale getirmek. Bu nedenle, proapoptotic mAb kombinasyonu rejimlerinin antineoplastic ilaçlarla tasarlamak için iyi adaylar bulunmaktadır.
Uyuşturucu synergism değerlendirmek için farklı matematiksel modeller tarif var; Bunlardan biri üzerinde birlikte Dizin Yöntem1temel alır. Bu yöntem Chou1tarafından geliştirilen medyan-etkisi ilkesine dayanır. Medyan-etkisi denklem uyuşturucu doz ve uyuşturucu etkisi aşağıdaki gibi karşılıklı olarak ilişkilendirir.
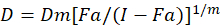
D ilaç doz işte; DM medyan-etkisi doz ise; SK doz tarafından etkilenen kesir olduğunu; m 1doz-etki arsa şeklini belirten bir üstür. Medyan-etkisi doz doz Dx engeller ya da "x" yüzde hücre öldürür bir ilacın hesaplamak için kullanılır. CI değer o zaman1aşağıdaki gibi uyuşturucu kombinasyon katkı etkisini değerlendirmek için hesaplanır.
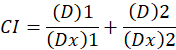
Bir katkı etkisi ve CI değeri 1 CI değeri gösterir < 1 CI değeri ise bir sinerjik etkisi gösterir > 1 husumet1gösterir. Bu yöntemin uygulama daha fazla bir bilgisayar programı, CompuSyn, synergism ve düşmanlık tüm dozda belirleyen kullanılabilirliğini tarafından yönetilir veya etkisi düzeylerini otomatik olarak12simüle.
Bizim grup mAb 8B6 özel O-asetil-GD2 gangliosid (OAcGD2) Nöroblastom antijen13 için geliştirilmiş ve daha fazla bu mAb hücre ölümü apoptozis11özniteliklerle ikna etmek mümkün olduğunu gösterdi. MAb 8B6 antineoplastic Ajan topotecan hücrelere Nöroblastom duyarlı olup olmadığını sınamak için yukarıda belirtilen yöntem Chou1tarafından geliştirilen uyarlanmış. İlk olarak, mAb 8B6 ve topotecan etkili doz 50 (ED50) değerlerini belirleriz. Daha sonra equipotent oranları ED50 değerlere göre iki bileşiklerin Nöroblastom hücrelerle yukarıda belirtilen simülasyon yazılımı kullanarak CI değerlerini belirlemek için sunulur. Bu yöntem synergism mAb 8B6 ve topotecan içinde vitroarasında göstermek için bize izin verir. Sonra biz daha fazla etki gücüne ve bu kombinasyon rejimi içinde vivogüvenliğini değerlendirmek için bir protokol tanımlamak. Bu iletişim kuralı, güçlü ve güvenli antikanser mAb ve kemoterapötik ajan kombinasyonuna preklinik çalışmalarda seçmek için kolayca uygulanabilir. Bu çalışmada şematik gösterimi Şekil 1' de verilmiştir.
Protokol
Hayvan barınma ve deneysel bir işlem (anlaşmaları #C44-278 ve #APAFIS 03479.01) Fransız hükümeti tarafından kabul edildi. Hayvan bakımı ve yordamlar yönergesi AB 2010/63/AB ve Fransız hukuku altında #2013-118 bilimsel amaçlarla kullanılan hayvanların korunması üzerinde gerçekleştirilmiştir.
1. ilaç etkileşimi arasında mAb 8B6 ve Topotecan In Vitro değerlendirilmesi
- 96-şey numune hazırlama
Dikkat: kurumun sağlık ve Güvenlik Komitesi danışmak ve laboratuvar emniyetle ilgili yerel yönetmelik kurallara uyun. Herhangi bir ortam, hücre hatları veya reaktifleri ile çalışmaya başlamadan önce malzeme ve güvenlik bilgi formu bilgileri gözden geçirin. Laminar akış mahallede iş ve uygun steril tekniği kullanabilirsiniz. Hücreleri işlemek için kullanılan tüm çözümleri/ekipman steril olmalıdır.
Not: Aşağıdaki protokol yapışık hücreleri kullanılmak üzere tasarlanmıştır. Değişiklik nonadherent hücre süspansiyon büyüyen yöntemi uygulamak için gerekli; Bu protokol quadruplicate deneysel her koşul için kullanır.- Bir T75 şişesi IMR5 hücreleri büyümek.
- İlk gün (gün 0), hücre confluency kontrol etmek için mikroskop altında hücre kültürü gözlemlemek. Şişeye hücre ortamından Aspire edin, fosfat tamponlu tuz çözeltisi (PBS) 5 mL ile yıkayın ve 3 mL %0,05 ethylenediaminetetraacetic asit (EDTA) eklemek / PBS çözüm. Şişeye kuluçka makinesi 3 dk (37 ° C, % 5 CO2) için geri dönün.
- Hücre kültürü hücre dekolmanı için mikroskop altında incelemek.
Not: gerekirse, tümör hücre türüne bağlı olarak ek bir 3-5 dk da kuluçka şişeye dönün. - Tam hücre orta 10 mL şişe için ekleyin ve hücre süspansiyon steril 15 mL konik tüp aktarın. Hücreler için 300 x gde 5 dk santrifüj kapasitesi. Bir hemasitometre kullanarak hücreleri saymak.
- Kaldırmak ve süpernatant atın. Hücre Pelet tam büyüme aracı olarak resuspend. 1 x 105 hücre/mL nihai bir konsantrasyon elde etmek için orta ses düzeyini ayarlayın.
- Hücre süspansiyon, 100 µL olan bir 96-şey kültür plaka 104 hücreleri her, ile tohum 84 kuyu. Şekil 2' de gösterilen deneysel düzen izleyin.
- Hücreleri hücre kuluçka (37 ° C, % 5 CO2) 18 h için kuluçkaya.
- Uyuşturucu eriyik hazırlığı
Not: uyuşturucu/mAb Sensitizasyonu çalışmaları için zamanlama, uzunluğu ve belirli uyuşturucu/mAb söz konusu uyacak şekilde konsantrasyon tedavi değiştirin. İlk toplama 3 x son konsantrasyonu olduğunu unutmayın.- Ertesi sabah (1. gün) tam büyüme orta kullanarak aşağıdaki uyuşturucu çözümleri hazırlayın.
-
mAb eriyik hazırlığı
- 240 µg/mL mAb konsantrasyon ile bir antikor çalışma çözümü elde etmek için tam büyüme ortamının 500 µL mAb sulandırmak.
- Beş iki kat seri dilutions Şekil 2' de gösterildiği gibi gerçekleştirin.
-
Topotecan eriyik hazırlığı
- Seyreltik olarak yukarıda, 120 son bir konsantrasyon ile uyuşturucu çalışan bir çözüm elde etmek için tam büyüme ortamının 500 µL ilaç nM.
- Beş iki kat seri dilutions Şekil 2' de gösterildiği gibi gerçekleştirin.
-
Antikor ve uyuşturucu eriyik hazırlığı
- 120 nM uyuşturucu ve 240 µg/mL mAb (çalışma çözüm) bir çözüm elde etmek için tam büyüme ortamının 500 µL uyuşturucu ve mAb çözümlerinde sulandırmak.
- Beş iki kat seri dilutions Şekil 2' de gösterildiği gibi gerçekleştirin.
-
mAb eriyik hazırlığı
- Son konsantrasyonu gelmesi, deneysel düzen ( Şekil 2) belirtildiği gibi ilgili kuyu, her ilaç çözümünün 50 µL aktarın.
Not: tam büyüme ortamının 50 µL Şekil 2' de gösterildiği gibi işlenmemiş hücre kuyu aktarın. - Kuluçka (37 ° C, % 5 CO2) 72 h için hücreleri kuluçkaya.
- Ertesi sabah (1. gün) tam büyüme orta kullanarak aşağıdaki uyuşturucu çözümleri hazırlayın.
- MTT tahlil
- 10 µL MTT reaktif çözüm her kuyunun içine ekleyin.
- 4 h için 37 ° C'de kuluçkaya.
- Bir çok kanallı pipet kullanarak lysis çözüm (0.01 M HCl % 10 SDS) 100 µL her kuyunun içine ekleyin ve pipetting tarafından iyice karıştırın.
- 4 h içinde oksijen odası (% 95 nem) için 37 ° C'de kuluçkaya.
- 570 absorbans okumak nm (bir570) ve 620 nm (bir620) bir spektrofotometre kullanarak.
Not: her örnek yeniden absorbans okumadan önce pipetting tarafından Mix; absorbans 620 nm spesifik olmayan arka plan değerleri düzeltme sağlar. - Düzeltilmiş absorbans hesaplamak: absorbans düzeltilmiş bir570-620=.
- Hücre canlılığı aşağıdaki gibi hesaplar: hücre canlılığı = 100 x (ortalama düzeltilmiş absorbans örnek / ortalama düzeltilmiş absorbans kontrol).
- Aşağıdaki denklemi kullanarak kesir etkilenen değerleri (Fa) hesaplamak: 1 - (ortalama düzeltilmiş absorbans örnek / ortalama düzeltilmiş absorbans kontrol).
- İlaç etkileşimi analitik simülasyon yazılımı tek ve ilaç kombinasyonu araştırmaları
- Başlangıç penceresini açmak için simülasyon yazılımı çalıştırın.
- Ana penceresini açmak için Yeni bir deneme düğmesini tıklatın.
- Deney adı penceresinde yazın.
Not: Bir tarih tarihi penceresinde eklenebilir. - Yeni tek ilaç butonuna tıklayın.
- Adı Ve soyadı penceresinde yazın.
- Kısaltmayı Abbrev penceresinde yazın.
- İlaç konsantrasyonu birimi birimleri penceresinde yazın.
- Veri noktası 1 doz ve SK değeri, Entertuşuna basın girin.
- Tüm veri noktalarını girilen kadar bu adımı yineleyin.
- Tamamlandı butonuna tıklayın.
- MAb veri noktaları girmek için aynı adımları izleyin.
Not: uyuşturucu tarafından kullanılanla aynı toplama ünitesi kullanın. - Yeni uyuşturucu açılan butonuna tıklayın.
- Uyuşturucu ve mAbseçin.
- Sabit oranını seçin ve Tamam' ı tıklatın.
- Adı Ve soyadı penceresinde yazın.
- Kısaltmayı Abbrev penceresinde yazın.
- Uyuşturucu/mAb oranı oranı penceresinde yazın.
- Veri noktası 1 doz girin ve Entertuşuna basın.
Not: Program mAb ve açılan doz otomatik olarak hesaplar. - Veri noktası 1 SK değerini girin ve Entertuşuna basın.
- Tüm veri noktalarını girilen kadar bu adımı yineleyin.
- Tamamlandı düğmesini ve ardından Rapor oluştur düğmesini tıklayın.
- Uyuşturucu ve mAb seçin ve sonra Tamam' ı tıklatın.
- Açılan seçin ve sonra Tamam' ı tıklatın.
- Üstbilgi, CI tablosuve Özet Tabloseçin. O zaman, Tamam' ı tıklatın.
- Analiz dosyasının dosya adını ve raporu oluşturmak için Kaydet ' i tıklatın.
Not: OKtıkladıktan sonra rapor otomatik olarak bilgisayarın varsayılan web tarayıcınızda açılır. - Raporu yazdırmak için Yazdır web tarayıcının Dosya menüsünden seçin. Rapor Başlık, tarih, dosya adı, açıklama Not, parametreleri (m, Dm ve r), ED50 tedavinin veya kombinasyonu ve CI tablo ED50, ED her birleşimi için kullanılan her iki aracı içeren bir Özet Tablo bölümü içerir 75, ED90ve ED95.
Not: CI değeri < 1 gösterir synergism, CI değeri = 1 gösterir additivity ve CI değeri > 1 husumet gösterir.
2. insan Nöroblastom Xenografts Nonobese diyabetik NOD Scid Gamma farelerde (NSG fareler) nesil
Not: hücre kültürü herhangi bir kirlenme hariç. Membran matris bir jel 5 ° C üzerindeki formlar, Bütün cultureware veya membran matris reaktif temas geliyor medya prechilled/buz-soğuk olmalıdır. Membran matris buz üzerinde tüm işlemi sırasında tutmak.
-
IMR5 hücre süspansiyon hazırlanması
- Membran matris reaktif gecede kullanmadan önce 4 ° C buzdolabında buz şişede batış tarafından çözülme.
- 0 gün, kültürlü IMR5 hücreler yukarıda ayrıntılı olarak hasat.
- Hücreleri bir 15 mL konik tüp ve 5 min için 300 x g , santrifüj aktarın.
- Süpernatant atmak. Hücreler 2 yıkama x ile buz gibi PBS, 15 mL ve 5 x 107 hücre/mL buz gibi PBS bir hücre süspansiyon hazırlamak.
Not: gerekirse, hücre süspansiyon 1.5 mL microcentrifuge tüp aktarın. - Membran matris şişe girdap.
Not: Membran matris reaktif çözdürülen ve dağınık. - Bir membran matris reaktif hacmi ve hücre süspansiyon 2, 5 x 107 hücreleri /mL elde etmek için pipetting karıştırın.
- Hücre süspansiyon buz üzerinde tutun.
-
Fareler hazırlanması
Not: Altı-yedi hafta yaşlı fareler olmalıdır.- Fareler altında belirli bir patojen bırakma durumu korumak.
- Fareler geldikten sonra bir üç - beş günlük iklimlendirme süre izin.
- Enjeksiyonu nerede olacak kanadını aşı günü, tıraş (2.3.6 bkz. adım).
-
Tümör hücre enjeksiyon hazırlanması
Not: buz gibi membran matris hücre süspansiyon aseptik prosedürü boyunca devam et.- Hücreleri karıştırın ve dikkatle 21 G iğne ile monte edilmiş bir 1 mL şırınga içine hücre süspansiyon çizin.
- Emin olmak için şırıngada hava hava kabarcığı yok olduğundan emin olun.
- Fare antiseptik bir çözüm ile aşı alanı dezenfekte.
- Yavaşça fare cilt parmaklar, enjeksiyon yerinde arasında kanatta sıkmak.
- İğneyi tam olarak cilt kapağı içine yerleştirin. İğne koymayın içine derin doku Subkutan Enjeksiyon emin olmak için.
- IMR5 hücre süspansiyon (yani, 2. 5 x 106 hücreler), 100 µL Subkutan Fareler alt sağ kanat enjekte.
- Kaçağı önlemek ve iğne çekmek için şırınga döndürün.
-
Vücut ağırlığı değişiklikler ve tümör büyüme izleme
- Uzunluğu (A) ve (B) bir kumpas ile tümör genişliği ölçmek.
- Tümör birimin 0.5 x (A x B2) formülü kullanarak hesaplar.
- Tümör ~ 50-60 mm3ortalama hacmi ulaştığında tedavi başlatmak.
3. ilaç ve antikor yönetim farelerde
-
İntravenöz mAb 8B6 İdaresi
- Dikkatle mAb çözüm ile 25 G iğne ile monte 1 mL şırıngaya doldur.
- A ısı lamba kuyruk ven genişletmek 10 dakika altında fareyi getirin.
- Bir kemirgen restrainer fare dizginlemek.
- Fare antiseptik bir çözüm ile aşı alanı dezenfekte.
- İğneyi paralel olarak kuyruk ven, delici 2-4 mm iğne yüzünü yukarı doğru eğimi (Şekil 3A) tutarken lümen içine yerleştirin.
- 100 µL antikor Çözüm intravenöz enjekte (IV).
- Enjeksiyon sona erdiğinde, yavaşça kanama önlemek için enjeksiyon yeri basınç.
-
Topotecan, mayi yönetimi
- 25 G iğne ile monte edilmiş bir 1 mL şırınga uyuşturucu çözüm çizmek.
- Fare ile posterior sona biraz yüksek bir sırtüstü pozisyonda tutun.
- Fare antiseptik bir çözüm ile aşı alanı dezenfekte.
- Fare karın orta hat bulun ve zihinsel karın bölgeleri bölmek. Enjeksiyon yeri sağ veya sol alt çeyreğinde (Şekil 3B) bulun.
- İğneyi karın (5 mm derin) sağ veya sol alt kadranda ~ 10 ° açıyla yerleştirin.
- Uyuşturucu çözeltinin 100 µL intraperitoneally enjekte (IP).
- Aşı site dezenfekte.
Sonuçlar
Temsilcisi sonuçları ve rakamlar daha önce yayımlanmış çalışma14izinle adapte olmuşlardır.
Anti-OAcGD2 mAb 8B6 sinerjik inhibitör etkileri Topotecan Nöroblastom hücre satırı büyüme geliştirir:
İlaç ve synergism topotecan ve mAb 8B6, uyuşturucu ve insan IMR5 Nöroblastom hücreleri ilk olarak ölçüldü bir...
Tartışmalar
İlaç etkileşimleri etkisini tahmin etmek için üç yöntem kullanılabilir:1isobologram metodoloji17, doğrusal olmayan karışımı modeli18ve kasanın içindekiler. Uygulama kullanıcı dostu bilgisayar programı kullanılabilirlik tarafından Basitleştirilmiş kombinasyonu Dizin analiz en sık kullanılır. Bu amaçla, ilk doz-etki tepki bir ÇMT tahlil19gerçekleştirerek tek başına veya birlikte, kullanılan her ar...
Açıklamalar
S.Fa., J.F. ve SB anti-O-asetil-GD2 terapötik antikorlar klinik uygulama kapsayan patent bekleyen mucitler olarak atanır.
Teşekkürler
Hibe desteği: Fondation de projesi de L 'Université de Nantes, les Bagouz' à Manon, La Ligue contre le kanser Comite de Loire-Atlantique, comité du Morbihan ve Comite de Vendée, une gül dökün S.A.R.A.H, L'Etoile de Martin ve la Société Française de Lutte contre les Kanser et les leucémies de L'Enfant et de L'adolescent (SFCE). M.B. ve J.F. La Ligue Contre Le kanser tarafından desteklenir. Yazarlar UTE tesisin yapısı Fédérative de Recherche François Bonamy, teşekkür ederim. Yazarlar onun teknik yardım almak için Ayrıca Dr. S. IMR5 hücreler sağlamak için Suzin (INSERM, Paris) ve Bayan H. Estéphan teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referanslar
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: "Postoperative validation of bone-anchored implants in the single-sided deafness population." Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Cancer Research. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Cancer Research. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır