Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Producción de nanogotas de decafluorobutano de cambio de fase filtradas por membrana a partir de microburbujas preformadas
En este artículo
Resumen
Este protocolo describe un método para generar grandes volúmenes de microburbujas de decafluorobutano encapsuladas en lípidos utilizando sonicación de punta de sonda y posteriormente condensarlos en nanogotas de cambio de fase utilizando extrusión de alta presión y filtración mecánica.
Resumen
Hay muchos métodos que se pueden utilizar para la producción de gotas vaporizables de cambio de fase para imágenes y terapia. Cada método utiliza diferentes técnicas y varía en precio, materiales y propósito. Muchos de estos métodos de fabricación dan como resultado poblaciones polidispersas con umbrales de activación no uniformes. Además, el control de los tamaños de las gotas generalmente requiere líquidos de perfluorocarbono estables con altos umbrales de activación que no son prácticos in vivo. Producir tamaños de gotas uniformes utilizando gases de bajo punto de ebullición sería beneficioso para los experimentos de imagen y terapia in vivo. Este artículo describe un método simple y económico para la formación de nanogotas de cambio de fase estabilizadas por lípidos filtradas por tamaño con decafluorobutano (DFB) de bajo punto de ebullición. Se describe un método común para generar microburbujas lipídicas, además de un nuevo método para condensarlas con extrusión a alta presión en un solo paso. Este método está diseñado para ahorrar tiempo, maximizar la eficiencia y generar mayores volúmenes de soluciones de microburbujas y nanogotas para una amplia variedad de aplicaciones utilizando equipos de laboratorio comunes que se encuentran en muchos laboratorios biológicos.
Introducción
Los agentes de contraste por ultrasonido (UCA) están creciendo rápidamente en popularidad para aplicaciones de imágenes y terapia. Las microburbujas, los UCA originales, son actualmente los agentes principales utilizados en aplicaciones de diagnóstico clínico. Las microburbujas son esferas llenas de gas, típicamente de 1-10 μm de diámetro, rodeadas de capas de lípidos, proteínas o polímeros1. Sin embargo, su tamaño y estabilidad in vivo pueden limitar su funcionalidad en muchas aplicaciones. Las nanogotas de cambio de fase, que contienen un núcleo líquido sobrecalentado, pueden superar algunas de estas limitaciones debido a su tamaño más pequeño y a la mejora de la vida útil de la circulación2. Cuando se expone al calor o a la energía acústica, el núcleo líquido sobrecalentado se vaporiza para formar una microburbuja de gas2,3,4,5. Dado que el umbral de vaporización está directamente relacionado con el tamaño de las gotas5,6, la formulación de suspensiones de gotas con un tamaño uniforme sería muy deseable para lograr umbrales de activación consistentes. Los métodos de formulación que producen tamaños de gotas uniformes son a menudo complejos y costosos, mientras que los enfoques más rentables dan como resultado soluciones de polidisperso7. Otra limitación es la capacidad de generar gotas estables de cambio de fase con gases perfluorocarbonos (PFC) de bajo punto de ebullición, lo cual es crítico para una activación eficiente in vivo8. En este manuscrito, se describe un protocolo para generar gotas de desplazamiento de fase vaporizables filtradas estables de bajo punto de ebullición para aplicaciones de imágenes y terapia in vivo.
Existen muchos métodos para producir gotas monodispersadas submicrónicas de desplazamiento de fase7. Uno de los métodos más robustos para controlar el tamaño es el uso de dispositivos microfluídicos. Estos dispositivos pueden ser costosos, tener tasas lentas de producción de gotas (~ 104-106 gotas / s)7 y requieren una capacitación extensa. Los dispositivos microfluídicos también requieren generalmente gases de alto punto de ebullición para evitar la vaporización espontánea y la obstrucción del sistema7. Sin embargo, un estudio reciente de gracia Lux et al.9 demuestra cómo el enfriamiento de un microfluidizador puede ser utilizado para generar altas concentraciones de cambio de fase submicrométrico (1010-1012/mL) utilizando decafluorobutano de bajo punto de ebullición (DFB) u octafluoropropano (OFP).
En general, los gases de bajo punto de ebullición como DFB u OFP son más fáciles de manejar utilizando burbujas de gas preformadas. Las gotas vaporizables se pueden producir a partir de burbujas precursoras estabilizadas con lípidos condensando el gas utilizando bajas temperaturas y presión elevada5,10. La concentración de gotas producidas utilizando este método depende de la concentración de microburbujas precursoras y la eficiencia de la conversión de burbujas en gotas. Se han reportado microburbujas concentradas a partir de sonicación de puntas que se acercan a > 1010 MB/mL11, mientras que un estudio separado ha reportado concentraciones de gotas que van desde ~1-3 x1011 gotas/ml de burbujas condensadas de OFP y DFP12. Cuando las gotas monodispersadas no son una preocupación, los métodos de condensación son los métodos más sencillos y de menor costo para generar gotas de cambio de fase estabilizadas con lípidos utilizando PFC de bajo punto de ebullición. Los métodos para generar burbujas de tamaño uniforme antes de la condensación pueden ayudar a crear poblaciones de gotas más monodispersas. Sin embargo, la generación de burbujas precursoras monodispersas también es difícil, ya que requiere enfoques más costosos como la microfluídica o las técnicas de centrifugación diferencial repetida11. Recientemente se ha publicado un enfoque alternativo para la producción de nanogotas DFB y OFB utilizando la nucleación espontánea de gotitas en liposomas13. Este método, que utiliza un efecto "Ouzo", es una forma sencilla de generar gotas de PFC de bajo punto de ebullición sin necesidad de condensar burbujas. La distribución del tamaño de las gotas de PFC se puede controlar mediante la delicada titulación y mezcla de componentes de PFC, lípidos y etanol utilizados para iniciar la nucleación de las gotas. También vale la pena señalar que la mezcla de perfluorocarbonos se puede utilizar para controlar los umbrales de estabilidad y activación de las nanogotas14,15. Un trabajo más reciente de Shakya et al. demuestra cómo la activación de nanogotas se puede ajustar emulsionando PFC de alto punto de ebullición dentro de un endoesqueleto de hidrocarburos para facilitar la nucleación heterogénea dentro del núcleo de gotas16, que es un enfoque que se puede considerar junto con otras formas de filtración de tamaño de gotas.
Una vez formadas, las gotas de cambio de fase se pueden extruir después de la formación para crear poblaciones más monodispersas. De hecho, un protocolo similar al método aquí descrito ha sido publicado previamente por Kopechek et al.17 utilizando dodecofluorpentano de alto punto de ebullición (DDFP) como núcleo de gotas. Los lectores que buscan usar gotas de cambio de fase con perfluorocarbonos de alto punto de ebullición (estables a temperatura ambiente) deben consultar el artículo anterior en su lugar. Generar y extruir gotas con gases de bajo punto de ebullición, como DFB y OFP, es más complicado y se aborda mejor condensando burbujas de gas preformadas.
En este protocolo, se describe un método común para generar microburbujas lipídicas preformadas con un núcleo de gas DFB utilizando la sonicación de la punta de la sonda. A continuación, se utiliza una extrusora comercial para condensar microburbujas preformadas en nanogotas de desplazamiento de fase submicrónicas (Figura 1). Las gotas resultantes son activables por calor y ultrasonido. Este método puede producir mayores volúmenes de solución de nanogotas que los métodos de condensación convencionales con distribuciones de tamaño más estrechas sin la necesidad de costosos dispositivos microfluídicos. La producción de soluciones de nanogotas con distribuciones de tamaño estrechas probablemente puede generar umbrales de vaporización más uniformes. Esto maximizará su potencial para numerosas aplicaciones, como imágenes, ablación, administración de fármacos y embolización1,3,4,6.
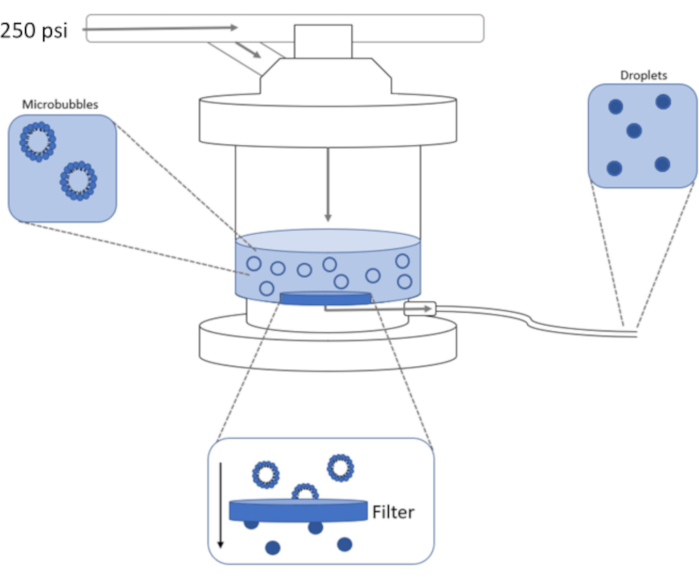
Figura 1: Esquema de configuración de extrusión de alta presión para condensar microburbujas preformadas en nanogotas de cambio de fase. La solución de microburbuja se agrega y está contenida en la cámara extrusora, y se aplican 250 psi, del tanque de nitrógeno, a través de la válvula de entrada de la cámara. El gas nitrógeno empujará la solución de microburbuja a través del filtro en la base de la cámara, condensando la muestra en nanogotas. La solución finalmente se empuja fuera del extrusor a través del tubo de salida de la muestra y se recoge. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Hacer películas lipídicas
- Prepare películas lipídicas para la generación de microburbujas utilizando 90% DSPC y 10% DSPE-PEG2K mezclando los lípidos en la proporción correcta utilizando las siguientes instrucciones:
- Hacer lípidos de stock de DSPC y DSPE-PEG2K en cloroformo. Pesar 50 mg de cada polvo lipídico en viales separados. Añadir 1 ml de cloroformo a cada vial con una jeringa de vidrio de 1 ml.
- Añadir 287 μL de material DSPC y 113 μL de DSPE-PEG2K (ambos 50 mg/ml) en un vial de centelleo de 20 ml utilizando una jeringa de vidrio.
- Secar los lípidos mezclados para eliminar el cloroformo usando nitrógeno. Utilizando una longitud adecuada de tubo conectado al nitrógeno de la casa, fluya ligeramente el gas nitrógeno sobre el espacio de cabeza del vial mientras se mezcla. Continúe hasta que no se observe cloroformo y la película lipídica restante comience a volverse blanca. Use tapones de rosca de polipropileno, cubra la muestra mientras introduce nitrógeno en el espacio de cabeza.
- Coloque los viales al vacío durante la noche con un desecador de vacío para eliminar cualquier cloroformo residual. Quedará una fina película translúcida que recubre la parte inferior del vial.
- Guarde los viales a -20 °C hasta que sea necesario.
2. Generación de microburbujas a partir de películas lipídicas
- Para hacer las microburbujas, agregue 10 ml de solución salina tampón de fosfato (PBS) que contenga 20% v / v propilenglicol y 20% v / v glicerol (pH final 7.2-7.4) a una película lipídica seca.
- Vuelva a tapar la muestra y caliente la muestra a 65 °C durante 30 minutos en un bloque de calefacción (o baño de agua caliente).
- Mientras la muestra se calienta, prepare el sonicador de baño aumentando la temperatura del baño a 65 ° C.
NOTA: Este proceso es más rápido si el agua se precalienta en un microondas o placa caliente antes de colocarla en el sonicador de baño. - Coloque el vial de centelleo que contiene la muestra calentada en el sonicador de baño de modo que solo la porción del vial que contiene la solución lipídica se sumerja en el baño de agua.
- Sonicar la solución lipídica tibia durante un mínimo de 15 min. Asegúrese de que la temperatura del agua se mantenga a 65 °C. Continúe sonicando en intervalos de 10-15 min hasta que la solución esté completamente clara (Figura 2).
NOTA: Si no hay un sonicador de baño disponible, la solución se puede sonicar con la punta al 10% de potencia hasta que esté clara. Sin embargo, la micropunta se desgastará más rápido y es más costosa de reemplazar.

Figura 2: Ejemplo de películas lipídicas hidratadas. Ejemplo de película lipídica hidratada (A) antes y (B) después de la sonicación del baño para formar vesículas unilamelares. Después de la sonicación del baño, la solución lipídica debe cambiar de una solución más opaca a translúcida. Haga clic aquí para ver una versión más grande de esta figura.
- Mientras aún está caliente, retire la tapa y sujete el vial en la carcasa insonorizada del sonicador para que la conexión de micropuntas del sonicador se sumerja justo debajo de la interfaz aire/líquido (Figura 3).
- Coloque el tanque de decafluorobutano junto a la carcasa insonorizada del sonicador.
- Prepara un baño de hielo y colócalo junto al recinto insonorizado. Esto se usará más adelante en el paso 2.14.
- Encienda el interruptor de encendido del sonicador.
- Después de que se inicie el sistema, establezca el nivel de potencia en 70%. No exceda el 70% de amplitud con el accesorio de micropunta. No inicie el sonicador en este momento.
- Coloque una longitud adecuada de tubo para guiar el gas desde la salida del tanque DFB hacia la solución lipídica caliente que se encuentra en el recinto. El tubo debe colocarse justo en el cuello del vial para permitir que el gas fluya hacia el espacio de la cabeza durante la sonicación (Figura 3).
- Abra la válvula del tanque lentamente hasta que se pueda ver que el gas fluye sobre la solución lipídica. Esto causará ligeras ondas en la superficie del líquido. Si el flujo de gas es demasiado alto, la solución se desbordará durante la formulación de microburbujas.
- Inicie el sonicador y ejecute durante 10 s continuamente para generar microburbujas. Si la solución de burbujas comienza a desbordarse durante la sonicación, detenga inmediatamente el sonicador.
- Apague el sonicador y cierre inmediatamente la válvula del tanque DFB.
- Cubra rápidamente la solución de microburbuja y sumerja el vial en el baño de hielo para enfriar la muestra por debajo de 55 °C (temperatura de transición vítrea de DSPC)
- Deje las muestras de microburbujas en el baño de hielo hasta que sea necesario.

Figura 3: Colocación de la punta de la sonda en la solución lipídica para optimizar la formación de microburbujas. Tenga cuidado de no permitir que la punta de la sonda toque el vidrio. Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación de la extrusora para la condensación de microburbujas
- Ensamble la extrusora de alta presión como se detalla en el manual del usuario utilizando un filtro cerámico de 200 nm (suministrado por el fabricante).
- Coloque la extrusora en el centro de un recipiente estanco para que el tubo de salida de la muestra no se presione contra el costado ni se engarce.
- Acople la extrusora al tanque de gas nitrógeno utilizando el adaptador suministrado por el fabricante.
- Haga un baño de hielo salado de -2 °C en el recipiente estanco alrededor de la extrusora con 400 ml de agua y 10 g de cloruro de sodio.
- Coloque el extremo del tubo de salida en un vial de centelleo para recoger la muestra extruida.
NOTA: Asegure el tubo al recipiente con cinta adhesiva si no se coloca plano o permanece dentro del vial.
4. Cebado de la extrusora para la condensación de microburbujas
- Abra y cierre la válvula de liberación para asegurarse de que no haya presión dentro de la extrusora.
- Retire la tapa de la cámara y agregue 5 ml de 1x PBS a la cámara del extrusor.
- Reemplace la tapa asegurándose de que vuelva a su lugar de forma segura.
- Abra el tanque de gas nitrógeno para que el manómetro lea 250 psi. Asegúrese de que la válvula de control de presión esté en la posición cerrada.
- Cierre el tanque de gas y abra la válvula de entrada de la cámara extrusora. La solución de PBS se empujará a través del sistema y saldrá del tubo de salida de la muestra hacia el vial de centelleo.
- Cuando solo salga gas del tubo, abra la válvula de liberación y permita que la presión caiga a 0 psi.
- Retire el vial de centelleo.
5. Microburbujas de preenfriamiento para extrusión
- Abra y cierre la válvula de liberación para asegurarse de que no haya presión dentro de la extrusora. Coloque un nuevo vial de centelleo al final del tubo de salida.
- Llene un recipiente de acero con 2-metil butano y agregue hielo seco para bajar la temperatura a -18 ° C.
- Inserte la solución de microburbuja en el 2-metil butano refrigerado para que la muestra se sumerja durante 2 min. Mueva el vial de centelleo durante los 2 minutos para mezclar suavemente las burbujas. Agregue hielo seco según sea necesario para mantener la temperatura entre -15 y -18 ° C. Tenga cuidado de no exceder los -20 °C o la solución de excipiente se congelará y destruirá la muestra de burbujas.
NOTA: Los pasos 5.2 y 5.3 también se pueden realizar enfriando la muestra de burbujas en un congelador de laboratorio durante un período de tiempo más prolongado. Sin embargo, se debe tener precaución para controlar cuidadosamente la temperatura del congelador y evitar congelar la muestra. - Después de 2 min, retire las microburbujas del 2-metil butano refrigerado, agite suavemente el vial para mezclar las microburbujas y use una jeringa refrigerada de 10 ml para transferir la solución al extrusor.
- Retire la tapa de la cámara del extrusor y agregue la solución de microburbujas a la cámara empujando lentamente el émbolo sobre la jeringa. Reemplace la tapa del extrusor asegurándose de que vuelva a su lugar de forma segura.
- Verifique que la válvula de control de presión y la válvula de liberación del extrusor estén en la posición cerrada.
- Abra el tanque de gas nitrógeno hasta que el manómetro lea 250 psi, cierre el tanque de gas y gire la válvula de control de presión a la posición abierta.
- Cuando la solución haya llenado el vial de centelleo en el tubo de salida, y solo salga gas del tubo, abra lentamente la válvula de liberación de presión y permita que la presión caiga a 0 psi.
- Coloque el vial de centelleo en un baño de hielo o nevera para su almacenamiento.
- Para el almacenamiento a largo plazo y minimizar la vaporización espontánea, guarde la muestra en un congelador estándar. Asegúrese de que la temperatura sea de -20 °C o superior para evitar la congelación de la muestra (la solución de excipiente de 20% de PPG y 20% de glicerol evitará que la muestra se congele en la mayoría de los congeladores de laboratorio).
6. Separación de gotas de liposomas por centrifugación
- Transfiera 10 ml de la solución de gotas extruidas a un tubo centrífugo de 15 ml.
- Centrifugar la muestra extruida a 1.500 x g durante 10 min a 4 °C. Un pellet compuesto de nanogotas DFB será evidente en la parte inferior del tubo (Figura 4). Las gotas vaporizadas espontáneamente aparecerán en la parte superior de la solución y deben desecharse.

Figura 4: Ejemplo de peletización de gotas de DFB de cambio de fase después de la centrifugación. Las nanogotas de DFB son más densas que los liposomas y se acumularán en la parte inferior del tubo de la centrífuga en un gránulo (caja roja). Haga clic aquí para ver una versión más grande de esta figura.
- Retire el sobrenadante y resuspenda el pellet en 2 ml de 1x PBS con 20% de glicerol y 20% de propilenglicol.
- Mezcle el tubo suavemente para obtener una solución homogénea y transfiera las gotas a un tubo centrífugo más pequeño de 2 ml.
- Lave la muestra dos veces más en un tubo centrífugo de 2 ml.
- Después del último lavado, vuelva a suspender el pellet en 100 μL de 1x PBS con 20% de glicerol y 20% de propilenglicol y guárdelo en hielo o en el congelador hasta que sea necesario.
7. Verificación microscopía de la vaporización de gotas
- Haga una solución de gotas diluidas agregando 2.5 μl de gotas concentradas a 7.5 μl de 1x PBS.
- Prepare un portaobjetos de microscopio con 10 μl de la muestra diluida. Usando un objetivo 40x, observe la muestra y guarde las imágenes.
- Retire el portaobjetos del microscopio y colóquelo en una placa de calor de 65 °C durante 1 minuto para vaporizar nanogotas en microburbujas.
- Utilice el mismo objetivo 40x para observar la muestra después del calentamiento para verificar la vaporización de gotas.
Resultados
Los resultados representativos de la distribución de tamaño se incluyen mediante el análisis de dispersión dinámica de luz (DLS) y detección de pulso resistivo sintonizable (TRSP). La Figura 5 muestra la distribución de tamaño de las soluciones de burbujas condensadas con y sin extrusión. Sin extrusión, el protocolo termina en el paso 5.3. Las burbujas refrigeradas se condensan ventilando la muestra a presión atmosférica mientras está fría. La única muestra condensada tiene un...
Discusión
Hay disponible un cuerpo completo de literatura que analiza la formulación, la física y las aplicaciones potenciales de las microburbujas y las gotas de cambio de fase para imágenes y terapia in vivo. Esta discusión se refiere explícitamente a la generación de microburbujas lipídicas y su conversión en gotas de cambio de fase submicrométricas utilizando un gas DFB de bajo punto de ebullición y extrusión a alta presión. El método descrito aquí está destinado a proporcionar un método relativamente simple de...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Dominique James en el laboratorio del Dr. Ken Hoyt por proporcionar análisis TRSP de nanogotas vaporizables de cambio de fase
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | - | - | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | - | - | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | - | - | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | - | - | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
Referencias
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados