Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство мембранно-фильтрованных фазовых декафторбутановых нанокафторбутановых из предварительно сформированных микропузырьков
В этой статье
Резюме
Этот протокол описывает способ генерации больших объемов инкапсулированных липидами микропузырьков декафторбутана с использованием ультразвуковой обработки зондовым наконечником и последующей конденсации их в нанокапли с фазовым сдвигом с использованием экструзии высокого давления и механической фильтрации.
Аннотация
Существует множество методов, которые могут быть использованы для производства испаряемых капель фазового сдвига для визуализации и терапии. Каждый метод использует различные методы и различается по цене, материалам и назначению. Многие из этих методов изготовления приводят к полидисперсным популяциям с неоднородными порогами активации. Кроме того, контроль размеров капель обычно требует стабильных перфторуглеродных жидкостей с высокими порогами активации, которые не являются практичными in vivo. Получение однородных размеров капель с использованием газов с низкой температурой кипения было бы полезно для экспериментов по визуализации in vivo и терапии. В данной статье описан простой и экономичный способ формирования калиброванных по размеру липид-стабилизированных фазово-сдвиговых нанокаплей с низкой температурой кипения декафторбутана (DFB). Описан распространенный способ генерации липидных микропузырьков, в дополнение к новому методу их конденсации с экструзией под высоким давлением за один этап. Этот метод предназначен для экономии времени, максимизации эффективности и создания больших объемов микропузырьковых и нанокаплетных растворов для широкого спектра применений с использованием общего лабораторного оборудования, найденного во многих биологических лабораториях.
Введение
Ультразвуковые контрастные вещества (UCA) быстро растут в популярности для визуализации и терапии. Микропузырьки, оригинальные UCA, в настоящее время являются основными агентами, используемыми в клинических диагностических приложениях. Микропузырьки представляют собой газонаполненные сферы, обычно диаметром 1-10 мкм, окруженные липидными, белковыми или полимерными оболочками1. Однако их размер и стабильность in vivo могут ограничивать их функциональность во многих приложениях. Нанокапли с фазовым сдвигом, которые содержат перегретое жидкое ядро, могут преодолеть некоторые из этих ограничений из-за их меньшего размера и улучшенного срока службы циркуляции2. При воздействии тепловой или акустической энергии перегретое жидкое ядро испаряется с образованием газового микропузырька2,3,4,5. Поскольку порог испарения непосредственно связан с размером капель5,6, для достижения последовательных пороговых значений активации было бы весьма желательно сформулировать суспензии капель с одинаковым размером. Методы составления рецептур, которые производят однородные размеры капель, часто являются сложными и дорогостоящими, тогда как более экономически эффективные подходы приводят к полидисперсным решениям7. Другим ограничением является способность генерировать стабильные капли фазового сдвига с перфторуглеродными газами с низкой температурой кипения (PFC), что имеет решающее значение для эффективной активации in vivo8. В этой рукописи описан протокол для получения стабильных отфильтрованных капель с фазовым сдвигом с низкой температурой кипения для визуализации in vivo и терапии.
Существует множество методов получения монодисперсных субмикронных фазово-сдвиговых капель7. Одним из наиболее надежных методов контроля размера является использование микрофлюидных устройств. Эти устройства могут быть дорогостоящими, иметь медленные темпы производства капель (~ 104-106 капель / с)7 и требуют обширной подготовки. Микрофлюидные устройства также обычно требуют газов с высокой температурой кипения, чтобы избежать спонтанного испарения и засорения системы7. Однако недавнее исследование de Gracia Lux et al.9 демонстрирует, как охлаждение микрофлюидизатора может быть использовано для получения высоких концентраций субмикронного фазового сдвига (1010-1012/мл) с использованием декафторбутана с низкой температурой кипения (DFB) или октафторпропана (OFP).
В целом, газы с низкой температурой кипения, такие как DFB или OFP, легче обрабатывать с помощью предварительно сформированных пузырьков газа. Испаряемые капли могут быть получены из стабилизированных прекурсорами липидных пузырьков путем конденсации газа с использованием низких температур и повышенного давления5,10. Концентрация капель, полученных с помощью этого метода, зависит от концентрации микропузырьков предшественника и эффективности превращения пузырьков в капли. Сообщалось о концентрированных микропузырьках от ультразвуковой обработки кончика, приближающейся к > 1010 МБ / мл11, в то время как в отдельном исследовании сообщалось о концентрациях капель в диапазоне от ~ 1-3 х1011 капель / мл от конденсированных пузырьков OFP и DFP12. Когда монодисперсные капли не являются проблемой, методы конденсации являются наиболее простыми и недорогими методами получения стабилизированных липидами каплей фазового сдвига с использованием ПФУ с низкой температурой кипения. Методы образования пузырьков однородного размера перед конденсацией могут помочь создать больше монодисперсных популяций капель. Однако создание монодисперсных пузырьков-предшественников также затруднено, что требует более дорогостоящих подходов, таких как микрофлюидика или методы повторного дифференциального центрифугирования11. Недавно был опубликован альтернативный подход к получению нанокапель DFB и OFB с использованием спонтанного зародыша капель в липосомах13. Этот метод, использующий эффект «узо», является простым способом получения капель PFC с низкой температурой кипения без необходимости конденсации пузырьков. Распределение по размерам капель PFC можно контролировать путем деликатного титрования и смешивания компонентов PFC, липидов и этанола, используемых для инициирования нуклеации капель. Также стоит отметить, что смешивание перфторуглеродов может быть использовано для контроля порогов стабильности и активации нанокапель14,15. Более поздняя работа Shakya et al. демонстрирует, как активация нанокаплей может быть настроена путем эмульгирования ПФУ с высокой температурой кипения в углеводородном эндоскелете для облегчения гетерогенного зарождения в ядре капли16, что является подходом, который можно рассматривать наряду с другими формами фильтрации размера капель.
После образования капли фазового сдвига могут быть экструдированы после образования для создания большего количества монодисперсных популяций. Фактически, протокол, аналогичный описанному здесь методу, был опубликован ранее Kopechek et al.17 с использованием додекофторпентана с высокой температурой кипения (DDFP) в качестве ядра капли. Читатели, стремящиеся использовать капли фазового сдвига с перфторуглеродами с высокой температурой кипения (стабильными при комнатной температуре), должны вместо этого ссылаться на статью выше. Генерация и экструдирование капель с низкой температурой кипения газов, таких как DFB и OFP, является более сложным и лучше всего подходит для конденсации предварительно сформированных пузырьков газа.
В этом протоколе описан распространенный способ генерации предварительно сформированных липидных микропузырьков с газовым ядром DFB с использованием обработки ультразвуком наконечника зонда. Затем коммерческий экструдер используется для конденсации предварительно сформированных микропузырьков в субмикронные нанокапли с фазовым сдвигом (рисунок 1). Полученные капли затем активируются с помощью тепла и ультразвука. Этот метод может производить большие объемы раствора нанокаплей, чем обычные методы конденсации с более узкими размерными распределениями без необходимости использования дорогостоящих микрофлюидных устройств. Производство нанокаплетных растворов с узким распределением размеров, вероятно, может привести к более однородным порогам испарения. Это позволит максимизировать их потенциал для многочисленных применений, таких как визуализация, абляция, доставка лекарств и эмболизация1,3,4,6.
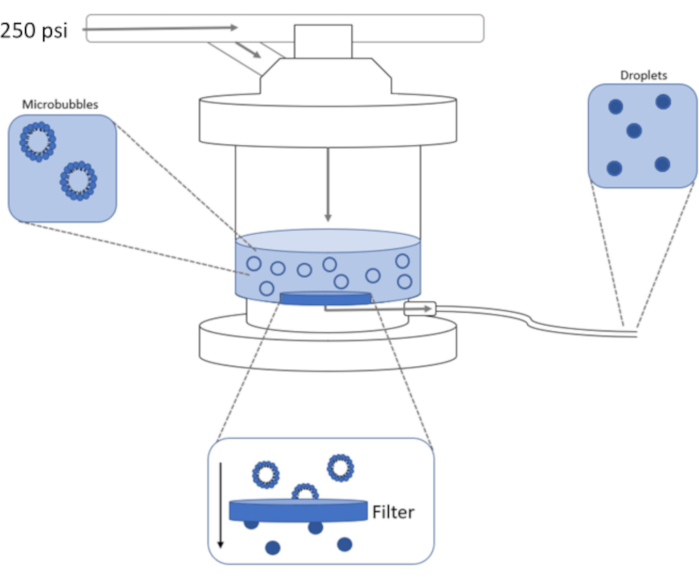
Рисунок 1: Схема экструзионной установки высокого давления для конденсации предварительно сформированных микропузырьков в нанокапли со сдвигом фазы. Микропузырьковый раствор добавляют и содержат в камере экструдера, а 250 фунтов на квадратный дюйм из азотного резервуара подают через впускной клапан камеры. Газообразный азот будет проталкивать микропузырьковый раствор через фильтр в основании камеры, конденсируя образец до нанокаплей. Раствор окончательно выталкивается из экструдера через пробу на выходе и собирается. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Изготовление липидных пленок
- Подготовьте липидные пленки для генерации микропузырьков с использованием 90% DSPC и 10% DSPE-PEG2K путем смешивания липидов в правильном соотношении с использованием следующих направлений:
- Изготавливайте стандартные липиды DSPC и DSPE-PEG2K в хлороформе. Взвесьте 50 мг каждого липидного порошка в отдельных флаконах. Добавьте 1 мл хлороформа в каждый флакон, используя стеклянный шприц объемом 1 мл.
- Добавьте 287 мкл запаса DSPC и 113 мкл запаса DSPE-PEG2K (оба 50 мг/мл) в сцинтилляционный флакон объемом 20 мл с помощью стеклянного шприца.
- Высушите смешанные липиды для удаления хлороформа с использованием азота. Используя трубку соответствующей длины, соединенную с домашним азотом, слегка протолкните газообразный азот над пространством флакона во время перемешивания. Продолжают до тех пор, пока хлороформ не будет замечен, а оставшаяся липидная пленка не начнет белеть. Используйте полипропиленовые винтовые колпачки, накройте образец при введении азота в пространство над головой.
- Поместите флаконы под вакуум на ночь, используя вакуумный осушитель, чтобы удалить любой остаточный хлороформ. Останется тонкая полупрозрачная пленка, покрывающая дно флакона.
- Хранить флаконы при температуре -20 °C до тех пор, пока это не понадобится.
2. Генерация микропузырьков из липидных пленок
- Чтобы получить микропузырьки, добавьте 10 мл 1x фосфатного буферного физиологического раствора (PBS), содержащего 20% v/v пропиленгликоля и 20% v/v глицерина (конечный рН 7,2-7,4) в сухую липидную пленку.
- Повторно поместите образец и нагрейте образец до 65 °C в течение 30 мин на нагревательном блоке (или водяной бане с подогревом).
- Пока образец нагревается, подготовьте звуковой аппарат для ванны, увеличив температуру ванны до 65 °C.
ПРИМЕЧАНИЕ: Этот процесс быстрее, если вода предварительно нагревается в микроволновой печи или конфорке перед помещением в ванну сиконикатора. - Поместите сцинтилляционный флакон, содержащий нагретый образец, в ультразвуковой аппарат ванны таким образом, чтобы только часть флакона, содержащая липидный раствор, была погружена в водяную баню.
- Наносите ультразвуком теплый липидный раствор в течение минимум 15 мин. Убедитесь, что температура воды остается на уровне 65 °C. Продолжайте настаивать ультразвуком с интервалом 10-15 мин до полного очищения раствора (рисунок 2).
ПРИМЕЧАНИЕ: Если анализатор для ванны недоступен, раствор можно обработать ультразвуком при 10% мощности до очистки. Тем не менее, микростеп будет изнашиваться быстрее и дороже в замене.

Рисунок 2: Пример гидратированных липидных пленок. Пример гидратированной липидной пленки (А) до и (В) после обработки ультразвуком в ванне с образованием одноламеллярных пузырьков. После обработки ванны ультразвуком липидный раствор должен перейти от более непрозрачного к полупрозрачному раствору. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Пока все еще тепло, снимите колпачок и зажмите флакон в звуконепроницаемый корпус ультразвуковика, чтобы микроконечное крепление ультразвуковика было погружено прямо под интерфейс воздух-жидкость (рисунок 3).
- Поместите резервуар с декафторбутаном рядом со звуконепроницаемым корпусом ультразвукового аппарата.
- Подготовьте ледяную ванну и поместите ее рядом со звуконепроницаемым корпусом. Это будет использовано позже в шаге 2.14.
- Включите выключатель питания для ультразвукового аппарата.
- После запуска системы установите уровень мощности на 70%. Не превышайте амплитуду 70% с прикреплением микроконверса. Не запускайте ультразвуковой аппарат в это время.
- Прикрепите трубку соответствующей длины, чтобы направить газ из выходного отверстия резервуара DFB в теплый раствор липидов, удерживаемый в корпусе. Трубка должна быть помещена только в горловину флакона, чтобы газ поступал в пространство над головой во время обработки ультразвуком (рисунок 3).
- Медленно открывайте клапан резервуара, пока не будет видно, как газ течет по раствору липидов. Это вызовет небольшую рябь на поверхности жидкости. Если поток газа слишком высок, раствор будет переполняться во время микропузырьковой формулы.
- Запустите ультразвуковой аппарат и работайте в течение 10 с непрерывно, чтобы генерировать микропузырьки. Если пузырьковый раствор начинает переполняться во время обработки ультразвуком, немедленно остановите ультразвуковой аппарат.
- Выключите ультразвуковой аппарат и немедленно закройте клапан бака DFB.
- Быстро закройте микропузырьк и погрузите флакон в ледяную ванну, чтобы охладить образец ниже 55 °C (температура стеклования DSPC)
- Оставьте микропузырьки в ледяной ванне до тех пор, пока это не понадобится.

Рисунок 3: Помещение наконечника зонда в липидный раствор для оптимизации образования микропузырьков. Позаботьтесь о том, чтобы наконечник зонда не касался стекла. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Подготовка экструдера для микропузырьковой конденсации
- Соберите экструдер высокого давления, как описано в руководстве пользователя, используя керамический фильтр 200 нм (поставляется от производителя).
- Поместите экструдер в центр водонепроницаемого контейнера так, чтобы выпускная трубка образца не прижималась к боковой стороне и не обжималась.
- Подключите экструдер к резервуару для азотного газа с помощью адаптера, поставляемого производителем.
- Сделайте соленую ледяную ванну -2 °C в водонепроницаемом контейнере вокруг экструдера, используя 400 мл воды и 10 г хлорида натрия.
- Поместите конец выходной трубки в сцинтилляционный флакон для сбора экструдированного образца.
ПРИМЕЧАНИЕ: Закрепите тюбик к контейнеру скотчем, если он не лежит плоско или не остается внутри флакона.
4. Заправка экструдера для конденсации микропузырьков
- Откройте и закройте выпускной клапан, чтобы убедиться, что внутри экструдера нет давления.
- Снимите крышку камеры и добавьте 5 мл 1x PBS в камеру экструдера.
- Замените крышку, убедившись, что она надежно щелкает обратно на место.
- Откройте резервуар для азотного газа так, чтобы манометр показывал 250 фунтов на квадратный дюйм. Убедитесь, что клапан регулирования давления находится в закрытом положении.
- Закройте бензобак и откройте впускной клапан камеры экструдера. Раствор PBS будет проталкиваться через систему и выходить из выпускной пробирки образца в сцинтилляционный флакон.
- Когда из трубки выходит только газ, откройте выпускной клапан и дайте давлению упасть до 0 фунтов на квадратный дюйм.
- Удалите сцинтилляционный флакон.
5. Предварительно охлаждающие микропузырьки для экструзии
- Откройте и закройте выпускной клапан, чтобы убедиться, что внутри экструдера нет давления. Поместите новый сцинтилляционный флакон на конец выходной трубки.
- Заполните стальной контейнер 2-метилбутаном и добавьте сухой лед, чтобы снизить температуру до -18 °C.
- Вставьте микропузырьковый раствор в охлажденный 2-метилбутан, чтобы образец погрузили в воду на 2 мин. Переместите сцинтилляционный флакон в течение 2 мин, чтобы аккуратно перемешать пузырьки. Добавляйте сухой лед по мере необходимости для поддержания температуры от -15 до -18 °C. Будьте осторожны, чтобы не превысить -20 °C, иначе раствор эксципиента замерзнет и разрушит пузырьковый образец.
ПРИМЕЧАНИЕ: Шаги 5.2 и 5.3 также могут быть выполнены путем охлаждения пузырькового образца в лабораторной морозильной камере в течение более длительного периода времени. Тем не менее, следует соблюдать осторожность, чтобы тщательно контролировать температуру морозильной камеры и избегать замораживания образца. - Через 2 мин удалите микропузырьки из охлажденного 2-метилбутана, аккуратно встряхните флакон, чтобы смешать микропузырьки, и используйте охлажденный шприц объемом 10 мл для переноса раствора в экструдер.
- Снимите крышку камеры экструдера и добавьте микропузырьковый раствор в камеру, медленно нажимая плунжер на шприц. Замените крышку экструдера, убедившись, что она надежно щелкает на месте.
- Убедитесь, что клапан регулирования давления и выпускной клапан экструдера находятся в закрытом положении.
- Откройте резервуар для азотного газа до тех пор, пока манометр не покажет 250 фунтов на квадратный дюйм, закройте газгольдер и поверните клапан регулирования давления в открытое положение.
- Когда раствор заполнит сцинтилляционный флакон на выходе из трубки, и из трубки выходит только газ, медленно откройте клапан сброса давления и дайте давлению упасть до 0 фунтов на квадратный дюйм.
- Поместите сцинтилляционный флакон в ледяную ванну или холодильник для хранения.
- Для длительного хранения и минимизации спонтанного испарения храните образец в стандартной морозильной камере. Убедитесь, что температура составляет -20 ° C или выше, чтобы избежать замораживания образца (вспомогательный раствор 20% PPG и 20% глицерина будет удерживать образец от замерзания в большинстве лабораторных морозильных камер).
6. Отделение капель от липосом центрифугированием
- Перенесите 10 мл экструдированного капельного раствора в центрифужную трубку объемом 15 мл.
- Центрифугировать экструдированный образец при 1 500 х г в течение 10 мин при 4 °C. Гранула, состоящая из нанокапель DFB, будет видна в нижней части трубки (рисунок 4). Самопроизвольно испарившиеся капли появятся в верхней части раствора и должны быть выброшены.

Рисунок 4: Пример гранулирования капель DFB со сдвигом фазы после центрифугирования. Нанокапли DFB более плотные, чем липосомы, и будут собираться на дне трубки центрифуги в гранулу (красная коробка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Удалите супернатант и повторно суспендируйте гранулу в 2 мл 1x PBS с 20% глицерина и 20% пропиленгликоля.
- Осторожно перемешайте пробирку до получения однородного раствора и переложите капли в меньшую центрифужную трубку объемом 2 мл.
- Промыть образец еще два раза в 2 мл центрифужной трубки.
- После последней промывки повторно суспендируйте гранулу в 100 мкл 1x PBS с 20% глицерином и 20% пропиленгликолем и храните на льду или в морозильной камере до тех пор, пока это не понадобится.
7. Микроскопическая проверка испарения капель
- Делают разбавленный капельный раствор, добавляя 2,5 мкл концентрированных капель к 7,5 мкл 1x PBS.
- Подготовьте слайд микроскопа с 10 мкл разбавленного образца. Используя 40-кратный объектив, наблюдайте за образцом и сохраняйте изображения.
- Извлеките предмет из микроскопа и поместите его на тепловую пластину с температурой 65 °C в течение 1 мин, чтобы испарить нанокапли в микропузырьки.
- Используйте тот же 40-кратный объектив для наблюдения за образцом после нагревания, чтобы проверить испарение капель.
Результаты
Репрезентативные результаты распределения по размерам включены с использованием динамического рассеяния света (DLS) и перестраиваемого резистивного импульсного зондирования (TRSP). На рисунке 5 показано распределение по размерам конденсированных пузырьковых растворов ?...
Обсуждение
Доступен обширный объем литературы, в которой обсуждается формулировка, физика и потенциальное применение микропузырьков и капель фазового сдвига для визуализации in vivo и терапии. Это обсуждение явно относится к генерации липидных микропузырьков и превращению их в субмикронные капли ...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Доминика Джеймса из лаборатории доктора Кена Хойта за предоставление TRSP-анализа испаряемых нанокапель с фазовым сдвигом.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | - | - | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | - | - | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | - | - | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | - | - | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
Ссылки
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены