A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור של ננו-טיפות דקפלואורובוטן מסוננות פאמברנה ממיקרו-טבלים מעוצבים מראש
In This Article
Summary
פרוטוקול זה מתאר שיטה ליצירת כמויות גדולות של מיקרו-נבלות decafluorobutane משומנים באמצעות sonication קצה בדיקה ולאחר מכן עיבוי אותם לתוך nanodroplets פאזה שינוי באמצעות שחול בלחץ גבוה סינון מכני.
Abstract
ישנן שיטות רבות שניתן להשתמש בהן לייצור טיפות פאזה-shift הניתנות להדמיה וטיפול. כל שיטה משתמשת בטכניקות שונות ומשתנה במחיר, בחומרים ובמטרה. רבות משיטות הייצור הללו גורמות לאוכלוסיות רב-ממדיספרס עם סף הפעלה לא אחיד. בנוסף, שליטה בגדלי הטיפות בדרך כלל דורשת נוזלים יציבים perfluorocarbon עם סף הפעלה גבוה שאינם מעשיים vivo. הפקת גדלי טיפה אחידים באמצעות גזים בנקודת רתיחה נמוכה תועיל לניסויים בהדמיה וטיפול ב- vivo. מאמר זה מתאר שיטה פשוטה וחסכונית להיווצרות ננו-טיפות הזזת פאזה מיוצבות-שומנים עם נקודת רתיחה נמוכה decafluorobutane (DFB). שיטה נפוצה ליצירת מיקרו-חלוקי שומנים מתוארת, בנוסף לשיטה חדשנית של עיבוי אותם עם שחול בלחץ גבוה בשלב אחד. שיטה זו נועדה לחסוך זמן, למקסם את היעילות ולייצר כמויות גדולות יותר של פתרונות microbubble וננו-טיפות למגוון רחב של יישומים באמצעות ציוד מעבדה משותף שנמצא במעבדות ביולוגיות רבות.
Introduction
סוכני ניגודיות אולטראסאונד (UCAs) גדלים במהירות בפופולריות עבור יישומי הדמיה וטיפול. Microbubbles, UCAs המקורי, הם כיום סוכני המיינסטרים המשמשים ביישומי אבחון קליניים. Microbubbles הם כדורים מלאים בגז, בדרך כלל 1-10 מיקרומטר קוטר, מוקף שומנים, חלבון, או קליפות פולימר1. עם זאת, גודלם ויציבותם יכולים להגביל את הפונקציונליות שלהם ביישומים רבים. ננו-טיפות פאזה, המכילות ליבה נוזלית מחוממת במיוחד, יכולות להתגבר על חלק מהמגבלות הללו בשל גודלן הקטן יותר ושיפור מחזור החיים2. כאשר הם נחשפים לחום או לאנרגיה אקוסטית, הליבה הנוזלית החמה מתאדה ויוצרת מיקרו-bble גז2,3,4,5. מכיוון שסף האידוי קשור ישירות לגודל טיפה 5,6, גיבוש מתלים טיפה בגודל אחיד יהיה רצוי מאוד להשגת סף הפעלה עקבי. שיטות ניסוח המייצרות גדלי טיפה אחידים הן לעתים קרובות מורכבות ויקרות, בעוד גישות חסכוניות יותר גורמות לפתרונות פולידיספרסה7. מגבלה נוספת היא היכולת לייצר טיפות יציבות של הסטת פאזה עם גזי פרפלואורוקרבון (PFC) בעלי נקודת רתיחה נמוכה, שהיא קריטית להפעלה יעילה ב-vivo8. בכתב יד זה, פרוטוקול מתואר ליצירת טיפות יציבות של נקודה נמוכה המסוננות ברתיחה נמוכה עבור יישומי הדמיה וטיפול ב- vivo.
ישנן שיטות רבות לייצור טיפות שינוי פאזה מונודיספרסות 7. אחת השיטות החזקות ביותר לשליטה בגודל היא השימוש במכשירים מיקרופלואידיים. מכשירים אלה יכולים להיות יקרים, יש שיעורים איטיים של ייצור טיפות (~ 104-106 טיפות / s)7, ודורשים הכשרה נרחבת. התקנים מיקרופלואידיים דורשים בדרך כלל גזים בנקודת רתיחה גבוהה כדי למנוע אידוי ספונטני וסתימה של המערכת7. עם זאת, מחקר שנערך לאחרונה על ידי דה Gracia Lux et al.9 מדגים כיצד קירור microfluidizer יכול לשמש כדי ליצור ריכוזים גבוהים של שינוי פאזה תת מיקרון (1010-1012/mL) באמצעות decafluorobutane נקודת רתיחה נמוכה (DFB) או octafluoropropane (OFP).
באופן כללי, גזים נקודת רתיחה נמוכה כגון DFB או OFP קל יותר להתמודד באמצעות בועות גז מעוצב מראש. טיפות Vaporizable ניתן לייצר מבועות מיוצבת שומנים מראש על ידי עיבוי הגז באמצעות טמפרטורות נמוכות ולחץ גבוה5,10. ריכוז הטיפות המיוצרות בשיטה זו תלוי בריכוז מיקרו-בועות מבשר ויעילות ההמרה של בועות לט טיפות. מיקרו-בועות מרוכזות דווחו מ- sonication טיפ המתקרב > 1010 MB/mL11, בעוד מחקר נפרד דיווח על ריכוזי טיפות הנעים בין ~ 1-3 x1011 טיפות / מ"ל מבועות OFP ו- DFP מרוכזות12. כאשר טיפות מונודיספרסיות אינן דאגה, שיטות עיבוי הן השיטות הפשוטות ביותר בעלות הנמוכה ביותר ליצירת טיפות הזזת פאזה מיוצבות בשומנים באמצעות PFCs של נקודת רתיחה נמוכה. שיטות ליצירת בועות בגודל אחיד לפני עיבוי יכולות לעזור ליצור אוכלוסיות מונודיספרזה יותר של טיפות. עם זאת, יצירת בועות מבשרי monodisperse היא גם קשה, הדורש גישות יקרות יותר כגון microfluidics או טכניקות צנטריפוגה דיפרנציאלית חוזרת11. גישה חלופית לייצור ננו-טיפות DFB ו- OFB פורסמה לאחרונה באמצעות התגרענות ספונטנית של טיפות בליפוזומים13. שיטה זו, תוך שימוש באפקט "אוזו", היא דרך פשוטה ליצור טיפות PFC בנקודת רתיחה נמוכה ללא צורך לדחוס בועות. התפלגות הגודל של טיפות PFC יכולה להיות נשלטת על ידי titration עדין ערבוב PFC, שומנים, ואתנול רכיבים המשמשים ליזום התגרענות של טיפות. ראוי גם לציין כי ערבוב של perfluorocarbons יכול לשמש כדי לשלוט ביציבות סף הפעלה של nanodroplets14,15. עבודה עדכנית יותר על ידי Shakya ואח 'מדגים כיצד הפעלת nanodroplet ניתן לכוונן על ידי אמולסיה של PFCs נקודת רתיחה גבוהה אמולסיה בתוך אנדוסקלטון פחמימנים כדי להקל על התגרענות הטרוגנית בתוך הליבה טיפה16, שהיא גישה שניתן לשקול יחד עם צורות אחרות של סינון גודל טיפה.
לאחר שנוצר, טיפות פאזה-shift ניתן להבלט לאחר היווצרות כדי ליצור אוכלוסיות monodisperse יותר. למעשה, פרוטוקול דומה לשיטה המתוארת כאן פורסם בעבר על ידי Kopechek et al.17 באמצעות dodecofluorpentane נקודת רתיחה גבוהה (DDFP) כליבה טיפה. קוראים המבקשים להשתמש טיפות פאזה-shift עם perfluorocarbons נקודת רתיחה גבוהה (יציב בטמפרטורת החדר) צריך להתייחס למאמר לעיל במקום. ייצור וחילוק טיפות עם גזים נקודת רתיחה נמוכה, כגון DFB ו- OFP, הוא מסובך יותר והוא ניגש בצורה הטובה ביותר על ידי עיבוי בועות גז מעוצבות מראש.
בפרוטוקול זה, שיטה נפוצה של יצירת microbubbles שומנים מראש עם ליבת גז DFB באמצעות sonication קצה בדיקה מתואר. לאחר מכן, אקסלר מסחרי משמש לדחיסת מיקרו-יבלות מעוצבות מראש לננו-טיפות משנה של הסטת פאזה (איור 1). הטיפות המתקבלות ניתנות להפעלה על ידי חום ואולטרסאונד. שיטה זו יכולה לייצר כמויות גדולות יותר של פתרון nanodroplet מאשר שיטות עיבוי קונבנציונליות עם חלוקת גודל צרה יותר ללא צורך במכשירים מיקרופלואידיים יקרים. ייצור פתרונות ננו-טיפות עם התפלגות גודל צרה יכול ככל הנראה ליצור סף אידוי אחיד יותר. זה ימקסם את הפוטנציאל שלהם עבור יישומים רבים כגון הדמיה, אבלציה, משלוח סמים, תסחיף1,3,4,6.
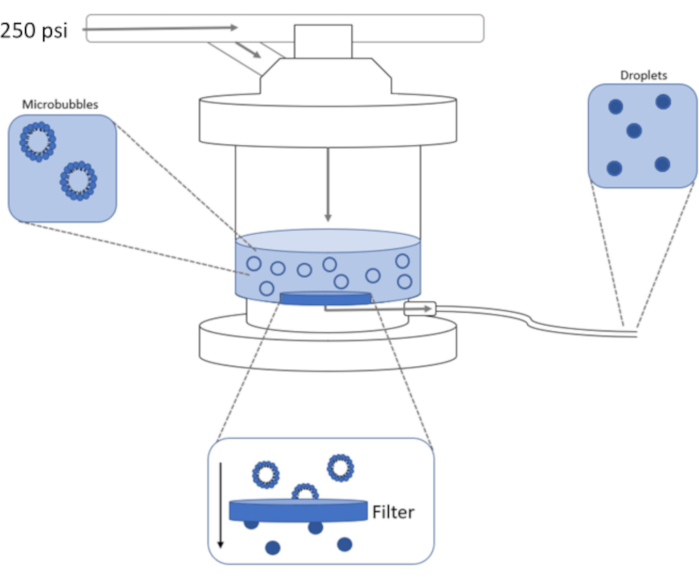
איור 1: סכמטי של מערך שחול בלחץ גבוה לעיבוי מיקרו-חלוקים מעוצבים מראש לננו-טיפות פאזה.. פתרון Microbubble מתווסף ומכולם בתא extruder, ו 250 פסאיי, ממיכל החנקן, מוחל דרך שסתום הכניסה של החדר. גז החנקן ידחוף את תמיסת המיקרו-חלוק דרך המסנן שבבסיס התא, וידחוס את הדגימה לננו-טיפות. הפתרון נדחף סוף סוף מתוך extruder דרך צינור שקע מדגם ונאסף. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. ביצוע סרטי שומנים בדם
- הכן סרטי שומנים לדור microbubble באמצעות 90% DSPC ו 10% DSPE-PEG2K על ידי ערבוב השומנים ביחס הנכון באמצעות הכיוונים הבאים:
- הפוך שומנים מלאי של DSPC ו DSPE-PEG2K בכלורופורם. שקול 50 מ"ג של כל אבקת שומנים בבקבוקונים נפרדים. הוסף 1 מ"ל של כלורופורם לכל בקבוקון באמצעות מזרק זכוכית 1 מ"ל.
- הוסף 287 μL של מלאי DSPC ו 113 μL של מלאי DSPE-PEG2K (שניהם 50 מ"ג / מ"ל) לתוך בקבוקון נוצץ 20 מ"ל באמצעות מזרק זכוכית.
- יבש את השומנים המעורבים כדי להסיר כלורופורם באמצעות חנקן. באמצעות אורך מתאים של צינורות המחוברים לחנקן הבית, זרימה קלות גז חנקן מעל מרחב הראש של ה- Vial תוך ערבוב. המשך עד שלא נצפה כלורופורם, וסרט השומנים הנותר מתחיל להפוך ללבן. השתמש בכובעי בורג פוליפרופילן, לכסות את המדגם תוך החדרת חנקן במרחב הראש.
- מניחים בקבוקונים תחת ואקום לילה באמצעות חיטוי ואקום כדי להסיר כלורופורם שיורית. סרט שקוף דק יישאר שמצפה את תחתית המצוינה.
- יש לאחסן בקבוקונים ב-20 מעלות צלזיוס עד הצורך.
2. יצירת מיקרו-יבלים מסרטי שומנים
- כדי להפוך את microbubbles, להוסיף 10 מ"ל של תמיסת מלח חוצץ פוספט 1x (PBS) המכיל 20% v / v פרופילן גליקול ו 20% v / v גליצל (pH סופי 7.2-7.4) לסרט שומנים יבש.
- מכסים מחדש את המדגם ואת המדגם החם ל 65 °C (30 דקות על בלוק חימום (או אמבט מים מחומם).
- בזמן המדגם מתחמם, להכין את sonicator האמבטיה על ידי הגדלת טמפרטורת האמבטיה ל 65 °C (65 °F).
הערה: תהליך זה מהיר יותר אם המים מחומם מראש במיקרוגל או בפלינט לפני הצבת sonicator האמבטיה. - מניחים את מקטורון הניצוצים המכיל את המדגם המחומם בסוניקטור האמבטיה, כך שרק החלק של הוויאל המכיל את תמיסת השומנים שקוע באמבט המים.
- Sonicate פתרון השומנים החם במשך מינימום של 15 דקות. ודא כי טמפרטורת המים נשארת ב 65 °C (65 °F). המשיכו להתרווח במרווחים של 10-15 דקות עד שהפתרון יהיה ברור לחלוטין (איור 2).
הערה: אם sonicator אמבטיה אינו זמין, הפתרון יכול להיות sonicated טיפ ב 10% כוח עד ברור. עם זאת, המיקרו-קצה יתפוגח מהר יותר ויקר יותר להחלפתו.

איור 2: דוגמה לסרטי שומנים מיובשים. דוגמה לסרט שומנים מיובש (A) לפני ו-(B) לאחר sonication אמבטיה כדי ליצור שלפוחיות חד-למלר. לאחר sonication אמבטיה, פתרון השומנים צריך לעבור מפתרון אטום יותר לשקוף. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- בעודכם עדיין חמים, הסירו את המכסה והידוקו את הקטוריון לתוך המתחם אטום לרעש של הסוניקטור, כך שהחיבור הזעיר-קצה של הסוניקאטור שקוע ממש מתחת לממשק האוויר/נוזל (איור 3).
- מניחים את הטנק של decafluorobutane ליד המתחם אטום לרעש של sonicator.
- הכן אמבט קרח והצב אותה ליד המתחם אטום לרעש. פעולה זו תשמש בהמשך שלב 2.14.
- הפעל את מתג ההפעלה עבור sonicator.
- לאחר הפעלת המערכת, הגדר את רמת ההספק ל- 70%. אין לחרוג מ-70% משרעת עם צירוף המיקרו-קצה. אל תתחיל את sonicator בשלב זה.
- צרף אורך מתאים של צינורות כדי להנחות את הגז משקע טנק DFB לתוך תמיסה שומנים חמים המוחזק במתחם. הצינור צריך להיות ממוקם רק לתוך הצוואר של הוויאל כדי לאפשר גז לזרום לתוך מרחב הראש במהלך sonication (איור 3).
- פתח את שסתום המיכל לאט עד שניתן יהיה לראות את הגז זורם מעל תמיסה שומנים בדם. זה יגרום גלים קלים על פני השטח של הנוזל. אם זרימת הגז גבוהה מדי, הפתרון יעלה על גדותיו במהלך ניסוח חלוקי מיקרו.
- הפעל את sonicator ולהפעיל במשך 10 s ברציפות כדי ליצור microbubbles. אם פתרון הבועה מתחיל לעלות על גדותיו במהלך sonication, מיד להפסיק את sonicator.
- כבה את sonicator ומיד לסגור את שסתום טנק DFB.
- מכסים במהירות את תמיסת המיקרו-חלוק ומטביעים את בקבוקון באמבט הקרח כדי לקרר את המדגם מתחת ל-55 מעלות צלזיוס (טמפרטורת המעבר מזכוכית של DSPC)
- השאירו את דגימות המיקרו-חלוק באמבט הקרח עד שיידרש.

איור 3: מיקום קצה בדיקה לתמיסת שומנים כדי לייעל את היווצרות המיקרו-חלוק. יש להקפיד לא לאפשר לקצה הגשוש לגעת בכוס. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. הכנת מסחטה לתחוב מיקרו-חלוק
- להרכיב מחול בלחץ גבוה כמפורט במדריך למשתמש באמצעות מסנן קרמיקה 200 ננומטר (מסופק מהיצרן).
- מניחים את המכבש במרכז מיכל אטום למים, כך צינור שקע מדגם לא נלחץ על הצד או קמט.
- צמד את המהלל למיכל גז חנקן באמצעות מתאם שסופק על ידי היצרן.
- הפוך אמבט קרח מלוח -2 מעלות צלזיוס במיכל אטום למים סביב המהלומה באמצעות 400 מ"ל של מים ו 10 גרם של נתרן כלורי.
- מניחים את קצה צינור השקע בלוויה נוצצת כדי לאסוף את הדגימה המובלטת.
הערה: אבטחו את הצינור למיכל עם סרט הדבקה אם הוא לא שוכב שטוח או נשאר בתוך הוויאל.
4. הקדמת המהלומה לתחוב מיקרו-חלוק
- פתח וסגור את שסתום השחרור כדי לוודא שאין לחץ בתוך המהלל.
- הסר את מכסה התא ולהוסיף 5 מ"ל של PBS 1x לתא extruder.
- החלף את המכסה וודא שהוא לוחץ בבטחה בחזרה למקומו.
- פתח את מיכל הדלק של החנקן כך שמד הלחץ יקרא 250 פסאיי. ודא שסתום בקרת הלחץ הוא במצב סגור.
- סגור את מיכל הדלק ופתח את שסתום הכניסה של תא המפלט. פתרון PBS יידחף דרך המערכת החוצה צינור שקע מדגם לתוך מטען הניצוץ.
- כאשר רק גז יוצא הצינורות, לפתוח את שסתום השחרור ולאפשר את הלחץ ליפול 0 פסאיי.
- הסר את מקטורן הניקוד.
5. מיקרו-קירור לפני שחול
- פתח וסגור את שסתום השחרור כדי לוודא שאין לחץ בתוך המהלל. מניחים מקטורן נוצץ חדש בקצה שפופרת השקע.
- מלא מיכל פלדה עם 2-מתיל בוטאן ולהוסיף קרח יבש כדי להוריד את הטמפרטורה למינוס 18 מעלות צלזיוס.
- הכנס את פתרון microbubble לתוך 2-מתיל בוטאן צונן כך המדגם הוא שקוע במשך 2 דקות. מעבירים את מילון הניקוד לאורך 2 הדקות כדי לערבב בעדינות את הבועות. מוסיפים קרח יבש לפי הצורך כדי לשמור על הטמפרטורה בין -15 ל -18 °C (70 °F). היזהר לא לחרוג -20 °C (70 °F) או הפתרון excipient יקפיא ולהרוס את דגימת הבועה.
הערה: שלבים 5.2 ו-5.3 יכולים להיעשות גם על ידי קירור דגימת הבועה במקפיא מעבדה לאורך פרק זמן ממושך יותר. עם זאת, יש להשתמש בזהירות כדי לפקח בזהירות על טמפרטורת המקפיא ולהימנע מהקפאת המדגם. - לאחר 2 דקות, להסיר את microbubbles מן 2-מתיל בוטאן צונן, בעדינות לנער את הבקבוקון לערבב את microbubbles ולהשתמש מזרק מצונן 10 מ"ל כדי להעביר את הפתרון אל extruder.
- הסר את מכסה תא extruder ולהוסיף את פתרון microbubble לתא על ידי לחיצה איטית הבוכנה על המזרק. החלף את מכסה ההפרשה וודא שהוא לוחץ בבטחה בחזרה במקומו.
- ודא כי שסתום בקרת הלחץ ואת שסתום השחרור של extruder נמצאים במצב סגור.
- פתח את מיכל הדלק של החנקן עד שמד הלחץ יקרא 250 פסאיי, סגור את מיכל הדלק וסובב את שסתום בקרת הלחץ למיקום הפתוח.
- כאשר הפתרון מילא את מקטורן הניצוצים בצינורות היציאה, ורק גז יוצא מהצינור, פתח לאט את שסתום שחרור הלחץ ואפשר ללחץ ליפול ל - 0 פסאיי.
- מניחים את מילון הניצים באמבט קרח או במקרר לאחסון.
- לאחסון לטווח ארוך ולמזעור אידוי ספונטני, יש לאחסן את הדגימה במקפיא סטנדרטי. ודא את הטמפרטורה היא -20 °C (C) ומעלה כדי למנוע הקפאת המדגם (הפתרון המרגש של 20% PPG ו 20% גליסול ימנע את המדגם מהקפאה ברוב מקפיאי המעבדה).
6. הפרדת טיפות ליפוזומים לפי צנטריפוגה
- העבר 10 מ"ל של פתרון טיפה מובלט לצינור צנטריפוגה 15 מ"ל.
- צנטריפוגה הדגימה המובלטת ב 1,500 x g במשך 10 דקות ב 4 °C (70 °F). גלולה המורכבת מננו-טיפות DFB תיתגלה בתחתית הצינור (איור 4). טיפות מתאדות באופן ספונטני יופיעו בחלק העליון של הפתרון ויש להשליך.

איור 4: דוגמה לטפות DFB בהזזת פאזה לאחר צנטריפוגה. ננו-טיפות DFB צפופות יותר ליפוזומים ויאספו בתחתית צינור הצנטריפוגה בכדור (קופסה אדומה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הסר את supernatant ו resuspend הכדור ב 2 מ"ל של 1x PBS עם 20% גליצל ו 20% פרופילן גליקול.
- מערבבים את הצינור בעדינות כדי להשיג פתרון הומוגני ולהעביר את הטיפות לצינור צנטריפוגה קטן יותר של 2 מ"ל.
- לשטוף את הדגימה פעמיים נוספות בצינור צנטריפוגה 2 מ"ל.
- לאחר הכביסה האחרונה, resuspend הכדור ב 100 μL של 1x PBS עם 20% גליצל ו 20% פרופילן גליקול ולאחסן על קרח או במקפיא עד הצורך.
7. אימות מיקרוסקופיה של אידוי טיפה
- הפוך פתרון טיפה מדולל על ידי הוספת 2.5 μl של טיפות מרוכזות ל 7.5 μl של 1x PBS.
- הכן שקופית מיקרוסקופ עם 10 מיקרול של המדגם המדולל. באמצעות מטרה של 40x, התבונן בדוגמה ושמור תמונות.
- הסר את השקופית מן המיקרוסקופ ומניחים אותו על צלחת חום 65 °C במשך 1 דקות כדי לאדות nanodroplets לתוך microbubbles.
- השתמש באותה מטרה 40x כדי לצפות במדגם לאחר חימום כדי לאמת אידוי טיפה.
תוצאות
תוצאות מייצגות של התפלגות הגודל כלולות באמצעות פיזור אור דינמי (DLS) וניתוח חישת פעימות התנגדותית (TRSP). איור 5 מציג את התפלגות הגודל של פתרונות בועות מרוכזים עם ובלי שחול. ללא שחול, הפרוטוקול מסתיים בשלב 5.3. הבועות המצונן מרוכזות על ידי אוורור המדגם ללחץ אטמוספרי בזמן הקור. המד...
Discussion
גוף ספרות מקיף זמין הדן בניסוח, בפיזיקה וביישומים פוטנציאליים של מיקרו-יבלות וטיפות פאזה-הסטה להדמיה וטיפול ב- vivo. דיון זה נוגע במפורש ליצירת מיקרו-חלוקי שומנים ולהמרתם לטירות משנה-מיקרון של העברת פאזה באמצעות גז DFB של נקודת רתיחה נמוכה ושחול בלחץ גבוה. השיטה המתוארת כאן נועדה לספק שיטה פש?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לדומיניק ג'יימס במעבדתו של ד"ר קן הויט על שסיפק ניתוח TRSP של ננו-טיפות פאזה-הסטה בלתי ניתנות לערפדיות
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | - | - | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | - | - | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | - | - | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | - | - | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
References
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved