È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione di nanogoccia di decafluorobutano a spostamento di fase filtrate a membrana da microbolle preformate
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per generare grandi volumi di microbolle di decafluorobutano incapsulate lipidiche utilizzando la sonicazione a punta di sonda e successivamente condensarle in nanogoccioline a sfasamento utilizzando l'estrusione ad alta pressione e la filtrazione meccanica.
Abstract
Esistono molti metodi che possono essere utilizzati per la produzione di goccioline a sfasamento vaporizzabili per l'imaging e la terapia. Ogni metodo utilizza tecniche diverse e varia nel prezzo, nei materiali e nello scopo. Molti di questi metodi di fabbricazione si traducono in popolazioni polidisperse con soglie di attivazione non uniformi. Inoltre, il controllo delle dimensioni delle goccioline richiede in genere liquidi perfluorocarburi stabili con soglie di attivazione elevate che non sono pratiche in vivo. Produrre goccioline di dimensioni uniformi utilizzando gas a basso punto di ebollizione sarebbe utile per gli esperimenti di imaging e terapia in vivo. Questo articolo descrive un metodo semplice ed economico per la formazione di nanogoccioline a sfasamento stabilizzate con lipidi filtrati con defluorobutano a basso punto di ebollizione (DFB). Viene descritto un metodo comune per generare microbolle lipidiche, oltre a un nuovo metodo per condensarle con estrusione ad alta pressione in un unico passaggio. Questo metodo è progettato per risparmiare tempo, massimizzare l'efficienza e generare volumi maggiori di soluzioni di microbolle e nanogoccioline per un'ampia varietà di applicazioni utilizzando apparecchiature di laboratorio comuni presenti in molti laboratori biologici.
Introduzione
Gli agenti di contrasto ad ultrasuoni (UCA) stanno rapidamente crescendo in popolarità per le applicazioni di imaging e terapia. Le microbolle, gli UCA originali, sono attualmente gli agenti principali utilizzati nelle applicazioni diagnostiche cliniche. Le microbolle sono sfere piene di gas, tipicamente di 1-10 μm di diametro, circondate da gusci lipidici, proteici o polimerici1. Tuttavia, le loro dimensioni e la stabilità in vivo possono limitare la loro funzionalità in molte applicazioni. Le nanogoccioline a sfasamento, che contengono un nucleo liquido surriscaldato, possono superare alcune di queste limitazioni a causa delle loro dimensioni più ridotte e della migliore durata della circolazione2. Se esposto al calore o all'energia acustica, il nucleo liquido surriscaldato vaporizza per formare una microbolletta di gas2,3,4,5. Poiché la soglia di vaporizzazione è direttamente correlata alla dimensione delle goccioline5,6, la formulazione di sospensioni di goccioline con dimensioni uniformi sarebbe altamente auspicabile per raggiungere soglie di attivazione coerenti. I metodi di formulazione che producono dimensioni uniformi delle goccioline sono spesso complessi e costosi, mentre approcci più convenienti si traducono in soluzioni polidisperse7. Un'altra limitazione è la capacità di generare goccioline stabili a sfasamento con gas perfluorocarburi (PFC) a basso punto di ebollizione, che è fondamentale per un'attivazione efficiente in vivo8. In questo manoscritto, viene descritto un protocollo per la generazione di goccioline a sfasamento vaporizzabili a basso punto di ebollizione filtrate stabili per applicazioni di imaging e terapia in vivo.
Esistono molti metodi per produrre goccioline a sfasamento submicroniche monodisperse7. Uno dei metodi più robusti per controllare le dimensioni è l'uso di dispositivi microfluidici. Questi dispositivi possono essere costosi, avere tassi lenti di produzione di goccioline (~ 104-106 goccioline / s) 7 e richiedono una formazione approfondita. Anche i dispositivi microfluidici richiedono generalmente gas ad alto punto di ebollizione per evitare la vaporizzazione spontanea e l'intasamento del sistema7. Tuttavia, un recente studio di de Gracia Lux et al.9 dimostra come il raffreddamento di un microfluidizzatore possa essere utilizzato per generare alte concentrazioni di sfasamento sub-micron (1010-1012 / mL) utilizzando decafluorobutano a basso punto di ebollizione (DFB) o ottafluoropropano (OFP).
In generale, i gas a basso punto di ebollizione come DFB o OFP sono più facili da gestire utilizzando bolle di gas preformate. Le goccioline vaporizzabili possono essere prodotte da bolle precursori stabilizzate ai lipidi condensando il gas utilizzando basse temperature e pressione elevata5,10. La concentrazione di goccioline prodotte con questo metodo dipende dalla concentrazione di microbolle precursori e dall'efficienza di conversione delle bolle in goccioline. Microbolle concentrate sono state riportate da una sonicazione della punta che si avvicina > 1010 MB / mL11, mentre uno studio separato ha riportato concentrazioni di goccioline che vanno da ~ 1-3 x1011 goccioline / mL da bolle condensate OFP e DFP12. Quando le goccioline monodisperse non sono un problema, i metodi di condensazione sono i metodi più semplici e più economici per generare goccioline a sfasamento stabilizzate con lipidi utilizzando PFC a basso punto di ebollizione. I metodi per generare bolle di dimensioni uniformi prima della condensazione possono aiutare a creare più popolazioni monodisperse di goccioline. Tuttavia, anche la generazione di bolle precursori monodisperse è difficile, richiedendo approcci più costosi come la microfluidica o tecniche di centrifugazione differenziale ripetuta11. Un approccio alternativo alla produzione di nanogoccioline DFB e OFB è stato recentemente pubblicato utilizzando la nucleazione spontanea di goccioline nei liposomi13. Questo metodo, che utilizza un effetto "Ouzo", è un modo semplice per generare goccioline PFC a basso punto di ebollizione senza dover condensare bolle. La distribuzione dimensionale delle goccioline PFC può essere controllata mediante una delicata titolazione e miscelazione di componenti PFC, lipidi ed etanolo utilizzati per avviare la nucleazione delle goccioline. Vale anche la pena notare che la miscelazione di perfluorocarburi può essere utilizzata per controllare la stabilità e le soglie di attivazione delle nanogoccioline14,15. Un lavoro più recente di Shakya et al. dimostra come l'attivazione delle nanogoccioline possa essere sintonizzata emulsionando PFC ad alto punto di ebollizione all'interno di un endoscheletro di idrocarburi per facilitare la nucleazione eterogenea all'interno del nucleo di goccioline16, che è un approccio che può essere considerato insieme ad altre forme di filtrazione delle dimensioni delle goccioline.
Una volta formate, le goccioline a sfasamento possono essere estruse dopo la formazione per creare più popolazioni monodisperse. In effetti, un protocollo simile al metodo qui descritto è stato pubblicato in precedenza da Kopechek et al.17 utilizzando il dodecofluorpentano ad alto punto di ebollizione (DDFP) come nucleo di goccioline. I lettori che cercano di utilizzare goccioline a sfasamento con perfluorocarburi ad alto punto di ebollizione (stabili a temperatura ambiente) dovrebbero invece fare riferimento all'articolo sopra. Generare ed estrudere goccioline con gas a basso punto di ebollizione, come DFB e OFP, è più complicato e si avvicina meglio condensando bolle di gas preformate.
In questo protocollo, viene descritto un metodo comune per generare microbolle lipidiche preformate con un nucleo di gas DFB utilizzando la sonicazione della punta della sonda. Successivamente, un estrusore commerciale viene utilizzato per condensare microbolle preformate in nanogoccioline a sfasamento submicroniche (Figura 1). Le goccioline risultanti sono quindi attivabili dal calore e dagli ultrasuoni. Questo metodo può produrre volumi maggiori di soluzione di nanogoccioline rispetto ai metodi di condensazione convenzionali con distribuzioni dimensionali più strette senza la necessità di costosi dispositivi microfluidici. La produzione di soluzioni di nanogoccioline con distribuzioni di dimensioni ridotte può probabilmente generare soglie di vaporizzazione più uniformi. Ciò massimizzerà il loro potenziale per numerose applicazioni come l'imaging, l'ablazione, la somministrazione di farmaci e l'embolizzazione1,3,4,6.
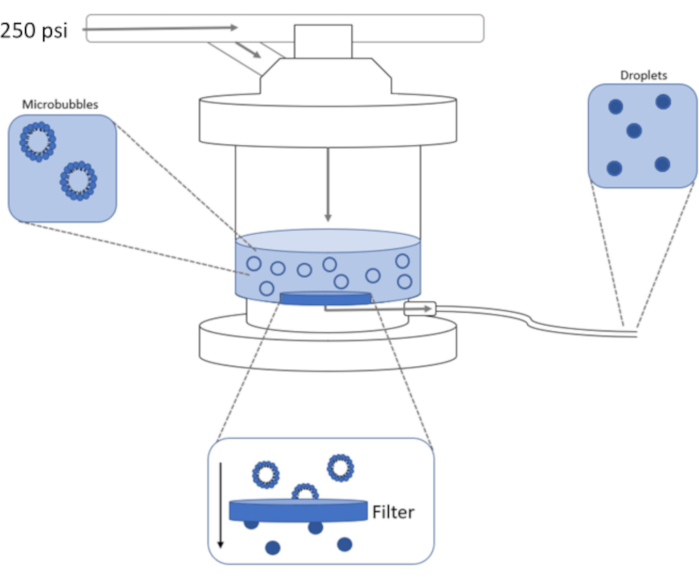
Figura 1: Schema di configurazione dell'estrusione ad alta pressione per condensare microbolle preformate in nanogoccioline a sfasamento. La soluzione di microbolle viene aggiunta e contenuta nella camera dell'estrusore e 250 psi, dal serbatoio dell'azoto, vengono applicati attraverso la valvola di ingresso della camera. Il gas azoto spingerà la soluzione di microbolle attraverso il filtro alla base della camera, condensando il campione in nanogoccioline. La soluzione viene infine spinta fuori dall'estrusore attraverso il tubo di uscita del campione e raccolta. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
1. Fare film lipidici
- Preparare i film lipidici per la generazione di microbolle utilizzando il 90% di DSPC e il 10% di DSPE-PEG2K mescolando i lipidi al rapporto corretto utilizzando le seguenti indicazioni:
- Produrre lipidi di riserva di DSPC e DSPE-PEG2K in cloroformio. Pesare 50 mg di ogni polvere lipidica in flaconcini separati. Aggiungere 1 mL di cloroformio a ciascun flaconcino utilizzando una siringa di vetro da 1 mL.
- Aggiungere 287 μL di DSPC stock e 113 μL di DSPE-PEG2K stock (entrambi 50 mg/mL) in un flaconcino a scintillazione da 20 mL utilizzando una siringa di vetro.
- Asciugare i lipidi misti per rimuovere il cloroformio usando l'azoto. Utilizzando una lunghezza appropriata di tubo collegato all'azoto domestico, far scorrere leggermente l'azoto gassoso sullo spazio di testa del flaconcino durante la miscelazione. Continuare fino a quando non si osserva alcun cloroformio e il film lipidico rimanente inizia a diventare bianco. Utilizzare tappi a vite in polipropilene, coprire il campione mentre si introduce azoto nello spazio di testa.
- Mettere i flaconcini sotto vuoto durante la notte utilizzando un essiccatore sottovuoto per rimuovere qualsiasi cloroformio residuo. Rimarrà un sottile film traslucido che ricopre il fondo del flaconcino.
- Conservare i flaconcini a -20 °C fino a quando necessario.
2. Generazione di microbolle da film lipidici
- Per realizzare le microbolle, aggiungere 10 mL di 1x soluzione salina tampone fosfato (PBS) contenente il 20% v/v di glicole propilenico e il 20% v/v di glicerolo (pH finale 7,2-7,4) a un film lipidico secco.
- Richiudere il campione e riscaldare il campione a 65 °C per 30 minuti su un blocco riscaldante (o bagno d'acqua riscaldato).
- Mentre il campione si sta riscaldando, preparare il sonicatore da bagno aumentando la temperatura del bagno a 65 °C.
NOTA: questo processo è più veloce se l'acqua viene preriscaldata in un forno a microonde o in una piastra elettrica prima di essere inserita nel sonicatore da bagno. - Posizionare il flaconcino di scintillazione contenente il campione riscaldato nel sonicatore da bagno in modo che solo la parte del flaconcino contenente la soluzione lipidica sia immersa nel bagno d'acqua.
- Sonicare la soluzione lipidica calda per un minimo di 15 min. Assicurarsi che la temperatura dell'acqua rimanga a 65 °C. Continuare a sonicare a intervalli di 10-15 minuti fino a quando la soluzione non è completamente chiara (Figura 2).
NOTA: se non è disponibile un sonicatore da bagno, la soluzione può essere ventilata al 10% di potenza fino a quando non è libera. Tuttavia, il microtip si consumerà più rapidamente ed è più costoso da sostituire.

Figura 2: Esempio di film lipidici idratati. Esempio di film lipidico idratato (A) prima e (B) dopo la sonicazione del bagno per formare vescicole uni-lamellari. Dopo la sonicazione del bagno, la soluzione lipidica dovrebbe passare da una soluzione più opaca a una traslucida. Fare clic qui per visualizzare una versione più grande di questa figura.
- Mentre è ancora caldo, rimuovere il cappuccio e bloccare la fiala nell'involucro insonorizzato del sonicatore in modo che l'attacco microtip del sonicatore sia immerso appena sotto l'interfaccia aria/liquido (Figura 3).
- Posizionare il serbatoio di decafluorobutano accanto all'involucro insonorizzato del sonicatore.
- Preparare un bagno di ghiaccio e posizionarlo accanto al recinto insonorizzato. Questo verrà utilizzato più avanti nel passaggio 2.14.
- Accendere l'interruttore di alimentazione per il sonicatore.
- Dopo l'avvio del sistema, impostare il livello di potenza su 70%. Non superare l'ampiezza del 70% con l'attacco microtip. Non avviare il sonicatore in questo momento.
- Fissare una lunghezza appropriata del tubo per guidare il gas dall'uscita del serbatoio DFB nella soluzione lipidica calda contenuta nell'involucro. Il tubo deve essere posizionato appena nel collo del flaconcino per consentire al gas di fluire nello spazio di testa durante la sonicazione (Figura 3).
- Aprire lentamente la valvola del serbatoio fino a quando il gas può essere visto scorrere sulla soluzione lipidica. Ciò causerà lievi increspature sulla superficie del liquido. Se il flusso di gas è troppo alto, la soluzione traboccherà durante la formulazione di microbolle.
- Avviare il sonicatore e correre per 10 s continuamente per generare microbolle. Se la soluzione a bolle inizia a traboccare durante la sonicazione, arrestare immediatamente il sonicatore.
- Spegnere il sonicatore e chiudere immediatamente la valvola del serbatoio DFB.
- Chiudere rapidamente la soluzione di microbolle e immergere il flaconcino nel bagno di ghiaccio per raffreddare il campione al di sotto di 55 °C (temperatura di transizione vetrosa di DSPC)
- Lasciare i campioni di microbolle nel bagno di ghiaccio fino a quando non è necessario.

Figura 3: Posizionamento della punta della sonda in soluzione lipidica per ottimizzare la formazione di microbolle. Fare attenzione a non permettere alla punta della sonda di toccare il vetro. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Preparazione dell'estrusore per la condensazione delle microbolle
- Assemblare l'estrusore ad alta pressione come dettagliato nel manuale dell'utente utilizzando un filtro ceramico da 200 nm (fornito dal produttore).
- Posizionare l'estrusore al centro di un contenitore a tenuta stagna in modo che il tubo di uscita del campione non venga premuto contro il lato o crimpato.
- Accoppiare l'estrusore al serbatoio del gas azoto utilizzando l'adattatore fornito dal produttore.
- Fare un bagno di ghiaccio salato a -2 °C nel contenitore a tenuta stagna intorno all'estrusore usando 400 ml di acqua e 10 g di cloruro di sodio.
- Posizionare l'estremità del tubo di uscita in un flaconcino di scintillazione per raccogliere il campione estruso.
NOTA: Fissare il tubo al contenitore con del nastro adesivo se non è piatto o rimane all'interno del flaconcino.
4. Adescamento dell'estrusore per la condensazione di microbolle
- Aprire e chiudere la valvola di rilascio per assicurarsi che non vi sia alcuna pressione all'interno dell'estrusore.
- Rimuovere il coperchio della camera e aggiungere 5 mL di 1x PBS alla camera dell'estrusore.
- Sostituire il coperchio assicurandosi che torni saldamente in posizione.
- Aprire il serbatoio del gas azoto in modo che il manometro legga 250 psi. Assicurarsi che la valvola di controllo della pressione sia in posizione chiusa.
- Chiudere il serbatoio del gas e aprire la valvola di ingresso della camera dell'estrusore. La soluzione PBS verrà spinta attraverso il sistema e fuori dalla provetta di uscita del campione nel flaconcino di scintillazione.
- Quando solo il gas esce dal tubo, aprire la valvola di rilascio e lasciare che la pressione scenda a 0 psi.
- Rimuovere il flaconcino di scintillazione.
5. Microbolle di pre-raffreddamento per estrusione
- Aprire e chiudere la valvola di rilascio per assicurarsi che non vi sia alcuna pressione all'interno dell'estrusore. Posizionare un nuovo flaconcino a scintillazione all'estremità del tubo di uscita.
- Riempire un contenitore di acciaio con 2-metil butano e aggiungere ghiaccio secco per portare la temperatura a -18 °C.
- Inserire la soluzione di microbolle nel 2-metil butano refrigerato in modo che il campione venga immerso per 2 minuti. Spostare il flaconcino di scintillazione per 2 minuti per mescolare delicatamente le bolle. Aggiungere ghiaccio secco secondo necessità per mantenere la temperatura tra -15 e -18 °C. Fare attenzione a non superare i -20 °C o la soluzione dell'eccipiente si congelerà e distruggerà il campione di bolle.
NOTA: i passaggi 5.2 e 5.3 possono essere eseguiti anche raffreddando il campione di bolle in un congelatore di laboratorio per un periodo di tempo più lungo. Tuttavia, è necessario prestare attenzione per monitorare attentamente la temperatura del congelatore ed evitare di congelare il campione. - Dopo 2 minuti, rimuovere le microbolle dal 2-metil butano refrigerato, agitare delicatamente il flaconcino per mescolare le microbolle e utilizzare una siringa refrigerata da 10 mL per trasferire la soluzione all'estrusore.
- Rimuovere il coperchio della camera dell'estrusore e aggiungere la soluzione di microbolle alla camera spingendo lentamente lo stantuffo sulla siringa. Sostituire il cappuccio dell'estrusore assicurandosi che faccia clic saldamente di nuovo in posizione.
- Verificare che la valvola di controllo della pressione e la valvola di rilascio dell'estrusore siano in posizione chiusa.
- Aprire il serbatoio del gas azoto fino a quando il manometro legge 250 psi, chiudere il serbatoio del gas e ruotare la valvola di controllo della pressione in posizione aperta.
- Quando la soluzione ha riempito il flaconcino di scintillazione nel tubo di uscita e solo il gas esce dal tubo, aprire lentamente la valvola di rilascio della pressione e lasciare che la pressione scenda a 0 psi.
- Mettere il flaconcino di scintillazione in un bagno di ghiaccio o in frigorifero per la conservazione.
- Per la conservazione a lungo termine e ridurre al minimo la vaporizzazione spontanea, conservare il campione in un congelatore standard. Assicurarsi che la temperatura sia di -20 °C o superiore per evitare il congelamento del campione (la soluzione di eccipiente di PPG al 20% e glicerolo al 20% impedirà al campione di congelarsi nella maggior parte dei congelatori di laboratorio).
6. Separare le goccioline dai liposomi mediante centrifugazione
- Trasferire 10 mL della soluzione di goccioline estruse in un tubo centrifugo da 15 mL.
- Centrifugare il campione estruso a 1.500 x g per 10 minuti a 4 °C. Un pellet composto da nanogoccioline DFB sarà evidente nella parte inferiore del tubo (Figura 4). Le goccioline vaporizzate spontaneamente appariranno nella parte superiore della soluzione e dovrebbero essere scartate.

Figura 4: Esempio di pellettizzazione di goccioline DFB a sfasamento dopo centrifugazione. Le nanogoccioline DFB sono più dense dei liposomi e si raccoglieranno sul fondo del tubo della centrifuga in un pellet (scatola rossa). Fare clic qui per visualizzare una versione più grande di questa figura.
- Rimuovere il surnatante e risospese il pellet in 2 mL di 1x PBS con il 20% di glicerolo e il 20% di glicole propilenico.
- Mescolare delicatamente il tubo per ottenere una soluzione omogenea e trasferire le goccioline in un tubo centrifugo più piccolo da 2 ml.
- Lavare il campione altre due volte in un tubo di centrifuga da 2 ml.
- Dopo l'ultimo lavaggio, risospesciare il pellet in 100 μL di 1x PBS con il 20% di glicerolo e il 20% di glicole propilenico e conservare sul ghiaccio o nel congelatore fino a quando necessario.
7. Verifica al microscopio della vaporizzazione delle goccioline
- Fare una soluzione di goccioline diluita aggiungendo 2,5 μl di goccioline concentrate a 7,5 μl di 1x PBS.
- Preparare un vetrino per microscopio con 10 μl del campione diluito. Utilizzando un obiettivo 40x, osservare il campione e salvare le immagini.
- Rimuovere il vetrino dal microscopio e posizionarlo su una piastra termica a 65 °C per 1 minuto per vaporizzare le nanogoccioline in microbolle.
- Utilizzare lo stesso obiettivo 40x per osservare il campione dopo il riscaldamento per verificare la vaporizzazione delle goccioline.
Risultati
I risultati rappresentativi della distribuzione dimensionale sono inclusi utilizzando la diffusione dinamica della luce (DLS) e l'analisi TRSP (Tunable Resistive Pulse Sensing). La Figura 5 mostra la distribuzione dimensionale delle soluzioni a bolle condensate con e senza estrusione. Senza estrusione, il protocollo termina al passaggio 5.3. Le bolle refrigerate vengono condensate sfogando il campione alla pressione atmosferica mentre è freddo. Il campione condensato ha una distribuzione mo...
Discussione
È disponibile un corpus completo di letteratura che discute la formulazione, la fisica e le potenziali applicazioni di microbolle e goccioline a sfasamento per l'imaging e la terapia in vivo. Questa discussione riguarda esplicitamente la generazione di microbolle lipidiche e la loro conversione in goccioline a sfasamento sub-micron utilizzando un gas DFB a basso punto di ebollizione ed estrusione ad alta pressione. Il metodo qui delineato ha lo scopo di fornire un metodo relativamente semplice per produrre grandi quanti...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare Dominique James nel laboratorio del Dr. Ken Hoyt per aver fornito l'analisi TRSP di nanogoccioline a sfasamento vaporizzabili
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | - | - | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | - | - | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | - | - | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | - | - | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
Riferimenti
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon