Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von membrangefilterten Phase-Shift-Decafluorbutan-Nanotröpfchen aus vorgeformten Mikrobläschen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Verfahren zur Erzeugung großer Mengen lipidverkapselter Decafluorbutan-Mikrobläschen mittels Sondenspitzen-Beschallung und anschließender Kondensation zu phasenverschobenen Nanotröpfchen mittels Hochdruckextrusion und mechanischer Filtration.
Zusammenfassung
Es gibt viele Methoden, die zur Herstellung von verdampfbaren Phasenverschiebungströpfchen für die Bildgebung und Therapie verwendet werden können. Jede Methode verwendet unterschiedliche Techniken und variiert in Preis, Material und Zweck. Viele dieser Herstellungsmethoden führen zu polydispersen Populationen mit ungleichmäßigen Aktivierungsschwellen. Darüber hinaus erfordert die Kontrolle der Tröpfchengrößen typischerweise stabile Perfluorcarbonflüssigkeiten mit hohen Aktivierungsschwellen, die in vivo nicht praktikabel sind. Die Herstellung einheitlicher Tröpfchengrößen unter Verwendung von Gasen mit niedrigem Siedepunkt wäre für In-vivo-Bildgebungs- und Therapieexperimente von Vorteil. Dieser Artikel beschreibt eine einfache und wirtschaftliche Methode zur Bildung von größengefilterten lipidstabilisierten Phasenverschiebungs-Nanotröpfchen mit niedrig siedendem Decafluorbutan (DFB). Eine gängige Methode zur Erzeugung von Lipid-Mikrobläschen wird beschrieben, zusätzlich zu einer neuartigen Methode, sie mit Hochdruckextrusion in einem einzigen Schritt zu kondensieren. Diese Methode wurde entwickelt, um Zeit zu sparen, die Effizienz zu maximieren und größere Mengen an Mikroblasen- und Nanotröpfchenlösungen für eine Vielzahl von Anwendungen mit gängigen Laborgeräten zu erzeugen, die in vielen biologischen Labors zu finden sind.
Einleitung
Ultraschall-Kontrastmittel (UCAs) werden für Bildgebungs- und Therapieanwendungen immer beliebter. Mikroblasen, die ursprünglichen UCAs, sind derzeit die Mainstream-Wirkstoffe, die in klinischen diagnostischen Anwendungen verwendet werden. Mikrobläschen sind gasgefüllte Kugeln mit einem Durchmesser von typischerweise 1-10 μm, die von Lipid-, Protein- oder Polymerhüllen umgeben sind1. Ihre Größe und In-vivo-Stabilität können jedoch ihre Funktionalität in vielen Anwendungen einschränken. Phasenverschobene Nanotröpfchen, die einen überhitzten flüssigen Kern enthalten, können einige dieser Einschränkungen aufgrund ihrer geringeren Größe und verbesserten Kreislauflebensdauer überwinden2. Wenn er Hitze oder akustischer Energie ausgesetzt wird, verdampft der überhitzte flüssige Kern zu einer Gasmikrobläsche2,3,4,5. Da die Verdampfungsschwelle in direktem Zusammenhang mit der Tröpfchengröße5,6 steht, wäre die Formulierung von Tröpfchensuspensionen mit einheitlicher Größe sehr wünschenswert, um konsistente Aktivierungsschwellen zu erreichen. Formulierungsverfahren, die einheitliche Tröpfchengrößen erzeugen, sind oft komplex und kostspielig, während kostengünstigere Ansätze zu polydispersen Lösungen führen7. Eine weitere Einschränkung ist die Fähigkeit, stabile Phasenverschiebungströpfchen mit perfluorierten (PFC)-Gasen mit niedrigem Siedepunkt zu erzeugen, was für eine effiziente Aktivierung in vivo8 entscheidend ist. In diesem Manuskript wird ein Protokoll zur Erzeugung stabiler, gefilterter, verdampfbarer Phasenverschiebungströpfchen mit niedrigem Siedepunkt für In-vivo-Bildgebungs- und Therapieanwendungen beschrieben.
Es gibt viele Methoden zur Herstellung monodispersierter Submikron-Phasenverschiebungströpfchen7. Eine der robustesten Methoden zur Kontrolle der Größe ist die Verwendung von mikrofluidischen Geräten. Diese Geräte können teuer sein, eine langsame Tröpfchenproduktion aufweisen (~ 104-106 Tröpfchen / s) 7 und erfordern ein umfangreiches Training. Mikrofluidische Geräte benötigen im Allgemeinen auch Gase mit hohem Siedepunkt, um eine spontane Verdampfung und Verstopfung des Systems zu vermeiden7. Eine aktuelle Studie von de Gracia Lux et al.9 zeigt jedoch, wie die Kühlung eines Mikrofluididizers verwendet werden kann, um hohe Konzentrationen von Submikron-Phasenverschiebung (1010-1012 / ml) unter Verwendung von Decafluorbutan (DFB) oder Octafluorpropan (OFP) mit niedrigem Siedepunkt zu erzeugen.
Im Allgemeinen sind Niedrigsiedepunktgase wie DFB oder OFP mit vorgeformten Gasblasen einfacher zu handhaben. Verdampfbare Tröpfchen können aus lipidstabilisierten Vorläuferblasen hergestellt werden, indem das Gas bei niedrigen Temperaturen und erhöhtem Druck kondensiert wird5,10. Die Konzentration der mit dieser Methode hergestellten Tröpfchen hängt von der Mikroblasenkonzentration der Vorstufe und der Effizienz der Umwandlung von Blasen in Tröpfchen ab. Konzentrierte Mikrobläschen wurden von der Spitzenbeschallung berichtet, die sich > 1010 MB / ml11 nähert, während eine separate Studie Tröpfchenkonzentrationen von ~ 1-3 x1011 Tröpfchen / ml aus kondensierten OFP- und DFP-Blasen12 gemeldet hat. Wenn monodispersierte Tröpfchen kein Problem darstellen, sind Kondensationsmethoden die einfachsten und kostengünstigsten Methoden zur Erzeugung von lipidstabilisierten Phasenverschiebungströpfchen unter Verwendung von PFCs mit niedrigem Siedepunkt. Methoden zur Erzeugung von Blasen gleichmäßiger Größe vor der Kondensation können dazu beitragen, mehr monodisperse Tröpfchenpopulationen zu erzeugen. Die Erzeugung monodisperser Vorläuferblasen ist jedoch ebenfalls schwierig, was kostspieligere Ansätze wie Mikrofluidik oder wiederholte differentielle Zentrifugationstechniken erfordert11. Ein alternativer Ansatz zur Herstellung von DFB- und OFB-Nanotröpfchen wurde kürzlich unter Verwendung der spontanen Keimbildung von Tröpfchen in Liposomen veröffentlicht13. Diese Methode, die einen "Ouzo" -Effekt verwendet, ist eine einfache Möglichkeit, PFC-Tröpfchen mit niedrigem Siedepunkt zu erzeugen, ohne Blasen kondensieren zu müssen. Die Größenverteilung der PFC-Tröpfchen kann durch delikate Titration und Mischen von PFC-, Lipid- und Ethanolkomponenten gesteuert werden, die zur Einleitung der Keimbildung der Tröpfchen verwendet werden. Es ist auch erwähnenswert, dass das Mischen von perfluorierten Kohlenwasserstoffen verwendet werden kann, um die Stabilität und die Aktivierungsschwellen von Nanotröpfchen zu kontrollieren14,15. Neuere Arbeiten von Shakya et al. zeigen, wie die Nanotröpfchenaktivierung durch Emulgieren von PFCs mit hohem Siedepunkt in einem Kohlenwasserstoff-Endoskelett abgestimmt werden kann, um die heterogene Keimbildung innerhalb des Tröpfchenkerns zu erleichtern16, was ein Ansatz ist, der zusammen mit anderen Formen der Tröpfchengrößenfiltration in Betracht gezogen werden kann.
Einmal gebildet, können Phasenverschiebungströpfchen nach der Bildung extrudiert werden, um mehr monodisperse Populationen zu erzeugen. Tatsächlich wurde ein ähnliches Protokoll wie die hier beschriebene Methode zuvor von Kopechek et al.17 unter Verwendung von Dodecofluorpentan (DDFP) mit hohem Siedepunkt als Tröpfchenkern veröffentlicht. Leser, die Phasenverschiebungströpfchen mit perfluorierten Kohlenwasserstoffen mit hohem Siedepunkt (stabil bei Raumtemperatur) verwenden möchten, sollten stattdessen auf den obigen Artikel verweisen. Das Erzeugen und Extrudieren von Tröpfchen mit Gasen mit niedrigem Siedepunkt wie DFB und OFP ist komplizierter und wird am besten durch Kondensieren von vorgeformten Gasblasen angegangen.
In diesem Protokoll wird eine gängige Methode zur Erzeugung von vorgeformten Lipid-Mikrobläschen mit einem DFB-Gaskern mittels Sondenspitzen-Beschallung beschrieben. Als nächstes wird ein kommerzieller Extruder verwendet, um vorgeformte Mikrobläschen zu Submikron-Phasenverschiebungs-Nanotröpfchen zu kondensieren (Abbildung 1). Die entstehenden Tröpfchen sind dann durch Hitze und Ultraschall aktierbar. Diese Methode kann größere Mengen an Nanotröpfchenlösung erzeugen als herkömmliche Kondensationsmethoden mit engeren Größenverteilungen, ohne dass teure mikrofluidische Geräte erforderlich sind. Die Herstellung von Nanotröpfchenlösungen mit engen Größenverteilungen kann wahrscheinlich gleichmäßigere Verdampfungsschwellen erzeugen. Dies wird ihr Potenzial für zahlreiche Anwendungen wie Bildgebung, Ablation, Arzneimittelabgabe und Embolisation maximieren1,3,4,6.
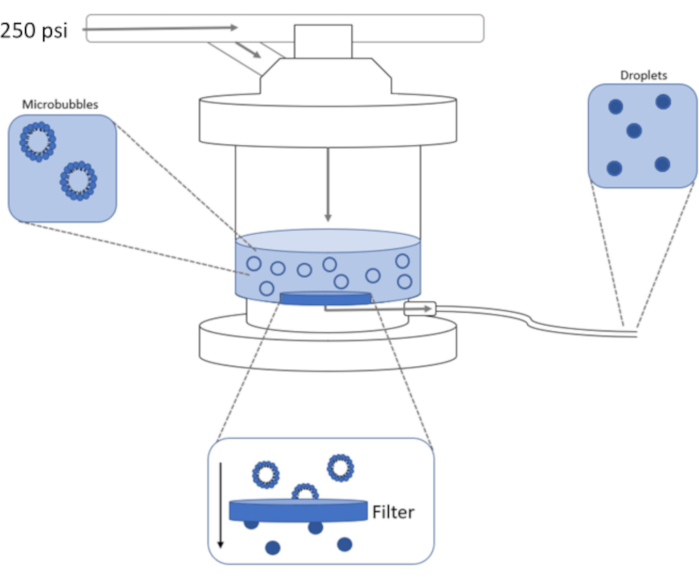
Abbildung 1: Schematische Darstellung des Hochdruck-Extrusionsaufbaus zur Kondensation von vorgeformten Mikrobläschen zu phasenverschobenen Nanotröpfchen. Mikrobläschenlösung wird in die Extruderkammer gegeben und in ihr enthalten, und 250 psi aus dem Stickstofftank werden durch das Kammereinlassventil aufgetragen. Das Stickstoffgas drückt die Mikrobläschenlösung durch den Filter an der Basis der Kammer und kondensiert die Probe zu Nanotröpfchen. Die Lösung wird schließlich durch das Probenauslassrohr aus dem Extruder geschoben und gesammelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
1. Lipidfilme herstellen
- Bereiten Sie Lipidfilme für die Mikrobläschenerzeugung mit 90% DSPC und 10% DSPE-PEG2K vor, indem Sie die Lipide im richtigen Verhältnis unter Verwendung der folgenden Anweisungen mischen:
- Herstellung von Stammlipiden aus DSPC und DSPE-PEG2K in Chloroform. Wiegen Sie 50 mg jedes Lipidpulvers in separaten Fläschchen. Geben Sie 1 ml Chloroform in jede Durchstechflasche mit einer 1 ml Glasspritze.
- Geben Sie 287 μL DSPC-Material und 113 μL DSPE-PEG2K-Material (beide 50 mg/ml) mit einer Glasspritze in eine 20-ml-Szintillationsflasche.
- Trocknen Sie die gemischten Lipide, um Chloroform mit Stickstoff zu entfernen. Unter Verwendung einer geeigneten Schlauchlänge, die mit dem Stickstoff des Hauses verbunden ist, wird beim Mischen das Stickstoffgas leicht über den Kopfraum der Durchstechflasche geleitet. Fahren Sie fort, bis kein Chloroform mehr beobachtet wird und der verbleibende Lipidfilm weiß wird. Verwenden Sie Polypropylen-Schraubverschlüsse, bedecken Sie die Probe, während Sie Stickstoff in den Kopfraum einführen.
- Legen Sie die Fläschchen über Nacht mit einem Vakuum-Exsikkator unter Vakuum, um Restchloroform zu entfernen. Ein dünner durchscheinender Film bleibt erhalten, der den Boden der Durchstechflasche bedeckt.
- Lagern Sie die Durchstechflaschen bei -20 °C, bis sie benötigt werden.
2. Erzeugung von Mikrobläschen aus Lipidfilmen
- Um die Mikrobläschen herzustellen, fügen Sie 10 ml 1x Phosphatpuffer-Kochsalzlösung (PBS) mit 20% v/v Propylenglykol und 20% v/v Glycerin (End-pH 7,2-7,4) zu einem trockenen Lipidfilm hinzu.
- Kappen Sie die Probe erneut und erwärmen Sie die Probe für 30 min auf 65 °C in einem Heizblock (oder beheizten Wasserbad).
- Während sich die Probe erwärmt, bereiten Sie den Badschallgerät vor, indem Sie die Badtemperatur auf 65 °C erhöhen.
HINWEIS: Dieser Vorgang ist schneller, wenn das Wasser in einer Mikrowelle oder Kochplatte vorgewärmt wird, bevor es in den Badschallgerät gegeben wird. - Legen Sie die Szintillationsflasche mit der erwärmten Probe in den Badschallgerät, so dass nur der Teil der Durchstechflasche, der die Lipidlösung enthält, in das Wasserbad eingetaucht wird.
- Die warme Lipidlösung wird mindestens 15 Minuten lang beschallt. Stellen Sie sicher, dass die Wassertemperatur bei 65 °C bleibt. In Abständen von 10-15 min weiter ultraschallisieren, bis die Lösung vollständig klar ist (Abbildung 2).
HINWEIS: Wenn kein Badschallgerät verfügbar ist, kann die Lösung mit 10% Leistung beschallt werden, bis sie klar ist. Der Mikrotip verschleißt jedoch schneller und ist teurer zu ersetzen.

Abbildung 2: Beispiel für hydratisierte Lipidfilme. Beispiel für einen hydratisierten Lipidfilm (A) vor und (B) nach der Beschallung des Bades zur Bildung von einlamellaren Vesikeln. Nach der Badbeschallung sollte die Lipidlösung von einer undurchsichtigeren zu einer durchscheinenden Lösung wechseln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Entfernen Sie im warmen Zustand die Kappe und klemmen Sie die Durchstechflasche in das schalldichte Gehäuse des Schallakutors, sodass die Mikrospitzenbefestigung des Ultraschallgeräts direkt unter der Luft-Flüssigkeits-Grenzfläche eingetaucht ist (Abbildung 3).
- Stellen Sie den Tank mit Decafluorbutan neben das schalldichte Gehäuse des Ultraschallgerätes.
- Bereiten Sie ein Eisbad vor und stellen Sie es neben das schalldichte Gehäuse. Dies wird später in Schritt 2.14 verwendet.
- Schalten Sie den Netzschalter für den Ultraschallgerät ein.
- Stellen Sie nach dem Systemstart die Leistungsstufe auf 70 % ein. Überschreiten Sie nicht 70% Amplitude mit dem Microtip-Aufsatz. Starten Sie den Ultraschallgerät zu diesem Zeitpunkt nicht.
- Befestigen Sie eine geeignete Schlauchlänge, um das Gas aus dem DFB-Tankauslass in die warme Lipidlösung im Gehäuse zu leiten. Das Röhrchen sollte direkt in den Hals der Durchstechflasche gelegt werden, damit während der Beschallung Gas in den Kopfraum fließen kann (Abbildung 3).
- Öffnen Sie das Tankventil langsam, bis das Gas über die Lipidlösung fließt. Dies führt zu leichten Wellen auf der Oberfläche der Flüssigkeit. Wenn der Gasfluss zu hoch ist, läuft die Lösung während der Mikroblasenformulierung über.
- Starten Sie den Ultraschallgerät und lassen Sie ihn 10 s kontinuierlich laufen, um Mikrobläschen zu erzeugen. Wenn die Blasenlösung während der Beschallung zu überlaufen beginnt, stoppen Sie sofort den Ultraschallgerät.
- Schalten Sie den Ultraschallgerät aus und schließen Sie sofort das DFB-Tankventil.
- Schließen Sie die Mikroblasenlösung schnell ab und tauchen Sie die Durchstechflasche in das Eisbad, um die Probe unter 55 °C zu kühlen (Glasübergangstemperatur von DSPC)
- Lassen Sie die Mikrobläschenproben bis zum Bedarf im Eisbad.

Abbildung 3: Platzierung der Sondenspitze in Lipidlösung zur Optimierung der Mikroblasenbildung. Achten Sie darauf, dass die Spitze der Sonde das Glas nicht berührt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Vorbereitung des Extruders für die Mikrobläschenkondensation
- Montieren Sie den Hochdruckextruder wie in der Bedienungsanleitung beschrieben mit einem 200 nm Keramikfilter (vom Hersteller geliefert).
- Stellen Sie den Extruder in die Mitte eines wasserdichten Behälters, damit das Probenauslassrohr nicht an die Seite gedrückt oder gekräuselt wird.
- Koppeln Sie den Extruder mit dem vom Hersteller gelieferten Adapter an den Stickstoffgastank.
- Machen Sie ein -2 °C gesalzenes Eisbad im wasserdichten Behälter um den Extruder mit 400 ml Wasser und 10 g Natriumchlorid.
- Legen Sie das Ende des Auslassrohrs in eine Szintillationsflasche, um die extrudierte Probe zu sammeln.
HINWEIS: Befestigen Sie das Röhrchen mit Klebeband am Behälter, wenn es nicht flach liegt oder in der Durchstechflasche bleibt.
4. Ansaugen des Extruders für Mikrobläschenkondensation
- Öffnen und schließen Sie das Entriegelungsventil, um sicherzustellen, dass kein Druck im Extruder vorhanden ist.
- Entfernen Sie den Kammerdeckel und geben Sie 5 ml 1x PBS in die Extruderkammer.
- Setzen Sie den Deckel wieder ein und stellen Sie sicher, dass er wieder sicher einrastet.
- Öffnen Sie den Stickstoffgastank, so dass das Manometer 250 psi anzeigt. Stellen Sie sicher, dass sich das Druckregelventil in der geschlossenen Position befindet.
- Schließen Sie den Gastank und öffnen Sie das Einlassventil der Extruderkammer. Die PBS-Lösung wird durch das System und aus dem Probenauslassröhrchen in die Szintillationsfläschchen geschoben.
- Wenn nur Gas aus dem Schlauch austritt, öffnen Sie das Entriegelungsventil und lassen Sie den Druck auf 0 psi fallen.
- Entfernen Sie die Szintillationsfläschchen.
5. Vorkühlen von Mikrobläschen für die Extrusion
- Öffnen und schließen Sie das Entriegelungsventil, um sicherzustellen, dass kein Druck im Extruder vorhanden ist. Legen Sie eine neue Szintillationsflasche an das Ende des Auslassrohrs.
- Füllen Sie einen Stahlbehälter mit 2-Methylbutan und fügen Sie Trockeneis hinzu, um die Temperatur auf -18 ° C zu senken.
- Geben Sie die Mikrobläschenlösung in das gekühlte 2-Methylbutan, so dass die Probe für 2 minuten eingetaucht wird. Bewegen Sie die Szintillationsflasche während der 2 Minuten, um die Blasen vorsichtig zu mischen. Fügen Sie nach Bedarf Trockeneis hinzu, um die Temperatur zwischen -15 und -18 °C zu halten. Achten Sie darauf, -20 °C nicht zu überschreiten, da sonst die Hilfsstofflösung gefriert und die Blasenprobe zerstört.
HINWEIS: Die Schritte 5.2 und 5.3 können auch durch Abkühlen der Blasenprobe in einem Laborgefrierschrank über einen längeren Zeitraum erfolgen. Es ist jedoch Vorsicht geboten, die Temperatur des Gefrierschranks sorgfältig zu überwachen und das Einfrieren der Probe zu vermeiden. - Entfernen Sie nach 2 min die Mikrobläschen aus dem gekühlten 2-Methylbutan, schütteln Sie die Durchstechflasche vorsichtig, um die Mikrobläschen zu mischen, und verwenden Sie eine gekühlte 10-ml-Spritze, um die Lösung in den Extruder zu überführen.
- Entfernen Sie den Deckel der Extruderkammer und geben Sie die Mikrobläschenlösung in die Kammer, indem Sie langsam den Kolben auf die Spritze drücken. Setzen Sie die Extruderkappe wieder ein, um sicherzustellen, dass sie wieder sicher einrastet.
- Stellen Sie sicher, dass sich das Druckregelventil und das Ablassventil des Extruders in der geschlossenen Position befinden.
- Öffnen Sie den Stickstoffgastank, bis das Manometer 250 psi anzeigt, schließen Sie den Gastank und drehen Sie das Druckregelventil in die geöffnete Position.
- Wenn die Lösung die Szintillationsflasche am Ausgangsschlauch gefüllt hat und nur Gas aus dem Rohr austritt, öffnen Sie langsam das Druckentlastungsventil und lassen Sie den Druck auf 0 psi fallen.
- Stellen Sie die Szintillationsflasche zur Aufbewahrung in ein Eisbad oder einen Kühlschrank.
- Zur Langzeitlagerung und Minimierung der spontanen Verdampfung lagern Sie die Probe in einem Standardgefrierschrank. Stellen Sie sicher, dass die Temperatur -20 °C oder höher ist, um ein Einfrieren der Probe zu vermeiden (die Hilfsstofflösung aus 20% PPG und 20% Glycerin verhindert, dass die Probe in den meisten Laborgefrierschränken gefriert).
6. Trennung von Tröpfchen von Liposomen durch Zentrifugation
- 10 mL der extrudierten Tröpfchenlösung in ein 15 mL Zentrifugenröhrchen überführen.
- Zentrifugieren Sie die extrudierte Probe bei 1.500 x g für 10 min bei 4 °C. Ein Pellet aus DFB-Nanotröpfchen wird am Boden des Röhrchens sichtbar sein (Abbildung 4). Spontan verdampfte Tröpfchen erscheinen an der Oberseite der Lösung und sollten verworfen werden.

Abbildung 4: Beispiel für phasenverschobene DFB-Tröpfchengranulation nach Zentrifugation. DFB-Nanotröpfchen sind dichter als Liposomen und sammeln sich am Boden des Zentrifugenröhrchens in einem Pellet (red box). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Entfernen Sie den Überstand und resuspenieren Sie das Pellet in 2 ml 1x PBS mit 20% Glycerin und 20% Propylenglykol.
- Mischen Sie das Röhrchen vorsichtig, um eine homogene Lösung zu erhalten, und übertragen Sie die Tröpfchen auf ein kleineres 2-ml-Zentrifugenröhrchen.
- Probe noch zweimal in 2 mL Zentrifugenröhrchen waschen.
- Nach der letzten Wäsche resuspendieren Sie das Pellet in 100 μL 1x PBS mit 20% Glycerin und 20% Propylenglykol und lagern Sie es auf Eis oder im Gefrierschrank, bis es benötigt wird.
7. Mikroskopische Überprüfung der Tröpfchenverdampfung
- Stellen Sie eine verdünnte Tröpfchenlösung her, indem Sie 2,5 μl konzentrierte Tröpfchen zu 7,5 μl 1x PBS hinzufügen.
- Bereiten Sie einen Objektträger mit 10 μl der verdünnten Probe vor. Beobachten Sie die Probe mit einem 40-fachen Objektiv und speichern Sie Bilder.
- Nehmen Sie den Objektträger aus dem Mikroskop und legen Sie ihn für 1 minute auf eine 65 °C warme Heizplatte, um Nanotröpfchen zu Mikrobläschen zu verdampfen.
- Verwenden Sie das gleiche 40-fache Objektiv, um die Probe nach dem Erhitzen zu beobachten, um die Tröpfchenverdampfung zu überprüfen.
Ergebnisse
Repräsentative Ergebnisse der Größenverteilung sind unter Verwendung der dynamischen Lichtstreuung (DLS) und der abstimmbaren resistiven Pulserfassung (TRSP) enthalten. Abbildung 5 zeigt die Größenverteilung von kondensierten Blasenlösungen mit und ohne Extrusion. Ohne Extrusion endet das Protokoll bei Schritt 5.3. Die gekühlten Blasen werden kondensiert, indem die Probe kalt auf Atmosphärendruck entlüftet wird. Die kondensierte einzige Probe hat eine viel breitere Verteilung in der...
Diskussion
Es steht eine umfassende Literatur zur Verfügung, die die Formulierung, Physik und mögliche Anwendungen von Mikrobläschen und Phasenverschiebungströpfchen für die In-vivo-Bildgebung und -Therapie diskutiert. Diese Diskussion bezieht sich explizit auf die Erzeugung von Lipid-Mikrobläschen und deren Umwandlung in Submikron-Phasenverschiebungströpfchen unter Verwendung eines DFB-Gases mit niedrigem Siedepunkt und einer Hochdruckextrusion. Die hier beschriebene Methode soll ein relativ einfaches Verfahren zur Herstell...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken Dominique James im Labor von Dr. Ken Hoyt für die TRSP-Analyse von verdampfbaren Phasenverschiebungs-Nanotröpfchen
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | - | - | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | - | - | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | - | - | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | - | - | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
Referenzen
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten