JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미리 형성된 마이크로버블에서 멤브레인 여과 위상 시프트 데카플루오로부탄 나노방울의 생산
요약
이 프로토콜은 프로브 팁 초음파 처리를 사용하여 대용량 지질 캡슐화된 데파플루오로부탄 마이크로버블을 생성하고 고압 압출 및 기계적 여과를 사용하여 위상 시프트 나노 방울로 응축시키는 방법을 설명합니다.
초록
화상 진찰 및 치료를 위한 vaporizable 상 시프트 물방울의 생산을 위해 이용될 수 있는 많은 방법이 있습니다. 각 방법은 서로 다른 기술을 활용하고 가격, 재료 및 목적에 따라 다릅니다. 이러한 제조 방법의 대부분은 균일하지 않은 활성화 임계값을 가진 다분산 인구를 초래합니다. 또한, 액적 크기를 제어하려면 일반적으로 생체 내에서 실용적이지 않은 높은 활성화 임계값을 가진 안정적인 퍼플루오로카본 액체가 필요합니다. 낮은 비등점 가스를 사용하여 균일 한 방울 크기를 생산하는 것은 생체 이미징 및 치료 실험에 도움이 될 것입니다. 이 문서에서는 저등점 데아플루오로부탄(DFB)을 이용한 크기 여과된 지질 안정화 위상 시프트 나노방울의 형성을 위한 간단하고 경제적인 방법을 설명합니다. 지질 마이크로 버블을 생성하는 일반적인 방법은 단일 단계에서 고압 압출로 응축하는 새로운 방법 외에도 설명됩니다. 이 방법은 많은 생물학적 실험실에서 발견되는 일반적인 실험실 장비를 사용하여 다양한 응용 분야에 대해 시간을 절약하고 효율성을 극대화하며 더 많은 양의 마이크로 버블 및 나노 드롭렛 솔루션을 생성하도록 설계되었습니다.
서문
초음파 조영제 (UCA)는 이미징 및 치료 응용 프로그램에 대한 인기가 급속히 증가하고 있습니다. 마이크로 버블, 원래 UCA, 현재 임상 진단 응용 프로그램에 사용되는 주류 에이전트입니다. 마이크로버블은 지질, 단백질 또는 폴리머 껍질1로 둘러싸인 직경 1-10 μm의 가스 로 채워진 구체입니다. 그러나 크기와 생체 내 안정성은 많은 응용 프로그램에서 기능을 제한할 수 있습니다. 과열된 액체 코어를 포함하는 위상 이동 나노 방울은 크기가 작고 순환 생활이 향상되어 이러한 제한 사항 중 일부를 극복 할 수 있습니다2. 열 또는 음향 에너지에 노출되면 과열된 액체 코어가 기화하여 가스 마이크로버블2,3,4,5를 형성합니다. 기화 임계값은 액적 크기5,6과 직접 관련이 있기 때문에 균일한 크기로 액적 현탁액을 공식화하는 것이 일관된 활성화 임계값을 달성하는 데 매우 바람직할 것입니다. 균일한 액적 크기를 생성하는 제형 방법은 종종 복잡하고 비용이 많이 드는 반면, 비용 효율적인 접근 방식은 다분산 솔루션7을 초래합니다. 또 다른 제한은 생체 내에서 효율적인 활성화에 매우 중요한 낮은 비등점 퍼플루오로카본(PFC) 가스로 안정적인 위상 시프트 방울을 생성하는 기능입니다. 이 원고에서, 프로토콜은 생체 내 이미징 및 치료 응용 을 위한 안정적인 여과 된 낮은 비등점 기발성 위상 이동 방울을 생성하기 위한 설명이다.
모노분산 서브미칸 위상 시프트 액적7을 생성하는 많은 방법이 있습니다. 크기를 제어하는 가장 강력한 방법 중 하나는 미세 유체 장치의 사용입니다. 이러한 장치는 비용이 많이 들 수 있으며, 물방울 생산 속도가 느려지며(~104-106방울/s)7이 필요하며 광범위한 교육이 필요합니다. 미세 유체 장치는 또한 일반적으로 시스템의 자발적인 기화 및 막힘을 피하기 위해 고비등점 가스가 필요합니다7. 그러나, de Gracia Lux et al.9에 의한 최근 연구는 저등점 decafluorobutane (DFB) 또는 옥타플루오로프로판 (OFP)를 사용하여 저조미크론 위상 시프트 (1010-1012/mL)의 고농도를 생성하는 데 미세 유체제를 냉각하는 방법을 보여줍니다.
일반적으로 DFB 또는 OFP와 같은 저등점 가스는 미리 형성된 가스 기포를 사용하여 취급하기가 더 쉽습니다. 증발성 물방울은 저온 및 고압5,10을 사용하여 가스를 응축시킴으로써 전구체 지질 안정화 기포로부터 생성될 수 있다. 이 방법을 사용하여 생산된 액적의 농도는 전구체 마이크로 버블 농도 및 방울로 의 기포 변환의 효율에 따라 달라집니다. 농축 마이크로 버블은 1010 MB /mL11 >에 접근하는 팁 초음파 처리에서 보고되었으며, 별도의 연구는 응축 된 OFP 및 DFP 거품12에서 ~ 1-3 x1011 방울 / mL에 이르는 방울 농도를보고했습니다. 단일 분산 된 액적문제가 우려되지 않는 경우 응축 방법은 낮은 비등점 PFC를 사용하여 지질 안정화 위상 시프트 액적을 생성하는 가장 간단하고 저렴한 방법입니다. 그러나, 단일분산 전구체 기포를 생성하는 것도 어렵기 때문에 미세유체또는 반복된 차동 원심분리기와 같은 비용이 많이 드는 접근법이 필요하다11. DFB와 OFB 나노방울을 생산하는 대체 접근법은 최근 리포솜13에 있는 물방울의 자발적인 핵을 사용하여 간행되었습니다. 이 방법은 "Ouzo" 효과를 활용하여 거품을 응축할 필요 없이 낮은 비등점 PFC 방울을 생성하는 간단한 방법입니다. PFC 액적의 크기 분포는 액적의 핵을 시작하는 데 사용되는 PFC, 지질 및 에탄올 성분을 섬세한 적정 및 혼합하여 제어할 수 있습니다. 또한 퍼플루오로카본의 혼합은 나노방울14,15의 안정성 과 활성화 임계값을 제어하는 데 사용될 수 있다는 점에 주목할 필요가 있습니다. Shakya 외.에 의한 최신 연구는 탄화수소 내골격 내에서 높은 비등점 PFC를 유화하여 나노 방울 활성화가 다른 형태의 액적 크기 여과와 함께 고려될 수 있는 접근법인 액적 코어16 내에서 이종성 핵화를 용이하게 함으로써 어떻게 조정할 수 있는지를 보여줍니다.
일단 형성되면, 위상 이동 액적더는 더 많은 단일 분산 인구를 만들기 위해 형성 후 압출 될 수있다. 실제로, 여기서 설명된 방법과 유사한 프로토콜은 코모펙 외.17 에 의해 이전에 공표되어 높은 비등점 도데코플루오펜타네(DDFP)를 액적 코어로 사용하였다. 높은 비등점 퍼플루오로카본 (실온에서 안정)과 위상 시프트 방울을 사용하고자하는 독자는 대신 위의 기사를 참조해야합니다. DFB 및 OFP와 같이 낮은 비등점 가스로 물방울을 생성하고 압출하는 것이 더 복잡하며 미리 형성된 가스 기포를 응축하여 접근하는 것이 가장 좋습니다.
본 프로토콜에서, 프로브 팁 초음파 처리를 사용하여 DFB 가스 코어로 미리 형성된 지질 마이크로버블을 생성하는 일반적인 방법이 설명된다. 다음으로, 상업용 압출기는 전형 마이크로버블을 서브미칸 위상 시프트 나노방울로 응축하는 데 사용된다(도 1). 결과 물방울은 열과 초음파에 의해 활성화됩니다. 이 방법은 고가의 미세 유체 장치 없이는 크기 분포가 좁은 기존 응축 방법보다 더 많은 양의 나노 드롭렛 솔루션을 생성할 수 있습니다. 크기 분포가 좁은 나노 드롭렛 솔루션의 생산은 더 균일한 기화 임계값을 생성할 수 있습니다. 이것은 화상 진찰, 절제, 약 납품 및 색전화1,3,4,6와 같은 수많은 응용에 대한 그들의 잠재력을 최대화할 것입니다.
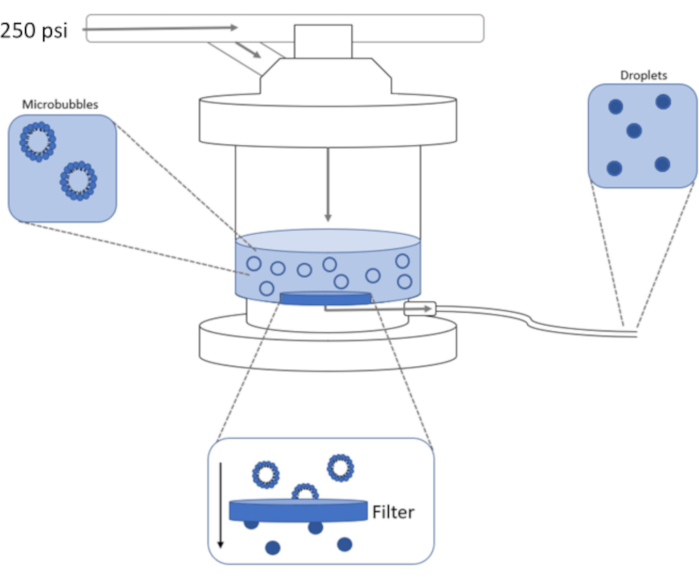
그림 1: 전형성 마이크로버블을 위상 시프트 나노방울로 응축하기 위한 고압 압출 설정의 회로도. 마이크로버블 용액은 압출기 챔버에 첨가되고 함유되고, 질소 탱크로부터 250psi가 챔버 입구 밸브를 통해 가적용됩니다. 질소 가스는 챔버의 기저에 있는 필터를 통해 마이크로버블 용액을 밀어 내고 샘플을 나노방울로 응축합니다. 용액은 마침내 샘플 콘센트 튜브를 통해 압출기에서 밀려 나서 수집됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 지질 필름 만들기
- 다음 방향을 사용하여 올바른 비율로 지질을 혼합하여 90% DSPC 및 10% DSPE-PEG2K를 사용하여 마이크로버블 생성을 위한 지질 필름을 준비합니다.
- 클로로폼으로 DSPC 및 DSPE-PEG2K의 스톡 지질을 만듭니다. 무게 50 별도의 바이알각 지질 분말의 mg. 1mL 유리 주사기를 사용하여 각 유리병에 1mL의 클로로폼을 추가합니다.
- DSPC 재고 287 μL과 DSPE-PEG2K 스톡 113 μL(모두 50 mg/mL)을 유리 주사기를 사용하여 20mL 의 진동 바이알에 넣습니다.
- 혼합 지질을 건조하여 질소를 사용하여 클로로포형을 제거합니다. 집 질소에 연결된 튜브의 적절한 길이를 사용하여 혼합하는 동안 유리병의 헤드 스페이스 에 질소 가스를 가볍게 흐르게합니다. 클로로폼이 관찰되지 않고 나머지 지질 필름이 흰색으로 바뀌기 시작할 때까지 계속합니다. 폴리 프로필렌 나사 캡을 사용하여 헤드 스페이스에 질소를 도입하면서 샘플을 덮습니다.
- 진공 건조기를 사용하여 하룻밤 동안 진공 밑에 바이알을 놓아 잔류 클로로폼을 제거하십시오. 바이알 의 바닥을 코팅 얇은 반투명 필름남아있을 것입니다.
- 필요할 때까지 바이알을 -20°C로 보관하십시오.
2. 지질 필름에서 마이크로 버블 생성
- 마이크로 버블을 만들려면, 1x 인산염 완충식염식염수(PBS)의 10mL를 20% v/v 프로필렌 글리콜과 20% v/v 글리세롤(최종 pH 7.2-7.4)을 드라이 지질 필름에 넣습니다.
- 시료를 65°C로 다시 캡하여 가열 블록(또는 가열된 수조)에서 30분 동안 다시 채장합니다.
- 시료가 온난화되는 동안 목욕 온도를 65°C로 늘려 목욕 초음파 처리기를 준비합니다.
참고: 욕조 초음파 처리기에 넣기 전에 전자레인지 나 핫플레이트에서 물이 예열된 경우이 과정이 빠릅니다. - 지질용액을 함유한 유리병의 일부만 수조에 침수되도록 목욕 초음파 처리기에서 따뜻한 시료를 함유한 신경병바이알을 놓는다.
- 따뜻한 지질 용액을 최소 15분 동안 초음파 처리합니다. 수온이 65°C로 유지되는지 확인합니다. 솔루션이 완전히 명확해질 때까지 10-15분 간격으로 초음파 처리를 계속합니다(그림 2).
참고: 목욕 초음파 처리기를 사용할 수 없는 경우 솔루션이 10%의 전력으로 초음파 처리될 수 있습니다. 그러나 마이크로 팁은 더 빨리 마모되고 교체비용이 더 비쌉습니다.

그림 2: 수화 지질 필름의 예. 목욕 초음파 처리 전후 (B) 수화 지질 필름 (A)의 예는 유니 라멜라 소포를 형성한다. 목욕 초음파 처리 후, 지질 용액은 반투명 솔루션에 더 불투명에서 이동해야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 여전히 따뜻한 동안 캡을 제거하고 초음파 처리기의 방음 인클로저에 유리병을 고정하여 초음파 처리기의 마이크로 팁 부착이 공기 / 액체 인터페이스 바로 아래에 잠급니다 (그림 3).
- 초음파 처리기의 방음 인클로저 옆에 데카플루오로부탄 탱크를 놓습니다.
- 얼음 목욕을 준비하고 방음 인클로저 옆에 놓습니다. 이 단계는 2.14 단계에서 나중에 사용됩니다.
- 초음파 처리기의 전원 스위치를 켭니다.
- 시스템이 시작된 후 전원 레벨을 70%로 설정합니다. 마이크로팁 부착물로 진폭70%를 초과하지 마십시오. 이 시간에 초음파 처리기를 시작하지 마십시오.
- DFB 탱크 콘센트에서 인클로저에 보관된 따뜻한 지질 용액으로 가스를 안내하기 위해 적절한 튜브 길이를 부착합니다. 튜브는 초음파 처리 중에 가스가 헤드 스페이스로 흐를 수 있도록 유리병의 목에 배치해야합니다 (그림 3).
- 가스가 지질 용액 위로 흐르는 것을 볼 수있을 때까지 탱크 밸브를 천천히 엽니 다. 이것은 액체의 표면에 약간의 파문을 일으킬 것입니다. 가스 흐름이 너무 높으면 마이크로 버블 제형 중에 용액이 오버플로됩니다.
- 초음파 처리기를 시작하고 마이크로 버블을 생성하기 위해 10 s 연속 실행합니다. 초음파 처리 중에 거품 솔루션이 오버플로되기 시작하면 초음파 처리기를 즉시 중지하십시오.
- 초음파 처리기를 끄고 DFB 탱크 밸브를 즉시 닫습니다.
- 마이크로 버블 용액을 빠르게 캡하고 얼음 욕조에 유리병을 잠그면 55 °C 이하의 샘플을 냉각시 (DSPC의 유리 전이 온도)
- 필요한 때까지 마이크로 버블 샘플을 얼음 욕조에 둡니다.

그림 3: 마이크로 버블 형성을 최적화하기 위해 지질 용액에 프로브 팁을 배치합니다. 프로브의 끝이 유리를 만지지 않도록주의하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 마이크로 버블 응축용 압출기 준비
- 200nm 세라믹 필터(제조업체에서 공급)를 사용하여 사용자 설명서에 자세히 설명된 대로 고압 압출기조립합니다.
- 방수 용기의 중앙에 압출기배치하여 샘플 콘센트 튜브가 측면에 대해 누르거나 압착되지 않도록 합니다.
- 제조 자가 공급 한 어댑터를 사용하여 압출기를 질소 가스 탱크에 결합하십시오.
- 400mL의 물과 10g의 염화 나트륨을 사용하여 압출기 주변의 방수 용기에 -2 °C 소금에 절인 얼음 목욕을하십시오.
- 압출 된 샘플을 수집하기 위해 출구 튜브의 끝을 신경병 바이알에 놓습니다.
참고: 평평하게 놓이지 않거나 유리병 내에 머무르지 않으면 테이프로 용기에 튜브를 고정합니다.
4. 마이크로 버블 응축용 압출기 프라이밍
- 방출 밸브를 열고 닫아 압출기 내에 압력이 없는지 확인합니다.
- 챔버 뚜껑을 제거하고 압출기 챔버에 1x PBS의 5 mL을 추가합니다.
- 뚜껑을 교체하여 안전하게 다시 제자리에 고정되도록 합니다.
- 압력 게이지가 250 psi를 읽을 수 있도록 질소 가스 탱크를 엽니 다. 압력 제어 밸브가 닫힌 위치에 있는지 확인합니다.
- 가스 탱크를 닫고 압출기 챔버 입구 밸브를 엽니다. PBS 용액은 시스템을 통해 밀어내고 샘플 출구 튜브를 신자극 유리병으로 밀어 넣을 것입니다.
- 가스만 튜브를 빠져나갈 때, 방출 밸브를 열고 압력이 0 psi로 떨어질 수 있도록 합니다.
- 반짝이 유리병을 제거합니다.
5. 압출을 위한 사전 냉각 마이크로 버블
- 방출 밸브를 열고 닫아 압출기 내에 압력이 없는지 확인합니다. 콘센트 튜브 의 끝에 새로운 반짝이는 유리병을 놓습니다.
- 2-메틸 부탄으로 강철 용기를 채우고 드라이 아이스를 추가하여 온도를 -18 °C로 끌어 올립니다.
- 차가운 2-메틸 부탄에 마이크로 버블 용액을 삽입하여 샘플을 2 분 동안 잠수하십시오. 2분 내내 반짝이는 유리병을 움직여 거품을 부드럽게 섞습니다. -15에서 -18 °C 사이의 온도를 유지하기 위해 필요에 따라 드라이 아이스를 추가합니다. -20°C를 초과하거나 부형제용이 동결및 파괴되지 않도록 주의하십시오.
참고: 단계 5.2 및 5.3은 더 오랜 기간 동안 실험실 냉동고에서 버블 샘플을 냉각하여 수행할 수도 있습니다. 그러나 냉동고의 온도를 주의 깊게 모니터링하고 시료를 동결하지 않도록주의해야 합니다. - 2 분 후, 차가운 2 메틸 부탄에서 마이크로 버블을 제거하고 유리병을 부드럽게 흔들어 마이크로 버블을 혼합하고 냉각 된 10 mL 주사기를 사용하여 용액을 압출기로 옮춥니다.
- 압출기 챔버 뚜껑을 제거하고 주사기의 플런저를 천천히 밀어 챔버에 마이크로 버블 용액을 추가합니다. 압출기 캡을 교체하여 안전하게 다시 제자리에 클릭합니다.
- 압출기의 압력 제어 밸브와 방출 밸브가 닫힌 위치에 있는지 확인합니다.
- 압력 게이지가 250 psi를 읽을 때까지 질소 가스 탱크를 열고 가스 탱크를 닫고 압력 제어 밸브를 열린 위치로 돌립니다.
- 용액이 출구 튜브에서 신경병 유리병을 채우고 가스만 튜브를 빠져나가는 경우 압력 방출 밸브를 천천히 열고 압력이 0 psi로 떨어질 수 있습니다.
- 반짝이는 유리병을 얼음 욕조 나 냉장고에 넣어 보관하십시오.
- 장기 저장 및 자발적기화를 최소화하기 위해 샘플을 표준 냉동고에 보관하십시오. 시료를 동결하지 않도록 온도가 -20°C 이상인지 확인하십시오(20% PPG 및 20% 글리세롤의 부형제용은 대부분의 실험실 냉동고에서 샘플을 동결하지 못하게 합니다).
6. 리포솜에서 원심분리로 방울을 분리
- 압출 된 액적 액액의 10 mL을 15 mL 원심분리기 튜브로 옮기십시오.
- 4°C에서 10분 동안 1,500 x g 의 압출 된 샘플을 원심 분리합니다. DFB 나노 방울로 구성된 펠릿은 튜브의 바닥에 명백합니다 (도 4). 자발적으로 기화 된 물방울은 솔루션의 상단에 나타나고 폐기해야합니다.

그림 4: 원심 분리 후 위상 이동 DFB 물방울 펠릿의 예. DFB 나노 방울은 리포솜보다 밀도가 높으며 펠릿(빨간색 상자)에서 원심분리기 튜브의 바닥에서 수집됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 상체를 제거하고 20 % 글리세롤과 20 % 프로필렌 글리콜로 1 x PBS의 2 mL에서 펠릿을 다시 놓습니다.
- 튜브를 부드럽게 섞어 균일한 용액을 얻고 작은 2mL 원심분리기 튜브로 방울을 옮기습니다.
- 2mL 원심분리기 튜브에서 2회 더 세척하십시오.
- 마지막 세척 후, 펠릿을 1x PBS 100 μL에 20% 글리세롤과 20% 프로필렌 글리콜로 재차판으로 재차 판하고 필요할 때까지 얼음이나 냉동실에 보관하십시오.
7. 액적 기화의 현미경 검사
- 농축 된 물방울의 2.5 μl을 1 x PBS의 7.5 μl에 추가하여 희석 된 액적 용액을 만듭니다.
- 희석된 시료의 10μl로 현미경 슬라이드를 준비합니다. 40배 의 목표를 사용하여 샘플을 관찰하고 이미지를 저장합니다.
- 현미경에서 슬라이드를 제거하고 마이크로 버블로 나노 방울을 기화하기 위해 1 분 동안 65 °C 열판에 놓습니다.
- 동일한 40배 의 목표를 사용하여 가열 후 샘플을 관찰하여 액적 기화를 확인합니다.
결과
크기 분포의 대표적인 결과는 동적 광 산란(DLS) 및 튜닝 가능한 저항 펄스 감지(TRSP) 분석을 사용하여 포함됩니다. 도 5는 압출 유무에 관계없이 응축된 버블 솔루션의 크기 분포를 나타낸다. 압출없이 프로토콜은 5.3 단계에서 끝납니다. 차가운 거품은 차가운 동안 대기압에 샘플을 배출하여 응축된다. 응축된 샘플만 400nm 에 가까운 훨씬 더 넓은 분포를 가지고 있습니다. 압출...
토론
생체 내 이미징 및 치료를 위한 마이크로 버블 및 위상 시프트 물방울의 제형, 물리학 및 잠재적인 응용 분야에 대해 설명하는 포괄적인 문헌 본문이 있습니다. 이 토론은 지질 마이크로 버블을 생성하고 낮은 비등점 DFB 가스 및 고압 압출을 사용하여 하위 미크로른 위상 이동 방울로 변환하는 데 명시적으로 관련됩니다. 여기에 설명된 방법은 이전 마이크로버블 응축 방법을 한 단계로 결합하여 ?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 vaporizable 위상 시프트 나노 방울의 TRSP 분석을 제공하는 박사 켄 호이트의 실험실에서 도미니크 제임스에게 감사드립니다
자료
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | - | - | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | - | - | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | - | - | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | - | - | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
참고문헌
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유