A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنتاج الأغشية المصفاة مرحلة التحول ديكافلوروبوتان Nanodroplets من الفقاعات الدقيقة مسبقة التشكيل
In This Article
Summary
يصف هذا البروتوكول طريقة لتوليد كميات كبيرة من الفقاعات الدقيقة المغلفة بالدهون decafluorobutane باستخدام سونيكيشن رأس المسبار وتكثيفها لاحقا في قطرات نانوية تحول المرحلة باستخدام البثق عالي الضغط والترشيح الميكانيكي.
Abstract
هناك العديد من الطرق التي يمكن استخدامها لإنتاج قطرات مرحلة التحول vaporizable للتصوير والعلاج. كل طريقة تستخدم تقنيات مختلفة وتختلف في السعر والمواد والغرض. العديد من هذه الأساليب تلفيق يؤدي إلى مجموعات متعددة التخصصات مع عتبات التنشيط غير موحدة. بالإضافة إلى ذلك، يتطلب التحكم في أحجام القطرات عادة سوائل بيرفلوروكربون مستقرة مع عتبات تنشيط عالية غير عملية في الجسم الحي. إنتاج أحجام قطرات موحدة باستخدام غازات نقطة الغليان المنخفض سيكون مفيدا لتجارب التصوير والعلاج في الجسم الحي. توضح هذه المقالة طريقة بسيطة واقتصادية لتشكيل القطرات النانوية المرحلية التي يتم تصفيتها بالدهون والمثبتة بالحجم مع ديكافلوروبوتان نقطة الغليان المنخفض (DFB). يتم وصف طريقة شائعة لتوليد الفقاعات الدقيقة الدهنية ، بالإضافة إلى طريقة جديدة لتكثيفها مع قذف الضغط العالي في خطوة واحدة. تم تصميم هذه الطريقة لتوفير الوقت، وتحقيق أقصى قدر من الكفاءة، وتوليد كميات أكبر من الفقاعات الصغيرة وحلول القطرات النانوية لمجموعة واسعة من التطبيقات باستخدام معدات المختبرات المشتركة الموجودة في العديد من المختبرات البيولوجية.
Introduction
وكلاء التباين بالموجات فوق الصوتية (UCAs) تنمو بسرعة في شعبية لتطبيقات التصوير والعلاج. الفقاعات الصغيرة ، وUCAs الأصلي ، هي حاليا العوامل الرئيسية المستخدمة في تطبيقات التشخيص السريري. الفقاعات الدقيقة هي مجالات مملوءة بالغاز ، وعادة ما يكون قطرها 1-10 ميكرومتر ، وتحيط بها الدهون أو البروتين أو قذائف البوليمر1. ومع ذلك، يمكن لحجمها واستقرارها في الجسم الحي الحد من وظائفها في العديد من التطبيقات. يمكن للقطرات النانوية المتحولة للمرحلة ، والتي تحتوي على نواة سائلة شديدة التسخين ، التغلب على بعض هذه القيود بسبب حجمها الأصغر وتحسين الدورة الدموية-life2. عندما تتعرض للحرارة أو الطاقة الصوتية، يتبخر اللب السائل المحموم لتشكيل ميكروبوببلة غاز2،3،4،5. وبما أن عتبة التبخير ترتبط مباشرة بحجم القطيرات 5،6، فإن صياغة تعليقات قطرات بحجم موحد ستكون مرغوبة للغاية لتحقيق عتبات تنشيط متسقة. وغالبا ما تكون طرق التركيب التي تنتج أحجام قطرات موحدة معقدة ومكلفة، في حين أن النهج الأكثر فعالية من حيث التكلفة تؤدي إلى حلول متعددة التخصصات7. وثمة قيد آخر هو القدرة على توليد قطرات مستقرة من مرحلة التحول مع غازات البيرفلوروكربون ذات نقطة الغليان المنخفضة ، وهو أمر بالغ الأهمية لتنشيط فعال في vivo8. في هذه المخطوطة، يتم وصف بروتوكول لتوليد قطرات تحويل مرحلي مستقرة قابلة للتبخير في تطبيقات التصوير والعلاج في الجسم الحي.
هناك العديد من الطرق لإنتاج قطرات المرحلة التحول submicron أحادية التشتت7. واحدة من أقوى الطرق للسيطرة على الحجم هو استخدام الأجهزة microfluidic. يمكن أن تكون هذه الأجهزة مكلفة ، ولها معدلات بطيئة لإنتاج القطيرات (~ 104-106 قطرات / ثانية)7 ، وتتطلب تدريبا مكثفا. تتطلب أجهزة Microfluidic أيضا غازات عالية الغليان لتجنب التبخير التلقائي وانسداد النظام7. ومع ذلك، توضح دراسة حديثة أجراها دي غراسيا لوكس وآخرون.9 كيف يمكن استخدام سائل التبريد الدقيق لتوليد تركيزات عالية من التحول المرحلي دون الميكرون (1010-1012/مل) باستخدام نقطة الغليان المنخفض ديكافلوروبوتان (DFB) أو الأوكتافلوروبران (OFP).
بشكل عام، تكون الغازات منخفضة الغليان مثل DFB أو OFP أسهل في التعامل معها باستخدام فقاعات الغاز مسبقة التكوين. يمكن إنتاج قطرات Vaporizable من فقاعات السلائف استقرت الدهون عن طريق تكثيف الغاز باستخدام درجات حرارة منخفضة وارتفاع pressure5,10. تركيز قطرات المنتجة باستخدام هذه الطريقة يعتمد على تركيز microbubble السلائف وكفاءة تحويل الفقاعات إلى قطرات. وقد تم الإبلاغ عن الفقاعات الدقيقة المركزة من سونيكيشن تلميح تقترب من > 1010 MB/mL11، في حين ذكرت دراسة منفصلة تركيزات قطرات تتراوح بين ~ 1-3 x1011 قطرات / مل من فقاعات OFP وDFP مكثف12. عندما لا تكون القطرات أحادية التشتت مصدر قلق ، فإن طرق التكثيف هي أكثر الطرق مباشرة وأقل تكلفة لتوليد قطرات تحول المرحلة المستقرة من الدهون باستخدام PFCs نقطة الغليان المنخفضة. ومع ذلك، فإن توليد فقاعات السلائف أحادية التشتت أمر صعب أيضا، حيث يتطلب اتباع نهج أكثر تكلفة مثل السوائل الدقيقة أو تقنيات الطرد المركزي التفاضلية المتكررة11. وقد تم مؤخرا نشر نهج بديل لإنتاج قطرات نانوية DFB و OFB باستخدام نواة عفوية من قطرات في liposomes13. هذه الطريقة ، وذلك باستخدام تأثير "Ouzo" ، هي طريقة بسيطة لتوليد قطرات PFC نقطة الغليان المنخفض دون الحاجة إلى تكثيف الفقاعات. يمكن التحكم في توزيع حجم قطرات PFC عن طريق المعايرة الدقيقة وخلط مكونات PFC والدهون والإيثانول المستخدمة لبدء نواة القطرات. وتجدر الإشارة أيضا إلى أنه يمكن استخدام خلط مركبات الكربون البيرفلورية للتحكم في الاستقرار وعتبات التنشيط للقطرات النانوية14,15. يوضح العمل الأحدث الذي قام به Shakya وآخرون كيف يمكن ضبط تنشيط القطرات النانوية عن طريق استحلاب مركبات الكربون المشبعة بالفلور عالية الغليان داخل الهيكل الخارجي الهيدروكربوني لتسهيل النوى غير المتجانسة داخل core16 القطيرات ، وهو نهج يمكن النظر فيه جنبا إلى جنب مع أشكال أخرى من ترشيح حجم القطيرات.
بمجرد تشكيلها ، يمكن قذف قطرات التحول المرحلي بعد التكوين لإنشاء المزيد من المجموعات السكانية الأحادية. في الواقع ، تم نشر بروتوكول مماثل للطريقة الموصوفة هنا سابقا من قبل Kopechek et al.17 باستخدام dodecofluorpentane نقطة الغليان العالية (DDFP) كجوهر قطرة. القراء الذين يسعون إلى استخدام قطرات المرحلة التحول مع نقطة الغليان العالي perfluorocarbons (مستقرة في درجة حرارة الغرفة) وينبغي الرجوع إلى المادة أعلاه بدلا من ذلك. توليد وقذف قطرات مع الغازات نقطة الغليان منخفضة، مثل DFB و OFP، هو أكثر تعقيدا وأفضل اقترب من خلال تكثيف فقاعات الغاز مسبقة التشكيل.
في هذا البروتوكول ، يتم وصف طريقة شائعة لتوليد الفقاعات الدقيقة الدهنية مسبقة التشكيل مع نواة غاز DFB باستخدام صوتنة طرف المسبار. بعد ذلك ، يتم استخدام البثق التجاري لتكثيف الفقاعات الدقيقة مسبقة التشكيل في قطرات نانوية مرحلية submicron (الشكل 1). ثم يتم تنشيط القطرات الناتجة عن طريق الحرارة والموجات فوق الصوتية. يمكن أن تنتج هذه الطريقة كميات أكبر من محلول القطرات النانوية من طرق التكثيف التقليدية مع توزيعات حجم أضيق دون الحاجة إلى أجهزة ميكروفلويديك باهظة الثمن. ومن المرجح أن يؤدي إنتاج حلول القطرات النانوية ذات التوزيعات الضيقة الحجم إلى توليد عتبات تبخير أكثر اتساقا. وهذا من شأنه أن يزيد من إمكاناتها للعديد من التطبيقات مثل التصوير، والاجتثاث، وتسليم الأدوية، والانسداد1،3،4،6.
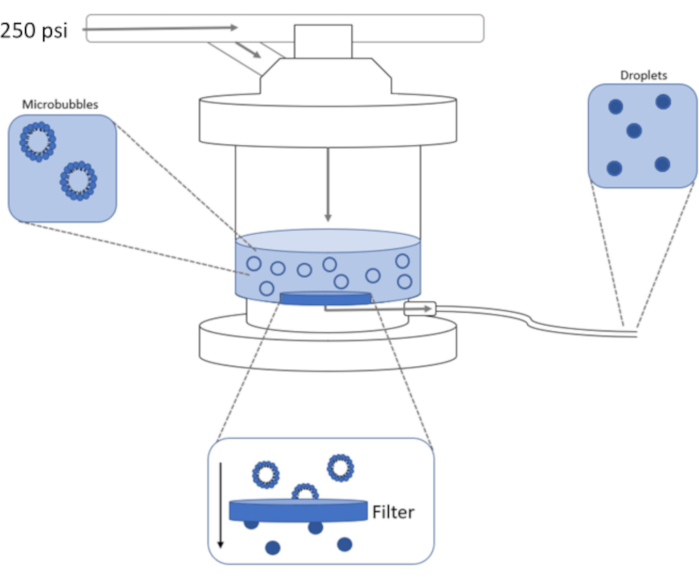
الشكل 1: تخطيطي لإعداد البثق عالي الضغط لتكثيف الفقاعات الدقيقة مسبقة التشكيل في قطرات نانوية تعمل بالمرحلة. يضاف محلول الفقاعات الصغيرة إلى غرفة البثق ويحتوى عليها، ويتم تطبيق 250 psi، من خزان النيتروجين، من خلال صمام مدخل الغرفة. سوف يدفع غاز النيتروجين محلول الفقاعات الدقيقة من خلال الفلتر في قاعدة الغرفة ، مما يكثف العينة إلى قطرات نانوية. يتم دفع الحل أخيرا من البثق من خلال أنبوب منفذ العينة وجمعها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. صنع أفلام الدهون
- إعداد أفلام الدهون لتوليد microbubble باستخدام 90٪ DSPC و 10٪ DSPE-PEG2K عن طريق خلط الدهون في النسبة الصحيحة باستخدام الاتجاهات التالية:
- جعل الدهون الأسهم من DSPC وDSPE-PEG2K في الكلوروفورم. وزن 50 ملغ من كل مسحوق الدهون في قوارير منفصلة. أضف 1 مل من الكلوروفورم إلى كل قارورة باستخدام حقنة زجاجية سعة مل واحد.
- إضافة 287 ميكرولتر من مخزون DSPC و 113 ميكرولتر من مخزون DSPE-PEG2K (كلاهما 50 ملغم / مل) في قارورة تلألؤ سعة 20 مل باستخدام حقنة زجاجية.
- تجفيف الدهون المختلطة لإزالة الكلوروفورم باستخدام النيتروجين. باستخدام طول مناسب من أنابيب متصلة النيتروجين المنزل، وتدفق غاز النيتروجين طفيفة على مساحة الرأس من القارورة أثناء الاختلاط. استمر حتى لا يلاحظ الكلوروفورم، ويبدأ فيلم الدهون المتبقي في التحول إلى اللون الأبيض. استخدام قبعات مسمار البولي بروبلين، وتغطية العينة أثناء إدخال النيتروجين في مساحة الرأس.
- ضع قنينات تحت الفراغ بين عشية وضحاها باستخدام مجفف فراغ لإزالة أي الكلوروفورم المتبقية. سيبقى فيلم شفاف رقيق يغطي الجزء السفلي من القارورة.
- تخزين قوارير في -20 درجة مئوية حتى الحاجة.
2. توليد الفقاعات الصغيرة من أفلام الدهون
- لجعل microbubbles، إضافة 10 مل من 1x الفوسفات العازلة المالحة (PBS) التي تحتوي على 20٪ v/v بروبيلين غليكول و 20٪ v/v الجلسرين (درجة الحموضة النهائي 7.2-7.4) إلى فيلم الدهون الجافة.
- إعادة الغطاء العينة وعينة دافئة إلى 65 درجة مئوية لمدة 30 دقيقة على كتلة التدفئة (أو حمام مائي ساخن).
- في حين أن العينة هي الاحترار، وإعداد sonicator حمام عن طريق زيادة درجة حرارة الحمام إلى 65 درجة مئوية.
ملاحظة: هذه العملية أسرع إذا تم تسخين الماء في ميكروويف أو لوحة ساخنة قبل وضعه في جهاز سونيكاتور الحمام. - ضع قارورة التلألؤ التي تحتوي على العينة الدافئة في جهاز صوتنة الحمام بحيث يتم غمر جزء القارورة الذي يحتوي على محلول الدهون فقط في حمام الماء.
- Sonicate حل الدهون الدافئة لمدة لا تقل عن 15 دقيقة. تأكد من أن درجة حرارة الماء لا تزال عند 65 درجة مئوية. الاستمرار في sonicate في فترات من 10-15 دقيقة حتى الحل واضح تماما (الشكل 2).
ملاحظة: إذا كان sonicator حمام غير متوفر، يمكن أن يكون الحل طرف sonicated في السلطة 10٪ حتى واضحة. ومع ذلك ، فإن microtip تبلى بشكل أسرع وأكثر تكلفة لاستبدالها.

الشكل 2: مثال على أفلام الدهون المائية. مثال على فيلم الدهون رطب (A) قبل و (ب) بعد سونيكيشن حمام لتشكيل حويصلات أحادية اللاميلار. بعد صوتنة الحمام ، يجب أن يتحول محلول الدهون من محلول أكثر غموضا إلى حل شفاف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- في حين لا تزال دافئة، وإزالة الغطاء والمشبك القارورة في الضميمة سونيكاتور عازلة للصوت بحيث يتم غمر مرفق microtip من sonicator فقط تحت واجهة الهواء / السائل (الشكل 3).
- ضع خزان ديكافلوروبوتان بجوار الحاوية العازلة للصوت من sonicator.
- قم بإعداد حمام جليدي ووضعه بجوار الحاوية العازلة للصوت. سيتم استخدام هذا لاحقا في الخطوة 2.14.
- قم بتشغيل مفتاح الطاقة ل sonicator.
- بعد بدء تشغيل النظام، قم بتعيين مستوى الطاقة إلى 70٪. لا تتجاوز 70٪ من السعة مع مرفق microtip. لا تبدأ سونيكاتور في هذا الوقت.
- إرفاق طول مناسب من الأنابيب لتوجيه الغاز من منفذ خزان DFB في محلول الدهون الدافئة التي عقدت في الضميمة. يجب وضع الأنبوب فقط في عنق القارورة للسماح للغاز بالتدفق إلى مساحة الرأس أثناء سونيكيشن (الشكل 3).
- افتح صمام الخزان ببطء حتى يمكن رؤية الغاز يتدفق فوق محلول الدهون. وهذا سوف يسبب تموجات طفيفة على سطح السائل. إذا كان تدفق الغاز مرتفعا جدا ، فسيفيض الحل أثناء تركيبة الفقاعات الدقيقة.
- بدء sonicator وتشغيل لمدة 10 ق باستمرار لتوليد microbubbles. إذا كان الحل فقاعة يبدأ في تجاوز أثناء sonication، وقف على الفور sonicator.
- إيقاف سونيكاتور وإغلاق صمام خزان DFB فورا.
- قم بسرعة بسقف محلول الفقاعات الدقيقة وغمر القارورة في حمام الثلج لتبريد العينة تحت 55 درجة مئوية (درجة حرارة انتقال الزجاج من DSPC)
- اترك عينات الفقاعات الصغيرة في حمام الثلج حتى الحاجة.

الشكل 3: وضع طرف المسبار في محلول الدهون لتحسين تكوين الفقاعات الدقيقة. الحرص على عدم السماح لطرف من التحقيق للمس الزجاج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد البثق لتكثيف الفقاعات الصغيرة
- تجميع مقذوف الضغط العالي كما هو مفصل في دليل المستخدم باستخدام مرشح السيراميك 200 نانومتر (الموردة من الشركة المصنعة).
- ضع الطارد في وسط حاوية محكمة بحيث لا يتم الضغط على أنبوب منفذ العينة ضد الجانب أو مجعد.
- زوجين من الطارد لخزان غاز النيتروجين باستخدام محول المقدمة من قبل الشركة المصنعة.
- جعل -2 درجة مئوية حمام الثلج المملح في وعاء محكم حول البثق باستخدام 400 مل من الماء و 10 غرام من كلوريد الصوديوم.
- ضع نهاية أنبوب المنفذ في قارورة التلألؤ لجمع العينة المقشرة.
ملاحظة: تأمين الأنبوب إلى الحاوية مع الشريط إذا لم يكن وضع شقة أو البقاء داخل القارورة.
4. فتيلة البثق لتكثيف microbubble
- افتح صمام الإطلاق واغلقه للتأكد من عدم وجود ضغط داخل الطارد.
- إزالة غطاء الغرفة وإضافة 5 مل من برنامج تلفزيوني 1x إلى غرفة البثق.
- استبدل الغطاء للتأكد من أنه ينقر بشكل آمن في مكانه.
- فتح خزان غاز النيتروجين بحيث يقرأ مقياس الضغط 250 psi. تأكد من أن صمام التحكم في الضغط في وضعية مغلقة.
- أغلق خزان الغاز وافتح صمام مدخل غرفة البثق. سيتم دفع حل برنامج تلفزيوني من خلال النظام والخروج من أنبوب منفذ العينة في قارورة التلألؤ.
- عندما يخرج الغاز فقط من الأنابيب، افتح صمام الإطلاق واترك الضغط ينخفض إلى 0 psi.
- إزالة قارورة التلألؤ.
5. قبل التبريد microbubbles للقذف
- افتح صمام الإطلاق واغلقه للتأكد من عدم وجود ضغط داخل الطارد. ضع قارورة جديدة للتألق في نهاية أنبوب المنفذ.
- ملء حاوية الصلب مع 2-ميثيل البيوتان وإضافة الجليد الجاف لخفض درجة الحرارة إلى -18 درجة مئوية.
- أدخل محلول الفقاعات الدقيقة في البوتان المبرد 2-ميثيل بحيث يتم غمر العينة لمدة دقيقتين. تحريك قارورة التلألؤ في جميع أنحاء 2 دقيقة لخلط بلطف فقاعات. أضف الثلج الجاف حسب الحاجة للحفاظ على درجة الحرارة بين -15 و-18 درجة مئوية. يجب الحرص على عدم تجاوز -20 درجة مئوية أو الحل المتعجل سوف تجميد وتدمير عينة فقاعة.
ملاحظة: يمكن أيضا القيام بالخطوات 5.2 و5.3 عن طريق تبريد عينة الفقاعة في ثلاجة مختبرية على مدى فترة زمنية أكثر تمديدا. ومع ذلك، ينبغي توخي الحذر لمراقبة درجة حرارة الفريزر بعناية وتجنب تجميد العينة. - بعد 2 دقيقة، قم بإزالة الفقاعات الدقيقة من البوتان المبرد 2-ميثيل، وهز القارورة برفق لخلط الفقاعات الدقيقة واستخدام حقنة مبردة 10 مل لنقل المحلول إلى الطارد.
- إزالة غطاء غرفة البثق وإضافة محلول microbubble إلى الغرفة عن طريق دفع ببطء المكبس على الحقنة. استبدل غطاء البثق مع التأكد من أنه ينقر بشكل آمن في مكانه.
- تحقق من أن صمام التحكم في الضغط وصمام إطلاق الطارد في وضع مغلق.
- افتح خزان غاز النيتروجين حتى يقرأ مقياس الضغط 250 psi، أغلق خزان الغاز، وحول صمام التحكم في الضغط إلى الموضع المفتوح.
- عندما يكون الحل قد شغل قارورة التلألؤ في أنابيب الخروج ، والغاز فقط هو الخروج من الأنبوب ، وفتح صمام إطلاق الضغط ببطء والسماح للضغط أن ينخفض إلى 0 psi.
- ضع قارورة التلألؤ في حمام جليدي أو ثلاجة للتخزين.
- للتخزين طويل الأجل وتقليل التبخير التلقائي، قم بتخزين العينة في ثلاجة قياسية. تأكد من أن درجة الحرارة -20 درجة مئوية أو أعلى لتجنب تجميد العينة (الحل المبدئي من PPG 20٪ و 20٪ الجلسرين سوف تبقي العينة من التجمد في معظم المجمدات المختبرية).
6. فصل قطرات من الليبوسومات عن طريق الطرد المركزي
- نقل 10 مل من محلول القطيرات مقذوف إلى أنبوب الطرد المركزي 15 مل.
- الطرد المركزي العينة مقذوف في 1500 × ز لمدة 10 دقيقة في 4 درجة مئوية. وسوف تكون بيليه تتألف من قطرات نانوية DFB واضحة في الجزء السفلي من الأنبوب (الشكل 4). ستظهر قطرات متبخرة تلقائيا في الجزء العلوي من المحلول ويجب التخلص منها.

الشكل 4: مثال على قطرات DFB التحول المرحلي بيليه بعد الطرد المركزي. قطرات نانوية DFB هي أكثر كثافة من الليبوسومات وسوف تجمع في الجزء السفلي من أنبوب الطرد المركزي في بيليه، (الصندوق الأحمر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إزالة supernatant وإعادة إنفاق بيليه في 2 مل من برنامج تلفزيوني 1x مع 20٪ الجلسرين و 20٪ بروبيلين غليكول.
- اخلط الأنبوب برفق للحصول على محلول متجانس ونقل القطرات إلى أنبوب طرد مركزي أصغر سعة 2 مل.
- عينة غسل مرتين أخريين في أنبوب الطرد المركزي 2 مل.
- بعد غسل الماضي، resuspend بيليه في 100 ميكرولتر من برنامج تلفزيوني 1x مع 20٪ الجلسرين و 20٪ البروبيلين غليكول وتخزينها على الجليد أو في الثلاجة حتى الحاجة.
7. التحقق المجهري من تبخير القطيرات
- جعل محلول قطرة مخففة عن طريق إضافة 2.5 ميكرولتر من قطرات مركزة إلى 7.5 ميكرولتر من برنامج تلفزيوني 1x.
- إعداد شريحة المجهر مع 10 ميكرولتر من العينة المخففة. باستخدام هدف 40x، مراقبة العينة وحفظ الصور.
- إزالة الشريحة من المجهر ووضعها على لوحة حرارة 65 درجة مئوية لمدة 1 دقيقة لتبخير nanodroplets في الفقاعات الصغيرة.
- استخدم نفس الهدف 40x لمراقبة العينة بعد التسخين للتحقق من تبخير القطيرات.
النتائج
يتم تضمين النتائج التمثيلية لتوزيع الحجم باستخدام تحليل تشتت الضوء الديناميكي (DLS) وتحليل استشعار النبض المقاوم غير القادر (TRSP). يوضح الشكل 5 حجم توزيع حلول الفقاعات المكثفة مع البثق وبدونه. بدون البثق، ينتهي البروتوكول عند الخطوة 5.3. يتم تكثيف الفقاعات المبردة عن طريق تنفي?...
Discussion
تتوفر مجموعة شاملة من الأدبيات التي تناقش التركيب والفيزياء والتطبيقات المحتملة للفقاعات الدقيقة وقطرات التحول المرحلي للتصوير والعلاج في الجسم الحي. تتعلق هذه المناقشة صراحة بتوليد الفقاعات الدقيقة الدهنية وتحويلها إلى قطرات تحول مرحلة دون ميكرون باستخدام غاز DFB منخفض الغليان والبثق ...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نود أن نشكر دومينيك جيمس في مختبر الدكتور كين هويت لتقديم تحليل TRSP للقطرات النانوية القابلة للتبخير في مرحلة التحول
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | - | - | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | - | - | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | - | - | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | - | - | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
References
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved