Method Article
Preparación de mosquitos Aedes aegypti machos irradiados y marcados para su liberación en un programa operativo de técnica de insectos estériles
En este artículo
Resumen
La técnica del insecto estéril (TIE) se utiliza para controlar poblaciones específicas de mosquitos médicamente importantes que pueden ser resistentes a los controles químicos. Aquí, describimos un método de cría masiva y preparación de mosquitos machos estériles para su liberación en un programa operativo de TIE dirigido al mosquito Aedes aegypti .
Resumen
El control de enfermedades humanas como el dengue, el zika y el chikungunya depende del control de su vector, el mosquito Aedes aegypti , porque no hay prevención. El control de los mosquitos vectores puede basarse en productos químicos aplicados a las etapas inmadura y adulta, lo que puede contribuir a la mortalidad de los no objetivos y, lo que es más importante, conducir a la resistencia a los insecticidas en el vector. La técnica del insecto estéril (TIE) es un método para controlar las poblaciones de plagas a través de la liberación de machos adultos esterilizados que se aparean con hembras silvestres para producir descendencia no viable. Este documento describe el proceso de producción de machos estériles para su uso en un programa operativo de TIE para el control de mosquitos Aedes aegypti . Aquí se describen los pasos utilizados en el programa, incluida la cría y el mantenimiento de una colonia, la separación de pupas machos y hembras, la irradiación y el marcado de machos adultos y el envío de machos de Aedes aegypti al sitio de liberación. También se discuten las advertencias de procedimiento, las limitaciones del programa y los objetivos futuros.
Introducción
La transmisión de patógenos transmitidos por mosquitos a los seres humanos causa millones de casos de enfermedad y muertes cada año en todo el mundo. En ausencia de vacunas efectivas y aprobadas para enfermedades transmitidas por mosquitos, como el Zika o el dengue, una de las formas más efectivas de reducir la transmisión es reducir las poblaciones de mosquitos vectores de enfermedades. Es preocupante que un número creciente de especies de mosquitos, tradicionalmente blanco de pesticidas, muestren niveles crecientes de resistencia a los plaguicidas1. Al mismo tiempo, las agencias gubernamentales han dado de baja o prohibido agresivamente los plaguicidas previamente aprobados, y se están desarrollando pocas medidas nuevas y efectivas de control químico 2,3. Esta constelación de obstáculos para el control de mosquitos ha motivado la exploración de técnicas alternativas no químicas para reducir las poblaciones de mosquitos.
Ciertas especies de mosquitos presentan desafíos para controlar los problemas de resistencia y registro de plaguicidas. Aedes aegypti (L.) es un mosquito vector de enfermedad prominente que es extremadamente difícil de controlar a través del manejo tradicional integrado de vectores debido al hábitat peridoméstico críptico explotado por esta especie para el desarrollo inmaduro y el descanso adulto 4,5. Los desafíos relacionados con la explotación del hábitat críptico alrededor de las residencias incluyen la dificultad de llegar a estos lugares con técnicas de pulverización de pesticidas, así como la posible falta de aceptación por parte del público para el acceso repetido a la propiedad privada para que las agencias de control de vectores de salud pública realicen las actividades intensivas de vigilancia y control cruciales para el manejo integrado de vectores (GIV) efectivo para esta especie.
Afortunadamente, SIT, un enfoque que ha demostrado ser exitoso para el control duradero de otras especies de insectos altamente desafiantes6, se está aplicando al problema de Aedes aegypti en una serie innovadora de experimentos y ensayos operativos con sede en St. Augustine, Florida (datos no publicados de KJL, RLA, SCB). La TIE se ha aplicado a una variedad de especies de insectos, incluidos los mosquitos, y se ha revisado en profundidad 7,8. SIT aprovecha la liberación masiva de machos criados en colonias esterilizados, por ejemplo, por exposición a radiación ionizante o productos químicos para abrumar la elección de pareja de las poblaciones naturales de hembras. Los machos esterilizados que se aparean con hembras salvajes hacen que los huevos sean infértiles debido al daño sufrido por los gametos masculinos, y si están presentes en cantidades suficientes, teóricamente pueden colapsar la población natural de Aedes aegypti.
Se inició un programa SIT para intentar reducir las poblaciones de Aedes aegypti en un área urbana en la costa atlántica de Florida, donde esta especie se recolonizó recientemente y se está expandiendo y presenta un riesgo para la salud pública para la transmisión de virus como Zika, dengue o chikungunya. Para maximizar el potencial de compatibilidad con las hembras silvestres, se estableció una nueva colonia utilizando Aedes aegypti capturado en el medio silvestre de la población objetivo para producir machos para el programa9. Esto se basó en la hipótesis de que los machos criados en colonias derivados localmente tendrían más probabilidades de competir con los machos salvajes locales para aparearse con las hembras salvajes locales. Para que la TIE sea efectiva, no solo es necesario que un número abrumador de machos estériles estén presentes en el área objetivo, sino que también deben ser capaces de cortejar y aparearse eficazmente con mosquitos hembras silvestres locales.
Se realizó una serie de experimentos para determinar el número óptimo de machos estériles a liberar (datos no publicados de KJL, RLA, SCB), así como dosis óptimas de radiación que harían que los machos fueran infértiles sin interferir con la supervivencia, el comportamiento o la aceptación por parte de las hembras salvajes (datos no publicados de KJL, RLA, SCB). Estos datos se publican en publicaciones aliadas de este grupo, pero algunos de estos hallazgos también se capturan en este protocolo y podrían usarse como punto de partida para nuevos programas de control de Aedes aegypti de SIT en otros lugares. Esta especie está expandiendo constantemente su rango, y los programas SIT muestran una gran promesa de ser soluciones rentables a largo plazo para controlar esta población. El objetivo de este protocolo es producir mosquitos Aedes aegypti esterilizados, machos y criados en colonias para su liberación sistemática en áreas al aire libre para interrumpir los ciclos reproductivos naturales de las poblaciones locales de Aedes aegypti en un programa operativo de control de vectores de salud pública.
Si bien se han publicado protocolos y flujos de trabajo similares para la producción de machos transgénicos de Aedes aegypti y flujos de trabajo de producción para Aedes SIT, o programas de incompatibilidad basados en Wolbachia en otros lugares, este protocolo ilustra cómo se han adaptado los protocolos existentes para la producción, separación e irradiación de pupas macho de Aedes aegypti, marcado y envasado de machos adultos, y envío al sitio de liberación para este programa 9, 10,11,12,13,14,15,16,17,18. Es posible que el componente de marcado de este protocolo no sea necesario en un programa SIT operativo maduro; sin embargo, se ha incluido aquí porque es una forma de monitorear la eficacia y controlar la calidad de todo el proceso en los primeros años de establecer el programa SIT. Los programas de control de mosquitos suelen ser administrados por las autoridades locales, por lo que pueden variar ampliamente en muchos aspectos de su organización, desde el tamaño y la base de financiación hasta el ajuste de las tácticas de control para maximizar el éxito local. Por lo tanto, el protocolo descrito en este documento debe evaluarse para determinar su compatibilidad con los recursos disponibles.
Protocolo
NOTA: Este protocolo es específico para el manejo de Aedes aegypti , pero puede modificarse para ser efectivo para otras especies de mosquitos.
1. Producción y mantenimiento de una colonia de Aedes aegypti
- Cría adultos de Aedes aegypti y producen huevos.
- Prepare un marco de aluminio plegable de 0,6 m x 0,6 m x 0,6 m, una jaula de cría grande con malla de fibra de vidrio de 20 x 20 y una manga de stockinette de alcance en una pared vertical.
- Coloque una tina de plástico de 1900 ml con pupas de Aedes aegypti (proporción de sexos de 1: 1) en cada jaula de cría, ate la manga cerrada y deje las copas en su lugar para la eclosión hasta que no surjan más adultos (es decir, aproximadamente 4 días). En este momento, retire las copas y mantenga las jaulas de cría de adultos a 28-30 ° C, >50% de humedad relativa (Rh) y un ciclo de luz: oscuridad (L: D) de 12:12 o 14:10.
NOTA: La producción de pupas de Aedes aegypti se describe en la sección 1.2. La densidad de pupas en la tina de 1900 ml debe ser tal que haya suficiente espacio para que todas las pupas salgan a tomar aire simultáneamente. - Veinticuatro horas después de colocar las pupas en las jaulas de cría, coloque un recipiente de solución de sacarosa al 10% con una mecha de esponja y suspenda una esponja de 10 cm x 2 cm empapada en miel de un gancho de alambre en cada jaula para proporcionar fuentes separadas de hidratación y nutrición a los mosquitos adultos. Controle las esponjas y el recipiente de sacarosa para detectar sequedad o crecimiento de moho, y reponga o cambie según sea necesario.
NOTA: Use un vaso de plástico de 120 ml con una mecha de esponja de 10 cm x 2 cm colocada a través de un recorte en la tapa en jaulas de cría pequeñas y un vaso de plástico de 460 ml con una mecha de esponja de 12 cm x 8 cm en jaulas grandes. - Proporcione una comida de sangre a cada jaula de cría 48-72 h después de que la mayoría de los adultos hayan emergido y cada 2-3 días a partir de entonces para mantener un alto número de hembras alimentadas con sangre para maximizar el rendimiento de los huevos. Llene un condón de piel de cordero con 50-100 ml de sangre bovina defibrinada y caliente hasta aproximadamente 37 ° C en un baño de agua caliente. Luego, use un paño o una toalla de papel para acariciar y secar parcialmente el condón antes de colocarlo en una placa de Petri forrada de papel dentro de la jaula durante 30-60 minutos.
NOTA: Antes de usar, enjuague el interior y el exterior de cada condón con agua 2-3x para eliminar los lubricantes u otros sustratos, y verifique si hay agujeros. Los condones se pueden reutilizar para 3-5 alimentaciones enjuagando la sangre y almacenándola en una taza de agua fría. Como algunas colonias pueden experimentar infestaciones de hormigas, es posible que sea necesario suspender los condones para limitar el acceso. - Espere 48-72 h después de cada alimentación con sangre, y luego introduzca una copa de oviposición en cada jaula de cría de adultos. Prepare las copas de oviposición agregando 200 ml de agua de pupa filtrada (es decir, las larvas de agua y las pupas fueron criadas) en una taza de plástico de 460 ml amueblada con una hoja de papel de germinación de semillas de 8-10 cm de alto x 30 cm de ancho (papel de oviposición) colocada a ras de la circunferencia interna de la taza. Revise los papeles de oviposición diariamente, reemplácelos cada 2-4 días y almacene cuidadosamente los papeles de oviposición cargados de huevo dejándolos secar durante 24-48 h a >50% Rh19.
NOTA: Deje las copas de oviposición en las jaulas de cría durante no más de 72 h para evitar que los huevos eclosionen. - Mantenga las jaulas de cría de adultos hasta por 3-4 semanas antes de descomponerlas y establecer nuevas jaulas de cría de adultos.
- Para romper una jaula de cría, retire y limpie la copa de oviposición, guarde el papel de oviposición cargado de huevos, retire y limpie el recipiente de solución de sacarosa y la esponja de miel, y congele la jaula para matar a todos los mosquitos.
- Retire todos los cuerpos de los mosquitos y limpie a fondo el interior y el exterior de cada jaula con agua y jabón diluido con toallas de papel y estropajas con esponjas. Deje que la jaula limpia se seque durante al menos 24 h antes de usarla en el siguiente ciclo de crianza.
NOTA: Utilice equipos de vacío equipados con filtración de alta eficiencia para eliminar las partículas que pueden provocar alergias. Los recipientes de solución de sacarosa se pueden limpiar y reutilizar 3-5x.
- Cría de larvas de Aedes aegypti a partir de huevos
- Preparar un stock de purín nutricional larvario mezclando 80 g de una proporción de 3:2 de hígado bovino en polvo:levadura de cerveza en 2200 ml de agua del grifo. Prepare comida para peces pulverizada. Vierta los copos de pescado en un molinillo de especias y muele hasta que sea un polvo fino.
NOTA: Esta suspensión se designa como marrón en este laboratorio. - Usando papel de oviposición cargado de huevos (5,000-10,000 huevos) del paso 1.1.5, corte una porción de 3-7 cm del papel de huevo perpendicular a la línea de oviposición y colóquelo en un recipiente de 460 ml medio lleno con agua del grifo junto con una pizca de copos de comida para peces pulverizados. Cubra y agite vigorosamente durante al menos 1 minuto.
NOTA: El papel de huevo debe almacenarse durante al menos 7 días (pero no más de 90 días, lo que puede reducir la eclosión) después de la oviposición antes de iniciar el proceso de eclosión para permitir la embrinación. Las bacterias y algas presentes en el alimento para peces desoxigenan rápidamente el agua, lo que desencadena el desarrollo larvario. - Vierta todo el contenido del recipiente desde el paso 1.2.2 en una bandeja de cría para larvas preparada con 3 L de agua del grifo y 50 ml de lechada marrón . Marque la sartén con la fecha de inicio, la información de la cepa, el horario de alimentación según la Tabla 1 y guárdela a 28-30 °C, >50% HR y a las 12:12 o 14:10 L:D ciclo.
NOTA: La proporción de 3 L de agua a 50 ml de marrón se basa en la profundidad del agua en las sartenes larvales particulares mencionadas en la Tabla de materiales. Las sartenes de diferentes tamaños soportarán diferentes densidades de pupa y, por lo tanto, requerirán diferentes cantidades de agua y lechada marrón . Las tasas de alimentación larvaria en la Tabla 1 se dan como un rango; La selección de la cantidad utilizada se basa en la experiencia y la determinación de la salud general de las larvas en desarrollo utilizando variables como la turbidez del agua, el color y el olor; presencia de película bacteriana en el agua; número o proporción de larvas vivas y muertas; y la motilidad de las larvas. En los días 3 a 6, alimentar a los mosquitos inmaduros con alimento para peces pulverizado de acuerdo con la Tabla 1. Agregar agua, reducir los alimentos y configurar 2-3 sartenes adicionales de las que requiere el proyecto son formas de manejar las sartenes larvales poco saludables.
- Preparar un stock de purín nutricional larvario mezclando 80 g de una proporción de 3:2 de hígado bovino en polvo:levadura de cerveza en 2200 ml de agua del grifo. Prepare comida para peces pulverizada. Vierta los copos de pescado en un molinillo de especias y muele hasta que sea un polvo fino.
| Día | Volumen de purín nutricional añadido | Volumen de agua añadido | Acciones |
| 1 | 50 ml (lodo) | 3000 ml | |
| 2 | (sin comida) | (sin agua) | |
| 3 | 1/4 - 1/2 cucharadita (alimento para peces pulverizado) | 500-1000 ml | |
| 4 | 1/2 - 3/4 cucharadita (alimento para peces pulverizado) | 500-1000 ml | |
| 5 | 1/2 - 3/4 cucharadita (alimento para peces pulverizado) | 500-1000 ml | |
| 6 | 1/4 - 1/2 cucharadita (alimento para peces pulverizado) | 500-1000 ml | |
| 7 | (sin comida) | (sin agua) | Pupas y larvas de cepa |
Tabla 1: Esquema de alimentación para la cría masiva de larvas de Aedes aegypti.
2. Separación de pupas macho de Aedes aegypti
- Concentrar las pupas de las sartenes larvales. Una vez alcanzada la proporción umbral aproximada de pupas, vierta el contenido de cada sartén a través de un tamiz (tamaño 20-40). Use una botella exprimida de agua del grifo para lavar las pupas y las larvas del tamiz en un vaso de precipitados de plástico graduado de 3000 ml.
NOTA: Solo se deben transferir 2-3 sartenes larvales a cada vaso de precipitados de 3000 ml para evitar el hacinamiento para que las pupas puedan llegar a la superficie cómodamente. Se espera que las pupas se desarrollen entre 130 y 140 h después de la eclosión del huevo en las condiciones de temperatura y luz mencionadas en el paso 1.2.3. Espere una eclosión de huevos notable el mismo día en que se configuran los huevos. Dependiendo de las condiciones ambientales, aproximadamente el 20-70% de las larvas habrán pupado y estarán listas para ser tamizadas dentro de los 6 días. La partición de las pupas en múltiples vasos de precipitados de 3000 ml garantiza volúmenes manejables para verter en el separador. - Separe las pupas macho de las larvas y las pupas hembras.
NOTA: Este paso puede ser realizado por un operador o dos operadores.- Para un solo operador que separa pupas macho:
- Divida el contenido de cada vaso de precipitados de 3000 ml generado en el paso 2.1 en múltiples recipientes de plástico de 1900 ml para reducir los derrames y la sobrecarga del separador. Prepare el separador de placas colocando un recipiente rígido poco profundo de recolección de 4000 ml debajo de la esclusa en la base del separador (Figura 1). Llene dos vasos de plástico graduado de 3000 ml aproximadamente 3/4 de agua del grifo.
NOTA: Use una manguera de fregadero como alternativa a los vasos graduados de plástico de 3000 ml. De lo contrario, los vasos de precipitados deberán rellenarse continuamente durante todo el proceso de separación. Se pueden encontrar detalles adicionales para operar el separador de pupa en las referencias12,20. - Vierta agua a través del espacio entre las placas de vidrio y ajuste las perillas superior e inferior en el sentido de las agujas del reloj o en el sentido contrario a las agujas del reloj para permitir que el agua fluya continuamente mientras genera simultáneamente agua estancada a una altura de aproximadamente 1,25 cm desde la base de las placas. Marque las posiciones iniciales de las perillas inferiores con cinta adhesiva. Una vez que el agua estancada se distribuya uniformemente a través de la base de las placas de vidrio con la misma altura y velocidad de drenaje, comience a verter el contenido de los recipientes de pupas y larvas a través del espacio entre las placas.
NOTA: Debe haber una clara separación entre pupas pequeñas (macho) y grandes (hembras); De lo contrario, enjuague este lote y ajuste las perillas superiores para reducir el espacio entre las placas. - Mientras vierte lentamente agua a través del separador, gire continuamente las perillas inferiores como un par en sentido contrario a las agujas del reloj ~ 1-2 cm desde la posición inicial marcada con cinta hasta que la mayoría o todas las larvas se hayan lavado y se hayan deslizado por la esclusa en el recipiente de recolección.
NOTA: Como una mano se usa para verter agua, la otra mano gira las perillas una a la vez, pero igualmente y en pequeños incrementos, para abrir lentamente las placas. La mayoría de las larvas se lavan rápidamente, pero habrá algunas larvas atrapadas con las pupas macho. Estas larvas rezagadas serán irradiadas, pero se retrasarán en el desarrollo y no se acercarán a los adultos con la cohorte focal de pupas. - Deseche o recicle las larvas de nuevo en la colonia, pero en cualquier caso, retírelas del recipiente de recolección antes de que las pupas macho comiencen a lavarse a través del separador. Haga una pausa en el proceso cesando el flujo de agua mientras el recipiente de recolección en la base de la esclusa se limpia de larvas vertiendo a través de un tamiz # 30, que se lava en un recipiente separado.
NOTA: Las larvas fluyen primero, seguidas por las pupas macho y finalmente las hembras (Figura 1). - Continúe vertiendo agua y gire las perillas inferiores hasta que las larvas macho se laven y se separen en el recipiente de recolección. Pausa el proceso para buscar y eliminar larvas del contenedor de recolección antes de transferir las pupas macho en el siguiente paso.
NOTA: El número de descargas necesarias para separar los machos depende del tempo del vertido de agua y la velocidad a la que giran las perillas. Por lo general, se necesitan 2000-2500 ml de agua para eliminar las larvas, 1000-1500 ml para eliminar las pupas macho y 200-400 ml para eliminar las pupas hembras. - Vierta las pupas macho fuera del recipiente de recolección a través de un tamiz # 20 sobre un fregadero. Use una botella de 1000 ml de agua del grifo para lavar a fondo las pupas macho del tamiz mientras vierte en un recipiente separado de 1900 ml.
- Una vez que todas las pupas macho se hayan separado, continúe vertiendo agua a través del separador y ajuste las perillas inferiores para que enjuaguen a través de las pupas hembra. Transfiera las hembras utilizando el proceso de tamiz descrito en el paso 2.2.1.6 a un recipiente separado hasta que todos los mosquitos inmaduros se eliminen del separador. Desecha las pupas hembras. Una vez que se haya procesado el lote, devuelva las perillas a sus posiciones iniciales originales y repita el proceso con el siguiente lote. Una vez procesados todos los lotes, deje las placas abiertas para que el separador pueda secarse.
NOTA: No hay una separación perfecta usando este dispositivo, que requiere paciencia y práctica. Las pupas o larvas obstinadas pueden desprenderse con un flujo pesado de agua, pero no en la medida en que las empuje hacia los lados, lo que podría contaminar futuras inundaciones.
- Divida el contenido de cada vaso de precipitados de 3000 ml generado en el paso 2.1 en múltiples recipientes de plástico de 1900 ml para reducir los derrames y la sobrecarga del separador. Prepare el separador de placas colocando un recipiente rígido poco profundo de recolección de 4000 ml debajo de la esclusa en la base del separador (Figura 1). Llene dos vasos de plástico graduado de 3000 ml aproximadamente 3/4 de agua del grifo.
- Para dos operadores que separen las pupas macho, modificar el punto 2.2.1 como sigue.
- Primer operador: Vierta agua a través del separador y gire las perillas gradualmente para separar larvas, pupas macho y pupas hembra.
- Segundo operador: Una vez que cada etapa se recoge en el recipiente de esclusas, tamizar el contenido del recipiente de esclusas para dividir las larvas, pupas macho y pupas hembras en múltiples recipientes separados de recolección de esclusas. Mantenga los vasos de precipitados grandes llenos de agua si no hay una manguera de fregadero disponible.
- Para un solo operador que separa pupas macho:
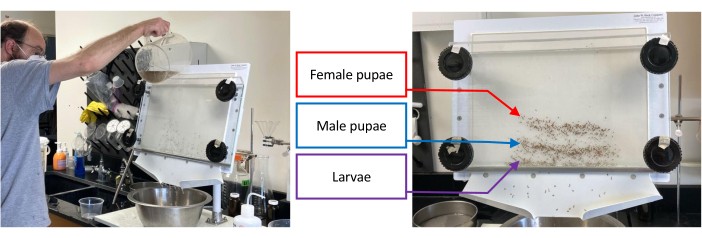
Figura 1: Separador de pupa que contiene un lote de Aedes aegypti inmaduro. La separación comienza vertiendo agua a través del separador mientras se giran las perillas inferiores 1-2 cm en sentido contrario a las agujas del reloj hasta que el conjunto objetivo, es decir, larvas, pupas macho o pupas hembra, se haya aislado tanto como sea posible de los conjuntos que quedan (imagen izquierda). La imagen de la derecha muestra la separación de larvas (banda más baja), pupas macho (banda media) y pupas hembras (banda superior). Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación de pupas macho de Aedes aegypti para irradiación
- Dividir las pupas macho en placas de Petri de plástico de 60 mm.
NOTA: El número de placas de Petri necesarias depende de cuántas pupas macho estén disponibles para la irradiación: una bandeja de cría de larvas del paso 1.2 llenará aproximadamente 1.5 placas de Petri. La edad de las pupas oscila entre 1 y 40 h. En este protocolo, la mitad más profunda de diámetro más pequeño de la placa de Petri se llama inferior, y la mitad menos profunda de mayor diámetro se llama superior.- Prepare discos precortados de papel de filtro para que se ajusten al diámetro interior del fondo de la placa de Petri. Coloque un disco de papel de filtro humedecido con agua en cada uno de los fondos de las placas de Petri para mantener las pupas hidratadas durante el transporte y el proceso de irradiación.
- Transfiera las pupas a placas de Petri. Colar las pupas macho recogidas en el paso 2.2.1.6 con un colador y lavar las pupas en un vaso de precipitados graduado de 1000 ml con la menor cantidad de agua posible. Vierta cuidadosamente las pupas en placas de Petri hasta que cada disco de papel de filtro esté cubierto uniformemente con una sola capa de pupas (Figura 2A - C). Coloque las placas de Petri en el borde de una mesa en una fila para facilitar el vertido.
NOTA: Una alternativa a colar las pupas es cortar la punta de una pipeta Pasteur de plástico de 3 ml a un diámetro lo suficientemente grande como para acomodar las pupas. Utilice la pipeta para transferir las pupas del recipiente producido en el paso 2.2.1.6 directamente a los discos de papel de filtro, de modo que quede una sola capa de pupas compacta en cada placa de Petri. Esto solo es práctico para lotes pequeños. - Utilice una pipeta Pasteur de 3 ml inalterada para eliminar el agua estancada del fondo de la placa de Petri para evitar el movimiento de la pupa durante la etapa de sexado (3.2) y el transporte.

Figura 2: Transferencia de pupas a placas de Petri para irradiación . (A) Las pupas tamizadas se vierten y se retrolavan en un vaso de precipitados de plástico de 1000 ml. (B) Se retiene un mínimo de agua en el vaso de precipitados para facilitar el vertido en placas de Petri. (C) Placas de Petri alineadas a lo largo del borde de una superficie para facilitar el vertido en una sola capa de pupas. (D) Las placas de Petri cargadas con pupas se apilan y aseguran para su entrega a la instalación de irradiación. Haga clic aquí para ver una versión más grande de esta figura.
- Sexo de las pupas para verificar si hay contaminación con hembras. Bajo un endoscopio de disección, use sondas para rotar cada pupa para verificar la superficie ventral en busca de un lóbulo genital de gran tamaño (Figura 3) que indique el sexo masculino. Retire y deseche las pupas con lóbulos genitales reducidos o pequeños que indiquen hembras y reemplácelas con un número igual de pupas macho para mantener el recuento correcto.
NOTA: En un programa operativo, este paso no es práctico debido a la gran cantidad de mosquitos y al hecho de que la separación, transferencia, irradiación y preparación de jaulas después de la irradiación se realizan en un día con tiempo limitado. Se puede verificar la calidad de una muestra de placas de Petri seleccionadas, particularmente en las primeras fases de desarrollo del programa SIT.
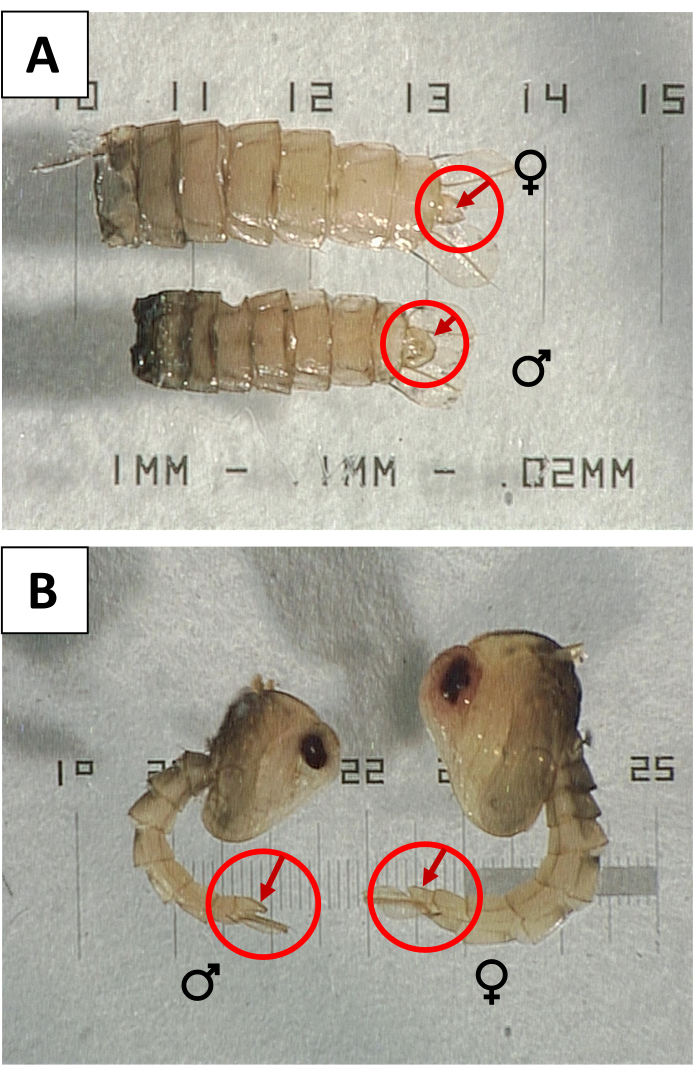
Figura 3: Sexado de pupas utilizando el lóbulo genital . (A) Vistas ventrales y (B) laterales de pupas hembras (♀) y machos (♂) de Aedes aegypti , con lóbulos genitales indicados para mostrar el dimorfismo sexual. Haga clic aquí para ver una versión más grande de esta figura.
- Cubra los fondos con la parte superior de las placas de Petri y asegúrelos con cinta de laboratorio. Agrupe las placas de Petri con cinta adhesiva con bandas elásticas en pilas dimensionadas para caber en la cámara de irradiación y selle dentro de una bolsa resellable de 3,8 L etiquetada (Figura 2D). No permita que las pupas permanezcan descubiertas durante >1 h.
4. Irradiación de pupas macho de Aedes aegypti
- Prepare la película dosimétrica del mismo lote cortando 1 cm2 cuadrados de películas y colocando cada cuadrado en su sobre individual.
NOTA: Toda la película utilizada en cada día se corta al mismo tiempo. Esto reduce la pequeña cantidad de variación inducida por el almacenamiento. El número de cuadrados necesarios para cada pila es 1 + (número de placas de Petri). - Prepare un kit para llevar a la instalación de irradiación, que debe incluir un temporizador de laboratorio, cinta de laboratorio, marcador permanente, sobres preparados de película dosimétrica, placa de dosimetría y una hoja de notas de laboratorio con listas de verificación para realizar un seguimiento de la información clave (Figura 4).
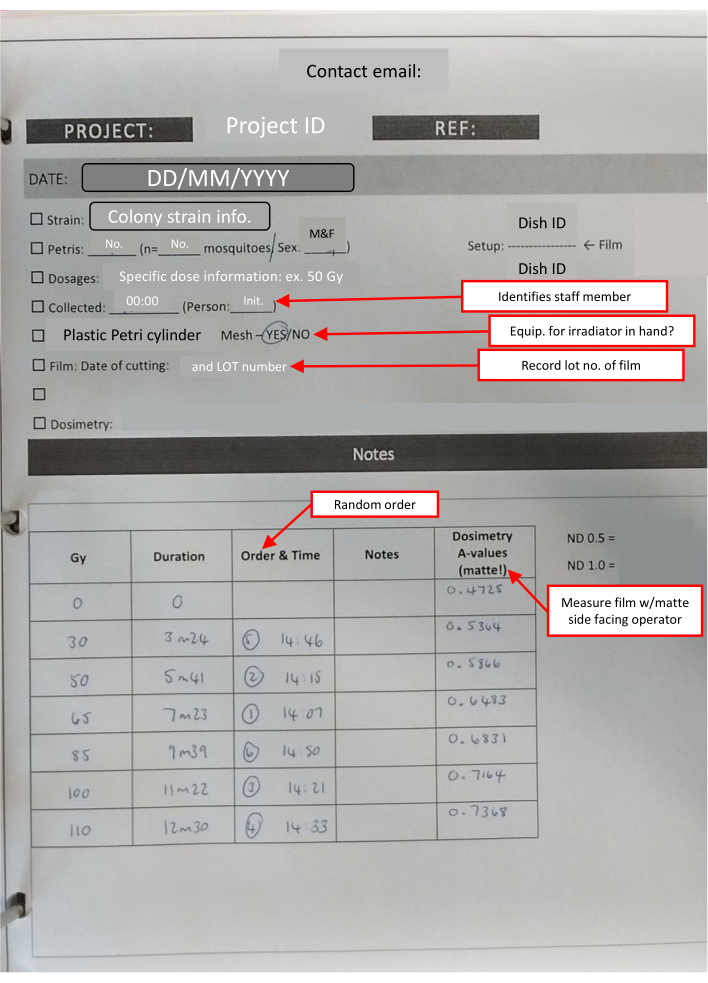
Figura 4: Esquema del libro de laboratorio-hoja IR completada para un conjunto de dosis-respuesta. Los cuadros de texto delineados en rojo (marcados con flechas rojas) indican notas útiles sobre las diferentes secciones y reiteran información clave. Haga clic aquí para ver una versión más grande de esta figura.
- Transportar las pupas a la instalación de irradiación. Coloque las placas de Petri de pupas macho del paso 3.3 en recipientes isotérmicos y guárdelas fuera de la luz solar directa y con aire acondicionado durante el transporte.
- Prepare pilas de placas de Petri para la irradiación en el irradiador. Apile el número apropiado de placas de Petri para que quepan en la cámara de irradiación con un sobre de película de dosimetría centrado entre cada plato y en la parte superior e inferior de la pila. Asegure los sobres y toda la pila con cinta de laboratorio para evitar derrames y facilitar la colocación de la pila en la cámara.
- Irradiar las placas de Petri de pupas macho. Coloque la pila de placas de Petri en la malla metálica rígida de la cámara para colocarla a la altura correcta para el cono óptimo de exposición basado en el mapeo de dosis previo de la unidad de irradiación específica21. Active la plataforma giratoria en el irradiador e irradie, iniciando simultáneamente el temporizador de laboratorio. Irradiar durante el intervalo apropiado para alcanzar la dosis deseada (los ejemplos se muestran en la Tabla 2).
NOTA: Este protocolo se basa en un irradiador de cesio-137 (ver la Tabla de materiales) y una dosis objetivo de 50 Gy. Debido a que el Cs-137 decae con el tiempo, la tasa de dosis se ajusta cada año mediante la realización de una serie de dosis-respuesta utilizando dosímetros de alanina, complementados con película radiocrómica para dosimetría de rutina y alanina en aproximadamente el 10% de las muestras irradiadas. Dada la tasa de dosis actual de 8,8 Gy/min, alcanzar la dosis objetivo de 50 Gy requiere 5 min, 41 s de exposición. La dosimetría de película de rutina se produce como se describe en el paso 4.7. La dosimetría de pellets de alanina se realiza en el Centro Nacional de Investigación de Haces de Electrones de la Universidad de Texas A&M o en el Instituto Nacional de Estándares y Tecnología en Gaithersburg, MD, EE.
| Dosis (Gy) | Tiempo (basado en 8,8 Gy/min) |
| 0 | NA |
| 10 | 1 min 8 s |
| 30 | 3 min 24 s |
| 50 | 5 min 41 s |
| 65 | 7 min 23 s |
| 85 | 9 min 39 s |
| 100 | 11 min 22 s |
| 110 | 12 min 30 s |
Tabla 2: Ejemplos de tiempos de dosificación para el irradiador de cesio-137.
- Una vez transcurrido el tiempo prescrito, retire las placas de Petri del irradiador y desmonte cuidadosamente la pila. Etiquete todas las placas de Petri y los sobres de película con la fecha y la ubicación en la pila. Selle los sobres y guárdelos para dosimetría. Vuelva a embalar las placas de Petri en el contenedor isotérmico para transportarlas de regreso al laboratorio principal.
NOTA: Registre si los adultos surgieron durante la irradiación y marque la placa de Petri afectada para que el adulto o adultos no escapen cuando las pupas se coloquen en las jaulas de cría (paso 5.2). - Confirmar la dosis de irradiación con película dosimétrica midiendo la película aproximadamente 24 h después de la exposición. Active el lector de dosimetría y permita que se equilibre a temperatura ambiente. Cargue la película con pinzas suministradas con el lector y siga las instrucciones del fabricante para leer la película irradiada, así como la película en blanco no irradiada del mismo lote. Ponga a cero el lector sin película entre lecturas y registre los datos como en la hoja de datos de ejemplo que se muestra en la Figura 5.
NOTA: Este protocolo se basa en los estándares ND0.5 y ND1.0 QA Filter Set. Es importante medir la película con el lado mate orientado hacia el operador.
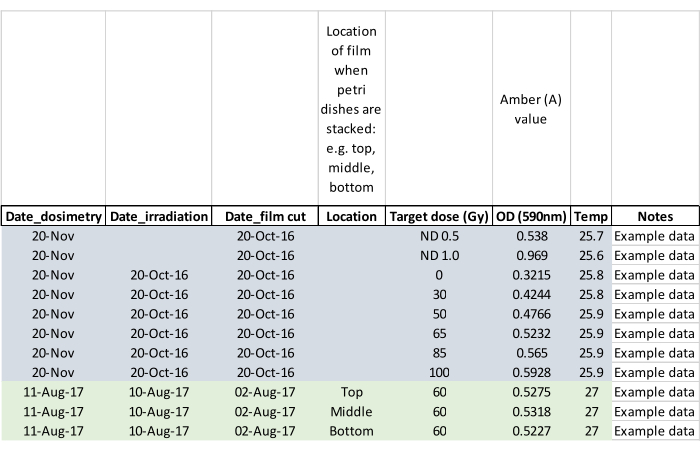
Figura 5: Hoja de datos de dosimetría rellenada con datos de ejemplo. Los encabezados de columna solicitan al operador que capture datos clave para su posterior análisis. Haga clic aquí para ver una versión más grande de esta figura.
5. Cría de pupas macho irradiadas de Aedes aegypti en adultos
- Limpie y prepare pequeñas jaulas de cría de plástico de 30 cm x 30 cm x 30 cm para que estén listas para las pupas irradiadas al regresar al laboratorio principal. Por cada 2 placas de Petri de pupas macho irradiadas, prepare 1 jaula de cría. Almacene cada jaula de cría con un vaso de plástico medio lleno que contenga 460 ml de agua del grifo y un recipiente de solución de sacarosa al 10%, como se describe en el paso 1.1.3.
- Transfiera inmediatamente las pupas irradiadas a las jaulas de cría preparadas después de regresar de la instalación de irradiación. Use una botella de agua exprimida para lavar cuidadosamente las pupas de cada placa de Petri en los 460 ml de agua en el vaso de plástico en cada jaula de cría. Después de 24 h, transfiera las copas a jaulas de cría nuevas y limpias que contengan la fuente de nutrición, y espere la eclosión restante de Aedes aegypti irradiado por machos adultos.
NOTA: Si han surgido pupas durante el proceso de irradiación, abra las placas de Petri con los volantes en una jaula vacía y, a continuación, continúe con el paso 5.2. Deseche los machos recogidos en esta jaula. Las pupas se transfieren a nuevas jaulas de cría después de 24 h porque los machos emergen antes que las hembras de la misma cohorte y aislar los días de emergencia puede reducir la incidencia de contaminación femenina y garantizar un envejecimiento preciso de los machos.
6. Marcado y pesaje de machos adultos irradiados de Aedes aegypti
NOTA: Esta sección del protocolo asume que dos personas están realizando las tareas; Para 1 persona, véase 6.4.

Figura 6: Embalaje marcado, irradiado, macho Aedes aegypti en contenedores de liberación. (A) Libere el recipiente que muestre la calcetina sujeta a un agujero cortado en el costado del cilindro de cartulina con cinta adhesiva, grapas y pegamento caliente. El bisel está en su lugar con un respaldo de etiqueta de cinta adhesiva pegado al costado. El bisel retiene la cubierta de malla de tul bien tirada; Una banda elástica (no visible) también sostiene el tul en su lugar debajo del bisel. (B) Lote de machos anestesiados en proceso de ser revueltos en tinte rosa en un pequeño vaso de cartulina. (C) Cuatro contenedores de liberación dentro de un contenedor de envío aislado. Tenga en cuenta que las mangas de stockinette están orientadas al centro del contenedor de envío, los materiales de embalaje están escondidos alrededor de los contenedores de liberación y las fuentes de nutrición e hidratación están en su lugar en la parte superior de cada contenedor de liberación cubierto por un fondo de placa de Petri invertido sostenido por bandas elásticas cruzadas y trozos de cinta. Haga clic aquí para ver una versión más grande de esta figura.
- Prepare los contenedores de liberación de cartulina.
- Corte un orificio de 11,5 cm de diámetro en el costado de un recipiente cilíndrico de cartulina de 3,9 L con tapa a 1,5-3,0 cm de la parte inferior para que el orificio no quede cubierto por la tapa (Figura 6A).
- Cortar una calcetín de 40-50 cm de longitud y grapar un extremo alrededor del interior del orificio de 11,5 cm cortado en 6.1.1. Utilice una grapadora de oficina estándar abierta para que las grapas puedan ser forzadas a través de la estona y la cartulina desde el interior del contenedor y hacia una superficie de trabajo adecuada, como un bloque de espuma de poliestireno extruido duro. Engarce las grapas con un destornillador de cabeza plana para asegurar firmemente la calcetina al perímetro del orificio y sujete la cinta adhesiva sobre el lado engarzado para evitar enganches. Selle el borde de la stockinette en el interior del cilindro a la cartulina con pegamento caliente y verifique todo el conjunto en busca de orificios de escape.
- Cree un bisel de retención retirando el disco interno de la tapa y corte un cuadrado de 33 cm x 33 cm de malla de tul de nylon lo suficientemente fino como para retener mosquitos machos adultos Aedes aegypti . Coloque la malla en el extremo abierto del cilindro y coloque el bisel sobre la malla para mantenerla en su lugar sin huecos. Tire de la malla hacia abajo para que sobresalga por debajo del bisel para hacer que la malla enseñada a través del extremo abierto y selle la malla sobresaliente apretada contra el cilindro con una banda elástica.
- Coloque un trozo de cinta adhesiva de 10 cm en el lado del bisel cubierto con un trozo de cinta de etiquetado de 8 cm para que la cinta de etiquetado se pueda reemplazar fácilmente sin rasgar el bisel.
NOTA: Los contenedores de liberación son duraderos y se pueden reutilizar >10 veces con el manejo adecuado. Antes de introducir cada nuevo lote de mosquitos machos marcados, irradiados, adultos, verifique que la existencia esté bien adherida al recipiente y haga reparaciones rápidamente si es necesario.
- Prepare la estación de pesaje y marcado.
- Vierta aproximadamente 50 mg de tinte de marcado en un recipiente de cartulina de 240 ml y extienda el tinte como una capa de polvo uniformemente alrededor de las superficies internas del recipiente. Golpee suavemente para desechar el exceso de tinte. Use tazas claramente etiquetadas para múltiples tintes para mantener los colores separados.
- Tara un barco de pesaje de 100-500 g en una balanza electrónica de 0,0001 g; crear un formulario de datos (Tabla 3); y pegue cuatro hojas de papel de copia de 215,9 mm x 355,6 mm para hacer una superficie de trabajo de 431,8 mm x 711,2 mm.
| Contenedor de liberación | Peso de los mosquitos | Número de jaula | Hembras en lote | Número de hombres | Contenedor de liberación | Masa total |
| ROSA I | 0.024 | D1 #1 | 25 | ROSA I | 2.03 | |
| ROSA I | 2.007 | D1 #1 | 7 | ROSA II | 1.99 | |
| ROSA II | 1.990 | D1 #1 | ROSA III | 2.03 | ||
| ROSA III | 0.026 | D1 #3 | 25 | |||
| ROSA III | 2.000 | D1 #3 | 18 |
Tabla 3: Tabla de datos de la estación de pesaje.
- Marque lotes cuantificados de machos adultos irradiados con pigmento fluorescente.
- Transfiera los mosquitos adultos (2.5-3.5 días de edad) de cada jaula de cría a viales aspiradores. Retire las fuentes de nutrición de la jaula de cría del paso 5.2 y coloque toda la jaula en una cámara grande deCO2 durante 5-7 minutos, golpeando los lados del recipiente para desalojar a los mosquitos que puedan estar aferrados a la jaula de cría. Después de que haya transcurrido el tiempo de exposición, retire la jaula de cría de la cámara y aspire todos los mosquitos adultos en una serie de viales de aspiración de plástico.
NOTA: La administración del 99.5-100% CO2 es desde un tanque con un regulador, púa de latón y tubo de silicona canalizado hacia la cámara a un caudal de 6 L / min. El número de viales necesarios para limpiar la jaula de cría depende de cuántos mosquitos haya en la jaula y de la competencia del operador, pero generalmente se requieren de 3 a 5 viales por jaula. Elija un aspirador que tenga pequeños viales de cambio rápido para facilitar el manejo de mosquitos adultos en lotes, por ejemplo, uno usando un vial recolector de poliestireno de 60 ml sellado con una pantalla de aluminio de malla 20 x 20 en un extremo y una válvula de solapa de acetato transparente en el otro. Toda la jaula se anestesia antes de la aspiración para reducir el tiempo de transferencia de mosquitos a viales para reducir el estrés en los mosquitos y mantener el protocolo tratable. - Clasifique todos los mosquitos adultos de cada jaula de cría por sexo.
- Exponer el primer vial del paso 6.3.1 al CO 2 en una cámara pequeña durante 4 min, y luego agitar suavemente los mosquitos anestesiados, extendiéndolos por la superficie de trabajo de papel blanco preparada en el paso 6.2.2.
- Cargue un nuevo vial vacío en el aspirador, aspire cuidadosamente todos los machos de la superficie de trabajo y pase este vial a la estación de pesaje (paso 6.3.3.). Cuente las hembras que queden atrás, aspire en un frasco separado y deséchelas, junto con cualquier macho aplastado.
- Repita este proceso con los viales restantes de 6.3.1, pero en algún momento del proceso de clasificación por sexo, genere un vial separado con solo 25 machos que también se pase a la estación de pesaje. Repita el paso 6.3.2. para cada jaula de cría.
NOTA: Al procesar machos adultos irradiados para sexar, pesar y marcar, realice un seguimiento del número de hembras en cada lote, que son datos clave para la resolución de problemas y la garantía de calidad de la clasificación del sexo de las pupas y todo el proceso. Si el recuento de hembras es más alto de lo esperado, una segunda persona debe extraer hembras mientras el operador principal aspira a los machos. Es importante pesar una muestra de 25 machos de cada jaula de cría para calcular un peso promedio por mosquito, que se utilizará para estimar el número de machos irradiados marcados liberados al final del protocolo.
- Pesar y teñir lotes de mosquitos machos adultos.
- En la estación de pesaje, colocar el primer vial de mosquitos machos adultos de la estación de sexado (sección 6.3.2) en una pequeña cámara deCO2 durante 2 min, y agitar cuidadosamente los mosquitos en la pesada con tara preparada en el paso 6.2.2. Anotar el peso de los mosquitos y verterlos en el vaso de tinte preparado en 6.2.1.
- Incline y gire lentamente la copa 1 rotación completa en el sentido de las agujas del reloj y en el sentido contrario a las agujas del reloj para que los mosquitos entren en contacto con la capa en polvo en las superficies internas de la copa y estén ligeramente espolvoreados con tinte (Figura 6B). Vierta los mosquitos marcados en un bote de pesaje.
- Proceda rápidamente al siguiente paso para que los mosquitos no se recuperen y escapen. Repita este paso hasta que se hayan procesado todos los viales de la sección 6.3.2.
NOTA: El peso de los machos del vial separado de 25 machos generado para cada jaula de cría en la sección 6.3.2 se registrará y se utilizará para calcular el peso medio por macho de esa jaula.
- Cargue los contenedores de liberación con machos adultos irradiados marcados. Doblar ligeramente la cabina de pesaje que contiene mosquitos machos anestesiados, marcados e irradiados desde el final del punto 6.3.3. para crear un canal y, a continuación, dirigir este canal a través de la manga de la stockinette para transferir los machos al contenedor de liberación. Continúe agregando mosquitos hasta que aproximadamente 2.0 g o 1500-3000 mosquitos machos estén en el recipiente de liberación y cierre la manga de la media. Marque la cinta de etiquetado en el bisel del recipiente de liberación con el color del tinte, el número del recipiente y el peso total de los mosquitos, y copie estos datos en el formulario del paso 6.2.2.
NOTA: El manejo de mosquitos en cualquier etapa de la vida induce estrés y puede reducir la supervivencia o el vigor. La serie de anestesias descritas en este protocolo podría afectar a los mosquitos; Sin embargo, los intentos de perseguir y aspirar mosquitos no anestesiados en cada paso inducirían un mayor estrés y un protocolo insostenible. Dividir el peso total de los mosquitos en cada contenedor de liberación por el peso medio por mosquito macho generado en la sección 6.3.3 para obtener una estimación del número de machos en ese contenedor de liberación; Cada contenedor de liberación no debe tener más de 2 g de machos, lo que equivale a aproximadamente 1 jaula de cría grande.
- Transfiera los mosquitos adultos (2.5-3.5 días de edad) de cada jaula de cría a viales aspiradores. Retire las fuentes de nutrición de la jaula de cría del paso 5.2 y coloque toda la jaula en una cámara grande deCO2 durante 5-7 minutos, golpeando los lados del recipiente para desalojar a los mosquitos que puedan estar aferrados a la jaula de cría. Después de que haya transcurrido el tiempo de exposición, retire la jaula de cría de la cámara y aspire todos los mosquitos adultos en una serie de viales de aspiración de plástico.
- Modificaciones del protocolo de marcado para un solo operador
- Primero realice la clasificación por sexo para todas las jaulas grandes. Exponga cada jaula grande aCO2 durante 4-5 minutos y aspire todos los mosquitos en 4-5 viales. Exponga cada vial aCO2 durante 2-3 minutos, coloque todos los mosquitos en la superficie de trabajo de papel blanco, retire las hembras y el recuento, y devuelva a los machos a su jaula de gran población.
- Pesaje y marcado
- Comience con la primera jaula de retención de machos producida en el paso 6.4.1: retire la fuente de nutrición y anestesie a los machos en una cámara grande deCO2 durante 5-7 min. Aspire a los machos anestesiados uniformemente en viales separados. Repita este paso con cada jaula de retención en el orden en que se produjeron.
NOTA: Se producirán aproximadamente 2-3 viales abarrotados por jaula de retención. El procesamiento de jaulas de retención de machos en el orden en que se produjeron maximiza el tiempo de recuperación para cada jaula de machos. - Anestesiar el primer vial producido en el paso 6.4.2.1. durante 1-2 min en una pequeña cámara deCO2 . Verter un pequeño número de mosquitos sobre la superficie de trabajo de papel blanco, aspirar 25 mosquitos machos en un vial nuevo y procesar como en 6.3.2 para determinar el peso medio por macho para esa jaula. Devuelva cualquier macho adicional al vial de origen, o aspire en un nuevo vial separado para ser procesado más tarde; Proceda con el pesaje, marcado y transferencia a los recipientes de liberación para el resto de los machos en el primer vial como se describe en el resto del paso 6.3. Repita el paso 6.4.2.2. (excepto para aislar 25 machos en un vial separado) para el resto de los viales producidos en la etapa 6.4.2.1. en el orden en que se produjeron, y luego pasar a la siguiente jaula de cría clasificada por sexo producida en 6.4.1.
NOTA: Los flujos de trabajo con una persona son más lentos, y algunos mosquitos machos necesitarán ser anestesiados varias veces. Busque y elimine constantemente mosquitos hembra.
- Comience con la primera jaula de retención de machos producida en el paso 6.4.1: retire la fuente de nutrición y anestesie a los machos en una cámara grande deCO2 durante 5-7 min. Aspire a los machos anestesiados uniformemente en viales separados. Repita este paso con cada jaula de retención en el orden en que se produjeron.
7. Embalaje y embalaje de contenedores de liberación de Aedes aegypti macho adulto marcado, irradiado
- Prepare los contenedores de liberación para el envío. Una vez que un recipiente de liberación esté lleno de machos marcados, coloque 4 bolas de algodón humedecidas con solución de sacarosa al 10% en la tapa de malla y cubra con un fondo invertido de una placa de Petri sostenida en su lugar por dos bandas de goma estiradas alrededor de todo el recipiente y sobre la placa de Petri para formar una cruz. Coloque un trozo de cinta adhesiva sobre la X de las dos bandas elásticas para mantenerlas en su lugar encima de la placa de Petri invertida.
NOTA: Asegúrese de que las bolas de algodón con solución de sacarosa al 10% no estén saturadas hasta el punto de gotear, lo que dañará el recipiente y atrapará y matará a los mosquitos. - Empaque los contenedores de liberación de cartulina en un enfriador de envío de espuma de poliestireno extruido. Introduzca 4 orificios de ventilación a través de la tapa del refrigerador y ocluya con algodón para mantener alejadas a las hormigas y mantener a los mosquitos escapados. Coloque 4 contenedores de liberación en posición vertical en el refrigerador de envío con la existencia de cada contenedor hacia el centro (Figura 6C). Coloque el plástico de burbujas entre cada recipiente y en el centro para estabilizarlos. Rellene el resto del espacio en el enfriador de envío con almohadas de aire o apile una segunda capa de 4 contenedores de liberación directamente sobre la primera capa y estabilícela de manera similar con almohadas de aire.
NOTA: Los recipientes de liberación deben estar lo suficientemente estabilizados para no moverse cuando se agitan. La temperatura dentro del paquete es ambiente. - Prepare el refrigerador de envío para la entrega. Selle el refrigerador de envío con la tapa ventilada y colóquelo en el sobreembalaje de cartón, cierre la cinta adhesiva y envíelo por expreso nocturno al lugar de liberación.
Resultados
La cría vigilante y adecuada de mosquitos consiste en una disponibilidad bien equilibrada de machos y hembras en jaulas de colonias, el mantenimiento de una solución fresca de sacarosa y miel, y una alimentación sanguínea constante de alta calidad. Estas condiciones proporcionarán hojas de huevos densamente empaquetadas óptimas para su uso en bandejas de cría larvaria SIT. El almacenamiento y uso adecuados de hojas de huevo secas, como el etiquetado sistemático para facilitar el uso de la más antigua a la más nueva, apoyará la eclosión uniforme en todas las sartenes. Llenar todas las sartenes de cría de larvas con agua antes de la eclosión puede disminuir el tiempo durante el cual las hojas de huevos están en los contenedores para incubar y promover un desarrollo saludable. El mantenimiento de las sartenes larvales desde la eclosión hasta la pupación requiere un compromiso cuidadoso por parte del personal de la colonia, ya que algunas sartenes pueden necesitar más o menos alimento o agua adicional dependiendo de las etapas de desarrollo y las variables ambientales. Si hay problemas con la etapa de desarrollo para el día programado de la separación del sexo de la pupa, los ajustes deben hacerse antes en el proceso, como eclosionar antes o después, ajustar los alimentos o cambiar la temperatura de la incubadora.
El proceso de cría en este protocolo no hace que todos los huevos eclosionados a tiempo se conviertan en pupas que puedan ser irradiadas y utilizadas con fines de control. Entre el 20 y el 50% de los mosquitos criados en colonias seguirán siendo larvas cuando las pupas necesiten ser separadas. Sin embargo, estas larvas no se desperdician, sino que se dejan madurar durante 24 h para producir pupas adicionales que pueden combinarse con pupas hembras de la separación del día anterior y reciclarse de nuevo en jaulas de colonias. En las jaulas de la colonia, se permitirá que las pupas maduren y se conviertan en adultos, se apareen, se alimenten de sangre y produzcan huevos que sostengan el proyecto SIT.
La separación de las pupas, el vertido de pupas en placas de Petri, la irradiación y la colocación en jaulas de retención de adultos después de la irradiación deben ocurrir en un día; Por lo tanto, se debe asignar el tiempo adecuado para procesar todos los pasos cómodamente. El montaje y la preparación de los contenedores de liberación deben realizarse antes del proceso de marcado. Cuando las cajas de envío se devuelven desde el sitio de liberación, los contenedores de liberación deben inspeccionarse y prepararse para su próximo uso. Desechar las bolas de algodón húmedas, ventilar los recipientes de liberación húmeda, limpiar las placas de Petri, reemplazar la malla y quitar las bandas elásticas del contenedor, mientras no estén en uso, prolongará en gran medida la vida útil de los contenedores de liberación.
Dada la realidad mundial de la pandemia viral de COVID-19, este protocolo, que suele ser una operación de varias personas, ha sido modificado para que sea manejable por una persona que trabaja sola en un laboratorio para cada paso. Los pasos en el proceso que se ven más obstaculizados por un escenario de una sola persona son los pasos de sexado, marcado, pesaje y mantenimiento de la cría de colonias. La separación de las pupas por sexo por una persona debería ser suficiente si hay múltiples separadores que operan simultáneamente en diferentes habitaciones. En una situación de pandemia en la que se produce el distanciamiento social en el lugar de trabajo, se requiere equipar varias estaciones para completar los pasos desde el sexado hasta el embalaje. Dependiendo de la velocidad del operador, se necesita una persona ~ 4 h para tener sexo con 15,000 mosquitos y luego otra 1-2 h para marcarlos, pesarlos y empaquetarlos. Un escenario de dos personas disminuye el tiempo durante el cual los mosquitos son anestesiados para marcar y reduce el tiempo total de trabajo. Sin embargo, incluso en un escenario de dos personas, asignar los 2.0 g completos de mosquitos por jaula de liberación puede ser un desafío debido al tiempo de trabajo limitado mientras los mosquitos están sedados. Aunque el proceso de limpieza y preparación de materiales de cría de larvas y adultos requiere mucho tiempo y mano de obra, se puede dividir de modo que los operadores individuales puedan trabajar de forma independiente y segura durante una pandemia.
La liberación de machos adultos, marcados e irradiados de Aedes aegypti está fuera del alcance de este protocolo, pero se presenta aquí en breve. El proceso de liberación de mosquitos machos marcados, irradiados comienza determinando una distribución uniforme de liberación de los contenedores de liberación basada en pesos (y, por lo tanto, números inferidos de machos estériles), como se informa en la Tabla 3. Después de que los envíos se entregan al distrito de control de vectores, se abren las cajas y se evalúan los contenedores de liberación para detectar cualquier problema con la mortalidad o la condición de los contenedores de liberación. A continuación, se permite que los mosquitos en los contenedores de liberación se aclimaten a la temperatura ambiente y la humedad durante 1-2 h antes del transporte al área de tratamiento. Los sitios de liberación en el área de tratamiento se identifican después de una vigilancia intensiva de puntos calientes de poblaciones silvestres de Aedes aegypti. El momento, la frecuencia y la densidad de las liberaciones se equilibran con la bionomía de la especie, así como con la meteorología, el apoyo público y las capacidades de cría en laboratorio.
Como los contenedores de liberación específicos se adaptan a sitios de liberación particulares, la etiqueta debe verificarse antes de abrir el contenedor de liberación cortando la malla en la parte superior, lo que permite al operador deformar la malla para que una parte de los machos pueda escapar. Este método de liberación fraccionada se repite en cada punto de liberación asignado para el contenedor hasta que todos los machos que vuelan libremente hayan sido liberados. Este proceso se repite para cada contenedor de liberación en su respectiva ubicación de liberación asignada hasta que se hayan procesado todos los contenedores. Opcionalmente, después de que los mosquitos hayan sido liberados, cualquier mosquito muerto o discapacitado que no se haya ido libremente puede recogerse en placas de Petri y etiquetarse para ser contado a mano o pesado para corregir el número estimado liberado. Se lleva a cabo una vigilancia continua y generalizada de las etapas adulta, de huevo e inmaduras de Aedes aegypti silvestre en el área objetivo, y posiblemente en sitios de control sin intervención, para evaluar la eficacia de la operación de TIE.
Discusión
El inicio de un programa de control con TIE que utiliza radiación requiere el establecimiento de una cepa local de Aedes aegypti. Este paso es crítico y puede permitir que SIT se distinga realmente de tecnologías de control similares. Al desarrollar el proyecto a partir de una cepa local de mosquitos, los machos generados probablemente tendrán comportamientos que les permitan adaptarse a los cambios y señales ambientales y localizar y aparearse con hembras silvestres en las cercanías. Además, la liberación de machos locales irradiados puede no generar una opinión pública negativa en comparación con, por ejemplo, la liberación de una cepa no local de mosquitos modificados genéticamente que podría, por ejemplo, introducir nuevos alelos en la población local de mosquitos.
Gastar recursos sustanciales para criar grandes cantidades de mosquitos solo para poder usar aproximadamente la mitad de ellos con fines de control es una limitación del programa Aedes aegypti SIT. Se deben hacer refinamientos al protocolo de cría para condensar la maduración de las larvas en plazos más definidos cuando las pupas estén listas. Esto permitiría recolectar más pupas en el momento óptimo de separación. Sin embargo, las pupas adicionales para procesar aumentan el riesgo de que más hembras pupan cuando se recolectan las pupas y, por lo tanto, aumentan la probabilidad de que las hembras terminen en placas de Petri con machos y posiblemente sean liberadas. Aunque la esperanza de vida, el comportamiento de alimentación sanguínea y el comportamiento de oviposición en pupas hembras irradiadas de Aedes aegypti se reducen en adultos, no es una buena estrategia liberar hembras incidentalmente junto con machos irradiados22. Por lo tanto, debe seguir siendo una prioridad minimizar el número de hembras separadas, irradiadas, marcadas y liberadas inadvertidamente con machos.
El éxito de un programa SIT depende en última instancia de la competencia exitosa de pareja por machos irradiados criados en colonias. La preservación de la competitividad masculina se basa en la selección exhaustiva de la dosis derivada experimentalmente y en la maximización de la proporción estimada de machos estériles:salvajes en la población. La selección de la dosis está determinada por varios factores clave que incluyen la longevidad, la fertilidad, la fecundidad y la mortalidad de las pupas. Se ha observado que los mosquitos machos exhibirán una curva de fertilidad asintótica que se acerca a cero a medida que aumenta la radiación (datos no publicados de KJL, RLA, SCB). Simultáneamente, la longevidad y los niveles de actividad del mosquito macho disminuyen exponencialmente a medida que aumenta la dosis de radiación (datos no publicados de KJL, RLA, SCB). Por lo tanto, en lugar de identificar una dosis que produzca una esterilidad del 99,9% en los hombres, es preferible centrarse en un porcentaje de esterilidad más bajo mientras se apoya la supervivencia. Una vez que se identifica un rango de dosis que no diferencia la longevidad o la mortalidad pupal de los machos irradiados de la de los machos no irradiados, se deben realizar evaluaciones adicionales sobre la fertilidad para identificar una dosis que haga que los machos sean abrumadoramente estériles, pero competitivos.
Al mismo tiempo, es fundamental comparar el número de mosquitos machos en la población con el de machos irradiados liberados. Esto se puede lograr recolectando machos de varios lugares dentro y alrededor del área de liberación objetivo repetidamente desde el mismo lugar y antes, durante y después del inicio del programa SIT. Se debe realizar un estudio de marca, liberación y recaptura para evaluar la proporción de mosquitos machos salvajes a mosquitos liberados. Un estudio de marca, liberación y recaptura se basa en la liberación de un número conocido de mosquitos marcados desde un punto específico y su posterior recaptura en puntos cercanos que rodean el punto de liberación inicial. Al comparar el número de machos recapturados y machos silvestres a distancias desde el punto de liberación, es posible estimar la población silvestre general de machos en el área de modo que se puedan liberar proporciones competitivas de machos estériles23. La maximización de la proporción de machos estériles: salvajes se puede lograr liberando machos más estériles y / o reduciendo la población silvestre por medios de control clásicos como la reducción de la fuente, el control inmaduro o los tratamientos adulticidas.
Para medir la efectividad de las liberaciones masculinas estériles, las colecciones de adultos se pueden comparar cronológicamente con un área de no intervención. A medida que se liberan machos estériles y el número de machos y hembras recolectados en un área disminuye en relación con un área comparable de no intervención, entonces se puede plantear la hipótesis de que se debe a que los machos estériles liberados superan con éxito a los machos fértiles locales. Este efecto también se puede observar en las copas trampa de oviposición desplegadas tanto en los sitios de intervención como en los de no intervención. Los huevos aún pueden producirse en el sitio de intervención, pero si eclosionan menos que los del sitio de no intervención, se puede plantear la hipótesis de que no están fertilizados debido a que las hembras se aparean con machos estériles. Más y más oviposición de huevos no fertilizados podrían eventualmente conducir a una reducción de la oviposición debido a la no sustitución de hembras en el sitio de intervención 8,24.
Las direcciones futuras de la tecnología y los programas de TIE se expanden naturalmente a otras especies de mosquitos médicamente importantes. Por ejemplo, esta tecnología puede adaptarse fácilmente para controlar Aedes albopictus, dada la bionomía muy similar de Aedes aegypti y Aedes albopictus. Otras especies de mosquitos vectores de enfermedades de interés incluyen Culex quinquefasciatus, Culex tarsalis y varias especies de Anopheles. Mejorar la eficacia de esta tecnología depende de aumentar la capacidad de las pupas macho producidas en un momento dado, lo que podría lograrse mediante manipulación genética o selección artificial, y mejorar la competitividad masculina, que podría lograrse aumentando la virilidad, la fertilidad o la longevidad.
En última instancia, los programas SIT no son una bala de plata para controlar los mosquitos. En cambio, son una herramienta en un conjunto de otras técnicas de control, como los programas de IVM, que compensan las debilidades entre las técnicas. Por ejemplo, mientras que el control químico ofrece un control rápido y barato, también fomenta el desarrollo de resistencia y mortalidad no objetivo; y mientras que la TIE es específica de cada especie y no es probable que genere resistencia, los machos TIE deben producirse y liberarse a perpetuidad para controlar las poblaciones migratorias de fuera del distrito de control de vectores.
Divulgaciones
Todos los autores no han declarado ningún conflicto de intereses.
Agradecimientos
Agradecemos a los Drs. R.-D. Xue, C. Bibbs, W. Qualls y V. Aryaprema del Distrito de Control de Mosquitos de Anastasia, St. Augustine, Florida, por su asociación en el desarrollo del programa SIT y la visión experta sobre la liberación operativa efectiva del macho estéril Aedes aegypti. Esta investigación fue apoyada por el USDA-ARS y el Departamento de Agricultura y Servicios al Consumidor de Florida (FDACS). La mención de nombres comerciales o productos comerciales en esta publicación es únicamente con el propósito de proporcionar información específica y no implica recomendación o respaldo por parte del USDA o FDACS.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-1/8" wrench (1" (1 inch) = 2.54 cm) | Craftsman | CMMT44707 | |
| 1/2 pint cardstock cup (1/2 pint = 236.5 mL) | Science Supplies WLE corp | 1/2 pint | |
| 1/4" tubing - tygon | Hudson Extrusions | LLDPE1/8 X 1/4 BLK | to attach to CO2 gas regulator |
| 1/8" brass barb w/ MIP connection | B&K | BHB-85NLB | to attach to CO2 gas regulator |
| 1000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-1000 | |
| 3000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-3000 | |
| Adult large cage | Bioquip | 1450D | |
| Aspirator vials | Bioquip | 2809V | |
| Bovine liver powder | MP Biomedicals | 290039601 | |
| Brewers yeast | MP Biomericals | 02903312-CF | |
| CO2 regulator | Randor | 64003038 | |
| CO2 tank (20# canister) | Praxair | CDBEVCARB20 | |
| Collection basin | Treasure Gurus | KI-ENAMELBOWL | for separator |
| Cotton balls - large | Fisher Scientific | 22-456-883 | |
| Deli cups w/lids - 470 mL | Pactiv DELItainer | PCTYSD2516 | |
| Deli cups w/lids - 1900 mL | Berry Global | T60764 | |
| DoseReader 4 | ND0.5 and ND1.0 QA Filter Set standards | ||
| Dosimetry film | Far West Technology, Inc. | ||
| Filter paper | Millipore | AP10045S0 | |
| Flashlight aspirator | Bioquip | 2809D | |
| Forceps - fine featherweight | Bioquip | 4748 or 4750 | featherweight |
| GAFchromic | radiochromic film | ||
| Gammator M | Radiation Machinery Corporation, Parsippany, NJ | Cesium-137 irradiator | |
| Hand held mechanical aspirator | Clarke Mosquito | 13500 | |
| Lambskin condoms | Trojan | Naturalamb | |
| Large CO2 chamber | Sterilite | Walmart # 568789514 | |
| Larval rearing pans | Blue Ridge Thermoforming | 01-FG-400-3N-ABS | Dimensions: 22.375 x 17.5 x 3 (inches) |
| Magnets - 20# pull | Master magnetics | MHHH20BX | |
| Marking dye | Dayglo | ECO-11 | Aurora Pink |
| Marking dye | Dayglo | ECO-17 | Saturn Yellow |
| Mesh | Falk | T301 | |
| Pasture pipettes | Thermo Scientific | 02-708-006 | |
| Petri dishes - large | VWR International | 25384-090 CS | |
| Petri dishes - small (60 mm x 15 mm) | Fisher Brand | FB0875713A | |
| Pupa separator | J.W. Hock | 1512 | |
| Red rubber hose | Welch | 331040-5 | |
| Release containers | Science Supplies WLE corp | 1 gallon | |
| Rubber bands - cross #19 | Alliance | ALL37196 | |
| Rubber bands - latitude #64 | Skillcraft | NSN0589974 | |
| Scale | Ohaus | H-4737 | |
| Seed germination paper - Heavy stock 76# | Anchor Paper | #76 | |
| Shipping coolers- 16 x 13 x 12.5" | MrBoxonline.com | Husky Foam Cooler kit | |
| Sieve #20 | Advantech | 20BS8F | |
| Sieve #30 | Advantech | 30BS8F | |
| Small cage - Bug Dorm | MegaView | Bug Dorm-1 | |
| Small CO2 chamber | Mainstays | Walmart # 562922221 | |
| Souffle cup lid | SOLO | 41165277456 | |
| Souffle cups - 4 oz (1 oz = 29.6 mL) | SOLO | 41165024104 | |
| Sponge | ocelo | MMM7274FD | |
| Squeeze bottle | Dynalon | 3UUP6 | |
| Stereoscope | Meiji Techno | EMZ-5 | |
| Stockinette | BSN Medical | 30-1006 | |
| Styrofoam | extruded polystyrene foam | ||
| Tropical fish flake food | Tetra | 4.52 pound | |
| Vaccum chamber - desiccator | BelArt | T9FB892757 | |
| Weigh boats | Globe Scientific | 3621 |
Referencias
- Moyes, C. L., et al. Contemporary status of insecticide resistance in the major Aedes vectors of arboviruses infecting humans. PLoS Neglected Tropical Diseases. 11 (7), 0005625 (2017).
- Baldacchino, F., et al. Control methods against invasive Aedes mosquitoes in Europe: a review. Pest Management Science. 71 (11), 1471-1485 (2015).
- Burkett, D. A., Cope, S. E., Strickman, D. A., White, G. B. The Deployed Warfighter Protection (DWFP) Research Program: Developing new public health pesticides, application technologies, and repellent systems. Journal of Integrated Pest Management. 4 (2), 1-7 (2013).
- Harwood, J. F., et al. Controlling Aedes aegypti in cryptic environments with manually carried ultra-low volume and mist blower pesticide applications. Journal of the American Mosquito Control Association. 32 (3), 217-223 (2016).
- Morrison, A. C., Zielinski-Gutierrez, E., Scott, T. W., Rosenberg, R. Defining challenges and proposing solutions for control of the virus vector Aedes aegypti. PLoS Medicine. 5 (3), 68 (2008).
- Klassen, W., Curtis, C. F., InDyck, V. A., Hendrichs, J., Robinson, A. S. History of the sterile insect technique. Sterile insect technique: principles and practice in area-wide integrated pest management. , 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector Borne and Zoonotic Diseases. 10 (3), 295-311 (2010).
- Dame, D. A., Curtis, C. F., Benedict, M. Q., Robinson, A. S., Knols, B. G. Historical applications of induced sterilisation in field populations of mosquitoes. Malaria Journal. 8, (2009).
- Bond, J. G., et al. Optimization of irradiation dose to Aedes aegypti and Ae. albopictus in a sterile insect technique program. PloS One. 14 (2), 0212520 (2019).
- Bourtzis, K., Lees, R. S., Hendrichs, J., Vreysen, M. J. B. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations. Acta Tropica. 157, 115-130 (2016).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments: JoVE. , e3579 (2014).
- Carvalho, D. O., et al. Aedes aegypti lines for combined sterile insect technique and incompatible insect technique applications: the importance of host genomic background. Entomologia experimentalis et applicata. 168 (6-7), 560-572 (2020).
- Mamai, W., et al. Aedes aegypti larval development and pupal production in the FAO/IAEA mass-rearing rack and factors influencing sex sorting efficiency. Parasite. 27, 43 (2020).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- . Methods in Aedes Research Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods%20in%20Aedes%20Research%202016.pdf (2016)
- Focks, D. A. An improved separator for the developmental stages, sexes, and species of mosquitoes (Diptera: Culicidae). Journal of Medical Entomology. 17 (6), 567-568 (1980).
- International Atomic Energy Agency. . Manual of Dosimetry in Radiotherapy. Technical Reports Series No. 110. , (1970).
- Aldridge, R. L., et al. Gamma-irradiation reduces survivorship, feeding behavior, and oviposition of female Aedes aegypti. Journal of the American Mosquito Control Association. 36 (3), 152-160 (2020).
- Cianci, D., et al. Estimating mosquito population size from mark-release-recapture data. Journal of Medical Entomology. 50 (3), 533-542 (2013).
- Knipling, E. F. . The basic principles of insect population suppression and management. , (1979).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados