Method Article
Preparazione di zanzare Aedes aegypti maschi irradiate e marcate per il rilascio in un programma operativo di tecnica degli insetti sterili
In questo articolo
Riepilogo
La tecnica degli insetti sterili (SIT) viene utilizzata per controllare specifiche popolazioni di zanzare importanti dal punto di vista medico che possono essere resistenti ai controlli chimici. Qui, descriviamo un metodo di allevamento di massa e preparazione di zanzare maschi sterili per il rilascio in un programma SIT operativo mirato alla zanzara Aedes aegypti .
Abstract
Il controllo di malattie umane come dengue, Zika e chikungunya si basa sul controllo del loro vettore, la zanzara Aedes aegypti , perché non c'è prevenzione. Il controllo dei vettori di zanzare può fare affidamento su sostanze chimiche applicate agli stadi immaturi e adulti, che possono contribuire alla mortalità dei non bersagli e, soprattutto, portare alla resistenza agli insetticidi nel vettore. La tecnica degli insetti sterili (SIT) è un metodo per controllare le popolazioni di parassiti attraverso il rilascio di maschi adulti sterilizzati che si accoppiano con femmine selvatiche per produrre prole non vitale. Questo articolo descrive il processo di produzione di maschi sterili da utilizzare in un programma SIT operativo per il controllo delle zanzare Aedes aegypti . Descritti qui sono i passaggi utilizzati nel programma, tra cui l'allevamento e il mantenimento di una colonia, la separazione delle pupe maschili e femminili, l'irradiazione e la marcatura dei maschi adulti e la spedizione dei maschi di Aedes aegypti al sito di rilascio. Vengono inoltre discussi avvertimenti procedurali, limitazioni del programma e obiettivi futuri.
Introduzione
La trasmissione di agenti patogeni trasmessi dalle zanzare all'uomo causa milioni di casi di malattie e decessi ogni anno in tutto il mondo. In assenza di vaccini efficaci e approvati per le malattie trasmesse dalle zanzare, come Zika o la febbre dengue, uno dei modi più efficaci per ridurre la trasmissione è ridurre le popolazioni di zanzare vettori di malattie. Esasperatamente, un numero crescente di specie di zanzare, tradizionalmente prese di mira dai pesticidi, mostrano livelli crescenti di resistenza ai pesticidi1. Allo stesso tempo, le agenzie governative hanno aggressivamente annullato o vietato pesticidi precedentemente approvati e poche nuove ed efficaci misure di controllo chimico sono state sviluppate 2,3. Questa costellazione di ostacoli al controllo delle zanzare ha motivato l'esplorazione di tecniche alternative non chimiche per ridurre le popolazioni di zanzare.
Alcune specie di zanzare presentano sfide per controllare i problemi di resistenza e registrazione dei pesticidi. Aedes aegypti (L.) è una zanzara vettore di malattie che è estremamente difficile da controllare attraverso la tradizionale gestione integrata dei vettori a causa dell'habitat peridomestico criptico sfruttato da questa specie per lo sviluppo immaturo e il riposo degli adulti 4,5. Le sfide legate allo sfruttamento dell'habitat criptico intorno alle residenze includono la difficoltà di raggiungere questi luoghi con tecniche di irrorazione dei pesticidi e la potenziale mancanza di accettazione da parte del pubblico per l'accesso ripetuto alla proprietà privata per le agenzie di controllo dei vettori di salute pubblica per condurre le intense attività di sorveglianza e controllo cruciali per un'efficace gestione integrata dei vettori (IVM) per questa specie.
Fortunatamente, SIT, un approccio che si è dimostrato efficace per il controllo duraturo di altre specie di insetti altamente impegnative6, viene applicato al problema Aedes aegypti in una serie innovativa di esperimenti e prove operative con sede a St. Augustine, in Florida (dati non pubblicati KJL, RLA, SCB). Il SIT è stato applicato a una serie di specie di insetti, comprese le zanzare, ed è stato esaminato in profondità 7,8. SIT sfrutta il rilascio di massa di maschi allevati in colonia sterilizzati, ad esempio, dall'esposizione a radiazioni ionizzanti o sostanze chimiche per sopraffare la scelta del compagno delle popolazioni naturali di femmine. I maschi sterilizzati che si accoppiano con femmine selvatiche rendono le uova sterili a causa dei danni subiti dai gameti maschili e, se presenti in numero sufficiente, possono teoricamente far crollare la popolazione naturale di Aedes aegypti.
Un programma SIT è stato avviato per tentare di ridurre le popolazioni di Aedes aegypti in un'area urbana nella Florida costiera atlantica dove questa specie è stata recentemente ricolonizzata e si sta espandendo e presentando un rischio per la salute pubblica per la trasmissione di virus come Zika, dengue o chikungunya. Per massimizzare il potenziale di compatibilità con le femmine selvatiche, è stata istituita una nuova colonia utilizzando Aedes aegypti catturato in natura dalla popolazione target per produrre maschi per il programma9. Ciò si basava sull'ipotesi che i maschi allevati localmente e allevati in colonia avrebbero maggiori probabilità di essere competitivi con i maschi selvatici locali per l'accoppiamento con le femmine selvatiche locali. Affinché il SIT sia efficace, non solo un numero schiacciante di maschi sterili deve essere presente nell'area bersaglio, ma devono anche essere in grado di corteggiare e accoppiarsi efficacemente con le zanzare femmine selvatiche locali.
È stata condotta una serie di esperimenti per determinare il numero ottimale di maschi sterili da rilasciare (dati non pubblicati KJL, RLA, SCB) e dosi ottimali di radiazioni che renderebbero i maschi sterili senza interferire con la sopravvivenza, il comportamento o l'accettazione da parte delle femmine selvatiche (dati non pubblicati KJL, RLA, SCB). Questi dati sono disponibili nelle pubblicazioni alleate di questo gruppo, ma alcuni di questi risultati sono catturati anche in questo protocollo e potrebbero essere utilizzati come punto di partenza per nuovi programmi di controllo SIT Aedes aegypti altrove. Questa specie sta espandendo costantemente il suo areale e i programmi SIT mostrano grandi promesse di essere soluzioni economiche e a lungo termine per controllare questa popolazione. L'obiettivo di questo protocollo è quello di produrre zanzare Aedes aegypti sterilizzate, maschi, allevate in colonia per il rilascio sistematico in aree esterne per interrompere i cicli riproduttivi naturali delle popolazioni locali di Aedes aegypti in un programma operativo di controllo del vettore di salute pubblica.
Mentre protocolli e flussi di lavoro simili sono stati pubblicati per la produzione di maschi transgenici di Aedes aegypti e flussi di lavoro di produzione per Aedes SIT, o programmi di incompatibilità basati su Wolbachia sono stati pubblicati altrove, questo protocollo illustra come i protocolli esistenti sono stati adattati per la produzione, la separazione e l'irradiazione di Aedes aegypti di pupe maschili, la marcatura e l'imballaggio di maschi adulti e la spedizione al sito di rilascio per questo programma 9, 10,11,12,13,14,15,16,17,18. Il componente di marcatura di questo protocollo potrebbe non essere richiesto in un programma SIT operativo maturo; tuttavia, è stato incluso qui perché è un modo per monitorare l'efficacia e controllare la qualità dell'intero processo nei primi anni di istituzione del programma SIT. I programmi di controllo delle zanzare sono in genere gestiti dalle autorità locali, quindi possono variare ampiamente in molti aspetti della loro organizzazione, dalle dimensioni e dalla base di finanziamento alla messa a punto delle tattiche di controllo per massimizzare il successo locale. Pertanto, il protocollo qui descritto dovrebbe essere valutato per la compatibilità con le risorse disponibili.
Protocollo
NOTA: Questo protocollo è specifico per la manipolazione di Aedes aegypti , ma può essere modificato per essere efficace per altre specie di zanzare.
1. Produzione e mantenimento di una colonia di Aedes aegypti
- Allevare Aedes aegypti adulto e produrre uova.
- Preparare un telaio pieghevole in alluminio pieghevole di 0,6 m x 0,6 m, una grande gabbia di allevamento con rete in fibra di vetro 20 x 20 e una custodia a calza su una parete verticale.
- Posizionare una vaschetta di plastica da 1900 ml con pupe Aedes aegypti (rapporto 1:1) in ogni gabbia di allevamento, legare la manica chiusa e lasciare le tazze in posizione per l'eclosione fino a quando non emergono altri adulti (cioè circa 4 giorni). A questo punto, rimuovere le coppette e mantenere le gabbie di allevamento per adulti a 28-30 °C, >50% di umidità relativa (Rh) e un ciclo 12:12 o 14:10 luce:scuro (L:D).
NOTA: La produzione di pupe di Aedes aegypti è descritta nel paragrafo 1.2. La densità delle pupe nella vasca da 1900 mL dovrebbe essere tale che ci sia abbastanza spazio per tutte le pupe per prendere aria contemporaneamente. - Ventiquattro ore dopo che le pupe sono state poste nelle gabbie di allevamento, posizionare un contenitore di soluzione di saccarosio al 10% con uno stoppino di spugna e sospendere una spugna di 10 cm x 2 cm imbevuta di miele da un gancio metallico in ogni gabbia per fornire fonti separate di idratazione e nutrimento alle zanzare adulte. Monitorare le spugne e il contenitore di saccarosio per la secchezza o la crescita di muffe e ricostituire o cambiare secondo necessità.
NOTA: Utilizzare un bicchiere di plastica da 120 ml con uno stoppino di spugna da 10 cm x 2 cm inserito attraverso un ritaglio nel coperchio in piccole gabbie di allevamento e un bicchiere di plastica da 460 ml con uno stoppino di spugna da 12 cm x 8 cm in gabbie grandi. - Fornire un pasto di sangue a ciascuna gabbia di allevamento 48-72 ore dopo che la maggior parte degli adulti è emersa e successivamente ogni 2-3 giorni per mantenere un numero elevato di femmine alimentate con sangue per massimizzare la resa delle uova. Riempire un preservativo di pelle di agnello con 50-100 ml di sangue bovino defibrinato, e riscaldare a circa 37 °C a bagnomaria. Quindi, utilizzare un panno o un tovagliolo di carta per tamponare e asciugare parzialmente il preservativo prima di posizionarlo su una capsula di Petri rivestita di carta all'interno della gabbia per 30-60 minuti.
NOTA: Prima dell'uso, sciacquare l'interno e l'esterno di ciascun preservativo con acqua 2-3 volte per rimuovere lubrificanti o altri substrati e verificare la presenza di fori. I preservativi possono essere riutilizzati per 3-5 poppate sciacquando il sangue e conservandoli in una tazza di acqua fredda. Poiché alcune colonie possono sperimentare infestazioni di formiche, potrebbe essere necessario sospendere i preservativi per limitare l'accesso. - Attendere 48-72 ore dopo ogni alimentazione con sangue, quindi introdurre una coppa di deposizione delle uova in ogni gabbia di allevamento adulto. Preparare le coppette di ovideposizione aggiungendo 200 ml di acqua di pupa filtrata (cioè le larve d'acqua e le pupe sono state allevate) in una tazza di plastica da 460 ml fornita con un foglio di carta per la germinazione dei semi alto 8-10 cm x largo 30 cm (carta ovideposizione) montato a filo lungo la circonferenza interna della tazza. Controllare quotidianamente le carte di ovodeposizione, sostituirle ogni 2-4 giorni e conservare accuratamente le carte di ovodeposizione cariche di uova lasciandole asciugare per 24-48 ore a >50% Rh19.
NOTA: Lasciare le coppette di deposizione delle uova nelle gabbie di allevamento per non più di 72 ore per evitare che le uova si schiudano. - Mantenere le gabbie di allevamento per adulti per un massimo di 3-4 settimane prima di abbatterle e allestire nuove gabbie di allevamento per adulti.
- Per abbattere una gabbia di allevamento, rimuovere e pulire la coppa di ovideposizione, conservare la carta carica di uova, rimuovere e pulire il contenitore della soluzione di saccarosio e la spugna di miele e congelare la gabbia per uccidere tutte le zanzare.
- Rimuovere tutti i corpi di zanzara e pulire accuratamente l'interno e l'esterno di ogni gabbia con acqua e sapone diluiti usando tovaglioli di carta e tamponi abrasivi con spugne. Lasciare asciugare la gabbia pulita per almeno 24 ore prima di utilizzarla nel successivo ciclo di allevamento.
NOTA: Utilizzare apparecchiature sottovuoto dotate di filtrazione ad alta efficienza per rimuovere il particolato che può causare allergie. I contenitori della soluzione di saccarosio possono essere puliti e riutilizzati 3-5 volte.
- Allevamento di larve di Aedes aegypti da uova
- Preparare una scorta di liquame nutrizionale larvale mescolando 80 g di un rapporto 3:2 di polvere di fegato bovino:lievito di birra in 2200 ml di acqua di rubinetto. Preparare cibo per pesci polverizzato. Versare i fiocchi di pesce in un tritaspezie e macinare fino a quando non è una polvere fine.
NOTA: Questo impasto è designato come marrone in questo laboratorio. - Utilizzando carta da uova carica di uova (5.000-10.000 uova) del punto 1.1.5, tagliare una porzione di 3-7 cm di carta da uova perpendicolare alla linea di ovideposizione e metterla in un contenitore da 460 ml riempito per metà con acqua di rubinetto insieme a un pizzico di fiocchi di cibo per pesci polverizzati. Coprire e agitare energicamente per almeno 1 min.
NOTA: La carta per uova deve essere conservata per almeno 7 giorni (ma non più di 90 giorni, il che può ridurre la schiusa) dopo l'ovideposizione prima di iniziare il processo di schiusa per consentire l'embrionazione. I batteri e le alghe presenti nel cibo per pesci deossigenano rapidamente l'acqua, innescando lo sviluppo larvale. - Versare l'intero contenuto del contenitore dal punto 1.2.2 in una vaschetta di allevamento larvale preparata con 3 L di acqua di rubinetto e 50 ml di liquame bruno . Contrassegnare la padella con la data di inizio, le informazioni sulla deformazione, il programma di alimentazione secondo la Tabella 1 e conservare a 28-30 °C, >50% Rh e 12:12 o 14:10 L:D ciclo.
NOTA: Il rapporto 3 L di acqua per 50 ml di marrone si basa sulla profondità dell'acqua nelle particolari vasche larvali menzionate nella Tabella dei materiali. Padelle di dimensioni diverse supporteranno diverse densità di pupe e quindi richiedono diverse quantità di acqua e liquami marroni . I tassi di alimentazione larvale nella tabella 1 sono indicati come intervallo; la selezione della quantità utilizzata si basa sull'esperienza e sulla determinazione della salute generale delle larve in via di sviluppo utilizzando variabili come torbidità dell'acqua, colore e odore; presenza di film batterico sull'acqua; numero o rapporto di larve vive e morte; e la motilità delle larve. Nei giorni da 3 a 6, nutrire le zanzare immature con cibo per pesci polverizzato secondo la Tabella 1. L'aggiunta di acqua, la riduzione del cibo e la creazione di 2-3 pentole extra rispetto a quelle richieste dal progetto sono modi per gestire le padelle larvali malsane.
- Preparare una scorta di liquame nutrizionale larvale mescolando 80 g di un rapporto 3:2 di polvere di fegato bovino:lievito di birra in 2200 ml di acqua di rubinetto. Preparare cibo per pesci polverizzato. Versare i fiocchi di pesce in un tritaspezie e macinare fino a quando non è una polvere fine.
| Giorno | Volume nutrizionale aggiunto liquame | Volume d'acqua aggiunto | Azioni |
| 1 | 50 mL (liquame) | 3000 ml | |
| 2 | (senza cibo) | (senza acqua) | |
| 3 | 1/4 - 1/2 cucchiaino (mangime per pesci polverizzato) | 500-1000 ml | |
| 4 | 1/2 - 3/4 cucchiaino (mangime per pesci polverizzato) | 500-1000 ml | |
| 5 | 1/2 - 3/4 cucchiaino (mangime per pesci polverizzato) | 500-1000 ml | |
| 6 | 1/4 - 1/2 cucchiaino (mangime per pesci polverizzato) | 500-1000 ml | |
| 7 | (senza cibo) | (senza acqua) | ceppo pupe e larve |
Tabella 1: Programma di alimentazione per l'allevamento di massa delle larve di Aedes aegypti.
2. Separazione delle pupe Aedes aegypti maschi
- Concentrare le pupe dalle padelle larvali. Una volta raggiunta la proporzione approssimativa di soglia di pupe, versare il contenuto di ciascuna padella attraverso un setaccio (taglia 20-40). Utilizzare una bottiglia di acqua di rubinetto per lavare le pupe e le larve dal setaccio in un becher di plastica graduato da 3000 ml.
NOTA: Solo 2-3 vaschette larvali devono essere trasferite in ogni becher da 3000 ml per evitare il sovraffollamento in modo che le pupe possano raggiungere comodamente la superficie. Si prevede che le pupe si sviluppino tra 130 e 140 ore dopo la schiusa delle uova nelle condizioni di temperatura e luce menzionate nella fase 1.2.3. Aspettatevi una schiusa evidente delle uova lo stesso giorno in cui le uova sono impostate. A seconda delle condizioni ambientali, circa il 20-70% delle larve si sarà impupata e sarà pronta per essere setacciata entro 6 giorni. La suddivisione delle pupe su più bicchieri da 3000 ml garantisce volumi gestibili da versare nel separatore. - Separare le pupe maschili dalle larve e dalle pupe femminili.
NOTA: questo passaggio può essere eseguito da uno o più operatori.- Per un singolo operatore che separa le pupe maschili:
- Dividere il contenuto di ciascun becher da 3000 mL generato al punto 2.1 in più contenitori di plastica da 1900 mL per ridurre le fuoriuscite e il sovraccarico del separatore. Preparare il separatore a piastre posizionando un contenitore di raccolta rigido poco profondo da 4000 mL sotto la chiusa alla base del separatore (Figura 1). Riempire due bicchieri di plastica graduata da 3000 ml pieni di acqua di rubinetto per circa 3/4.
NOTA: Utilizzare un tubo flessibile per lavello in alternativa ai becher graduati in plastica da 3000 ml. In caso contrario, i becher dovranno essere riempiti continuamente durante tutto il processo di separazione. Ulteriori dettagli per il funzionamento del separatore di pupa si trovano nelle referenze12,20. - Versare acqua attraverso lo spazio tra le lastre di vetro e regolare le manopole superiore e inferiore in senso orario o antiorario per consentire all'acqua di fluire continuamente generando contemporaneamente acqua stagnante ad un'altezza di circa 1,25 cm dalla base delle piastre. Segnare le posizioni di partenza delle manopole inferiori con del nastro adesivo. Una volta che l'acqua stagnante è distribuita uniformemente attraverso la base delle lastre di vetro con uguale altezza e velocità di scarico, iniziare a versare il contenuto dei contenitori di pupe e larve attraverso lo spazio tra le piastre.
NOTA: dovrebbe essere presente una netta separazione tra piccole (maschi) e grandi (femmine); In caso contrario, lavare questo lotto e regolare le manopole superiori per ridurre lo spazio tra le piastre. - Mentre si versa lentamente l'acqua attraverso il separatore, ruotare continuamente le manopole inferiori in coppia in senso antiorario ~ 1-2 cm dalla posizione iniziale contrassegnata con nastro fino a quando la maggior parte o tutte le larve non sono state lavate e fatte scivolare lungo la chiusa nel contenitore di raccolta.
NOTA: Mentre una mano viene utilizzata per versare acqua, l'altra mano ruota le manopole una alla volta, ma ugualmente e in piccoli incrementi, per aprire lentamente le piastre. La maggior parte delle larve viene rapidamente lavata, ma ci saranno alcune larve catturate con le pupe maschili. Queste larve vagabonde saranno irradiate ma saranno in ritardo nello sviluppo e non si avvicineranno agli adulti con la coorte focale di pupe. - Scartare o riciclare le larve nella colonia, ma in entrambi i casi, rimuoverle dal contenitore di raccolta prima che le pupe maschili inizino a lavare attraverso il separatore. Mettere in pausa il processo interrompendo il flusso d'acqua mentre il contenitore di raccolta alla base della chiusa viene eliminato dalle larve versando attraverso un setaccio # 30, che viene lavato in un contenitore separato.
NOTA: Le larve passano per prime, seguite dalle pupe maschili e infine dalle femmine (Figura 1). - Continuare a versare acqua e ruotare le manopole inferiori fino a quando le larve maschili non vengono lavate e separate nel contenitore di raccolta. Metti in pausa il processo per verificare e rimuovere le larve dal contenitore di raccolta prima del trasferimento delle pupe maschili nella fase successiva.
NOTA: Il numero di sciacquoni necessari per separare i maschi dipende dal tempo del getto d'acqua e dalla velocità con cui vengono ruotate le manopole. Di solito ci vogliono 2000-2500 ml di acqua per scovare le larve, 1000-1500 ml per scovare le pupe maschili e 200-400 ml per scovare le pupe femmine. - Versare le pupe maschili fuori dal contenitore di raccolta attraverso un setaccio # 20 su un lavandino. Utilizzare una bottiglia di acqua del rubinetto da 1000 ml per controlavare le pupe maschili dal setaccio mentre si versa in un contenitore separato da 1900 ml.
- Una volta che tutte le pupe maschili sono state separate, continuare a versare acqua attraverso il separatore e regolare le manopole inferiori per sciacquare attraverso le pupe femminili. Trasferire le femmine utilizzando il processo di setaccio descritto al punto 2.2.1.6 in un contenitore separato fino a quando tutte le zanzare immature non vengono espulse dal separatore. Scartare le pupe femminili. Una volta che il batch è stato elaborato, riportare le manopole nelle loro posizioni iniziali originali e ripetere il processo con il lotto successivo. Una volta lavorati tutti i lotti, lasciare le piastre aperte in modo che il separatore possa asciugarsi.
NOTA: non esiste una separazione perfetta utilizzando questo dispositivo, che richiede pazienza e pratica. Le pupe o le larve ostinate possono essere spostate con un flusso d'acqua pesante, ma non nella misura in cui le spinge ai lati, il che potrebbe contaminare future inondazioni.
- Dividere il contenuto di ciascun becher da 3000 mL generato al punto 2.1 in più contenitori di plastica da 1900 mL per ridurre le fuoriuscite e il sovraccarico del separatore. Preparare il separatore a piastre posizionando un contenitore di raccolta rigido poco profondo da 4000 mL sotto la chiusa alla base del separatore (Figura 1). Riempire due bicchieri di plastica graduata da 3000 ml pieni di acqua di rubinetto per circa 3/4.
- Per due operatori che separano le pupe maschili, modificare il paragrafo 2.2.1 come segue.
- Primo operatore: versare acqua attraverso il separatore e ruotare le manopole in modo incrementale per separare larve, pupe maschili e pupe femmine.
- Secondo operatore: una volta che ogni fase è stata raccolta nel contenitore della chiusa, setacciare il contenuto del contenitore della chiusa per dividere le larve, le pupe maschili e le pupe femminili in più contenitori separati per la raccolta delle chiuse. Tenere i bicchieri grandi riempiti d'acqua se non è disponibile un tubo del lavandino.
- Per un singolo operatore che separa le pupe maschili:
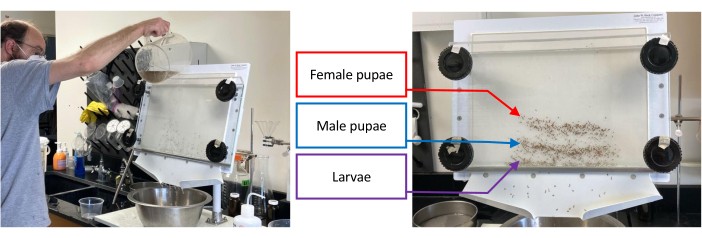
Figura 1: Separatore di pupa contenente un lotto di Aedes aegypti immaturo. La separazione inizia versando acqua attraverso il separatore mentre si ruotano le manopole inferiori di 1-2 cm in senso antiorario fino a quando il set mirato, cioè larve, pupe maschili o pupe femminili, è stato isolato il più possibile dai set che rimangono (immagine a sinistra). L'immagine a destra mostra la separazione delle larve (banda inferiore), delle pupe maschili (banda centrale) e delle pupe femminili (banda superiore). Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Preparazione di pupe Aedes aegypti maschi per l'irradiazione
- Dividere le pupe maschili in piastre di Petri di plastica da 60 mm.
NOTA: Il numero di piastre di Petri necessarie dipende da quante pupe maschi sono disponibili per l'irradiazione: una vaschetta di allevamento larvale dal punto 1.2 riempirà circa 1,5 piastre di Petri. L'età delle pupe varia da 1 a 40 ore. In questo protocollo, la metà più profonda del diametro più piccolo della piastra di Petri è chiamata il fondo, e la metà meno profonda di diametro maggiore è chiamata la parte superiore.- Preparare dischi pretagliati di carta da filtro per adattarsi al diametro interno del fondo della capsula di Petri. Posizionare un disco di carta da filtro inumidito con acqua in ciascuno dei fondi delle piastre di Petri per mantenere le pupe idratate durante il trasporto e il processo di irradiazione.
- Trasferire le pupe in piastre di Petri. Filtrare le pupe maschili raccolte al punto 2.2.1.6 con un setaccio e lavare le pupe in un becher graduato da 1000 ml con meno acqua possibile. Versare con cautela le pupe in piastre di Petri fino a quando ogni disco di carta da filtro è uniformemente coperto con un singolo strato di pupe (Figura 2A - C). Disporre le piastre di Petri sul bordo di un tavolo in fila per facilitare il versamento.
NOTA: Un'alternativa allo sforzo delle pupe è quella di tagliare la punta di una pipetta Pasteur di plastica da 3 mL ad un diametro abbastanza grande da ospitare le pupe. Utilizzare la pipetta per trasferire le pupe dal contenitore prodotto al punto 2.2.1.6 direttamente sui dischi di carta da filtro in modo che vi sia un unico strato di pupe strettamente imballato in ciascuna capsula di Petri. Questo è pratico solo per piccoli lotti. - Utilizzare una pipetta Pasteur da 3 mL inalterata per rimuovere l'acqua stagnante dal fondo della capsula di Petri per evitare il movimento della pupa durante la fase di sessaggio (3.2) e il trasporto.

Figura 2: Trasferimento delle pupe alle piastre di Petri per l'irradiazione . (A) Le pupe setacciate vengono versate e lavate in un becher di plastica da 1000 ml. (B) Nel becher viene trattenuta una quantità minima di acqua per facilitare il versamento nelle piastre di Petri. (C) Piastre di Petri allineate lungo il bordo di una superficie per facilitare il versamento in un unico strato di pupe. (D) Le piastre di Petri cariche di pupe sono impilate e fissate per la consegna all'impianto di irradiazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Sesso le pupe per verificare la contaminazione con le femmine. Sotto un cannocchiale di dissezione, utilizzare sonde per ruotare ogni pupa per controllare la superficie ventrale per un lobo genitale di grandi dimensioni (Figura 3) che indica il sesso maschile. Rimuovere e scartare le pupe con lobi genitali ridotti o piccoli che indicano le femmine e sostituirle con un numero uguale di pupe maschili per mantenere il conteggio corretto.
NOTA: In un programma operativo, questo passaggio non è pratico a causa del gran numero di zanzare e del fatto che la separazione, il trasferimento, l'irradiazione e la preparazione delle gabbie dopo l'irradiazione vengono effettuati in un giorno con un tempo limitato. Il controllo di qualità di un campione da piastre di Petri selezionate può essere fatto, in particolare nelle prime fasi di sviluppo del programma SIT.
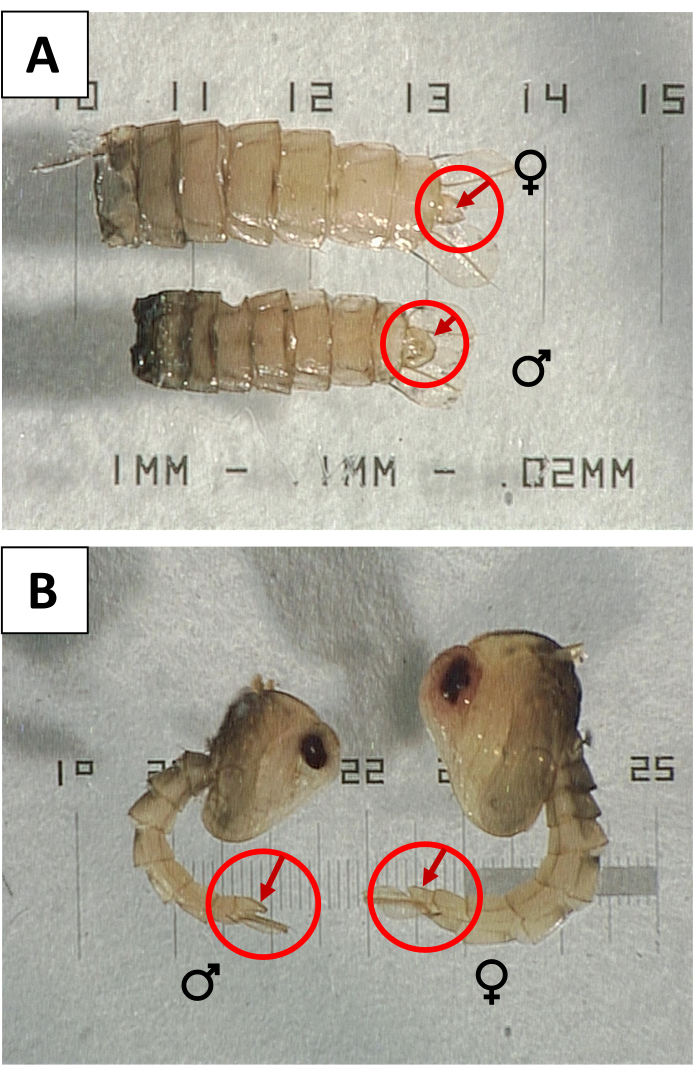
Figura 3: Sesso delle pupe usando il lobo genitale . (A) Vista ventrale e (B) laterale delle pupe Aedes aegypti femminili (♀) e maschili (♂) con lobi genitali indicati per mostrare il dimorfismo sessuale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Coprire i fondi con le parti superiori delle piastre di Petri e fissare con nastro da laboratorio. Impacchettare le piastre di Petri nastrate con elastici in pile dimensionate per adattarsi alla camera di irradiazione e sigillare all'interno di un sacchetto richiudibile etichettato da 3,8 L (Figura 2D). Non lasciare che le pupe rimangano scoperte per >1 ora.
4. Irradiazione di pupe Aedes aegypti maschi
- Preparare il film dosimetrico dallo stesso lotto tagliando 1 cm2 quadrati di film e posizionando ogni quadrato nella sua busta individuale.
NOTA: Tutti i film utilizzati ogni giorno vengono tagliati contemporaneamente. Ciò riduce la piccola quantità di variazione indotta dallo stoccaggio. Il numero di quadrati necessari per ogni pila è 1 + (numero di piastre di Petri). - Preparare un kit da portare nell'impianto di irradiazione, che dovrebbe includere un timer da laboratorio, un nastro da laboratorio, un pennarello permanente, buste preparate di pellicola per dosimetria, un badge di dosimetria e un foglio di note di laboratorio con liste di controllo per tenere traccia delle informazioni chiave (Figura 4).
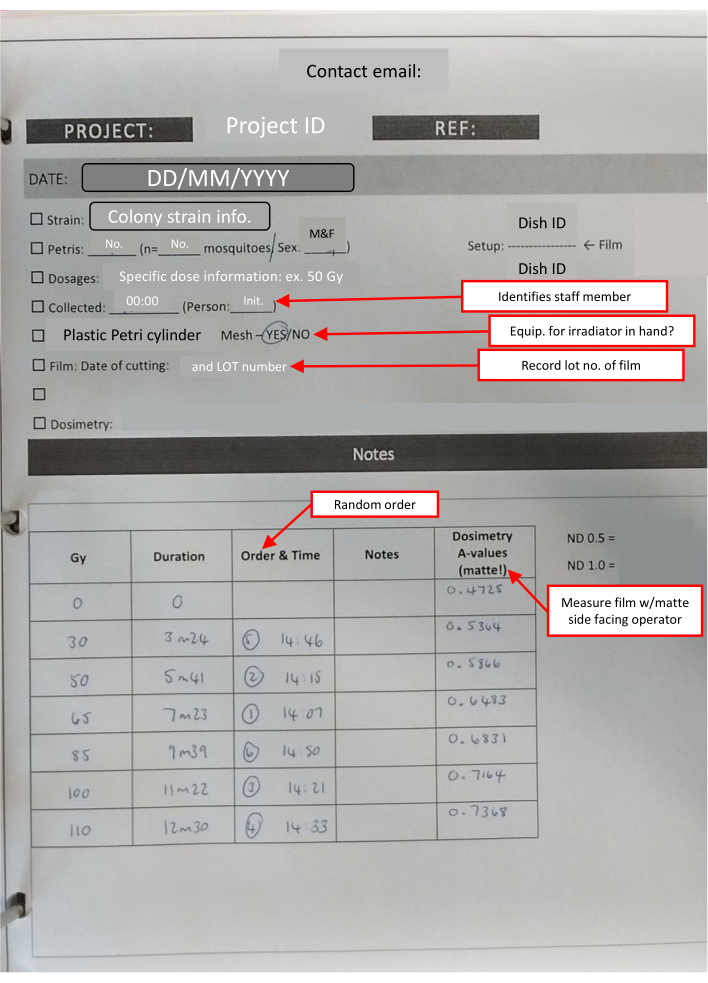
Figura 4: Schema del libro di laboratorio-foglio IR completato per un set dose-risposta. Le caselle di testo delineate in rosso (contrassegnate da frecce rosse) indicano note utili sulle diverse sezioni e ripetono le informazioni chiave. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Trasportare le pupe all'impianto di irradiazione. Posizionare le piastre di Petri delle pupe maschili dal punto 3.3 in contenitori isolati e conservare al riparo dalla luce solare diretta e con aria condizionata durante il trasporto.
- Preparare pile di piastre di Petri per l'irradiazione all'irradiatore. Impilare il numero appropriato di piastre di Petri da inserire nella camera di irradiazione con un involucro di pellicola dosimetrica centrato tra ciascun piatto e nella parte superiore e inferiore della pila. Fissare le buste e l'intera pila con nastro da laboratorio per evitare fuoriuscite e facilitare il posizionamento della pila nella camera.
- Irradiare le piastre di Petri delle pupe maschili. Posizionare la pila di piastre di Petri sulla rete metallica rigida nella camera per posizionarla all'altezza corretta per il cono di esposizione ottimale in base alla precedente mappatura della dose dell'unità di irradiazione specifica21. Attivare la piattaforma girevole sull'irradiatore e irradiare, avviando contemporaneamente il timer di laboratorio. Irradiare per l'intervallo appropriato per ottenere la dose desiderata (esempi sono mostrati nella Tabella 2).
NOTA: Questo protocollo si basa su un irradiatore di cesio-137 (vedere la tabella dei materiali) e una dose target di 50 Gy. Poiché Cs-137 decade nel tempo, l'intensità di dose viene aggiustata ogni anno eseguendo una serie dose-risposta utilizzando dosimetri di alanina, integrati con film radiocromico per la dosimetria di routine e alanina in circa il 10% dei campioni irradiati. Data l'attuale intensità di dose di 8,8 Gy/min, il raggiungimento della dose target di 50 Gy richiede 5 minuti e 41 s di esposizione. La dosimetria di routine del film si verifica come descritto al punto 4.7. La dosimetria del pellet di alanina viene eseguita presso il National Center for Electron Beam Research presso la Texas A & M University o presso il National Institute of Standards and Technology di Gaithersburg, MD, USA.
| Dosaggio (Gy) | Tempo (basato su 8,8 Gy/min) |
| 0 | NA |
| 10 | 1 min 8 s |
| 30 | 3 min 24 s |
| 50 | 5 min 41 s |
| 65 | 7 min 23 s |
| 85 | 9 min 39 s |
| 100 | 11 min 22 s |
| 110 | 12 min 30 s |
Tabella 2: Tempi di dosaggio di esempio per l'irradiatore al cesio-137.
- Una volta trascorso il tempo prescritto, rimuovere le piastre di Petri dall'irradiatore e smontare con cura la pila. Etichetta tutte le piastre di Petri e le buste di pellicola con la data e la posizione nella pila. Sigillare le buste e conservare per la dosimetria. Reimballare le piastre di Petri nel contenitore isolato per il trasporto al laboratorio principale.
NOTA: Registrare se gli adulti sono emersi durante l'irradiazione e contrassegnare la capsula di Petri interessata in modo che l'adulto o gli adulti non fuoriescano quando le pupe vengono inserite nelle gabbie di allevamento (fase 5.2). - Confermare la dose di irradiazione con pellicola per dosimetria misurando la pellicola circa 24 ore dopo l'esposizione. Attivare il lettore di dosimetria e consentirgli di equilibrarsi a temperatura ambiente. Caricare la pellicola utilizzando una pinza fornita con il lettore e seguire le istruzioni del produttore per leggere la pellicola irradiata e la pellicola bianca non irradiata dello stesso lotto. Azzerare il lettore senza pellicola tra le letture e registrare i dati come nella scheda dati di esempio mostrata nella Figura 5.
NOTA: questo protocollo si basa sugli standard ND0.5 e ND1.0 QA Filter Set. È importante misurare il film con il lato opaco rivolto verso l'operatore.
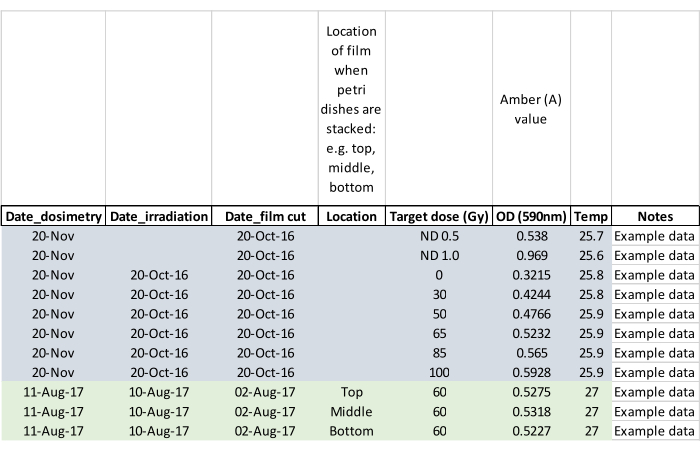
Figura 5: Scheda tecnica della dosimetria popolata con dati di esempio. Le intestazioni di colonna richiedono all'operatore di acquisire i dati chiave per un'analisi successiva. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Allevamento di pupe Aedes aegypti maschi irradiate in adulti
- Pulire e preparare piccole gabbie di allevamento di plastica di 30 cm x 30 cm x 30 cm in modo che siano pronte per le pupe irradiate al ritorno al laboratorio principale. Per ogni 2 piastre di Petri di pupe maschi irradiate, preparare 1 gabbia di allevamento. Conservare ciascuna gabbia di allevamento con un bicchiere di plastica riempito per metà contenente 460 ml di acqua di rubinetto e un contenitore per soluzione di saccarosio al 10%, come descritto al punto 1.1.3.
- Trasferire immediatamente le pupe irradiate nelle gabbie di allevamento preparate dopo il ritorno dall'impianto di irradiazione. Utilizzare una bottiglia d'acqua per lavare accuratamente le pupe da ciascuna capsula di Petri nei 460 ml di acqua nel bicchiere di plastica in ogni gabbia di allevamento. Dopo 24 ore, trasferire le coppette in nuove gabbie di allevamento pulite contenenti la fonte di nutrimento e attendere l'eclosione rimanente di Aedes aegypti adulto irradiato da maschi.
NOTA: Se durante il processo di irradiazione sono emerse delle pupe, aprire le piastre di Petri con i volantini in una gabbia vuota, quindi continuare con il punto 5.2. Scartare i maschi raccolti in questa gabbia. Le pupe vengono trasferite in nuove gabbie di allevamento dopo 24 ore perché i maschi emergono prima delle femmine della stessa coorte e isolare i giorni di emergenza può ridurre l'incidenza della contaminazione femminile e garantire un invecchiamento accurato dei maschi.
6. Marcatura e pesatura dei maschi adulti di Aedes aegypti irradiati
NOTA: questa sezione del protocollo presuppone che due persone stiano eseguendo le attività; per 1 persona, vedi 6.4.

Figura 6: Confezionamento di Aedes aegypti maschio marcati e irradiati in contenitori di rilascio. (A) Contenitore di rilascio che mostra la stockinette fissata ad un foro praticato sul lato del cilindro del cartoncino con nastro adesivo, graffette e colla a caldo. La lunetta è in posizione con un supporto per etichette in nastro adesivo apposto sul lato. La lunetta mantiene la copertura in rete di tulle strettamente tirata; Un elastico (non visibile) tiene anche il tulle in posizione sotto la lunetta. (B) Lotto di maschi anestetizzati in procinto di essere fatti cadere in colorante rosa in una piccola tazza di cartoncino. (C) Quattro contenitori di rilascio all'interno di container isolati. Si noti che le maniche di stoccaggio sono orientate al centro del contenitore di spedizione, i materiali di imballaggio sono nascosti attorno ai contenitori di rilascio e le fonti di nutrizione e idratazione sono posizionate sopra ogni contenitore di rilascio coperto da un fondo di piastra di Petri rovesciato tenuto fermo da elastici incrociati e pezzi di nastro adesivo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Preparare contenitori di rilascio cartoncino.
- Tagliare un foro di 11,5 cm di diametro sul lato di un contenitore cilindrico da cartoncino da 3,9 L con coperchio a 1,5-3,0 cm dal fondo in modo che il foro non sia coperto dal coperchio (Figura 6A).
- Tagliare una stockinette di 40-50 cm di lunghezza e graffettarne un'estremità attorno all'interno del foro di 11,5 cm tagliato in 6.1.1. Utilizzare una cucitrice standard da ufficio aperta in modo che le graffette possano essere forzate attraverso la stockinette e il cartoncino dall'interno del contenitore e in una superficie di lavoro adatta come un blocco di polistirene espanso estruso duro. Crimpare le graffette usando un cacciavite a testa piatta per fissare saldamente la stockinette al perimetro del foro e fissare il nastro adesivo sul lato arricciato per evitare ostacoli. Sigillare il bordo della stockinette all'interno del cilindro sul cartoncino con colla a caldo e controllare l'intero gruppo per i fori di fuga.
- Crea una lunetta di fissaggio rimuovendo il disco interno dal coperchio e taglia una rete quadrata di tulle di nylon di 33 cm x 33 cm abbastanza fine da trattenere le zanzare Aedes aegypti maschi adulti. Posizionare la rete sull'estremità aperta del cilindro e montare la lunetta sopra la rete per tenerla in posizione senza spazi vuoti. Tirare la rete verso il basso in modo che sporga sotto la lunetta per rendere la maglia insegnata attraverso l'estremità aperta e sigillare la rete sporgente contro il cilindro con un elastico.
- Posizionare un pezzo di nastro adesivo di 10 cm sul lato della lunetta coperto da un pezzo di nastro adesivo da 8 cm in modo che il nastro adesivo possa essere sostituito facilmente senza strappare la cornice.
NOTA: i contenitori di rilascio sono durevoli e possono essere riutilizzati >10x con una corretta manipolazione. Prima di introdurre ogni nuovo lotto di zanzare marcate, irradiate, adulte, maschi, controllare che la stockinette sia saldamente attaccata al contenitore e effettuare prontamente le riparazioni se necessario.
- Preparare la stazione di pesatura e marcatura.
- Versare circa 50 mg di colorante marcante in un contenitore di cartoncino da 240 ml e distribuire il colorante come una mano di polvere uniformemente intorno alle superfici interne del contenitore. Picchiettare delicatamente per eliminare il colorante in eccesso. Usa tazze chiaramente etichettate per più coloranti per mantenere separati i colori.
- Tara una barca da 100-500 g pesata su una bilancia elettronica da 0,0001 g; creare un modulo dati (tabella 3); e incollare insieme quattro fogli di carta da copia da 215,9 x 355,6 mm per creare una superficie di lavoro di 431,8 mm x 711,2 mm.
| Contenitore di rilascio | Peso delle zanzare | Numero della gabbia | Femmine in batch | Numero di maschi | Contenitore di rilascio | Massa totale |
| ROSA I | 0.024 | D1 #1 | 25 | ROSA I | 2.03 | |
| ROSA I | 2.007 | D1 #1 | 7 | ROSA II | 1.99 | |
| ROSA II | 1.990 | D1 #1 | ROSA III | 2.03 | ||
| ROSA III | 0.026 | D1 #3 | 25 | |||
| ROSA III | 2.000 | D1 #3 | 18 |
Tabella 3: Tabella dei dati delle stazioni di pesatura.
- Mark ha quantificato lotti di maschi adulti irradiati con pigmento fluorescente.
- Trasferire le zanzare adulte (2,5-3,5 giorni) da ciascuna gabbia di allevamento in fiale di aspiratore. Rimuovere le fonti di nutrimento dalla gabbia di allevamento dal punto 5.2 e posizionare l'intera gabbia in una grande camera di CO2 per 5-7 minuti, battendo i lati del contenitore per rimuovere le zanzare che potrebbero essere aggrappate alla gabbia di allevamento. Trascorso il tempo di esposizione, rimuovere la gabbia di allevamento dalla camera e aspirare tutte le zanzare adulte in una serie di flaconcini di aspirazione in plastica.
NOTA: La somministrazione del 99,5-100% di CO2 avviene da un serbatoio con un regolatore, una punta di ottone e un tubo di silicone incanalato nella camera ad una portata di 6 L/min. Il numero di fiale necessarie per liberare la gabbia di allevamento dipende da quante zanzare sono presenti nella gabbia e dall'abilità dell'operatore, ma in genere sono necessarie 3-5 fiale per gabbia. Scegli un aspiratore che abbia piccole fiale a cambio rapido per facilitare la gestione delle zanzare adulte in lotti, ad esempio, uno utilizzando una fiala di raccolta del polistirene da 60 ml sigillata con schermo in alluminio a maglie 20 x 20 su un'estremità e una valvola a palestra in acetato trasparente sull'altra. L'intera gabbia viene anestetizzata prima dell'aspirazione per ridurre il tempo di trasferimento delle zanzare in fiale per ridurre lo stress sulle zanzare e mantenere il protocollo trattabile. - Ordina tutte le zanzare adulte da ogni gabbia di allevamento per sesso.
- Esporre il primo flaconcino dal punto 6.3.1 a CO 2 in una piccola camera per 4 minuti, quindi scuotere delicatamente le zanzare anestetizzate, distribuendole sulla superficie di lavoro su carta bianca preparata al punto 6.2.2.
- Caricare un nuovo flaconcino vuoto nell'aspiratore, aspirare con cura tutti i maschi dal piano di lavoro e passare questo flaconcino alla stazione di pesata (punto 6.3.3.). Conta tutte le femmine rimaste indietro e aspirale in una fiala separata e scartale, insieme a tutti i maschi schiacciati.
- Ripetere questo processo con i flaconcini rimanenti del punto 6.3.1, ma ad un certo punto del processo di selezione del sesso, generare un flaconcino separato con solo 25 maschi che viene anche passato alla stazione di pesatura. Ripetere il passaggio 6.3.2. per ogni gabbia di allevamento.
NOTA: Durante l'elaborazione di maschi adulti irradiati per il sesso, la pesatura e la marcatura, tenere traccia del numero di femmine in ciascun lotto, che sono dati chiave per la risoluzione dei problemi e la garanzia della qualità della selezione del sesso della pupa e dell'intero processo. Se il conteggio delle femmine è superiore al previsto, una seconda persona dovrebbe estrarre le femmine mentre l'operatore principale aspira i maschi. È importante pesare un campione di 25 maschi di ogni gabbia di allevamento per calcolare un peso medio per zanzara, che verrà utilizzato per stimare il numero di maschi irradiati marcati rilasciati alla fine del protocollo.
- Pesare e colorare lotti di zanzare maschi adulti.
- Alla stazione di pesata, collocare il primo flaconcino di zanzare maschi adulti dalla stazione di selezione (punto 6.3.2) in una piccola camera di CO 2 per 2 minuti e agitare delicatamente le zanzare nella barca di pesatura tarata preparata al punto 6.2.2. Registrare il peso delle zanzare e versare le zanzare nella tazza di tintura preparata al punto 6.2.1.
- Inclinare e ruotare lentamente la tazza 1 rotazione completa in senso orario e antiorario in modo che le zanzare entrino in contatto con il rivestimento in polvere sulle superfici interne della tazza e siano tutte leggermente spolverate con colorante (Figura 6B). Versare le zanzare contrassegnate in una barca di pesata.
- Procedere rapidamente al passaggio successivo in modo che le zanzare non si riprendano e sfuggano. Ripetere questo passaggio fino a quando tutti i flaconcini del paragrafo 6.3.2 sono stati elaborati.
NOTA: Il peso dei maschi dal flaconcino separato di 25 maschi generato per ciascuna gabbia di allevamento di cui al punto 6.3.2 è registrato e utilizzato per calcolare il peso medio per maschio di tale gabbia.
- Caricare i contenitori di rilascio con maschi adulti irradiati contrassegnati. Piegare leggermente il battello di pesatura contenente zanzare maschi anestetizzati, marcati, irradiati dalla fine del punto 6.3.3. per creare un canale, quindi dirigere questo canale attraverso la manica della stockinette per trasferire i maschi nel contenitore di rilascio. Continuare ad aggiungere zanzare fino a quando circa 2,0 g o 1500-3000 zanzare maschi sono nel contenitore di rilascio e legare la manica della stockinette chiusa. Contrassegnare il nastro adesivo sulla lunetta del contenitore di rilascio con il colore del colorante, il numero del contenitore e il peso totale delle zanzare e copiare questi dati nel modulo dal passaggio 6.2.2.
NOTA: La manipolazione delle zanzare in qualsiasi fase della vita induce stress e può ridurre la sopravvivenza o il vigore. La serie di anestetizzazioni descritte in questo protocollo potrebbe avere un impatto sulle zanzare; Tuttavia, i tentativi di inseguire e aspirare zanzare non anestetizzate, ad ogni passo, indurrebbero uno stress maggiore e un protocollo insostenibile. Dividere il peso totale delle zanzare in ciascun contenitore di rilascio per il peso medio per zanzara maschio generato nella sezione 6.3.3 per ricavare una stima del numero di maschi in quel contenitore di rilascio; Ogni contenitore di rilascio non dovrebbe avere più di 2 g di maschi, il che equivale a circa 1 grande gabbia di allevamento.
- Trasferire le zanzare adulte (2,5-3,5 giorni) da ciascuna gabbia di allevamento in fiale di aspiratore. Rimuovere le fonti di nutrimento dalla gabbia di allevamento dal punto 5.2 e posizionare l'intera gabbia in una grande camera di CO2 per 5-7 minuti, battendo i lati del contenitore per rimuovere le zanzare che potrebbero essere aggrappate alla gabbia di allevamento. Trascorso il tempo di esposizione, rimuovere la gabbia di allevamento dalla camera e aspirare tutte le zanzare adulte in una serie di flaconcini di aspirazione in plastica.
- Modifiche al protocollo di marcatura per un singolo operatore
- Condurre prima lo smistamento del sesso per tutte le gabbie di grandi dimensioni. Esporre ogni gabbia grande a CO2 per 4-5 minuti e aspirare tutte le zanzare in 4-5 flaconcini. Esporre ogni fiala a CO 2 per2-3 minuti, rovesciare tutte le zanzare sulla superficie di lavoro della carta bianca, rimuovere le femmine e il conteggio e riportare i maschi nella loro grande gabbia di popolazione.
- Pesatura e marcatura
- Iniziare con la prima gabbia di contenimento maschile prodotta al punto 6.4.1: rimuovere la fonte di nutrimento e anestetizzare i maschi in una grande camera di CO2 per 5-7 minuti. Aspirare uniformemente i maschi anestetizzati in fiale separate. Ripeti questo passaggio con ogni gabbia di contenimento nell'ordine in cui sono stati prodotti.
NOTA: Saranno prodotte circa 2-3 fiale affollate per gabbia di contenimento. La lavorazione delle gabbie maschili nell'ordine in cui sono state prodotte massimizza il tempo di recupero per ogni gabbia di maschi. - Anestetizzare il primo flaconcino prodotto al punto 6.4.2.1. per 1-2 minuti in una piccola camera CO2 . Versare un piccolo numero di zanzare sulla superficie di lavoro della carta bianca, aspirare 25 zanzare maschi in una nuova fiala e procedere come in 6.3.2 per determinare il peso medio per maschio per quella gabbia. Riportare eventuali altri maschi nel flaconcino sorgente o aspirarli in un nuovo flaconcino separato da elaborare in seguito; Procedere con la pesatura, la marcatura e il trasferimento nei contenitori di rilascio per il resto dei maschi nel primo flaconcino come descritto nel resto del punto 6.3. Ripetere il passaggio 6.4.2.2. (ad eccezione dell'isolamento di 25 maschi in un flaconcino separato) per il resto dei flaconcini prodotti al punto 6.4.2.1. nell'ordine in cui sono stati prodotti, per poi passare alla successiva gabbia di allevamento per sesso prodotta al punto 6.4.1.
NOTA: i flussi di lavoro con una persona sono più lenti e alcune zanzare maschi dovranno essere anestetizzate. Cerca e rimuovi costantemente le zanzare femmine.
- Iniziare con la prima gabbia di contenimento maschile prodotta al punto 6.4.1: rimuovere la fonte di nutrimento e anestetizzare i maschi in una grande camera di CO2 per 5-7 minuti. Aspirare uniformemente i maschi anestetizzati in fiale separate. Ripeti questo passaggio con ogni gabbia di contenimento nell'ordine in cui sono stati prodotti.
7. Imballaggio e spedizione di contenitori di rilascio di Aedes aegypti maschio adulto marcati, irradiati
- Preparare i contenitori di rilascio per la spedizione. Una volta che un contenitore di rilascio è pieno di maschi marcati, posizionare 4 batuffoli di cotone inumiditi con soluzione di saccarosio al 10% sul coperchio della rete e coprire con un fondo rovesciato di una capsula di Petri tenuta in posizione da due elastici tesi attorno all'intero contenitore e sopra la piastra di Petri per formare una croce. Posizionare un pezzo di nastro adesivo sopra la X dei due elastici per tenerli in posizione sopra la capsula di Petri rovesciata.
NOTA: Assicurarsi che i batuffoli di cotone con soluzione di saccarosio al 10% non siano saturi al punto di gocciolare, il che danneggerà il contenitore e intrappolerà e ucciderà le zanzare. - Imballare i contenitori di rilascio del cartoncino in un dispositivo di raffreddamento per spedizioni in polistirene espanso estruso. Inserire 4 fori di ventilazione attraverso il coperchio del refrigeratore e occludere con cotone per tenere fuori le formiche e tenere dentro le zanzare sfuggite. Posizionare 4 contenitori di rilascio in posizione verticale nel dispositivo di raffreddamento di spedizione con la stockinette di ciascun contenitore rivolta verso il centro (Figura 6C). Infilare un pluriball tra ogni contenitore e al centro per stabilizzarli. Riempire il resto dello spazio nel dispositivo di raffreddamento di spedizione con cuscini d'aria o impilare un secondo strato di 4 contenitori di rilascio direttamente sopra il primo strato e allo stesso modo stabilizzare con cuscini d'aria.
NOTA: i contenitori di rilascio devono essere sufficientemente stabilizzati da non muoversi quando vengono scossi. La temperatura all'interno della confezione è ambientale. - Prepara il dispositivo di raffreddamento per la consegna. Sigillare il dispositivo di raffreddamento della spedizione con il coperchio ventilato e inserire nel cartone sovraimballare, chiudere il nastro adesivo e spedire tramite espresso notturno al luogo di rilascio.
Risultati
Un allevamento vigile e adeguato delle zanzare consiste in una disponibilità equilibrata di maschi e femmine in gabbie di colonia, nel mantenimento di soluzione fresca di saccarosio e miele e in un'alimentazione costante di sangue di alta qualità. Queste condizioni forniranno fogli di uova densamente imballati ottimali per l'uso nelle vaschette di allevamento larvale SIT. La corretta conservazione e l'uso di fogli di uova essiccati, come l'etichettatura sistematica per facilitare l'uso dal più vecchio al più recente, supporteranno una schiusa uniforme su tutte le pentole. Riempire tutte le vaschette di allevamento larvale con acqua prima della schiusa può ridurre il tempo per il quale i fogli di uova sono in contenitori di schiusa e promuovere uno sviluppo sano. La manutenzione delle vasche larvali dalla schiusa alla pupa richiede un attento impegno da parte del personale della colonia poiché alcune pentole potrebbero aver bisogno di più o meno cibo o acqua aggiuntiva a seconda delle fasi di sviluppo e delle variabili ambientali. Se ci sono problemi con lo stadio di sviluppo entro il giorno programmato della separazione del sesso pupale, le regolazioni dovrebbero essere apportate prima nel processo, come la schiusa prima o dopo, la regolazione del cibo o la modifica della temperatura dell'incubatrice.
Il processo di allevamento in questo protocollo non fa sì che tutte le uova si schiudano in tempo per svilupparsi in pupe che possono essere irradiate e utilizzate a fini di controllo. Tra il 20 e il 50% delle zanzare allevate in colonia saranno ancora larve nel momento in cui le pupe dovranno essere separate. Tuttavia, queste larve non vengono sprecate, ma lasciate maturare per 24 ore per rendere ulteriori pupe che possono essere combinate con pupe femmine dalla separazione del giorno precedente e riciclate di nuovo nelle gabbie delle colonie. Nelle gabbie delle colonie, le pupe potranno maturare in adulti, accoppiarsi, nutrirsi con il sangue e produrre uova che sostengono il progetto SIT.
La separazione delle pupe, il versamento delle pupe nelle piastre di Petri, l'irradiazione e il posizionamento in gabbie per adulti dopo l'irradiazione devono avvenire in un giorno; Pertanto, è necessario assegnare un tempo adeguato per elaborare comodamente tutte le fasi. L'assemblaggio e la preparazione dei contenitori di rilascio devono essere effettuati prima del processo di marcatura. Quando le scatole di spedizione vengono restituite dal sito di rilascio, i contenitori di rilascio devono essere ispezionati e preparati per il loro prossimo utilizzo. Scartare batuffoli di cotone bagnati, arieggiare i contenitori a rilascio umido, pulire le piastre di Petri, sostituire la rete e rimuovere gli elastici dal contenitore, mentre non in uso, prolungherà notevolmente la vita dei contenitori di rilascio.
Data la realtà mondiale della pandemia virale COVID-19, questo protocollo che è tipicamente un'operazione multi-persona è stato modificato per essere trattabile da una persona che lavora da sola in un laboratorio per ogni fase. Le fasi del processo che sono maggiormente ostacolate da uno scenario di una sola persona sono le fasi di mantenimento del sesso, della marcatura, della pesatura e dell'allevamento delle colonie. Separare le pupe per sesso da una persona dovrebbe essere sufficiente se ci sono più separatori che operano contemporaneamente in stanze diverse. In una situazione di pandemia in cui si verifica il distanziamento sociale sul posto di lavoro, è necessario dotare più stazioni per completare i passaggi dal sesso all'imballaggio. A seconda della velocità dell'operatore, ci vuole una persona ~ 4 h per sesso 15.000 zanzare e poi un'altra 1-2 h per contrassegnarle, pesarle e confezionarle. Uno scenario a due persone diminuisce il tempo durante il quale le zanzare vengono anestetizzate per la marcatura e riduce il tempo di lavoro complessivo. Tuttavia, anche in uno scenario di due persone, allocare l'intero 2,0 g di zanzare per gabbia di rilascio può essere difficile a causa del tempo di lavoro limitato mentre le zanzare sono sedate. Sebbene il processo di pulizia e preparazione dei materiali di allevamento larvali e adulti sia estremamente dispendioso in termini di tempo e manodopera, può essere suddiviso in modo tale che i singoli operatori possano lavorare in modo indipendente e sicuro durante una pandemia.
Il rilascio di maschi adulti, marcati e irradiati di Aedes aegypti esula dall'ambito di questo protocollo, ma è presentato qui in breve. Il processo di rilascio di zanzare maschi marcate e irradiate inizia determinando una distribuzione uniforme del rilascio dei contenitori di rilascio in base ai pesi (e quindi al numero dedotto di maschi sterili), come riportato nella Tabella 3. Dopo che le spedizioni sono state consegnate al distretto di controllo vettoriale, le scatole vengono aperte e i contenitori di rilascio valutati per eventuali problemi di mortalità o condizioni dei contenitori di rilascio. Le zanzare nei contenitori di rilascio sono quindi autorizzate ad acclimatarsi alla temperatura e all'umidità ambiente per 1-2 ore prima del trasporto nell'area di trattamento. I siti di rilascio nell'area di trattamento sono identificati dopo un'intensa sorveglianza per i punti caldi delle popolazioni selvatiche di Aedes aegypti. La tempistica, la frequenza e la densità dei rilasci sono bilanciate dalla bionomia della specie, nonché dalla meteorologia, dal sostegno pubblico e dalle capacità di allevamento in laboratorio.
Poiché i contenitori di rilascio specifici sono abbinati a particolari siti di rilascio, l'etichetta deve essere sottoposta a un controllo incrociato prima dell'apertura del contenitore di rilascio tagliando la rete sulla parte superiore, consentendo all'operatore di deformare la rete in modo che una parte dei maschi possa fuoriuscire. Questo metodo di rilascio frazionario viene ripetuto in ogni punto di rilascio assegnato per il contenitore fino a quando tutti i maschi che volano liberamente sono stati rilasciati. Questo processo viene quindi ripetuto per ogni contenitore di rilascio nella rispettiva posizione di rilascio assegnata fino a quando tutti i contenitori non sono stati elaborati. Facoltativamente, dopo che le zanzare sono state rilasciate, tutte le zanzare morte o disabili che non se ne sono andate liberamente possono essere raccolte in piastre di Petri ed etichettate per essere contate a mano o pesate per correggere il numero stimato rilasciato. La sorveglianza continua e pervasiva degli stadi adulti, delle uova e immaturi di Aedes aegypti selvatici nell'area bersaglio, e possibilmente nei siti di controllo non di intervento, è condotta per valutare l'efficacia dell'operazione SIT.
Discussione
L'avvio di un programma di controllo con SIT che utilizza radiazioni richiede la creazione di un ceppo locale di Aedes aegypti. Questo passaggio è fondamentale e può consentire a SIT di distinguersi veramente da tecnologie di controllo simili. Sviluppando il progetto da un ceppo locale di zanzara, i maschi generati avranno probabilmente comportamenti che permetteranno loro di adattarsi ai cambiamenti e ai segnali ambientali e di localizzare e accoppiarsi con le femmine selvatiche nelle vicinanze. Inoltre, il rilascio di maschi locali irradiati potrebbe non generare un'opinione pubblica negativa rispetto, ad esempio, al rilascio di un ceppo non locale di zanzare geneticamente modificate che potrebbe, ad esempio, introdurre nuovi alleli nella popolazione locale di zanzare.
Spendere risorse sostanziali per allevare grandi quantità di zanzare solo per essere in grado di utilizzarne circa la metà per scopi di controllo è una limitazione del programma SIT Aedes aegypti . Dovrebbero essere apportati perfezionamenti al protocollo di allevamento per condensare la maturazione delle larve in tempi più definiti quando le pupe saranno pronte. Ciò consentirebbe di raccogliere più pupe nel momento ottimale della separazione. Tuttavia, ulteriori pupe da elaborare aumentano il rischio che più femmine si impupino quando le pupe vengono raccolte e quindi aumentano la probabilità che le femmine finiscano in piastre di Petri con i maschi e possibilmente vengano rilasciate. Sebbene la durata della vita, il comportamento di alimentazione del sangue e il comportamento di ovideposizione nelle femmine irradiate di Aedes aegypti siano ridotti negli adulti, non è una buona strategia rilasciare le femmine incidentalmente accanto ai maschi irradiati22. Pertanto, dovrebbe rimanere una priorità ridurre al minimo il numero di femmine inavvertitamente separate, irradiate, marcate e rilasciate con i maschi.
Il successo di un programma SIT si basa in ultima analisi sul successo della competizione del compagno da parte di maschi irradiati allevati in colonia. Il mantenimento della competitività maschile si basa su una selezione esaustiva della dose derivata sperimentalmente e sulla massimizzazione del rapporto stimato tra maschi sterili e selvatici nella popolazione. La selezione della dose è determinata da diversi fattori chiave che includono longevità, fertilità, fecondità e mortalità pupale. È stato osservato che le zanzare maschi mostreranno una curva di fertilità asintotica che si avvicina allo zero all'aumentare delle radiazioni (dati non pubblicati KJL, RLA, SCB). Allo stesso tempo, la longevità delle zanzare maschi e i livelli di attività diminuiscono esponenzialmente all'aumentare della dose di radiazioni (dati non pubblicati KJL, RLA, SCB). Pertanto, piuttosto che identificare una dose che produce il 99,9% di sterilità nei maschi, è preferibile concentrarsi su una percentuale di sterilità inferiore sostenendo la sopravvivenza. Una volta identificato un intervallo di dosaggio che non differenzi la longevità o la mortalità pupale dei maschi irradiati da quella dei maschi non irradiati, dovrebbero essere condotte ulteriori valutazioni sulla fertilità per identificare una dose che renda i maschi prevalentemente sterili, ma competitivi.
Allo stesso tempo, è fondamentale confrontare il numero di zanzare maschi nella popolazione con quello dei maschi irradiati rilasciati. Ciò può essere ottenuto raccogliendo maschi da varie posizioni all'interno e intorno all'area di rilascio target ripetutamente dalla stessa posizione e prima, durante e dopo l'avvio del programma SIT. Uno studio di marcatura, rilascio, ricattura dovrebbe essere condotto per valutare il rapporto tra zanzare maschi selvatiche e zanzare rilasciate. Uno studio di marcatura, rilascio, ricattura si basa sul rilascio di un numero noto di zanzare marcate da un punto specifico e sulla loro successiva ricattura in punti in prossimità del punto di rilascio iniziale. Confrontando il numero di maschi ricatturati e maschi selvatici a distanze dal punto di rilascio, è possibile stimare la popolazione selvatica generale di maschi nell'area in modo che i rapporti competitivi dei maschi sterili possano essere rilasciati23. Massimizzare il rapporto tra maschi sterili e selvatici può essere ottenuto rilasciando più maschi sterili e / o riducendo la popolazione selvatica con mezzi di controllo classici come la riduzione della fonte, il controllo immaturo o i trattamenti adulticidi.
Per valutare l'efficacia dei rilasci maschili sterili, le collezioni di adulti possono essere confrontate cronologicamente con un'area di non intervento. Poiché i maschi sterili vengono rilasciati e il numero di maschi e femmine raccolti in un'area diminuisce in relazione a un'area di non intervento comparabile, allora si può ipotizzare che ciò sia dovuto al fatto che i maschi sterili rilasciati superano con successo i maschi fertili locali. Questo effetto può essere osservato anche nelle coppe trappola di ovideposizione dispiegate sia nei siti di intervento che in quelli di non intervento. Le uova possono ancora essere prodotte nel sito di intervento, ma se si schiudono meno di quelle provenienti dal sito di non intervento, si può ipotizzare che non vengano fecondate a causa dell'accoppiamento delle femmine con maschi sterili. Sempre più ovideposizioni di uova non fecondate potrebbero alla fine portare a una riduzione della deposizione delle uova a causa della mancata sostituzione delle femmine nel sito di intervento 8,24.
Le direzioni future della tecnologia e dei programmi SIT si espandono naturalmente in ulteriori specie di zanzare importanti dal punto di vista medico. Ad esempio, questa tecnologia può essere facilmente adattata per controllare Aedes albopictus, data la bionomia molto simile di Aedes aegypti e Aedes albopictus. Altre specie di zanzare vettore di malattie di interesse includono Culex quinquefasciatus, Culex tarsalis e varie specie di Anopheles. Il miglioramento dell'efficacia di questa tecnologia dipende dall'aumento della capacità delle pupe maschili prodotte in un dato momento, che potrebbe essere raggiunta attraverso la manipolazione genetica o la selezione artificiale, e dal miglioramento della competitività maschile, che potrebbe essere raggiunta aumentando la virilità, la fertilità o la longevità.
In definitiva, i programmi SIT non sono un proiettile d'argento per il controllo delle zanzare. Sono invece uno strumento in una suite di altre tecniche di controllo, come i programmi IVM, che compensano in modo incrociato le debolezze tra le tecniche. Ad esempio, mentre il controllo chimico offre un controllo rapido ed economico, favorisce anche lo sviluppo di resistenza e mortalità non bersaglio; e mentre il SIT è specie-specifico e non è probabile che generi resistenza, i maschi SIT devono essere prodotti e rilasciati in perpetuo per controllare le popolazioni immigrate al di fuori del distretto di controllo dei vettori.
Divulgazioni
Tutti gli autori non hanno dichiarato conflitti di interesse.
Riconoscimenti
Ringraziamo i dottori R.-D. Xue, C. Bibbs, W. Qualls e V. Aryaprema dell'Anastasia Mosquito Control District, St. Augustine, Florida, per la collaborazione nello sviluppo del programma SIT e la visione esperta sull'efficace rilascio operativo di maschi sterili Aedes aegypti. Questa ricerca è stata sostenuta dall'USDA-ARS e dal Dipartimento dell'agricoltura e dei servizi ai consumatori della Florida (FDACS). La menzione di nomi commerciali o prodotti commerciali in questa pubblicazione ha il solo scopo di fornire informazioni specifiche e non implica raccomandazione o approvazione da parte dell'USDA o della FDACS.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-1/8" wrench (1" (1 inch) = 2.54 cm) | Craftsman | CMMT44707 | |
| 1/2 pint cardstock cup (1/2 pint = 236.5 mL) | Science Supplies WLE corp | 1/2 pint | |
| 1/4" tubing - tygon | Hudson Extrusions | LLDPE1/8 X 1/4 BLK | to attach to CO2 gas regulator |
| 1/8" brass barb w/ MIP connection | B&K | BHB-85NLB | to attach to CO2 gas regulator |
| 1000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-1000 | |
| 3000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-3000 | |
| Adult large cage | Bioquip | 1450D | |
| Aspirator vials | Bioquip | 2809V | |
| Bovine liver powder | MP Biomedicals | 290039601 | |
| Brewers yeast | MP Biomericals | 02903312-CF | |
| CO2 regulator | Randor | 64003038 | |
| CO2 tank (20# canister) | Praxair | CDBEVCARB20 | |
| Collection basin | Treasure Gurus | KI-ENAMELBOWL | for separator |
| Cotton balls - large | Fisher Scientific | 22-456-883 | |
| Deli cups w/lids - 470 mL | Pactiv DELItainer | PCTYSD2516 | |
| Deli cups w/lids - 1900 mL | Berry Global | T60764 | |
| DoseReader 4 | ND0.5 and ND1.0 QA Filter Set standards | ||
| Dosimetry film | Far West Technology, Inc. | ||
| Filter paper | Millipore | AP10045S0 | |
| Flashlight aspirator | Bioquip | 2809D | |
| Forceps - fine featherweight | Bioquip | 4748 or 4750 | featherweight |
| GAFchromic | radiochromic film | ||
| Gammator M | Radiation Machinery Corporation, Parsippany, NJ | Cesium-137 irradiator | |
| Hand held mechanical aspirator | Clarke Mosquito | 13500 | |
| Lambskin condoms | Trojan | Naturalamb | |
| Large CO2 chamber | Sterilite | Walmart # 568789514 | |
| Larval rearing pans | Blue Ridge Thermoforming | 01-FG-400-3N-ABS | Dimensions: 22.375 x 17.5 x 3 (inches) |
| Magnets - 20# pull | Master magnetics | MHHH20BX | |
| Marking dye | Dayglo | ECO-11 | Aurora Pink |
| Marking dye | Dayglo | ECO-17 | Saturn Yellow |
| Mesh | Falk | T301 | |
| Pasture pipettes | Thermo Scientific | 02-708-006 | |
| Petri dishes - large | VWR International | 25384-090 CS | |
| Petri dishes - small (60 mm x 15 mm) | Fisher Brand | FB0875713A | |
| Pupa separator | J.W. Hock | 1512 | |
| Red rubber hose | Welch | 331040-5 | |
| Release containers | Science Supplies WLE corp | 1 gallon | |
| Rubber bands - cross #19 | Alliance | ALL37196 | |
| Rubber bands - latitude #64 | Skillcraft | NSN0589974 | |
| Scale | Ohaus | H-4737 | |
| Seed germination paper - Heavy stock 76# | Anchor Paper | #76 | |
| Shipping coolers- 16 x 13 x 12.5" | MrBoxonline.com | Husky Foam Cooler kit | |
| Sieve #20 | Advantech | 20BS8F | |
| Sieve #30 | Advantech | 30BS8F | |
| Small cage - Bug Dorm | MegaView | Bug Dorm-1 | |
| Small CO2 chamber | Mainstays | Walmart # 562922221 | |
| Souffle cup lid | SOLO | 41165277456 | |
| Souffle cups - 4 oz (1 oz = 29.6 mL) | SOLO | 41165024104 | |
| Sponge | ocelo | MMM7274FD | |
| Squeeze bottle | Dynalon | 3UUP6 | |
| Stereoscope | Meiji Techno | EMZ-5 | |
| Stockinette | BSN Medical | 30-1006 | |
| Styrofoam | extruded polystyrene foam | ||
| Tropical fish flake food | Tetra | 4.52 pound | |
| Vaccum chamber - desiccator | BelArt | T9FB892757 | |
| Weigh boats | Globe Scientific | 3621 |
Riferimenti
- Moyes, C. L., et al. Contemporary status of insecticide resistance in the major Aedes vectors of arboviruses infecting humans. PLoS Neglected Tropical Diseases. 11 (7), 0005625 (2017).
- Baldacchino, F., et al. Control methods against invasive Aedes mosquitoes in Europe: a review. Pest Management Science. 71 (11), 1471-1485 (2015).
- Burkett, D. A., Cope, S. E., Strickman, D. A., White, G. B. The Deployed Warfighter Protection (DWFP) Research Program: Developing new public health pesticides, application technologies, and repellent systems. Journal of Integrated Pest Management. 4 (2), 1-7 (2013).
- Harwood, J. F., et al. Controlling Aedes aegypti in cryptic environments with manually carried ultra-low volume and mist blower pesticide applications. Journal of the American Mosquito Control Association. 32 (3), 217-223 (2016).
- Morrison, A. C., Zielinski-Gutierrez, E., Scott, T. W., Rosenberg, R. Defining challenges and proposing solutions for control of the virus vector Aedes aegypti. PLoS Medicine. 5 (3), 68 (2008).
- Klassen, W., Curtis, C. F., InDyck, V. A., Hendrichs, J., Robinson, A. S. History of the sterile insect technique. Sterile insect technique: principles and practice in area-wide integrated pest management. , 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector Borne and Zoonotic Diseases. 10 (3), 295-311 (2010).
- Dame, D. A., Curtis, C. F., Benedict, M. Q., Robinson, A. S., Knols, B. G. Historical applications of induced sterilisation in field populations of mosquitoes. Malaria Journal. 8, (2009).
- Bond, J. G., et al. Optimization of irradiation dose to Aedes aegypti and Ae. albopictus in a sterile insect technique program. PloS One. 14 (2), 0212520 (2019).
- Bourtzis, K., Lees, R. S., Hendrichs, J., Vreysen, M. J. B. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations. Acta Tropica. 157, 115-130 (2016).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments: JoVE. , e3579 (2014).
- Carvalho, D. O., et al. Aedes aegypti lines for combined sterile insect technique and incompatible insect technique applications: the importance of host genomic background. Entomologia experimentalis et applicata. 168 (6-7), 560-572 (2020).
- Mamai, W., et al. Aedes aegypti larval development and pupal production in the FAO/IAEA mass-rearing rack and factors influencing sex sorting efficiency. Parasite. 27, 43 (2020).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- . Methods in Aedes Research Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods%20in%20Aedes%20Research%202016.pdf (2016)
- Focks, D. A. An improved separator for the developmental stages, sexes, and species of mosquitoes (Diptera: Culicidae). Journal of Medical Entomology. 17 (6), 567-568 (1980).
- International Atomic Energy Agency. . Manual of Dosimetry in Radiotherapy. Technical Reports Series No. 110. , (1970).
- Aldridge, R. L., et al. Gamma-irradiation reduces survivorship, feeding behavior, and oviposition of female Aedes aegypti. Journal of the American Mosquito Control Association. 36 (3), 152-160 (2020).
- Cianci, D., et al. Estimating mosquito population size from mark-release-recapture data. Journal of Medical Entomology. 50 (3), 533-542 (2013).
- Knipling, E. F. . The basic principles of insect population suppression and management. , (1979).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon