Method Article
Préparation de moustiques mâles Aedes aegypti irradiés et marqués en vue de leur libération dans le cadre d’un programme opérationnel de techniques d’insectes stériles
Dans cet article
Résumé
La technique de l’insecte stérile (TS) est utilisée pour contrôler des populations de moustiques spécifiques et importantes sur le plan médical qui peuvent être résistantes aux contrôles chimiques. Ici, nous décrivons une méthode d’élevage de masse et de préparation de moustiques mâles stériles pour la libération dans le cadre d’un programme SIT opérationnel ciblant le moustique Aedes aegypti .
Résumé
Le contrôle de maladies humaines telles que la dengue, le Zika et le chikungunya repose sur le contrôle de leur vecteur, le moustique Aedes aegypti , car il n’y a pas de prévention. La lutte contre les moustiques vecteurs peut s’appuyer sur des produits chimiques appliqués aux stades immatures et adultes, ce qui peut contribuer à la mortalité des non-cibles et, plus important encore, entraîner une résistance aux insecticides chez le vecteur. La technique de l’insecte stérile (TSS) est une méthode de contrôle des populations de ravageurs par la libération de mâles adultes stérilisés qui s’accouplent avec des femelles sauvages pour produire une progéniture non viable. Cet article décrit le processus de production de mâles stériles pour une utilisation dans un programme SIT opérationnel pour la lutte contre les moustiques Aedes aegypti . Les étapes utilisées dans le cadre du programme sont décrites ici, y compris l’élevage et le maintien d’une colonie, la séparation des pupes mâles et femelles, l’irradiation et le marquage des mâles adultes et l’expédition des mâles Aedes aegypti vers le site de remise en liberté. Les mises en garde procédurales, les limites du programme et les objectifs futurs sont également abordés.
Introduction
La transmission d’agents pathogènes transmis par les moustiques à l’homme provoque des millions de cas de maladies et de décès chaque année dans le monde. En l’absence de vaccins efficaces et approuvés contre les maladies transmises par les moustiques, telles que Zika ou la dengue, l’un des moyens les plus efficaces de réduire la transmission consiste à réduire les populations de moustiques vecteurs de maladies. De manière contrariante, un nombre croissant d’espèces de moustiques, traditionnellement ciblées par les pesticides, affichent des niveaux croissants de résistance aux pesticides1. Simultanément, les organismes gouvernementaux ont agressivement radié ou interdit les pesticides précédemment approuvés, et peu de nouvelles mesures efficaces de lutte chimique sont en cours d’élaboration 2,3. Cette constellation d’obstacles à la lutte contre les moustiques a motivé l’exploration de techniques alternatives non chimiques pour réduire les populations de moustiques.
Certaines espèces de moustiques présentent des défis pour contrôler les problèmes de résistance et d’homologation des pesticides. Aedes aegypti (L.) est un moustique vecteur de maladie important qui est extrêmement difficile à contrôler par la gestion traditionnelle intégrée des vecteurs en raison de l’habitat péridomestique cryptique exploité par cette espèce pour le développement immature et le repos adulte 4,5. Les défis liés à l’exploitation de l’habitat cryptique autour des résidences comprennent la difficulté d’atteindre ces endroits avec des techniques de pulvérisation de pesticides ainsi que le manque potentiel d’acceptation par le public d’un accès répété à la propriété privée pour les organismes de santé publique de lutte antivectorielle afin de mener les activités intensives de surveillance et de contrôle essentielles à une gestion intégrée efficace des vecteurs (GIV) pour cette espèce.
Heureusement, SIT, une approche qui s’est avérée efficace pour lutter durablement contre d’autres espèces d’insectes très difficiles6, est appliquée au problème d’Aedes aegypti dans le cadre d’une série révolutionnaire d’expériences et d’essais opérationnels basés à St. Augustine, en Floride (données non publiées KJL, RLA, SCB). La TIS a été appliquée à diverses espèces d’insectes, y compris les moustiques, et a fait l’objet d’un examen approfondi 7,8. SIT tire parti de la libération massive de mâles élevés en colonie stérilisés, par exemple, par l’exposition à des rayonnements ionisants ou à des produits chimiques pour submerger le choix du partenaire des populations naturelles de femelles. Les mâles stérilisés qui s’accouplent avec des femelles sauvages rendent les œufs infertiles en raison des dommages subis par les gamètes mâles et, s’ils sont présents en nombre suffisant, peuvent théoriquement écraser la population naturelle d’Aedes aegypti.
Un programme de TIS a été lancé pour tenter de réduire les populations d’Aedes aegypti dans une zone urbaine de la côte atlantique de la Floride où cette espèce a récemment recolonisé et est en expansion et présente un risque pour la santé publique pour la transmission de virus tels que Zika, la dengue ou le chikungunya. Afin de maximiser le potentiel de compatibilité avec les femelles sauvages, une nouvelle colonie a été établie en utilisant des Aedes aegypti capturés dans la nature de la population cible pour produire des mâles pour le programme9. Cela était basé sur l’hypothèse que les mâles d’origine locale élevés par colonie seraient plus susceptibles d’être compétitifs avec les mâles sauvages locaux pour l’accouplement avec les femelles sauvages locales. Pour que le SIT soit efficace, non seulement un nombre écrasant de mâles stériles doivent être présents dans la zone cible, mais ils doivent également être capables de courtiser et de s’accoupler efficacement avec les moustiques femelles sauvages locaux.
Une série d’expériences a été menée pour déterminer le nombre optimal de mâles stériles à libérer (données non publiées de KJL, RLA, SCB) ainsi que des doses optimales de rayonnement qui rendraient les mâles infertiles sans interférer avec la survie, le comportement ou l’acceptation par les femelles sauvages (données non publiées KJL, RLA, SCB). Ces données sont à paraître dans les publications alliées de ce groupe, mais certaines de ces conclusions sont également consignées dans ce protocole et pourraient être utilisées comme point de départ pour de nouveaux programmes de lutte contre SIT Aedes aegypti ailleurs. Cette espèce élargit constamment son aire de répartition, et les programmes de TIS sont très prometteurs pour être des solutions rentables et à long terme pour contrôler cette population. L’objectif de ce protocole est de produire des moustiques Aedes aegypti mâles stérilisés, élevés par colonies, pour les relâcher systématiquement dans des zones extérieures afin de perturber les cycles de reproduction naturels des populations locales d’Aedes aegypti dans le cadre d’un programme opérationnel de lutte antivectorielle de santé publique.
Bien que des protocoles et des flux de travail similaires aient été publiés pour la production de mâles transgéniques d’Aedes aegypti et que des flux de production pour Aedes SIT, ou des programmes d’incompatibilité basés sur Wolbachia aient été publiés ailleurs, ce protocole illustre comment les protocoles existants ont été adaptés pour la production, la séparation et l’irradiation des pupes mâles mâles, le marquage et l’emballage des mâles adultes, et l’expédition au site de dissémination pour ce programme9, 10,11,12,13,14,15,16,17,18. La composante de marquage de ce protocole peut ne pas être requise dans un programme de TIS opérationnel mature; cependant, il a été inclus ici parce qu’il s’agit d’une façon de surveiller l’efficacité et de contrôler la qualité de l’ensemble du processus au cours des premières années de l’établissement du programme de. Les programmes de lutte contre les moustiques sont généralement gérés par les autorités locales, de sorte qu’ils peuvent varier considérablement dans de nombreux aspects de leur organisation, de la taille et de la base de financement à l’ajustement des tactiques de contrôle pour maximiser le succès local. Par conséquent, la compatibilité du protocole décrit ici avec les ressources disponibles devrait être évaluée.
Protocole
REMARQUE : Ce protocole est spécifique à la manipulation d’Aedes aegypti , mais peut être modifié pour être efficace pour d’autres espèces de moustiques.
1. Production et maintien d’une colonie d’Aedes aegypti
- Élever des Aedes aegypti adultes et produire des œufs.
- Préparez un cadre pliable en aluminium de 0,6 m x 0,6 m x 0,6 m, une grande cage d’élevage avec un grillage en treillis de fibre de verre de 20 x 20 et un manchon de stockinette accessible sur un mur vertical.
- Placez une cuve en plastique de 1900 ml avec des pupes Aedes aegypti (sex-ratio de 1:1) dans chaque cage d’élevage, attachez la manche fermée et laissez les gobelets en place pour l’éclosion jusqu’à ce qu’il n’y ait plus d’adultes (c.-à-d. environ 4 jours). À ce stade, retirez les gobelets et maintenez les cages d’élevage pour adultes à 28-30 °C, >50% d’humidité relative (Rh) et un cycle lumière:foncé (L:D) de 12:12 ou 14:10.
NOTA: La production de pupes d’Aedes aegypti est décrite à la section 1.2. La densité des pupes dans le bac de 1900 ml devrait être telle qu’il y ait suffisamment d’espace pour que toutes les pupes puissent venir chercher de l’air simultanément. - Vingt-quatre heures après le placement des pupes dans les cages d’élevage, placez un récipient de solution de saccharose à 10% avec une mèche en éponge et suspendez une éponge de 10 cm x 2 cm imbibée de miel à partir d’un crochet métallique dans chaque cage pour fournir des sources distinctes d’hydratation et de nutrition aux moustiques adultes. Surveillez la sécheresse ou la croissance de moisissures des éponges et du contenant de saccharose, et réapprovisionnez-les ou changez-les au besoin.
REMARQUE : Utilisez un gobelet en plastique de 120 ml muni d’une mèche en éponge de 10 cm x 2 cm insérée à travers une découpe dans le couvercle dans de petites cages d’élevage et un gobelet en plastique de 460 ml muni d’une mèche éponge de 12 cm x 8 cm dans de grandes cages. - Fournir un repas de sang à chaque cage d’élevage 48 à 72 heures après l’émergence de la majorité des adultes et tous les 2 à 3 jours par la suite pour maintenir un nombre élevé de femelles nourries de sang afin de maximiser le rendement en œufs. Remplissez un condom en peau d’agneau avec 50 à 100 ml de sang bovin défibriné et réchauffez-le à environ 37 °C dans un bain d’eau chaude. Ensuite, utilisez un chiffon ou une serviette en papier pour tapoter et sécher partiellement le préservatif avant de le placer sur une boîte de Petri doublée de papier à l’intérieur de la cage pendant 30 à 60 minutes.
REMARQUE: Avant utilisation, rincez l’intérieur et l’extérieur de chaque condom avec de l’eau 2-3x pour enlever les lubrifiants ou autres substrats, et vérifiez s’il y a des trous. Les préservatifs peuvent être réutilisés pour 3 à 5 tétées en rinçant le sang et en les stockant dans une tasse d’eau froide. Comme certaines colonies peuvent subir des infestations de fourmis, les préservatifs peuvent devoir être suspendus pour en limiter l’accès. - Attendez 48 à 72 heures après chaque alimentation sanguine, puis introduisez une coupe de ponte dans chaque cage d’élevage pour adultes. Préparer les gobelets de ponte en ajoutant 200 mL d’eau nympale filtrée (c.-à-d. que les larves d’eau et les pupes ont été élevées) dans une tasse en plastique de 460 ml munie d’une feuille de papier de germination des graines (papier de ponte) de 8 à 10 cm de haut x 30 cm de large (papier de ponte) au ras de la circonférence intérieure de la tasse. Vérifiez les papiers de ponte tous les jours, remplacez-les tous les 2-4 jours et stockez soigneusement les papiers de ponte chargés d’œufs en les laissant sécher pendant 24-48 h à >50% Rh19.
REMARQUE : Laisser les gobelets de ponte dans les cages d’élevage pendant 72 heures au maximum pour empêcher l’éclosion des œufs. - Entretenez les cages d’élevage pour adultes jusqu’à 3-4 semaines avant de les décomposer et d’installer de nouvelles cages d’élevage pour adultes.
- Pour briser une cage d’élevage, retirez et nettoyez la coupe de ponte, rangez le papier de ponte chargé d’œufs, retirez et nettoyez le récipient de solution de saccharose et l’éponge à miel, et congelez la cage pour tuer tous les moustiques.
- Enlevez tous les corps des moustiques et nettoyez soigneusement l’intérieur et l’extérieur de chaque cage avec du savon dilué et de l’eau à l’aide d’essuie-tout et de tampons à récurer avec des éponges. Laissez sécher la cage propre pendant au moins 24 heures avant de l’utiliser lors du prochain cycle d’élevage.
REMARQUE: Utilisez un équipement de vide équipé d’une filtration à haute efficacité pour éliminer les particules qui peuvent entraîner des allergies. Les récipients de solution de saccharose peuvent être nettoyés et réutilisés 3-5x.
- Élevage de larves d’Aedes aegypti à partir d’œufs
- Préparer un bouillon de lisier nutritionnel larvaire en mélangeant 80 g d’un rapport 3:2 de poudre de foie de bovin:levure de bière dans 2200 ml d’eau du robinet. Préparez de la nourriture pour poissons pulvérisée. Versez les flocons de poisson dans un moulin à épices et broyez jusqu’à ce qu’il soit une poudre fine.
NOTE: Cette boue est désignée comme brune dans ce laboratoire. - À l’aide du papier de ponte chargé d’œufs (5 000 à 10 000 œufs) de l’étape 1.1.5, couper une portion de 3 à 7 cm du papier d’œuf perpendiculairement à la ligne de ponte et la placer dans un contenant de 460 ml à moitié rempli d’eau du robinet avec une pincée de flocons de nourriture pulvérisée pour poissons. Couvrir et agiter vigoureusement pendant au moins 1 min.
REMARQUE : Le papier d’œuf doit être conservé pendant au moins 7 jours (mais pas plus de 90 jours, ce qui peut réduire l’éclosion) après la ponte avant de commencer le processus d’éclosion pour permettre l’embryonation. Les bactéries et les algues présentes dans la nourriture pour poissons désoxygénent rapidement l’eau, ce qui déclenche le développement larvaire. - Verser tout le contenu du contenant de l’étape 1.2.2 dans un bac d’élevage larvaire préparé avec 3 L d’eau du robinet et 50 mL de lisier brun . Marquer la poêle avec la date de début, les informations sur la souche, le calendrier d’alimentation selon le tableau 1 et conserver à 28-30 °C, >50% HR et 12:12 ou 14:10 L:D cycle.
REMARQUE : Le rapport de 3 L d’eau pour 50 mL de brun est basé sur la profondeur de l’eau dans les bassins larvaires particuliers mentionnés dans le tableau des matériaux. Des casseroles de différentes tailles supporteront différentes densités de nymphes et nécessiteront donc différentes quantités d’eau et de boue brune . Les taux d’alimentation des larves dans le tableau 1 sont donnés sous forme d’intervalle; la sélection de la quantité utilisée est fondée sur l’expérience et la détermination de la santé globale des larves en développement à l’aide de variables telles que la turbidité, la couleur et l’odeur de l’eau; présence d’un film bactérien sur l’eau; nombre ou rapport de larves vivantes et mortes; et la motilité des larves. Les jours 3 à 6, nourrir les moustiques immatures pulvérisés de la nourriture pour poissons conformément au tableau 1. L’ajout d’eau, la réduction de la nourriture et la mise en place de 2 à 3 casseroles supplémentaires par rapport aux besoins du projet sont des moyens de gérer les bacs larvaires malsains.
- Préparer un bouillon de lisier nutritionnel larvaire en mélangeant 80 g d’un rapport 3:2 de poudre de foie de bovin:levure de bière dans 2200 ml d’eau du robinet. Préparez de la nourriture pour poissons pulvérisée. Versez les flocons de poisson dans un moulin à épices et broyez jusqu’à ce qu’il soit une poudre fine.
| Jour | Lisier nutritionnel de volume ajouté | Volume d’eau ajouté | Actions |
| 1 | 50 mL (lisier) | 3000 mL | |
| 2 | (pas de nourriture) | (pas d’eau) | |
| 3 | 1/4 - 1/2 c. à thé (nourriture pulvérisée pour poissons) | 500-1000 mL | |
| 4 | 1/2 - 3/4 c. à thé (nourriture pulvérisée pour poissons) | 500-1000 mL | |
| 5 | 1/2 - 3/4 c. à thé (nourriture pulvérisée pour poissons) | 500-1000 mL | |
| 6 | 1/4 - 1/2 c. à thé (nourriture pulvérisée pour poissons) | 500-1000 mL | |
| 7 | (pas de nourriture) | (pas d’eau) | Souche PUPES et larves |
Tableau 1 : Calendrier d’alimentation pour l’élevage en masse des larves d’Aedes aegypti.
2. Séparation des pupes mâles Aedes aegypti
- Concentrer les pupes des bassins larvaires. Une fois que le seuil approximatif de pupes est atteint, verser le contenu de chaque casserole à travers un tamis (taille 20-40). Utilisez une bouteille d’eau du robinet pressée pour laver les pupes et les larves du tamis dans un bécher en plastique gradué de 3000 mL.
REMARQUE : Seulement 2 ou 3 bacs larvaires doivent être transférés dans chaque bécher de 3000 ml pour éviter le surpeuplement afin que les pupes puissent atteindre la surface confortablement. Les pupes devraient se développer entre 130 et 140 h après l’éclosion des œufs dans les conditions de température et de lumière mentionnées à l’étape 1.2.3. Attendez-vous à une éclosion notable des œufs le jour même où les œufs sont installés. Selon les conditions environnementales, environ 20 à 70% des larves auront baspusé et seront prêtes à être tamisées dans les 6 jours. La répartition des pupes sur plusieurs béchers de 3000 ml garantit des volumes gérables à verser dans le séparateur. - Séparer les pupes mâles des larves et des pupes femelles.
Remarque : Cette étape peut être effectuée par un opérateur ou deux opérateurs.- Pour un seul opérateur séparant les pupes mâles :
- Répartir le contenu de chaque bécher de 3000 mL généré à l’étape 2.1 dans plusieurs contenants en plastique de 1900 mL afin de réduire les déversements et les surcharges du séparateur. Préparer le séparateur à plaques en plaçant un récipient de collecte rigide peu profond de 4000 mL sous l’écluse à la base du séparateur (figure 1). Remplissez deux béchers en plastique gradué de 3000 ml aux 3/4 d’eau du robinet.
REMARQUE : Utilisez un tuyau d’évier comme alternative aux béchers gradués en plastique de 3000 mL. Sinon, les béchers devront être remplis en permanence tout au long du processus de séparation. Des détails supplémentaires sur le fonctionnement du séparateur nymphal se trouvent dans les références12,20. - Versez de l’eau à travers l’espace entre les plaques de verre et ajustez les boutons supérieur et inférieur dans le sens horaire ou antihoraire pour permettre à l’eau de s’écouler continuellement tout en générant simultanément de l’eau stagnante à une hauteur d’environ 1,25 cm de la base des plaques. Marquez les positions de départ des boutons inférieurs avec du ruban adhésif. Une fois que l’eau stagnante est répartie uniformément sur la base des plaques de verre avec une hauteur et un taux de drainage égaux, commencez à verser le contenu des récipients de pupes et de larves à travers l’espace entre les plaques.
REMARQUE : Une séparation claire doit être établie entre les petites (nymphes mâles) et les grandes (femelles); Sinon, rincez ce lot et ajustez les boutons supérieurs pour réduire l’espace entre les plaques. - Tout en versant lentement de l’eau à travers le séparateur, faites tourner continuellement les boutons inférieurs par paire dans le sens inverse des aiguilles d’une montre ~1-2 cm de la position de départ marquée jusqu’à ce que la plupart ou la totalité des larves aient traversé et glissé le long de l’écluse dans le récipient de collecte.
REMARQUE: Comme une main est utilisée pour verser de l’eau, l’autre main tourne les boutons un à la fois, mais également et par petits incréments, pour ouvrir lentement les plaques. La plupart des larves sont rapidement emportées, mais certaines larves seront capturées avec les pupes mâles. Ces larves traînardes seront irradiées, mais prendront du retard dans leur développement et ne s’approcheront pas des adultes avec la cohorte focale de nymphes. - Jetez ou recyclez les larves dans la colonie, mais dans les deux cas, retirez-les du contenant de collecte avant que les pupes mâles ne commencent à laver à travers le séparateur. Interrompez le processus en cessant l’écoulement de l’eau pendant que le récipient de collecte à la base de l’écluse est débarrassé des larves en versant à travers un tamis #30, qui est lavé à contre-courant dans un récipient séparé.
REMARQUE : Les larves traversent en premier, suivies des pupes mâles et enfin des femelles (figure 1). - Continuez à verser de l’eau et faites pivoter les boutons inférieurs jusqu’à ce que les larves mâles soient lavées et séparées dans le récipient de collecte. Suspendre le processus pour vérifier et retirer les larves du contenant de collecte avant le transfert des pupes mâles à l’étape suivante.
REMARQUE: Le nombre de rinçages nécessaires pour séparer les mâles dépend du tempo de la coulée d’eau et de la vitesse à laquelle les boutons sont tournés. Il faut habituellement 2000-2500 mL d’eau pour évacuer les larves, 1000-1500 mL pour évacuer les pupes mâles et 200-400 mL pour débusquer les pupes femelles. - Versez les pupes mâles hors du récipient de collecte à travers un tamis #20 au-dessus d’un évier. Utilisez une bouteille d’eau du robinet pressée de 1000 ml pour laver les pupes mâles du tamis tout en versant dans un récipient séparé de 1900 ml.
- Une fois que toutes les pupes mâles ont été séparées, continuez à verser de l’eau à travers le séparateur et ajustez les boutons inférieurs pour rincer à travers les pupes femelles. Transvaser les femelles à l’aide du tamis décrit à l’étape 2.2.1.6 dans un récipient séparé jusqu’à ce que tous les moustiques immatures soient éliminés du séparateur. Jetez les pupes femelles. Une fois le lot traité, remettez les boutons à leur position de départ initiale et répétez le processus avec le lot suivant. Une fois tous les lots traités, laissez les plaques ouvertes pour que le séparateur puisse sécher.
REMARQUE: Il n’y a pas de séparation parfaite avec cet appareil, ce qui nécessite de la patience et de la pratique. Les pupes ou les larves tenaces peuvent être délogées par un fort écoulement d’eau, mais pas au point de les pousser sur les côtés, ce qui pourrait contaminer les inondations futures.
- Répartir le contenu de chaque bécher de 3000 mL généré à l’étape 2.1 dans plusieurs contenants en plastique de 1900 mL afin de réduire les déversements et les surcharges du séparateur. Préparer le séparateur à plaques en plaçant un récipient de collecte rigide peu profond de 4000 mL sous l’écluse à la base du séparateur (figure 1). Remplissez deux béchers en plastique gradué de 3000 ml aux 3/4 d’eau du robinet.
- Pour deux opérateurs séparant les pupes mâles, modifier la section 2.2.1 comme suit.
- Premier opérateur : Versez de l’eau à travers le séparateur et faites pivoter les boutons progressivement pour séparer les larves, les pupes mâles et les pupes femelles.
- Deuxième opérateur : Une fois chaque étape recueillie dans le conteneur d’écluse, tamiser le contenu du conteneur d’écluse pour répartir les larves, les pupes mâles et les pupes femelles dans plusieurs récipients de collecte d’écluses distincts. Gardez les grands béchers remplis d’eau si un tuyau d’évier n’est pas disponible.
- Pour un seul opérateur séparant les pupes mâles :
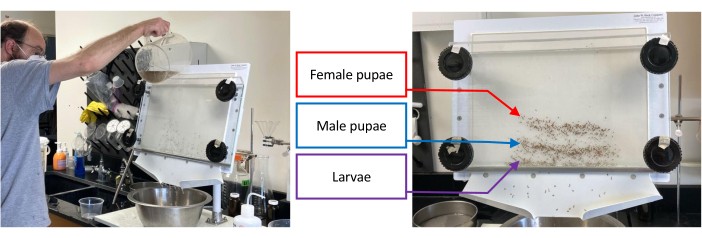
Figure 1 : Séparateur nymphal contenant un lot d’Aedes aegypti immature. La séparation commence par verser de l’eau à travers le séparateur tout en tournant les boutons inférieurs de 1 à 2 cm dans le sens inverse des aiguilles d’une montre jusqu’à ce que l’ensemble ciblé, c’est-à-dire les larves, les pupes mâles ou les pupes femelles, ait été isolé autant que possible des ensembles qui restent (image de gauche). L’image de droite montre la séparation des larves (bande inférieure), des pupes mâles (bande médiane) et des pupes femelles (bande supérieure). Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation des pupes mâles Aedes aegypti pour l’irradiation
- Répartissez les pupes mâles dans des boîtes de Petri en plastique de 60 mm.
NOTE: Le nombre de boîtes de Petri nécessaires dépend du nombre de pupes mâles disponibles pour l’irradiation: une cuvette d’élevage larvaire de l’étape 1.2 remplira environ 1,5 boîte de Pétri. L’âge des pupes varie de 1 à 40 h. Dans ce protocole, la moitié plus profonde de plus petit diamètre de la boîte de Petri est appelée le fond, et la moitié plus profonde de diamètre plus profond est appelée le haut.- Préparez des disques prédécoupés de papier filtre pour s’adapter au diamètre intérieur du fond de la boîte de Pétri. Placez un disque de papier filtre humidifié à l’eau dans chacun des fonds des boîtes de Petri pour garder les pupes hydratées tout au long du transport et du processus d’irradiation.
- Transférer les pupes dans des boîtes de Petri. Filtrer les pupes mâles recueillies à l’étape 2.2.1.6 avec un tamis et laver les pupes dans un bécher gradué de 1000 ml avec le moins d’eau possible. Verser délicatement les pupes dans des boîtes de Petri jusqu’à ce que chaque disque de papier filtre soit uniformément recouvert d’une seule couche de pupes (Figure 2A - C). Disposez les boîtes de Petri au bord d’une table dans une rangée pour faciliter le versement.
REMARQUE : Une solution de rechange à la tension des pupes consiste à couper l’extrémité d’une pipette Pasteur en plastique de 3 ml à un diamètre suffisamment grand pour accueillir les nymphes. Utilisez la pipette pour transférer les pupes du récipient produit à l’étape 2.2.1.6 directement sur les disques de papier filtre afin qu’il y ait une seule couche de pupes serrée dans chaque boîte de Pétri. Ceci n’est pratique que pour les petits lots. - Utiliser une pipette Pasteur inchangée de 3 ml pour éliminer l’eau stagnante du fond de la boîte de Petri afin d’empêcher le mouvement des nymphes pendant l’étape de sexage (3.2) et le transport.

Figure 2 : Transfert des pupes dans des boîtes de Petri pour irradiation. (A) Les pupes tamisées sont versées et lavées à contre-courant dans un bécher en plastique de 1000 mL. (B) Un minimum d’eau est retenu dans le bécher pour faciliter le versement dans les boîtes de Pétri. (C) Boîtes de Petri alignées le long du bord d’une surface pour faciliter le versement d’une seule couche de nymphes. (D) Les boîtes de Petri chargées de pupes sont empilées et sécurisées pour être livrées à l’installation d’irradiation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Sexez les pupes pour vérifier la contamination par les femelles. Dans le cadre d’une lunette de dissection, utilisez des sondes pour faire pivoter chaque nymphe afin de vérifier la surface ventrale à la recherche d’un lobe génital de grande taille (figure 3) indiquant le sexe masculin. Enlever et jeter les pupes avec des lobes génitaux réduits ou petits qui indiquent des femelles et remplacez-les par un nombre égal de pupes mâles pour maintenir le nombre correct.
NOTE: Dans un programme opérationnel, cette étape n’est pas pratique en raison du grand nombre de moustiques et du fait que la séparation, le transfert, l’irradiation et la préparation des cages après l’irradiation sont tous effectués en une journée avec un temps limité. Il est possible de vérifier la qualité d’un échantillon de certaines boîtes de Pétri, en particulier dans les premières phases de l’élaboration du programme de TSI.
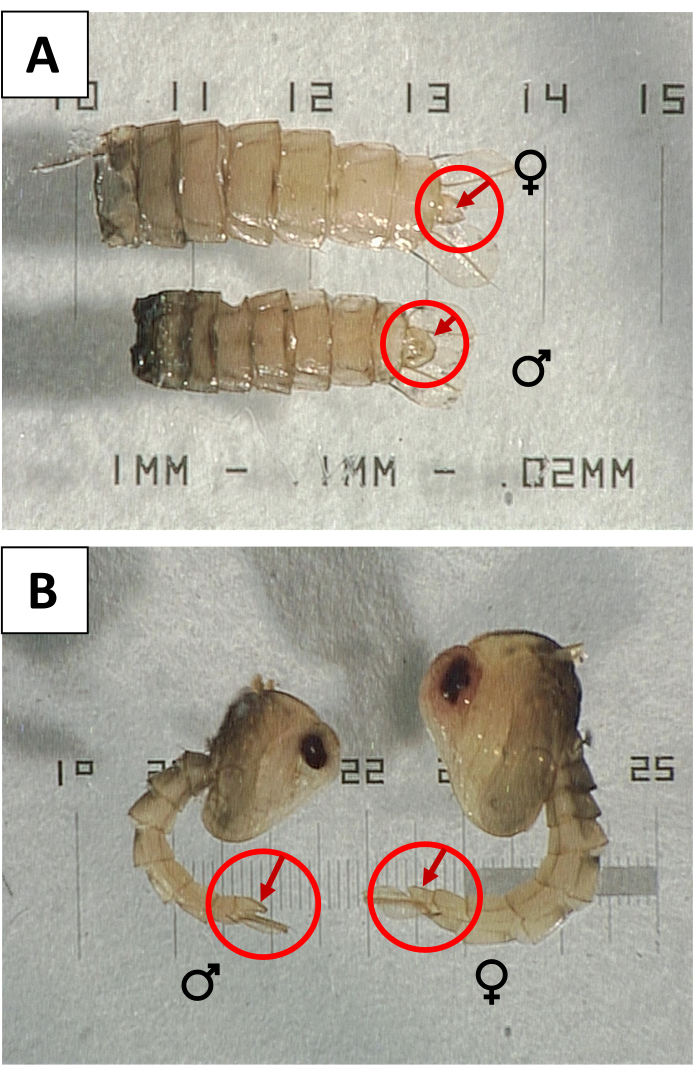
Figure 3 : Pupes sexage à l’aide du lobe génital. (A) Vues ventrales et (B) latérales des pupes femelles () et mâles (♀ ♂) Aedes aegypti, avec les lobes génitaux indiqués pour montrer le dimorphisme sexuel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Couvrir le fond avec le dessus des boîtes de Petri et fixer avec du ruban adhésif de laboratoire. Regroupez les boîtes de Petri collées avec des bandes élastiques dans des piles dimensionnées pour tenir dans la chambre d’irradiation et scellez-les dans un sac refermable étiqueté de 3,8 L (figure 2D). Ne laissez pas les pupes rester à découvert pendant >1 h.
4. Irradiation des pupes mâles Aedes aegypti
- Préparez le film de dosimétrie à partir du même lot en coupant 1 cm2 carrés de films et en plaçant chaque carré dans son enveloppe individuelle.
REMARQUE: Tous les films utilisés chaque jour sont coupés en même temps. Cela réduit la faible quantité de variation induite par le stockage. Le nombre de carrés nécessaires pour chaque pile est de 1 + (nombre de boîtes de Pétri). - Préparez une trousse à emporter dans l’installation d’irradiation, qui devrait comprendre une minuterie de laboratoire, du ruban de laboratoire, un marqueur permanent, des enveloppes préparées de film de dosimétrie, un badge de dosimétrie et une feuille de notes de laboratoire avec des listes de vérification pour faire le suivi des renseignements clés (figure 4).
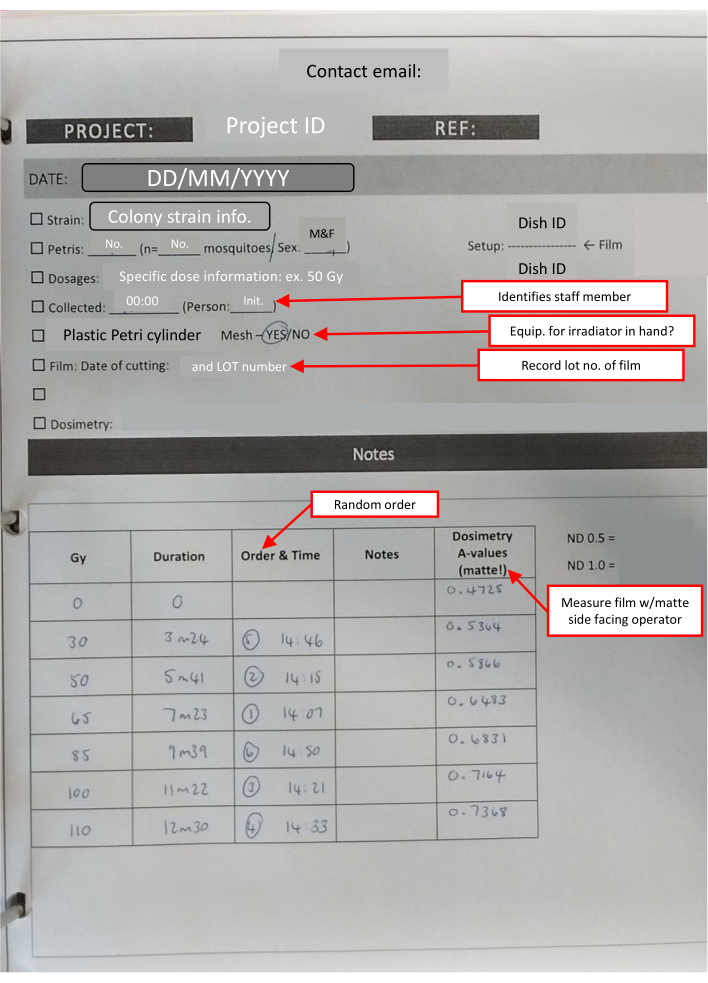
Figure 4 : Feuille de présentation du cahier de laboratoire - IR remplie pour un ensemble dose-réponse. Les encadrés encadrés en rouge (marqués par des flèches rouges) indiquent des notes utiles sur les différentes sections et réitèrent les informations clés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Transporter les pupes à l’installation d’irradiation. Placer les boîtes de Petri des pupes mâles de l’étape 3.3 dans des récipients isothermes et les conserver à l’abri de la lumière directe du soleil et avec air conditionné pendant le transport.
- Préparer des piles de boîtes de Petri pour l’irradiation à l’irradiateur. Empiler le nombre approprié de boîtes de Petri pour les insérer dans la chambre d’irradiation avec une enveloppe de film de dosimétrie centrée entre chaque boîte et en haut et en bas de la pile. Fixez les enveloppes et l’ensemble de la pile avec du ruban de laboratoire pour éviter les déversements et faciliter le placement de la pile dans la chambre.
- Irradier les boîtes de Petri des pupes mâles. Placer la pile de boîtes de Petri sur le treillis métallique rigide de la chambre pour la positionner à la bonne hauteur pour le cône d’exposition optimal sur la base de la cartographie de dose précédente de l’unité d’irradiation spécifique21. Activez le plateau tournant de l’irradiateur et irradiez, en lançant simultanément la minuterie de laboratoire. Irradier pendant l’intervalle approprié pour atteindre la dose désirée (des exemples sont présentés dans le tableau 2).
NOTE: Ce protocole est basé sur un irradiateur au césium 137 (voir le tableau des matériaux) et une dose cible de 50 Gy. Étant donné que le Cs-137 se désintègre avec le temps, le débit de dose est ajusté chaque année en effectuant une série dose-réponse à l’aide de dosimètres à l’alanine, complétés par un film radiochromique pour la dosimétrie de routine et de l’alanine dans environ 10% des échantillons irradiés. Compte tenu du débit de dose actuel de 8,8 Gy/min, l’atteinte de la dose cible de 50 Gy nécessite 5 minutes et 41 s d’exposition. La dosimétrie filmique de routine se produit comme décrit à l’étape 4.7. La dosimétrie des pastilles d’alanine est effectuée au National Center for Electron Beam Research de la Texas A&M University ou au National Institute of Standards and Technology de Gaithersburg, MD, États-Unis.
| Posologie (Gy) | Temps (basé sur 8,8 Gy/min) |
| 0 | NA |
| 10 | 1 min 8 s |
| 30 | 3 min 24 s |
| 50 | 5 min 41 s |
| 65 | 7 min 23 s |
| 85 | 9 min 39 s |
| 100 | 11 min 22 s |
| 110 | 12 min 30 s |
Tableau 2 : Exemples de temps de dosage pour l’irradiateur au césium 137.
- Une fois le temps prescrit écoulé, retirez les boîtes de Petri de l’irradiateur et démontez soigneusement la pile. Étiquetez toutes les boîtes de Petri et les enveloppes de film avec la date et le lieu dans la pile. Scellez les enveloppes et conservez-les pour la dosimétrie. Remballez les boîtes de Petri dans le conteneur isotherme pour les ramener au laboratoire principal.
REMARQUE : Notez si les adultes sont apparus pendant l’irradiation et marquez la boîte de Petri affectée de manière à ce que l’adulte ou les adultes ne s’échappent pas lorsque les pupes sont placées dans les cages d’élevage (étape 5.2). - Confirmer la dose d’irradiation à l’aide d’un film de dosimétrie en mesurant le film environ 24 heures après l’exposition. Activez le lecteur de dosimétrie et laissez-le s’équilibrer à température ambiante. Chargez le film à l’aide des pinces fournies avec le lecteur et suivez les instructions du fabricant pour lire le film irradié ainsi que le film vierge non irradié du même lot. Mettez à zéro le lecteur sans film entre les lectures et enregistrez les données comme dans l’exemple de fiche technique illustré à la figure 5.
REMARQUE: Ce protocole est basé sur les normes ND0.5 et ND1.0 QA Filter Set. Il est important de mesurer le film avec le côté mat face à l’opérateur.
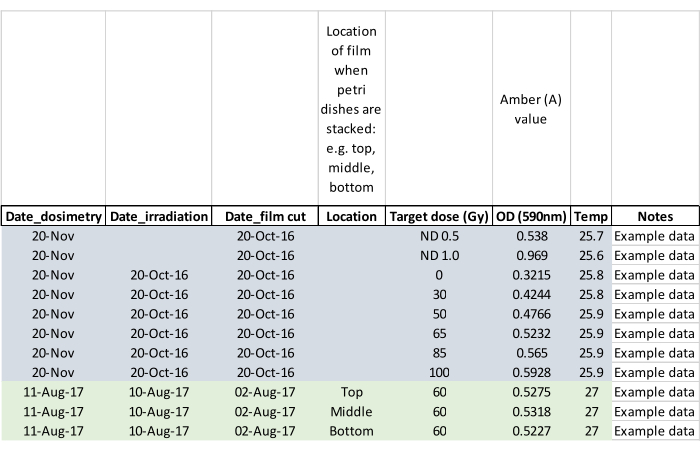
Figure 5 : Fiche de données de dosimétrie remplie avec des exemples de données. Les en-têtes de colonne invitent l’opérateur à capturer les données clés pour une analyse ultérieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Élevage de pupes mâles irradiées d’Aedes aegypti en adultes
- Nettoyez et préparez les petites cages d’élevage en plastique de 30 cm x 30 cm x 30 cm afin qu’elles soient prêtes pour les pupes irradiées à leur retour au laboratoire principal. Pour 2 boîtes de Petri de pupes mâles irradiées, préparez 1 cage d’élevage. Remplir chaque cage d’élevage d’un gobelet en plastique à moitié rempli contenant 460 ml d’eau du robinet et un contenant de solution de saccharose à 10 %, tel que décrit à l’étape 1.1.3.
- Transférer immédiatement les pupes irradiées dans les cages d’élevage préparées après leur retour de l’installation d’irradiation. Utilisez une bouteille d’eau pressée pour laver soigneusement les pupes de chaque boîte de Petri dans les 460 ml d’eau dans le gobelet en plastique de chaque cage d’élevage. Après 24 h, transférer les gobelets dans de nouvelles cages d’élevage propres contenant la source de nutrition et attendre l’éclosion restante d’Aedes aegypti mâle adulte irradié.
REMARQUE: Si des pupes sont apparues pendant le processus d’irradiation, ouvrez les boîtes de Petri avec les dépliants dans une cage vide, puis passez à l’étape 5.2. Jetez les mâles rassemblés dans cette cage. Les pupes sont transférées dans de nouvelles cages d’élevage après 24 heures parce que les mâles émergent avant les femelles de la même cohorte et isoler les jours d’émergence peut réduire l’incidence de la contamination femelle et assurer un vieillissement précis des mâles.
6. Marquage et pesée des mâles adultes irradiés d’Aedes aegypti
Remarque : Cette section du protocole suppose que deux personnes effectuent les tâches ; Pour 1 personne, voir 6.4.

Figure 6 : Emballage d’Aedes aegypti mâle marqué et irradié dans des contenants de libération. (A) Récipient de dégagement montrant une stockinette fixée à un trou découpé sur le côté du cylindre en carton avec du ruban de masquage, des agrafes et de la colle chaude. La lunette est en place avec un support d’étiquette de ruban de masquage apposé sur le côté. La lunette conserve le couvercle en maille de tulle bien tiré; Une bande élastique (non visible) maintient également le tulle en place sous la lunette. (B) Lot de mâles anesthésiés en train d’être culbutés dans un colorant rose dans une petite tasse en carton. C) Quatre conteneurs de débâchement à l’intérieur d’un conteneur d’expédition isotherme. Notez que les manchons de stockinette sont orientés vers le milieu du conteneur d’expédition, que les matériaux d’emballage sont rangés autour des contenants de libération et que des sources de nutrition et d’hydratation sont en place sur le dessus de chaque contenant de démoulage recouvert d’un fond de boîte de Petri inversé maintenu fermement par des bandes élastiques croisées et des morceaux de ruban adhésif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Préparez les contenants de vidange du papier cartonné.
- Percer un trou de 11,5 cm de diamètre sur le côté d’un contenant cylindrique de 3,9 L en papier cartonné à couvercle à 1,5 à 3,0 cm du fond afin que le trou ne soit pas recouvert par le couvercle (figure 6A).
- Couper une stockinette de 40 à 50 cm de longueur et agrafer une extrémité de celle-ci autour de l’intérieur du trou de 11,5 cm découpé en 6.1.1. Utilisez une agrafeuse de bureau standard ouverte de manière à ce que les agrafes puissent être forcées à travers la stockinette et le papier cartonné de l’intérieur du contenant et dans une surface de travail appropriée telle qu’un bloc de mousse de polystyrène extrudé dur. Sertir les agrafes à l’aide d’un tournevis à tête plate pour fixer hermétiquement la stockinette au périmètre du trou et fixer du ruban de masquage sur le côté serti pour éviter les accrocs. Scellez le bord de la stockinette à l’intérieur du cylindre sur le papier cartonné avec de la colle chaude et vérifiez l’ensemble pour détecter les trous d’évacuation.
- Créez une lunette de retenue en retirant le disque intérieur du couvercle et coupez un carré de 33 cm x 33 cm de maille de tulle en nylon assez fin pour retenir les moustiques mâles adultes Aedes aegypti . Placez le treillis à l’extrémité ouverte du cylindre et placez la lunette sur la maille pour la maintenir en place sans espaces. Tirez le treillis vers le bas de sorte qu’il dépasse sous la lunette pour que le maillage soit enseigné à travers l’extrémité ouverte et scellez le treillis saillant contre le cylindre avec un élastique.
- Placez un morceau de ruban adhésif de 10 cm sur le côté de la lunette recouvert d’un morceau de ruban d’étiquetage de 8 cm afin que le ruban d’étiquetage puisse être remplacé facilement sans déchirer la lunette.
REMARQUE: Les contenants de dégagement sont durables et peuvent être réutilisés >10x avec une manipulation appropriée. Avant d’introduire chaque nouveau lot de moustiques mâles mâles adultes et irradiés marqués, vérifiez que la stockinette est solidement attachée au conteneur et effectuez rapidement des réparations si nécessaire.
- Préparez la station de pesée et de marquage.
- Versez environ 50 mg de colorant de marquage dans un contenant de papier cartonné de 240 ml et étalez le colorant sous forme d’une couche de poudre uniformément autour des surfaces intérieures du contenant. Tapotez doucement pour éliminer l’excès de colorant. Utilisez des tasses clairement étiquetées pour plusieurs colorants afin de garder les couleurs séparées.
- Tare un bateau de pesage de 100 à 500 g sur une balance électronique de 0,0001 g; créer un formulaire de données (tableau 3); et collez ensemble quatre feuilles de papier de 215,9 mm x 355,6 mm pour obtenir une surface de travail de 431,8 mm x 711,2 mm.
| Conteneur de libération | Poids des moustiques | Numéro de cage | Femmes en lot | Nombre d’hommes | Conteneur de libération | Masse totale |
| ROSE I | 0.024 | D1 #1 | 25 | ROSE I | 2.03 | |
| ROSE I | 2.007 | D1 #1 | 7 | ROSE II | 1.99 | |
| ROSE II | 1.990 | D1 #1 | ROSE III | 2.03 | ||
| ROSE III | 0.026 | D1 #3 | 25 | |||
| ROSE III | 2.000 | D1 #3 | 18 |
Tableau 3 : Tableau de données de la station de pesée.
- Marquer des lots quantifiés de mâles adultes irradiés avec un pigment fluorescent.
- Transférer les moustiques adultes (âgés de 2,5 à 3,5 jours) de chaque cage d’élevage dans des flacons d’aspirateur. Retirez les sources de nutrition de la cage d’élevage de l’étape 5.2 et placez la cage entière dans une grande chambre de CO2 pendant 5 à 7 minutes, en frappant les côtés du récipient pour déloger les moustiques qui peuvent s’accrocher à la cage d’élevage. Une fois le temps d’exposition écoulé, retirez la cage d’élevage de la chambre et aspirez tous les moustiques adultes dans une série de flacons d’aspiration en plastique.
REMARQUE: L’administration du 99,5-100% CO2 se fait à partir d’un réservoir avec un régulateur, une barbe en laiton et un tube en silicone canalisés dans la chambre à un débit de 6 L / min. Le nombre de flacons nécessaires pour nettoyer la cage d’élevage dépend du nombre de moustiques dans la cage et de la compétence de l’opérateur, mais 3 à 5 flacons sont généralement nécessaires par cage. Choisissez un aspirateur qui a de petits flacons à changement rapide pour faciliter la gestion des moustiques adultes par lots, par exemple, un utilisant un flacon collecteur de polystyrène de 60 ml scellé avec un écran en aluminium de 20 x 20 mailles à une extrémité et une valve à clapet en acétate transparent à l’autre. Toute la cage est anesthésiée avant l’aspiration afin de réduire le temps de transfert des moustiques dans des flacons afin de réduire le stress sur les moustiques et de garder le protocole traitable. - Triez tous les moustiques adultes de chaque cage d’élevage par sexe.
- Exposer le premier flacon de l’étape 6.3.1 au CO 2 dans une petite chambre pendant 4 min, puis secouer doucement les moustiques anesthésiés en les étalant sur le papier blanc préparé à l’étape 6.2.2.
- Charger un nouveau flacon vide dans l’aspirateur, aspirer soigneusement tous les mâles de la surface de travail et passer ce flacon à la station de pesée (étape 6.3.3.). Comptez toutes les femelles laissées derrière, aspirez-les dans une fiole séparée et jetez-les, ainsi que tous les mâles écrasés.
- Répétez ce processus avec les flacons restants de 6.3.1, mais à un moment donné du processus de tri par sexe, générez un flacon séparé avec seulement 25 mâles qui est également passé à la station de pesée. Répétez l’étape 6.3.2. pour chaque cage d’élevage.
REMARQUE : Lors du traitement des mâles adultes irradiés pour le sexage, la pesée et le marquage, gardez une trace du nombre de femelles dans chaque lot, qui sont des données clés pour le dépannage et l’assurance qualité du tri sexuel nymphal et de l’ensemble du processus. Si le nombre de femelles est plus élevé que prévu, une deuxième personne devrait extraire les femelles pendant que l’opérateur principal aspire les mâles. Il est important de peser un échantillon de 25 mâles de chaque cage d’élevage pour calculer un poids moyen par moustique, qui sera utilisé pour estimer le nombre de mâles irradiés marqués relâchés à la fin du protocole.
- Peser et teindre les lots de moustiques mâles adultes.
- Au poste de pesée, placer le premier flacon de moustiques mâles adultes du poste de sexage (section 6.3.2) dans une petite chambre de CO 2 pendant 2 minutes et agiter délicatement les moustiques dans le bateau de pesée tared préparé à l’étape 6.2.2. Enregistrer le poids des moustiques et verser les moustiques dans le gobelet de teinture préparé en 6.2.1.
- Inclinez et tournez lentement la tasse 1 en pleine rotation dans le sens des aiguilles d’une montre et dans le sens inverse des aiguilles d’une montre afin que les moustiques entrent en contact avec le revêtement en poudre sur les surfaces internes de la tasse et soient tous légèrement saupoudrés de colorant (figure 6B). Versez les moustiques marqués dans un bateau de pesée.
- Passez rapidement à l’étape suivante afin que les moustiques ne se rétablissent pas et ne s’échappent pas. Répétez cette étape jusqu’à ce que tous les flacons de la section 6.3.2 aient été traités.
REMARQUE : Le poids des mâles provenant du flacon séparé de 25 mâles généré pour chaque cage d’élevage à la section 6.3.2 est enregistré et utilisé pour calculer le poids moyen par mâle de cette cage.
- Charger les contenants de libération avec des mâles adultes irradiés marqués. Plier légèrement le bateau de pesée contenant des moustiques mâles anesthésiés, marqués, irradiés à la fin de la section 6.3.3. pour créer un canal, puis dirigez ce canal à travers le manchon de stockinette pour transférer les mâles dans le conteneur de libération. Continuez à ajouter les moustiques jusqu’à ce qu’environ 2,0 g ou 1500-3000 moustiques mâles soient dans le contenant de libération et attachez le manchon de la stockinette fermé. Marquez le ruban d’étiquetage sur le cadre du contenant de libération avec la couleur du colorant, le numéro du récipient et le poids total des moustiques, puis copiez ces données dans le formulaire à partir de l’étape 6.2.2.
REMARQUE: La manipulation des moustiques à n’importe quel stade de la vie induit un stress et peut réduire la survie ou la vigueur. La série d’anesthésiations décrite dans ce protocole pourrait avoir un impact sur les moustiques; Cependant, les tentatives de poursuivre et d’aspirer les moustiques non anesthésiés à chaque étape induiraient un stress accru et un protocole insoutenable. Diviser le poids total des moustiques dans chaque contenant de remise à l’eau par le poids moyen par moustique mâle généré à la section 6.3.3 pour obtenir une estimation du nombre de mâles dans ce contenant de remise à l’eau; Chaque contenant de remise à l’eau ne doit pas contenir plus de 2 g de mâles, ce qui équivaut à environ 1 grande cage d’élevage.
- Transférer les moustiques adultes (âgés de 2,5 à 3,5 jours) de chaque cage d’élevage dans des flacons d’aspirateur. Retirez les sources de nutrition de la cage d’élevage de l’étape 5.2 et placez la cage entière dans une grande chambre de CO2 pendant 5 à 7 minutes, en frappant les côtés du récipient pour déloger les moustiques qui peuvent s’accrocher à la cage d’élevage. Une fois le temps d’exposition écoulé, retirez la cage d’élevage de la chambre et aspirez tous les moustiques adultes dans une série de flacons d’aspiration en plastique.
- Modifications du protocole de marquage pour un seul opérateur
- Effectuez d’abord le tri sexuel pour toutes les grandes cages. Exposez chaque grande cage au CO2 pendant 4-5 minutes et aspirez tous les moustiques dans 4-5 flacons. Exposez chaque flacon au CO 2 pendant2-3 minutes, déposez tous les moustiques sur la surface de travail en papier blanc, retirez les femelles et comptez, et remettez les mâles dans leur grande cage de population.
- Pesée et marquage
- Commencez par la première cage de rétention des mâles produite à l’étape 6.4.1 : retirer la source de nutrition et anesthésier les mâles dans une grande chambre de CO2 pendant 5 à 7 min. Aspirer uniformément les mâles anesthésiés dans des flacons séparés. Répétez cette étape avec chaque cage de rétention dans l’ordre dans lequel elles ont été produites.
REMARQUE: Environ 2-3 flacons encombrés seront produits par cage de rétention. Le traitement des cages de détention des mâles dans l’ordre où elles ont été produites maximise le temps de récupération pour chaque cage de mâles. - Anesthésier le premier flacon produit à l’étape 6.4.2.1. pendant 1-2 min dans une petite chambre de CO2 . Versez un petit nombre de moustiques sur la surface de travail en papier blanc, aspirez 25 moustiques mâles dans un nouveau flacon et procédez comme en 6.3.2 pour déterminer le poids moyen par mâle pour cette cage. Remettre tout mâle supplémentaire dans le flacon source ou aspirer dans un nouveau flacon séparé pour être traité plus tard; procéder à la pesée, au marquage et au transfert dans les contenants de libération pour le reste des mâles dans le premier flacon, comme décrit dans le reste de l’étape 6.3. Répétez l’étape 6.4.2.2. (sauf pour isoler 25 mâles dans un flacon séparé) pour le reste des flacons produits à l’étape 6.4.2.1. dans l’ordre dans lequel ils ont été produits, puis passez à la prochaine cage d’élevage triée par sexe produite en 6.4.1.
REMARQUE: Les flux de travail avec une personne sont plus lents et certains moustiques mâles devront être anesthésiés plusieurs fois. Recherchez et enlevez constamment les moustiques femelles.
- Commencez par la première cage de rétention des mâles produite à l’étape 6.4.1 : retirer la source de nutrition et anesthésier les mâles dans une grande chambre de CO2 pendant 5 à 7 min. Aspirer uniformément les mâles anesthésiés dans des flacons séparés. Répétez cette étape avec chaque cage de rétention dans l’ordre dans lequel elles ont été produites.
7. Contenants d’emballage et d’expédition d’Aedes aegypti mâles adultes irradiés marqués
- Préparer les conteneurs de mainlevée pour l’expédition. Une fois qu’un récipient de libération est rempli de mâles marqués, placez 4 boules de coton imbibées de solution de saccharose à 10% sur le couvercle en maille et recouvrez avec un fond inversé d’une boîte de Petri maintenue en place par deux élastiques tendus autour du récipient entier et sur la boîte de Petri pour former une croix. Placez un morceau de ruban de masquage sur le X des deux élastiques pour les maintenir en place sur la boîte de Petri inversée.
REMARQUE: Assurez-vous que les boules de coton contenant une solution de saccharose à 10% ne sont pas saturées au point de s’égoutter, ce qui endommagerait le récipient et piègerait et tuerait les moustiques. - Emballez les contenants de dégagement de papier cartonné dans une glacière d’expédition en mousse de polystyrène extrudé. Percez 4 trous de ventilation à travers le couvercle de la glacière et obstruez avec du coton pour empêcher les fourmis d’entrer et garder les moustiques échappés. Placer 4 conteneurs de déverrouillage à la verticale dans la glacière d’expédition, la stockinette de chaque contenant étant orientée vers le centre (figure 6C). Glissez du papier bulle entre chaque récipient et au centre pour les stabiliser. Remplissez le reste de l’espace dans la glacière d’expédition avec des coussins d’air ou empilez une deuxième couche de 4 conteneurs de dégagement directement au-dessus de la première couche et stabilisez de la même manière avec des coussins d’air.
NOTA: Les contenants de dégagement doivent être suffisamment stabilisés pour ne pas bouger lorsqu’ils sont secoués. La température à l’intérieur de l’emballage est ambiante. - Préparez la glacière d’expédition pour la livraison. Scellez la glacière d’expédition avec le couvercle ventilé et placez-la dans le suremballage en carton, fermez le ruban adhésif et expédiez-la par express de nuit jusqu’au lieu de libération.
Résultats
Un élevage vigilant et adéquat des moustiques consiste en une disponibilité équilibrée des mâles et des femelles dans les cages des colonies, le maintien d’une solution de saccharose frais et de miel, et une alimentation sanguine constante de haute qualité. Ces conditions permettront d’obtenir des feuilles d’oeufs densément tassées optimales pour une utilisation dans les bacs d’élevage larvaire SIT. L’entreposage et l’utilisation appropriés des feuilles d’œufs séchés, comme l’étiquetage systématique pour faciliter l’utilisation du plus ancien au plus récent, favoriseront l’éclosion uniforme dans toutes les casseroles. Le fait de remplir toutes les cuvettes d’élevage larvaire avec de l’eau avant l’éclosion peut réduire le temps pendant lequel les feuilles d’œufs sont dans les contenants d’éclosion et favoriser un développement sain. L’entretien des bassins larvaires de l’écoutille à la nymphose exige un engagement prudent de la part du personnel de la colonie, car certaines cuvettes peuvent nécessiter plus ou moins de nourriture ou d’eau supplémentaire selon les stades de développement et les variables environnementales. S’il y a des problèmes avec le stade de développement au jour prévu de la séparation des sexes nymphaux, des ajustements doivent être effectués plus tôt dans le processus, tels que l’éclosion plus tôt ou plus tard, l’ajustement de la nourriture ou la modification de la température de l’incubateur.
Le processus d’élevage prévu dans ce protocole ne fait pas éclore tous les œufs à temps pour se transformer en nymphes qui peuvent être irradiées et utilisées à des fins de lutte. Entre 20 et 50% des moustiques élevés dans la colonie seront encore des larves au moment où les pupes devront être séparées. Cependant, ces larves ne sont pas gaspillées, mais laissées à maturité pendant 24 heures pour produire des pupes supplémentaires qui peuvent être combinées avec les pupes femelles de la séparation de la veille et recyclées dans des cages de colonie. Dans les cages de la colonie, les pupes seront autorisées à devenir adultes, à s’accoupler, à nourrir le sang et à produire des œufs qui soutiennent le projet SIT.
La séparation des nymphes, le versement des pupes dans des boîtes de Pétri, l’irradiation et le placement dans des cages de détention pour adultes après l’irradiation doivent se faire en une journée; Par conséquent, suffisamment de temps devrait être alloué pour traiter toutes les étapes confortablement. L’assemblage et la préparation des contenants de déversement doivent être effectués avant le processus de marquage. Lorsque les boîtes d’expédition sont retournées du lieu de mainlevée, les contenants de mainlevée doivent être inspectés et préparés pour leur prochaine utilisation. Jeter les boules de coton humides, aérer les contenants à libération humide, nettoyer les boîtes de Petri, remplacer les mailles et retirer les bandes élastiques du récipient, lorsqu’elles ne sont pas utilisées, prolongera considérablement la durée de vie des contenants de démoulage.
Compte tenu de la réalité mondiale de la pandémie virale de COVID-19, ce protocole, qui est généralement une opération impliquant plusieurs personnes, a été modifié pour être traité par une personne travaillant seule dans un laboratoire à chaque étape. Les étapes du processus qui sont le plus entravées par un scénario impliquant une seule personne sont les étapes de sexage, de marquage, de pesée et d’entretien de l’élevage des colonies. La séparation des pupes par sexe par une personne devrait être suffisante s’il y a plusieurs séparateurs fonctionnant simultanément dans différentes pièces. Dans une situation de pandémie où la distanciation sociale se produit sur le lieu de travail, il est nécessaire d’équiper plusieurs stations pour effectuer les étapes allant du sexage à l’emballage. Selon la vitesse de l’opérateur, il faut une personne ~ 4 h pour sexer 15 000 moustiques, puis 1 à 2 h pour les marquer, les peser et les emballer. Un scénario à deux personnes diminue le temps pendant lequel les moustiques sont anesthésiés pour le marquage et réduit le temps de travail global. Pourtant, même dans un scénario à deux personnes, l’allocation de la totalité des 2,0 g de moustiques par cage de relâchement peut être difficile en raison du temps de travail limité pendant que les moustiques sont sous sédation. Bien que le processus de nettoyage et de préparation du matériel d’élevage des larves et des adultes prenne beaucoup de temps et de main-d’œuvre, il peut être cloisonné de manière à ce que les opérateurs individuels puissent travailler de manière indépendante et en toute sécurité pendant une pandémie.
La libération de mâles adultes, marqués et irradiés d’Aedes aegypti n’entre pas dans le champ d’application de ce protocole, mais elle est présentée brièvement ici. Le processus de libération de moustiques mâles marqués et irradiés commence par la détermination d’une distribution uniforme des contenants de libération en fonction du poids (et donc du nombre présumé de mâles stériles), comme indiqué dans le tableau 3. Une fois les expéditions livrées au district de lutte antivectorielle, les boîtes sont ouvertes et les conteneurs de mainlevée sont évalués pour tout problème de mortalité ou d’état des conteneurs de mainlevée. Les moustiques dans les conteneurs de libération sont ensuite autorisés à s’acclimater à la température et à l’humidité ambiantes pendant 1 à 2 heures avant d’être transportés vers la zone de traitement. Les sites de remise en liberté dans la zone de traitement sont identifiés après une surveillance intensive des points chauds des populations sauvages d’Aedes aegypti. Le moment, la fréquence et la densité des rejets sont équilibrés par la bionomie de l’espèce ainsi que par la météorologie, le soutien du public et les capacités d’élevage en laboratoire.
Étant donné que des contenants de libération spécifiques sont adaptés à des sites de libération particuliers, l’étiquette doit être vérifiée avant que le contenant de démoulage ne soit ouvert en coupant le treillis sur le dessus, ce qui permet à l’opérateur de déformer le treillis de sorte qu’une partie des mâles puisse s’échapper. Cette méthode de libération fractionnée est répétée à chaque point de libération assigné pour le conteneur jusqu’à ce que tous les mâles volant librement aient été relâchés. Ce processus est ensuite répété pour chaque conteneur de rejet à leur emplacement de rejet assigné respectif jusqu’à ce que tous les conteneurs aient été traités. En option, après la libération des moustiques, tous les moustiques morts ou handicapés qui ne sont pas partis librement peuvent être rassemblés dans des boîtes de Petri et étiquetés pour être comptés à la main ou pesés pour corriger le nombre estimé de libérés. Une surveillance continue et généralisée des stades adulte, œuf et immature d’Aedes aegypti sauvage dans la zone cible, et possiblement dans les sites témoins non interventionnels, est effectuée pour évaluer l’efficacité de l’opération SIT.
Discussion
Le lancement d’un programme de contrôle mettant en vedette des TIS utilisant des rayonnements nécessite l’établissement d’une souche locale d’Aedes aegypti. Cette étape est essentielle et peut permettre à SIT de vraiment se distinguer des technologies de contrôle similaires. En développant le projet à partir d’une souche locale de moustique, les mâles générés auront probablement des comportements qui leur permettront de s’adapter aux changements environnementaux et aux signaux et de localiser et de s’accoupler avec les femelles sauvages dans les environs. En outre, la libération de mâles locaux irradiés peut ne pas générer d’opinion publique négative comparée, par exemple, à la libération d’une souche non locale de moustiques génétiquement modifiés qui pourrait, par exemple, introduire de nouveaux allèles dans la population locale de moustiques.
Dépenser des ressources substantielles pour élever de grandes quantités de moustiques seulement pour pouvoir utiliser environ la moitié d’entre eux à des fins de contrôle est une limitation du programme SIT Aedes aegypti . Des améliorations devraient être apportées au protocole d’élevage afin de condenser la maturation des larves dans des délais plus définis lorsque les pupes seront prêtes. Cela permettrait de collecter plus de pupes au moment optimal de la séparation. Cependant, l’ajout de pupes à traiter augmente le risque qu’un plus grand nombre de femelles se nymphosent lorsque les pupes sont collectées et, par conséquent, augmente la probabilité que les femelles se retrouvent dans des boîtes de Petri avec des mâles et éventuellement relâchées. Bien que la durée de vie, le comportement d’alimentation sanguine et le comportement de ponte chez les pupes femelles irradiées Aedes aegypti soient réduits chez les adultes, ce n’est pas une bonne stratégie de relâcher accidentellement les femelles aux côtés des mâles irradiés22. Par conséquent, il devrait demeurer prioritaire de réduire au minimum le nombre de femelles séparées, irradiées, marquées et relâchées par inadvertance avec des mâles.
Le succès d’un programme de TIS repose en fin de compte sur la réussite de la compétition entre partenaires par des mâles irradiés élevés par des colonies. La préservation de la compétitivité des mâles repose sur une sélection exhaustive de la dose dérivée expérimentalement et sur la maximisation du rapport estimé entre mâles stériles/sauvages dans la population. Le choix de la dose est déterminé par plusieurs facteurs clés, notamment la longévité, la fertilité, la fécondité et la mortalité nymphale. Il a été observé que les moustiques mâles présenteront une courbe de fertilité asymptotique qui se rapproche de zéro à mesure que le rayonnement augmente (données non publiées KJL, RLA, SCB). Simultanément, la longévité et les niveaux d’activité des moustiques mâles diminuent de façon exponentielle à mesure que la dose de rayonnement augmente (données non publiées de KJL, RLA, SCB). Par conséquent, plutôt que d’identifier une dose qui donne une stérilité de 99,9% chez les mâles, il est préférable de se concentrer sur un pourcentage de stérilité plus faible tout en soutenant la survie. Une fois qu’une plage de doses est déterminée qui ne différencie pas la longévité ou la mortalité nymphale des mâles irradiés de celle des mâles non irradiés, des évaluations supplémentaires de la fertilité devraient être effectuées pour déterminer une dose qui rend les mâles extrêmement stériles, mais compétitifs.
Simultanément, il est essentiel de comparer le nombre de moustiques mâles dans la population à celui des mâles irradiés relâchés. Cela peut être accompli en recueillant des mâles à divers endroits dans et autour de la zone de libération cible à plusieurs reprises au même endroit et avant, pendant et après le lancement du programme de TS. Une étude de marquage, de remise en liberté et de recapture devrait être menée pour évaluer le rapport entre les moustiques mâles sauvages et les moustiques relâchés. Une étude de marquage, de remise en liberté et de recapture repose sur la libération d’un nombre connu de moustiques marqués à partir d’un point spécifique et leur recapture ultérieure à des points situés à proximité immédiate du point de libération initial. En comparant le nombre de mâles et de mâles sauvages capturés à des distances du point de relâchement, il est possible d’estimer la population sauvage générale de mâles dans la région afin que des ratios compétitifs de mâles stériles puissent être relâchés23. Il est possible de maximiser le rapport entre mâles stériles et sauvages en relâchant davantage de mâles stériles et/ou en réduisant la population sauvage par des moyens de contrôle classiques tels que la réduction à la source, le contrôle immature ou les traitements adulticides.
Pour évaluer l’efficacité des libérations masculines stériles, les collections d’adultes peuvent être comparées chronologiquement à une zone de non-intervention. Au fur et à mesure que les mâles stériles sont relâchés et que le nombre de mâles et de femelles collectés dans une zone diminue par rapport à une zone comparable de non-intervention, on peut supposer que cela est dû au fait que les mâles stériles relâchés réussissent à supplanter les mâles fertiles locaux. Cet effet peut également être observé dans les coupelles de ponte déployées à la fois dans les sites d’intervention et de non-intervention. Les œufs peuvent encore être produits dans le site d’intervention, mais s’ils éclosent moins que ceux du site de non-intervention, on peut supposer qu’ils ne sont pas fécondés parce que les femelles s’accouplent avec des mâles stériles. De plus en plus de pontes d’œufs non fécondés pourraient éventuellement entraîner une réduction de la ponte due au non-remplacement des femelles dans le site d’intervention 8,24.
Les orientations futures de la technologie et des programmes SIT s’étendent naturellement à d’autres espèces de moustiques importantes sur le plan médical. Par exemple, cette technologie peut être facilement adaptée pour contrôler Aedes albopictus, étant donné la bionomie très similaire d’Aedes aegypti et d’Aedes albopictus. D’autres espèces de moustiques vecteurs de maladies d’intérêt comprennent Culex quinquefasciatus, Culex tarsalis et diverses espèces d’anophèles. L’amélioration de l’efficacité de cette technologie dépend de l’augmentation de la capacité des pupes mâles produites à un moment donné, ce qui pourrait être réalisé par manipulation génétique ou sélection artificielle, et de l’amélioration de la compétitivité des mâles, qui pourrait être obtenue en augmentant la virilité, la fertilité ou la longévité.
En fin de compte, les programmes SIT ne sont pas une solution miracle pour contrôler les moustiques. Ils sont plutôt un outil dans une suite d’autres techniques de contrôle, telles que les programmes de GIV, qui compensent de manière croisée les faiblesses entre les techniques. Par exemple, alors que la lutte chimique offre un contrôle rapide et peu coûteux, elle favorise également le développement de la résistance et de la mortalité non ciblée; et bien que la TIS soit propre à l’espèce et qu’elle ne soit pas susceptible de générer de la résistance, les mâles de la SIT doivent être produits et relâchés à perpétuité pour contrôler les populations immigrantes provenant de l’extérieur du district de lutte antivectorielle.
Déclarations de divulgation
Tous les auteurs n’ont déclaré aucun conflit d’intérêts.
Remerciements
Nous remercions les Drs R.-D. Xue, C. Bibbs, W. Qualls et V. Aryaprema du Anastasia Mosquito Control District, St. Augustine, Floride, pour leur partenariat dans l’élaboration du programme SIT et leurs connaissances d’experts sur la libération opérationnelle efficace d’Aedes aegypti mâle stérile. Cette recherche a été soutenue par l’USDA-ARS et le Florida Department of Agriculture and Consumer Services (FDACS). La mention de noms commerciaux ou de produits commerciaux dans cette publication est uniquement dans le but de fournir des informations spécifiques et n’implique pas une recommandation ou une approbation de la part de l’USDA ou du FDACS.
matériels
| Name | Company | Catalog Number | Comments |
| 1-1/8" wrench (1" (1 inch) = 2.54 cm) | Craftsman | CMMT44707 | |
| 1/2 pint cardstock cup (1/2 pint = 236.5 mL) | Science Supplies WLE corp | 1/2 pint | |
| 1/4" tubing - tygon | Hudson Extrusions | LLDPE1/8 X 1/4 BLK | to attach to CO2 gas regulator |
| 1/8" brass barb w/ MIP connection | B&K | BHB-85NLB | to attach to CO2 gas regulator |
| 1000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-1000 | |
| 3000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-3000 | |
| Adult large cage | Bioquip | 1450D | |
| Aspirator vials | Bioquip | 2809V | |
| Bovine liver powder | MP Biomedicals | 290039601 | |
| Brewers yeast | MP Biomericals | 02903312-CF | |
| CO2 regulator | Randor | 64003038 | |
| CO2 tank (20# canister) | Praxair | CDBEVCARB20 | |
| Collection basin | Treasure Gurus | KI-ENAMELBOWL | for separator |
| Cotton balls - large | Fisher Scientific | 22-456-883 | |
| Deli cups w/lids - 470 mL | Pactiv DELItainer | PCTYSD2516 | |
| Deli cups w/lids - 1900 mL | Berry Global | T60764 | |
| DoseReader 4 | ND0.5 and ND1.0 QA Filter Set standards | ||
| Dosimetry film | Far West Technology, Inc. | ||
| Filter paper | Millipore | AP10045S0 | |
| Flashlight aspirator | Bioquip | 2809D | |
| Forceps - fine featherweight | Bioquip | 4748 or 4750 | featherweight |
| GAFchromic | radiochromic film | ||
| Gammator M | Radiation Machinery Corporation, Parsippany, NJ | Cesium-137 irradiator | |
| Hand held mechanical aspirator | Clarke Mosquito | 13500 | |
| Lambskin condoms | Trojan | Naturalamb | |
| Large CO2 chamber | Sterilite | Walmart # 568789514 | |
| Larval rearing pans | Blue Ridge Thermoforming | 01-FG-400-3N-ABS | Dimensions: 22.375 x 17.5 x 3 (inches) |
| Magnets - 20# pull | Master magnetics | MHHH20BX | |
| Marking dye | Dayglo | ECO-11 | Aurora Pink |
| Marking dye | Dayglo | ECO-17 | Saturn Yellow |
| Mesh | Falk | T301 | |
| Pasture pipettes | Thermo Scientific | 02-708-006 | |
| Petri dishes - large | VWR International | 25384-090 CS | |
| Petri dishes - small (60 mm x 15 mm) | Fisher Brand | FB0875713A | |
| Pupa separator | J.W. Hock | 1512 | |
| Red rubber hose | Welch | 331040-5 | |
| Release containers | Science Supplies WLE corp | 1 gallon | |
| Rubber bands - cross #19 | Alliance | ALL37196 | |
| Rubber bands - latitude #64 | Skillcraft | NSN0589974 | |
| Scale | Ohaus | H-4737 | |
| Seed germination paper - Heavy stock 76# | Anchor Paper | #76 | |
| Shipping coolers- 16 x 13 x 12.5" | MrBoxonline.com | Husky Foam Cooler kit | |
| Sieve #20 | Advantech | 20BS8F | |
| Sieve #30 | Advantech | 30BS8F | |
| Small cage - Bug Dorm | MegaView | Bug Dorm-1 | |
| Small CO2 chamber | Mainstays | Walmart # 562922221 | |
| Souffle cup lid | SOLO | 41165277456 | |
| Souffle cups - 4 oz (1 oz = 29.6 mL) | SOLO | 41165024104 | |
| Sponge | ocelo | MMM7274FD | |
| Squeeze bottle | Dynalon | 3UUP6 | |
| Stereoscope | Meiji Techno | EMZ-5 | |
| Stockinette | BSN Medical | 30-1006 | |
| Styrofoam | extruded polystyrene foam | ||
| Tropical fish flake food | Tetra | 4.52 pound | |
| Vaccum chamber - desiccator | BelArt | T9FB892757 | |
| Weigh boats | Globe Scientific | 3621 |
Références
- Moyes, C. L., et al. Contemporary status of insecticide resistance in the major Aedes vectors of arboviruses infecting humans. PLoS Neglected Tropical Diseases. 11 (7), 0005625 (2017).
- Baldacchino, F., et al. Control methods against invasive Aedes mosquitoes in Europe: a review. Pest Management Science. 71 (11), 1471-1485 (2015).
- Burkett, D. A., Cope, S. E., Strickman, D. A., White, G. B. The Deployed Warfighter Protection (DWFP) Research Program: Developing new public health pesticides, application technologies, and repellent systems. Journal of Integrated Pest Management. 4 (2), 1-7 (2013).
- Harwood, J. F., et al. Controlling Aedes aegypti in cryptic environments with manually carried ultra-low volume and mist blower pesticide applications. Journal of the American Mosquito Control Association. 32 (3), 217-223 (2016).
- Morrison, A. C., Zielinski-Gutierrez, E., Scott, T. W., Rosenberg, R. Defining challenges and proposing solutions for control of the virus vector Aedes aegypti. PLoS Medicine. 5 (3), 68 (2008).
- Klassen, W., Curtis, C. F., InDyck, V. A., Hendrichs, J., Robinson, A. S. History of the sterile insect technique. Sterile insect technique: principles and practice in area-wide integrated pest management. , 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector Borne and Zoonotic Diseases. 10 (3), 295-311 (2010).
- Dame, D. A., Curtis, C. F., Benedict, M. Q., Robinson, A. S., Knols, B. G. Historical applications of induced sterilisation in field populations of mosquitoes. Malaria Journal. 8, (2009).
- Bond, J. G., et al. Optimization of irradiation dose to Aedes aegypti and Ae. albopictus in a sterile insect technique program. PloS One. 14 (2), 0212520 (2019).
- Bourtzis, K., Lees, R. S., Hendrichs, J., Vreysen, M. J. B. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations. Acta Tropica. 157, 115-130 (2016).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments: JoVE. , e3579 (2014).
- Carvalho, D. O., et al. Aedes aegypti lines for combined sterile insect technique and incompatible insect technique applications: the importance of host genomic background. Entomologia experimentalis et applicata. 168 (6-7), 560-572 (2020).
- Mamai, W., et al. Aedes aegypti larval development and pupal production in the FAO/IAEA mass-rearing rack and factors influencing sex sorting efficiency. Parasite. 27, 43 (2020).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- . Methods in Aedes Research Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods%20in%20Aedes%20Research%202016.pdf (2016)
- Focks, D. A. An improved separator for the developmental stages, sexes, and species of mosquitoes (Diptera: Culicidae). Journal of Medical Entomology. 17 (6), 567-568 (1980).
- International Atomic Energy Agency. . Manual of Dosimetry in Radiotherapy. Technical Reports Series No. 110. , (1970).
- Aldridge, R. L., et al. Gamma-irradiation reduces survivorship, feeding behavior, and oviposition of female Aedes aegypti. Journal of the American Mosquito Control Association. 36 (3), 152-160 (2020).
- Cianci, D., et al. Estimating mosquito population size from mark-release-recapture data. Journal of Medical Entomology. 50 (3), 533-542 (2013).
- Knipling, E. F. . The basic principles of insect population suppression and management. , (1979).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon