Method Article
Vorbereitung bestrahlter und markierter männlicher Aedes aegypti-Moskitos für die Freisetzung in einem operationellen sterilen Insektentechnikprogramm
In diesem Artikel
Zusammenfassung
Die sterile Insektentechnik (SIT) wird verwendet, um spezifische, medizinisch wichtige Moskitopopulationen zu kontrollieren, die gegen chemische Kontrollen resistent sein können. Hier beschreiben wir eine Methode der Massenaufzucht und Vorbereitung steriler männlicher Moskitos für die Freisetzung in einem operationellen SIT-Programm, das auf die Aedes aegypti-Mücke abzielt.
Zusammenfassung
Die Bekämpfung menschlicher Krankheiten wie Dengue-Fieber, Zika und Chikungunya beruht auf der Kontrolle ihres Vektors, der Aedes aegypti-Mücke , da es keine Prävention gibt. Die Bekämpfung von Moskitovektoren kann sich auf Chemikalien stützen, die auf die unreifen und erwachsenen Stadien angewendet werden, was zur Mortalität von Nichtzielen beitragen und vor allem zu Insektizidresistenzen im Vektor führen kann. Die sterile Insektentechnik (SIT) ist eine Methode zur Kontrolle von Schädlingspopulationen durch die Freisetzung sterilisierter erwachsener Männchen, die sich mit wilden Weibchen paaren, um nicht lebensfähige Nachkommen zu produzieren. Dieser Artikel beschreibt den Prozess der Herstellung steriler Männchen für die Verwendung in einem operationellen SIT-Programm zur Bekämpfung von Aedes aegypti-Moskitos . Hier sind die Schritte beschrieben, die im Programm verwendet werden, einschließlich der Aufzucht und Pflege einer Kolonie, der Trennung männlicher und weiblicher Puppen, der Bestrahlung und Markierung erwachsener Männchen und des Versands von Aedes aegypti-Männchen an die Freisetzungsstelle. Diskutiert werden auch verfahrenstechnische Vorbehalte, Programmbeschränkungen und zukünftige Ziele.
Einleitung
Die Übertragung von durch Moskitos übertragenen Krankheitserregern auf den Menschen verursacht jedes Jahr weltweit Millionen von Krankheitsfällen und Todesfällen. In Ermangelung wirksamer, zugelassener Impfstoffe für durch Moskitos übertragene Krankheiten wie Zika oder Dengue-Fieber besteht eine der wirksamsten Möglichkeiten, die Übertragung zu reduzieren, darin, die Populationen von Krankheitsvektormücken zu reduzieren. Ärgerlich ist, dass immer mehr Mückenarten, die traditionell von Pestiziden bekämpft werden, eine zunehmende Pestizidresistenz aufweisen1. Gleichzeitig haben Regierungsbehörden zuvor zugelassene Pestizide aggressiv abgemeldet oder verboten, und es werden nur wenige neue, wirksame chemische Kontrollmaßnahmen entwickelt 2,3. Diese Konstellation von Hindernissen für die Mückenbekämpfung hat die Erforschung alternativer nicht-chemischer Techniken zur Reduzierung von Moskitopopulationen motiviert.
Bestimmte Mückenarten stellen eine Herausforderung dar, um Fragen der Resistenz und Pestizidregistrierung zu kontrollieren. Aedes aegypti (L.) ist eine prominente Krankheitsvektormücke, die aufgrund des kryptischen perihäuslichen Lebensraums, der von dieser Art für unreife Entwicklung und adultes Ruhen genutzt wird, extrem schwierig durch traditionelles integriertes Vektormanagement zu kontrollieren ist 4,5. Zu den Herausforderungen im Zusammenhang mit der Nutzung des kryptischen Lebensraums um Wohnhäuser gehören die Schwierigkeit, diese Orte mit Pestizidsprühtechniken zu erreichen, sowie die potenzielle mangelnde Akzeptanz der Öffentlichkeit für den wiederholten Zugang zu Privateigentum für Vektorkontrollbehörden der öffentlichen Gesundheit, um die intensiven Überwachungs- und Kontrollaktivitäten durchzuführen, die für ein effektives integriertes Vektormanagement (IVM) für diese Art entscheidend sind.
Glücklicherweise wird SIT, ein Ansatz, der sich für die dauerhafte Bekämpfung anderer sehr anspruchsvoller Insektenarten6 als erfolgreich erwiesen hat, in einer bahnbrechenden Reihe von Experimenten und Betriebsversuchen in St. Augustine, Florida, auf das Aedes aegypti-Problem angewendet (KJL, RLA, SCB unveröffentlichte Daten). SIT wurde auf eine Reihe von Insektenarten, einschließlich Moskitos, angewendet und in der Tiefeüberprüft 7,8. SIT nutzt die Massenfreisetzung von paaraufgezogenen Männchen, die beispielsweise durch ionisierende Strahlung oder Chemikalien sterilisiert wurden, um die Partnerwahl natürlicher Populationen von Weibchen zu überwältigen. Sterilisierte Männchen, die sich mit wilden Weibchen paaren, machen die Eier aufgrund von Schäden an männlichen Gameten unfruchtbar und können, wenn sie in ausreichender Anzahl vorhanden sind, theoretisch die natürliche Aedes aegypti-Population zum Absturz bringen.
Ein SIT-Programm wurde initiiert, um zu versuchen, die Populationen von Aedes aegypti in einem städtischen Gebiet an der Atlantikküste Floridas zu reduzieren, wo diese Art kürzlich wieder besiedelt wurde und sich ausbreitet und ein Risiko für die öffentliche Gesundheit für die Übertragung von Viren wie Zika, Dengue oder Chikungunya darstellt. Um das Potenzial für die Kompatibilität mit wilden Weibchen zu maximieren, wurde eine neue Kolonie mit wild gefangenen Aedes aegypti aus der Zielpopulation gegründet, um Männchen für das Programm9 zu produzieren. Dies basierte auf der Hypothese, dass lokal abgeleitete, kolonieaufgezogene Männchen eher mit lokalen wilden Männchen um die Paarung mit lokalen wilden Weibchen konkurrieren würden. Damit die SIT wirksam ist, muss nicht nur eine überwältigende Anzahl steriler Männchen im Zielgebiet anwesend sein, sondern sie müssen auch in der Lage sein, lokale wilde weibliche Moskitos effektiv zu umwerben und sich mit ihnen zu paaren.
Eine Reihe von Experimenten wurde durchgeführt, um die optimale Anzahl steriler Männchen zu bestimmen (KJL, RLA, SCB unveröffentlichte Daten) sowie optimale Strahlendosen, die die Männchen unfruchtbar machen würden, ohne das Überleben, das Verhalten oder die Akzeptanz durch wilde Weibchen zu beeinträchtigen (KJL, RLA, SCB unveröffentlichte Daten). Diese Daten werden in verwandten Publikationen dieser Gruppe veröffentlicht, aber einige dieser Ergebnisse sind auch in diesem Protokoll erfasst und könnten als Ausgangspunkt für neue SIT Aedes aegypti-Kontrollprogramme anderswo verwendet werden. Diese Art erweitert ständig ihr Verbreitungsgebiet, und SIT-Programme sind vielversprechend, um kostengünstige, langfristige Lösungen zur Kontrolle dieser Population zu sein. Das Ziel dieses Protokolls ist es, sterilisierte, männliche, kolonieaufgezogene Aedes aegypti-Mücken für die systematische Freisetzung in Außenbereiche herzustellen, um die natürlichen Fortpflanzungszyklen lokaler Aedes aegypti-Populationen in einem operationellen Programm zur Kontrolle von Vektoren im Bereich der öffentlichen Gesundheit zu stören.
Während ähnliche Protokolle und Arbeitsabläufe für die Produktion transgener Aedes aegypti-Männchen veröffentlicht wurden und Produktionsabläufe für Aedes SIT oder Wolbachia-basierte Inkompatibilitätsprogramme an anderer Stelle veröffentlicht wurden, veranschaulicht dieses Protokoll, wie bestehende Protokolle für die Produktion, Trennung und Bestrahlung männlicher Puppen, die Kennzeichnung und Verpackung erwachsener Männchen und den Versand an die Freisetzungsstelle für dieses Programm angepasst wurden9. 10,11,12,13,14,15,16,17,18. Die Markierungskomponente dieses Protokolls ist in einem ausgereiften operationellen SIT-Programm möglicherweise nicht erforderlich. Es wurde jedoch hier aufgenommen, weil es eine Möglichkeit ist, die Wirksamkeit zu überwachen und die Qualität des gesamten Prozesses in den ersten Jahren der Einrichtung des SIT-Programms zu kontrollieren. Moskitobekämpfungsprogramme werden in der Regel von lokalen Behörden durchgeführt, so dass sie in vielen Aspekten ihrer Organisation stark variieren können, von Größe und Finanzierungsbasis bis hin zur Feinabstimmung von Kontrolltaktiken, um den lokalen Erfolg zu maximieren. Daher sollte das hierin beschriebene Protokoll auf Kompatibilität mit verfügbaren Ressourcen bewertet werden.
Protokoll
HINWEIS: Dieses Protokoll ist spezifisch für die Handhabung von Aedes aegypti , kann aber modifiziert werden, um für andere Mückenarten wirksam zu sein.
1. Produktion und Pflege einer Aedes aegypti Kolonie
- Hintere erwachsene Aedes aegypti und produzieren Eier.
- Bereiten Sie einen 0,6 m x 0,6 m x 0,6 m großen zusammenklappbaren Aluminiumrahmen, einen großen Aufzuchtkäfig mit 20 x 20 Glasfasergitter und eine Stockinette-Hülle an einer vertikalen Wand vor.
- Stellen Sie eine 1900-ml-Plastikwanne mit Aedes aegypti-Puppen (Geschlechterverhältnis 1: 1) in jeden Aufzuchtkäfig, binden Sie den Ärmel zu und lassen Sie die Becher zur Eklosion an Ort und Stelle, bis keine Erwachsenen mehr auftauchen (dh ca. 4 Tage). Entfernen Sie zu diesem Zeitpunkt die Becher und halten Sie die Aufzuchtkäfige für Erwachsene bei 28-30 °C, >50% relativer Luftfeuchtigkeit (Rh) und einem Hell-Dunkel-Zyklus (L:D) von 12:12 oder 14:10.
ANMERKUNG: Die Herstellung von Aedes aegypti-Puppen wird in Abschnitt 1.2 beschrieben. Die Dichte der Puppen in der 1900-ml-Wanne sollte so sein, dass genügend Platz für alle Puppen vorhanden ist, um gleichzeitig nach Luft zu kommen. - Vierundzwanzig Stunden, nachdem die Puppen in die Aufzuchtkäfige gelegt wurden, stellen Sie einen Behälter mit 10% iger Saccharoselösung mit einem Schwammdocht auf und hängen Sie einen 10 cm x 2 cm in Honig getränkten Schwamm an einem Drahthaken in jedem Käfig auf, um erwachsenen Moskitos separate Flüssigkeits- und Nahrungsquellen zu bieten. Überwachen Sie die Schwämme und den Saccharosebehälter auf Trockenheit oder Schimmelbildung und füllen oder ändern Sie sie nach Bedarf.
HINWEIS: Verwenden Sie einen 120-ml-Kunststoffbecher mit einem 10 cm x 2 cm großen Schwammdocht, der durch einen Ausschnitt im Deckel in kleinen Aufzuchtkäfigen angebracht ist, und einen 460-ml-Kunststoffbecher mit einem Schwammdocht von 12 cm x 8 cm in großen Käfigen. - Geben Sie jedem Aufzuchtkäfig 48-72 h nach dem Schlüpfen der Mehrheit der Erwachsenen und danach alle 2-3 Tage eine Blutmahlzeit, um eine hohe Anzahl von blutgefütterten Weibchen aufrechtzuerhalten, um den Eierertrag zu maximieren. Füllen Sie ein Lammfellkondom mit 50-100 ml defibriniertem Rinderblut und erwärmen Sie es auf ca. 37 °C in einem heißen Wasserbad. Verwenden Sie dann ein Tuch oder Papiertuch, um das Kondom abzutupfen und teilweise zu trocknen, bevor Sie es für 30-60 Minuten auf eine mit Papier ausgelegte Petrischale im Käfig legen.
HINWEIS: Spülen Sie vor Gebrauch die Innen- und Außenseite jedes Kondoms 2-3x mit Wasser ab, um Gleitmittel oder andere Substrate zu entfernen, und prüfen Sie auf Löcher. Kondome können für 3-5 Fütterungen wiederverwendet werden, indem das Blut ausgespült und in einer Tasse kaltem Wasser aufbewahrt wird. Da es bei einigen Kolonien zu Ameisenbefall kommen kann, müssen Kondome möglicherweise ausgesetzt werden, um den Zugang zu beschränken. - Warten Sie 48-72 h nach jeder Blutfütterung und führen Sie dann einen Eiablagebecher in jeden erwachsenen Aufzuchtkäfig ein. Bereiten Sie die Eiablagebecher vor, indem Sie 200 ml gefiltertes Puppenwasser (d. H. Die Wasserlarven und Puppen wurden aufgezogen) in einen 460-ml-Kunststoffbecher geben, der mit einem 8-10 cm hohen x 30 cm breiten Blatt Samenkeimpapier (Eiablagepapier) versehen ist, das bündig entlang des inneren Umfangs des Bechers angebracht ist. Überprüfen Sie die Eiablagepapiere täglich, ersetzen Sie sie alle 2-4 Tage und lagern Sie die eibeladenen Eiablagepapiere sorgfältig, indem Sie sie 24-48 h bei >50% Rh19 trocknen lassen.
HINWEIS: Lassen Sie die Eiablagebecher nicht länger als 72 h in den Aufzuchtkäfigen, um zu verhindern, dass die Eier schlüpfen. - Pflegen Sie die Aufzuchtkäfige für Erwachsene bis zu 3-4 Wochen, bevor Sie sie abbauen und neue Aufzuchtkäfige für Erwachsene einrichten.
- Um einen Aufzuchtkäfig abzubauen, entfernen und reinigen Sie den Eiablagebecher, lagern Sie das mit Eiern beladene Eiablagepapier, entfernen und reinigen Sie den Saccharoselösungsbehälter und den Honigschwamm und frieren Sie den Käfig ein, um alle Moskitos zu töten.
- Entfernen Sie alle Moskitokörper und reinigen Sie die Innen- und Außenseite jedes Käfigs gründlich mit verdünnter Seife und Wasser mit Papiertüchern und Scheuerschwämmen mit Schwämmen. Lassen Sie den sauberen Käfig mindestens 24 Stunden trocknen, bevor Sie ihn im nächsten Aufzuchtzyklus verwenden.
HINWEIS: Verwenden Sie Vakuumgeräte, die mit einer hocheffizienten Filtration ausgestattet sind, um Partikel zu entfernen, die zu Allergien führen können. Saccharoselösungsbehälter können 3-5x gereinigt und wiederverwendet werden.
- Aufzucht von Aedes aegypti-Larven aus Eiern
- Bereiten Sie einen Vorrat an Larven-Nährstoffschlamm vor, indem Sie 80 g eines Verhältnisses von Rinderleberpulver:Bierhefe im Verhältnis 3:2 in 2200 ml Leitungswasser mischen. Bereiten Sie pulverisiertes Fischfutter zu. Fischflocken in eine Gewürzmühle gießen und mahlen, bis ein feines Pulver entsteht.
HINWEIS: Diese Gülle wird in diesem Labor als braun bezeichnet. - Schneiden Sie mit eibeladenem (5.000-10.000 Eier) Eiablagepapier aus Schritt 1.1.5 einen 3-7 cm großen Teil des Eipapiers senkrecht zur Eiablagelinie ab und legen Sie ihn in einen 460-ml-Behälter, der zur Hälfte mit Leitungswasser gefüllt ist, zusammen mit einer Prise pulverisierter Fischfutterflocken. Abdecken und mindestens 1 min kräftig rühren.
HINWEIS: Eipapier muss mindestens 7 Tage (aber nicht länger als 90 Tage, was das Schlüpfen reduzieren kann) nach der Eiablage gelagert werden, bevor der Schlupfprozess eingeleitet wird, um die Embryonation zu ermöglichen. Bakterien und Algen, die im Fischfutter vorhanden sind, entsauerstoffarmen das Wasser schnell, was die Larvenentwicklung auslöst. - Gießen Sie den gesamten Inhalt des Behältnisses aus Schritt 1.2.2 in eine Larvenaufzuchtpfanne, die mit 3 L Leitungswasser und 50 ml brauner Gülle vorbereitet wurde. Markieren Sie die Pfanne mit Startdatum, Stamminformationen, dem Fütterungsplan gemäß Tabelle 1 und lagern Sie sie bei 28-30 °C, >50% Rh und 12:12 oder 14:10 L:D Zyklus.
HINWEIS: Das Verhältnis von 3 L Wasser zu 50 ml Braun basiert auf der Wassertiefe in den jeweiligen Larvenpfannen, die in der Materialtabelle aufgeführt sind. Unterschiedlich große Pfannen unterstützen unterschiedliche Puppendichten und benötigen daher unterschiedliche Mengen an Wasser und brauner Gülle. Die Larvenfütterungsraten in Tabelle 1 sind als Bereich angegeben; Die Auswahl der verwendeten Menge basiert auf Erfahrung und Bestimmung der allgemeinen Gesundheit der sich entwickelnden Larven unter Verwendung von Variablen wie Wassertrübung, Farbe und Geruch; Vorhandensein von Bakterienfilm auf dem Wasser; Anzahl oder Verhältnis von lebenden und toten Larven; und die Beweglichkeit von Larven. An den Tagen 3 bis 6 füttern Sie unreife Moskitos pulverisiertes Fischfutter gemäß Tabelle 1. Das Hinzufügen von Wasser, das Reduzieren von Nahrung und das Aufstellen von 2-3 zusätzlichen Pfannen, als das Projekt erfordert, sind Möglichkeiten, ungesunde Larvenpfannen zu verwalten.
- Bereiten Sie einen Vorrat an Larven-Nährstoffschlamm vor, indem Sie 80 g eines Verhältnisses von Rinderleberpulver:Bierhefe im Verhältnis 3:2 in 2200 ml Leitungswasser mischen. Bereiten Sie pulverisiertes Fischfutter zu. Fischflocken in eine Gewürzmühle gießen und mahlen, bis ein feines Pulver entsteht.
| Tag | Volumen Nährstoff-Gülle hinzugefügt | Volumen Wasser hinzugefügt | Aktionen |
| 1 | 50 mL (Gülle) | 3000 ml | |
| 2 | (kein Essen) | (kein Wasser) | |
| 3 | 1/4 - 1/2 TL (pulverisiertes Fischfutter) | 500-1000 ml | |
| 4 | 1/2 - 3/4 TL (pulverisiertes Fischfutter) | 500-1000 ml | |
| 5 | 1/2 - 3/4 TL (pulverisiertes Fischfutter) | 500-1000 ml | |
| 6 | 1/4 - 1/2 TL (pulverisiertes Fischfutter) | 500-1000 ml | |
| 7 | (kein Essen) | (kein Wasser) | Stammpuppen und Larven |
Tabelle 1: Fütterungsschema für die Massenaufzucht von Aedes aegypti-Larven.
2. Trennung männlicher Aedes aegypti-Puppen
- Konzentriere Puppen aus den Larvenpfannen. Sobald der ungefähre Schwellenanteil der Puppen erreicht ist, gießen Sie den Inhalt jeder Pfanne durch ein Sieb (Größe 20-40). Verwenden Sie eine Quetschflasche mit Leitungswasser, um die Puppen und Larven aus dem Sieb in einen 3000 ml Messglasbecher zu waschen.
HINWEIS: Nur 2-3 Larvenpfannen sollten auf jedes 3000-ml-Becherglas übertragen werden, um eine Überfüllung zu vermeiden, damit die Puppen die Oberfläche bequem erreichen können. Es wird erwartet, dass sich Puppen zwischen 130 und 140 Stunden nach dem Schlüpfen des Eies unter den in Schritt 1.2.3 genannten Temperatur- und Lichtbedingungen entwickeln. Erwarten Sie ein auffälliges Schlüpfen der Eier am selben Tag, an dem die Eier aufgestellt werden. Abhängig von den Umweltbedingungen haben sich etwa 20-70% der Larven verpuppt und sind innerhalb von 6 Tagen gesiebt. Die Aufteilung der Puppen auf mehrere 3000-ml-Becher gewährleistet überschaubare Volumina, die in den Separator gegossen werden können. - Trennen Sie männliche Puppen von den Larven und weiblichen Puppen.
HINWEIS: Dieser Schritt kann von einem oder zwei Operatoren ausgeführt werden.- Für einen einzelnen Bediener, der männliche Puppen trennt:
- Teilen Sie den Inhalt jedes in Schritt 2.1 erzeugten 3000-ml-Becherglases in mehrere 1900-ml-Kunststoffbehälter auf, um das Verschütten und die Überlastung des Separators zu reduzieren. Bereiten Sie den Plattenseparator vor, indem Sie einen starren, flachen 4000-ml-Auffangbehälter unterhalb der Schleuse an der Basis des Separators platzieren (Abbildung 1). Füllen Sie zwei 3000 mL abgestufte Kunststoffbecher etwa 3/4 voll Leitungswasser.
HINWEIS: Verwenden Sie einen Waschbeckenschlauch als Alternative zu den 3000-ml-Messbechern aus Kunststoff. Andernfalls müssen Becher während des gesamten Trennprozesses kontinuierlich nachgefüllt werden. Weitere Einzelheiten zur Bedienung des Puppenseparators finden Sie in den Referenzen12,20. - Gießen Sie Wasser durch den Raum zwischen den Glasplatten und stellen Sie die oberen und unteren Knöpfe im Uhrzeigersinn oder gegen den Uhrzeigersinn ein, damit Wasser kontinuierlich durchfließen kann, während gleichzeitig stehendes Wasser bis zu einer Höhe von etwa 1,25 cm von der Basis der Platten erzeugt wird. Markieren Sie die Startpositionen der unteren Knöpfe mit Klebeband. Sobald stehendes Wasser gleichmäßig über die Basis der Glasplatten mit gleicher Höhe und Abflussrate verteilt ist, beginnen Sie, den Inhalt der Behälter von Puppen und Larven durch den Raum zwischen den Platten zu gießen.
HINWEIS: Es sollte eine klare Trennung zwischen kleinen (männlichen) und großen (weiblichen) Puppen vorhanden sein; Andernfalls spülen Sie diese Charge durch und stellen Sie die oberen Knöpfe ein, um den Abstand zwischen den Platten zu verringern. - Während Sie langsam Wasser durch den Separator gießen, drehen Sie die unteren Knöpfe kontinuierlich als Paar gegen den Uhrzeigersinn ~1-2 cm von der mit Klebeband markierten Startposition, bis die meisten oder alle Larven durchgewaschen sind und die Schleuse hinunter in den Auffangbehälter gerutscht sind.
HINWEIS: Während eine Hand zum Eingießen von Wasser verwendet wird, dreht die andere Hand die Knöpfe nacheinander, aber gleichmäßig und in kleinen Schritten, um die Platten langsam zu öffnen. Die meisten Larven werden schnell durchgespült, aber es werden einige Larven mit den männlichen Puppen gefangen. Diese Nachzüglerlarven werden bestrahlt, bleiben aber in der Entwicklung zurück und nähern sich nicht Erwachsenen mit der fokalen Kohorte der Puppen. - Entsorgen oder recyceln Sie die Larven zurück in die Kolonie, aber in beiden Fällen entfernen Sie sie aus dem Sammelbehälter, bevor die männlichen Puppen beginnen, den Separator zu waschen. Pausieren Sie den Prozess, indem Sie den Wasserfluss stoppen, während der Sammelbehälter am Boden der Schleuse von Larven befreit wird, indem er durch ein Sieb # 30 gegossen wird, das in einen separaten Behälter zurückgespült wird.
HINWEIS: Larven fließen zuerst durch, gefolgt von männlichen Puppen und schließlich den Weibchen (Abbildung 1). - Gießen Sie weiter Wasser und drehen Sie die unteren Knöpfe, bis die männlichen Larven durchgewaschen und in den Auffangbehälter getrennt sind. Pausieren Sie den Prozess, um nach Larven zu suchen und diese aus dem Sammelbehälter zu entfernen, bevor Sie die männlichen Puppen im nächsten Schritt übertragen.
HINWEIS: Die Anzahl der Spülungen, die zum Trennen der Männchen erforderlich sind, hängt vom Tempo des Wassergusses und der Geschwindigkeit ab, mit der die Knöpfe gedreht werden. Es braucht normalerweise 2000-2500 ml Wasser, um die Larven auszuspülen, 1000-1500 ml, um die männlichen Puppen auszuspülen, und 200-400 ml, um die weiblichen Puppen auszuspülen. - Gießen Sie die männlichen Puppen aus dem Sammelbehälter durch ein #20-Sieb über ein Waschbecken. Verwenden Sie eine 1000-ml-Quetschflasche mit Leitungswasser, um die männlichen Puppen aus dem Sieb zurückzuspülen, während Sie sie in einen separaten 1900-ml-Behälter gießen.
- Sobald alle männlichen Puppen getrennt wurden, gießen Sie weiter Wasser durch den Separator und stellen Sie die unteren Knöpfe so ein, dass sie durch die weiblichen Puppen gespült werden. Die Weibchen werden mit dem in Schritt 2.2.1.6 beschriebenen Siebverfahren in einen separaten Behälter überführt, bis alle unreifen Mücken aus dem Separator gespült sind. Verwerfen Sie die weiblichen Puppen. Sobald die Charge verarbeitet wurde, bringen Sie die Knöpfe in ihre ursprüngliche Ausgangsposition zurück und wiederholen Sie den Vorgang mit der nächsten Charge. Sobald alle Chargen verarbeitet sind, lassen Sie die Platten offen, damit der Separator trocknen kann.
HINWEIS: Es gibt keine perfekte Trennung mit diesem Gerät, was Geduld und Übung erfordert. Hartnäckige Puppen oder Larven können mit einem starken Wasserfluss entfernt werden, aber nicht in dem Maße, dass sie zu den Seiten gedrückt werden, was zukünftige Überschwemmungen kontaminieren könnte.
- Teilen Sie den Inhalt jedes in Schritt 2.1 erzeugten 3000-ml-Becherglases in mehrere 1900-ml-Kunststoffbehälter auf, um das Verschütten und die Überlastung des Separators zu reduzieren. Bereiten Sie den Plattenseparator vor, indem Sie einen starren, flachen 4000-ml-Auffangbehälter unterhalb der Schleuse an der Basis des Separators platzieren (Abbildung 1). Füllen Sie zwei 3000 mL abgestufte Kunststoffbecher etwa 3/4 voll Leitungswasser.
- Für zwei Bediener, die die männlichen Puppen trennen, wird Abschnitt 2.2.1 wie folgt geändert.
- Erster Bediener: Gießen Sie Wasser durch den Separator und drehen Sie die Knöpfe inkrementell, um Larven, männliche Puppen und weibliche Puppen zu trennen.
- Zweiter Bediener: Sobald jede Stufe in den Schleusenbehälter gesammelt wurde, sieben Sie den Inhalt des Schleusenbehälters aus, um die Larven, männlichen Puppen und weiblichen Puppen in mehrere, separate Schleusensammelbehälter aufzuteilen. Halten Sie die großen Becher mit Wasser gefüllt, wenn kein Waschbeckenschlauch verfügbar ist.
- Für einen einzelnen Bediener, der männliche Puppen trennt:
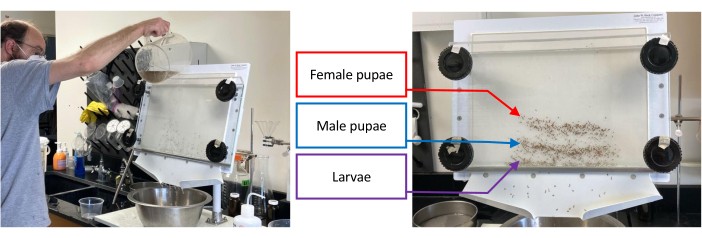
Abbildung 1: Puppenseparator, der eine Charge unreifer Aedes aegypti enthält. Die Trennung beginnt mit dem Gießen von Wasser durch den Separator, wobei die unteren Knöpfe um 1-2 cm gegen den Uhrzeigersinn gedreht werden, bis das Zielset, d.h. Larven, männliche Puppen oder weibliche Puppen, so weit wie möglich von den verbleibenden Sätzen isoliert wurde (linkes Bild). Das rechte Bild zeigt die Trennung von Larven (unteres Band), männlichen Puppen (mittleres Band) und weiblichen Puppen (oberes Band). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Vorbereitung männlicher Aedes aegypti-Puppen zur Bestrahlung
- Teilen Sie die männlichen Puppen in 60 mm Petrischalen aus Kunststoff auf.
HINWEIS: Die Anzahl der benötigten Petrischalen hängt davon ab, wie viele männliche Puppen zur Bestrahlung zur Verfügung stehen: Eine Larvenaufzuchtpfanne aus Schritt 1.2 füllt etwa 1,5 Petrischale. Das Alter der Puppen reicht von 1 bis 40 h alt. In diesem Protokoll wird die tiefere Hälfte der Petrischale mit kleinerem Durchmesser als Boden und die flachere Hälfte mit größerem Durchmesser als Oberseite bezeichnet.- Bereiten Sie vorgeschnittene Scheiben aus Filterpapier vor, um den Innendurchmesser des Petrischalenbodens anzupassen. Legen Sie eine wasserangefeuchtete Filterpapierscheibe in jeden der Böden der Petrischale, um die Puppen während des Transports und des Bestrahlungsprozesses hydratisiert zu halten.
- Übertragen Sie die Puppen in Petrischale. Die in Schritt 2.2.1.6 gesammelten männlichen Puppen mit einem Sieb abseihen und die Puppen mit möglichst wenig Wasser in ein 1000 ml Messglas waschen. Gießen Sie die Puppen vorsichtig in Petrischale, bis jede Filterpapierscheibe gleichmäßig mit einer einzigen Puppenschicht bedeckt ist (Abbildung 2A - C). Ordnen Sie die Petrischalen an der Tischkante in einer Reihe an, um das Einschenken zu erleichtern.
HINWEIS: Eine Alternative zum Belasten der Puppen besteht darin, die Spitze einer 3-ml-Pasteur-Pipette aus Kunststoff auf einen Durchmesser zu schneiden, der groß genug ist, um die Puppen aufzunehmen. Mit der Pipette werden die Puppen aus dem in Schritt 2.2.1.6 hergestellten Behälter direkt auf die Filterpapierscheiben übertragen, so dass sich in jeder Petrischale eine einzige, dicht gepackte Puppenschicht befindet. Dies ist nur für kleine Chargen praktisch. - Verwenden Sie eine unveränderte 3-ml-Pasteur-Pipette, um stehendes Wasser vom Petrischalenboden zu entfernen, um Puppenbewegungen während des Geschlechtsschritts (3.2) und des Transports zu verhindern.

Abbildung 2: Überführung von Puppen auf Petrischalen zur Bestrahlung . (A) Gesiebte Puppen werden gegossen und in ein 1000-ml-Plastikbecherglas zurückgespült. (B) Im Becherglas wird nur minimales Wasser zurückgehalten, um das Eingießen in Petrischalen zu erleichtern. (C) Petrischale, die am Rand einer Oberfläche aufgereiht sind, um das Eingießen in eine einzelne Schicht Puppen zu erleichtern. (D) Mit Puppen beladene Petrischalen werden gestapelt und für die Lieferung an die Bestrahlungsanlage gesichert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Sex die Puppen, um nach Kontamination mit Weibchen zu suchen. Verwenden Sie unter einem Sezierfernrohr Sonden, um jede Puppe zu drehen, um die ventrale Oberfläche auf einen großen Genitallappen zu überprüfen (Abbildung 3), der auf das männliche Geschlecht hinweist. Entfernen und entsorgen Sie die Puppen mit reduzierten oder kleinen Genitallappen, die auf Weibchen hinweisen, und ersetzen Sie sie durch eine gleiche Anzahl männlicher Puppen, um die korrekte Anzahl beizubehalten.
HINWEIS: In einem operationellen Programm ist dieser Schritt aufgrund der großen Anzahl von Moskitos und der Tatsache, dass Trennung, Transfer, Bestrahlung und Vorbereitung von Käfigen nach der Bestrahlung an einem Tag mit begrenzter Zeit durchgeführt werden, nicht praktikabel. Insbesondere in frühen Phasen der Entwicklung des SIT-Programms kann eine Probe von ausgewählten Petrischalen überprüft werden.
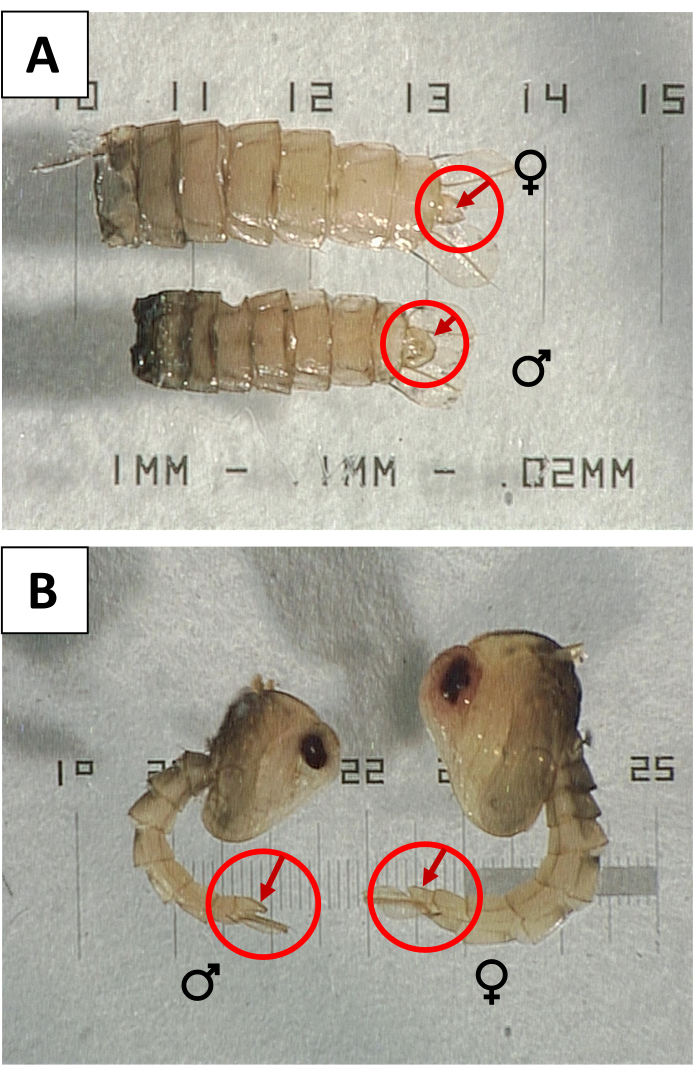
Abbildung 3: Geschlechtsbestimmung von Puppen anhand des Genitallappens . (A) Ventrale und (B) Seitenansichten von weiblichen () und männlichen (♀ ♂) Aedes aegypti-Puppen , wobei Genitallappen den Geschlechtsdimorphismus zeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Bedecken Sie die Böden mit den Oberseiten der Petrischalen und sichern Sie sie mit Laborband. Bündeln Sie die verklebten Petrischalen mit elastischen Bändern in Stapeln, die so dimensioniert sind, dass sie in die Bestrahlungskammer passen, und verschließen Sie sie in einem beschrifteten 3,8-Liter-wiederverschließbaren Beutel (Abbildung 2D). Lassen Sie die Puppen nicht für >1 h unbedeckt bleiben.
4. Bestrahlung männlicher Aedes aegypti-Puppen
- Bereiten Sie Dosimetriefolie aus derselben Charge vor, indem Sie 1 cm2 Quadrate Folien schneiden und jedes Quadrat in seine individuelle Hülle legen.
HINWEIS: Alle Filme, die an jedem Tag verwendet werden, werden zur gleichen Zeit geschnitten. Dies reduziert die geringe Variation, die durch die Lagerung induziert wird. Die Anzahl der Quadrate, die für jeden Stapel benötigt werden, beträgt 1 + (Anzahl der Petrischale). - Bereiten Sie ein Kit für die Bestrahlungseinrichtung vor, das einen Labortimer, ein Laborband, einen Permanentmarker, vorbereitete Hüllen mit Dosimetriefolie, einen Dosimetrieausweis und ein Labornotizblatt mit Checklisten enthalten sollte, um die wichtigsten Informationen zu verfolgen (Abbildung 4).
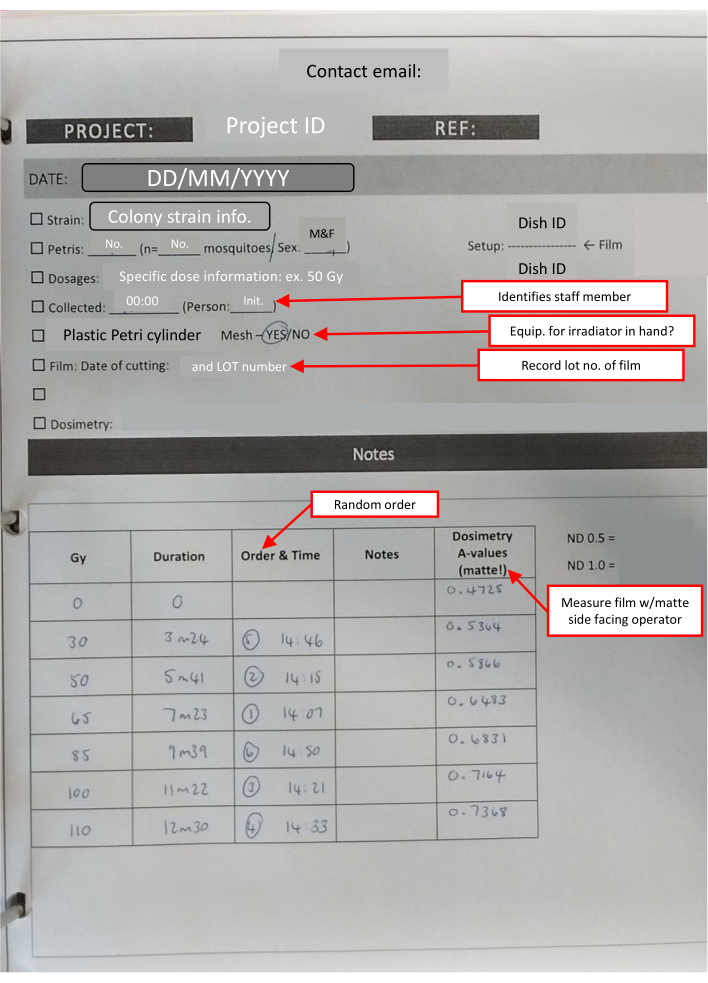
Abbildung 4: Laborbuch-Gliederungs-IR-Blatt für einen Dosis-Wirkungs-Set. Rot umrandete Textfelder (durch rote Pfeile gekennzeichnet) weisen auf nützliche Hinweise zu den verschiedenen Abschnitten hin und wiederholen wichtige Informationen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Transport der Puppen zur Bestrahlungsanlage. Die Petrischalen männlicher Puppen aus Schritt 3.3 in isolierte Behälter geben und während des Transports vor direkter Sonneneinstrahlung und Klimaanlage lagern.
- Bereiten Sie Stapel von Petrischalen für die Bestrahlung am Bestrahlungsgerät vor. Stapeln Sie die entsprechende Anzahl von Petrischalen in die Bestrahlungskammer mit einer Dosimetriefolienhülle, die zwischen jeder Schale und oben und unten des Stapels zentriert ist. Sichern Sie die Umschläge und den gesamten Stapel mit Laborband, um Verschütten zu verhindern und die Platzierung des Stapels in der Kammer zu erleichtern.
- Bestrahlen Sie die Petrischalen männlicher Puppen. Legen Sie den Stapel Petrischalen auf das starre Metallnetz in der Kammer, um ihn in der richtigen Höhe für den optimalen Expositionskegel basierend auf der vorherigen Dosiszuordnung der spezifischen Bestrahlungseinheit21 zu positionieren. Aktivieren Sie den Drehteller am Bestrahlungsgerät und bestrahlen Sie gleichzeitig, wodurch der Labortimer gestartet wird. Bestrahlen Sie für das geeignete Intervall, um die gewünschte Dosis zu erreichen (Beispiele sind in Tabelle 2 dargestellt).
HINWEIS: Dieses Protokoll basiert auf einem Cäsium-137-Bestrahlungsgerät (siehe Materialtabelle) und einer Zieldosis von 50 Gy. Da Cs-137 im Laufe der Zeit zerfällt, wird die Dosisleistung jedes Jahr angepasst, indem eine Dosis-Wirkungs-Serie mit Alanindosimetern durchgeführt wird, ergänzt mit radiochromem Film für die Routinedosimetrie und Alanin in etwa 10% der bestrahlten Proben. Bei der aktuellen Dosisleistung von 8,8 Gy/min erfordert das Erreichen der Zieldosis von 50 Gy eine Exposition von 5 min und 41 s. Die routinemäßige Filmdosimetrie erfolgt wie in Schritt 4.7 beschrieben. Die Alanin-Pellet-Dosimetrie wird entweder am National Center for Electron Beam Research der Texas A&M University oder am National Institute of Standards and Technology in Gaithersburg, MD, USA, durchgeführt.
| Dosierung (Gy) | Zeit (basierend auf 8,8 Gy/min) |
| 0 | NA |
| 10 | 1 Min. 8 Sek. |
| 30 | 3 Min. 24 Sek. |
| 50 | 5 Min. 41 Sek. |
| 65 | 7 Min. 23 Sek. |
| 85 | 9 Min. 39 Sek. |
| 100 | 11 Min. 22 Sek. |
| 110 | 12 Min. 30 Sek. |
Tabelle 2: Beispiel-Dosierungszeiten für den Cäsium-137-Bestrahlungsgerät.
- Nach Ablauf der vorgeschriebenen Zeit nehmen Sie die Petrischalen aus dem Bestrahler und zerlegen den Stapel vorsichtig. Beschriften Sie alle Petrischalen und Filmumschläge mit Datum und Ort im Stapel. Verschließen Sie die Umschläge und bewahren Sie sie für die Dosimetrie auf. Verpacken Sie die Petrischalen in den isolierten Behälter für den Transport zurück ins Hauptlabor.
HINWEIS: Notieren Sie, ob Erwachsene während der Bestrahlung aufgetaucht sind, und markieren Sie die betroffene Petrischale, damit die Erwachsenen nicht entkommen, wenn die Puppen in die Aufzuchtkäfige gesetzt werden (Schritt 5.2). - Bestätigen Sie die Bestrahlungsdosis mit einem Dosimetriefilm, indem Sie den Film ca. 24 h nach der Belichtung messen. Aktivieren Sie den Dosimetrieleser und lassen Sie ihn auf Raumtemperatur ausgleichen. Legen Sie den Film mit einer mit dem Lesegerät gelieferten Pinzette ein und befolgen Sie die Anweisungen des Herstellers zum Lesen des bestrahlten Films sowie des unbestrahlten Rohlingsfilms aus derselben Charge. Stellen Sie das Lesegerät ohne Film zwischen den Messwerten auf Null und zeichnen Sie die Daten wie im Beispieldatenblatt in Abbildung 5 auf.
HINWEIS: Dieses Protokoll basiert auf den Standards ND0.5 und ND1.0 QA Filter Set. Es ist wichtig, die Folie mit der matten Seite zu messen, die dem Bediener zugewandt ist.
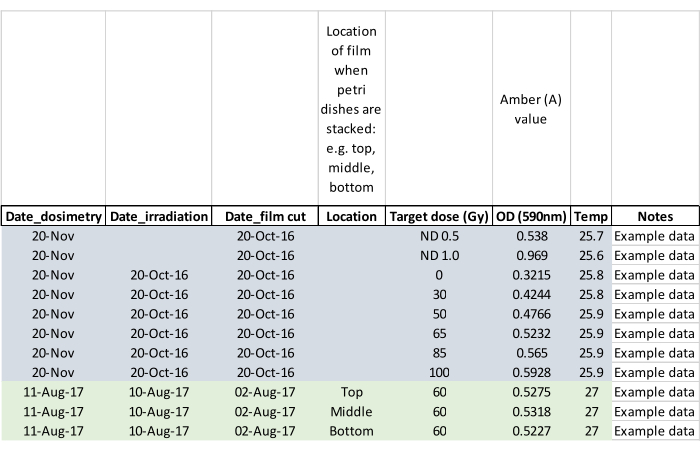
Abbildung 5: Dosimetrie-Datenblatt mit Beispieldaten. Die Spaltenüberschriften fordern den Bediener auf, wichtige Daten für eine spätere Analyse zu erfassen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Aufzucht bestrahlter männlicher Aedes aegypti-Puppen bei Erwachsenen
- Reinigen und bereiten Sie kleine Kunststoffe 30 cm x 30 cm x 30 cm Aufzuchtkäfige vor, damit sie bei der Rückkehr ins Hauptlabor für bestrahlte Puppen bereit sind. Für jeweils 2 Petrischalen bestrahlter männlicher Puppen 1 Aufzuchtkäfig vorbereiten. Bestücken Sie jeden Aufzuchtkäfig mit einem halbgefüllten Kunststoffbecher mit 460 ml Leitungswasser und einem Behältnis mit 10%iger Saccharoselösung, wie in Schritt 1.1.3 beschrieben.
- Die bestrahlten Puppen werden nach der Rückkehr aus der Bestrahlungseinrichtung sofort in die vorbereiteten Aufzuchtkäfige überführt. Verwenden Sie eine Quetschflasche Wasser, um die Puppen von jeder Petrischale vorsichtig in die 460 ml Wasser im Plastikbecher in jedem Aufzuchtkäfig zu waschen. Nach 24 h die Becher in neue, saubere Aufzuchtkäfige mit der Nahrungsquelle umfüllen und die verbleibende Eklosierung des erwachsenen, männlich bestrahlten Aedes aegypti abwarten.
HINWEIS: Wenn während des Bestrahlungsvorgangs Puppen aufgetaucht sind, öffnen Sie die Petrischalen mit den Fliegern in einen leeren Käfig und fahren Sie dann mit Schritt 5.2 fort. Verwerfen Sie die in diesem Käfig gesammelten Männchen. Puppen werden nach 24 Stunden in neue Aufzuchtkäfige verlegt, da Männchen vor Weibchen derselben Kohorte schlüpfen und die Isolierung der Tage der Schlüpfung die Inzidenz weiblicher Kontamination reduzieren und eine genaue Alterung der Männchen gewährleisten kann.
6. Markieren und Wiegen bestrahlter erwachsener Aedes aegypti Männchen
HINWEIS: In diesem Abschnitt des Protokolls wird davon ausgegangen, dass zwei Personen die Aufgaben ausführen. für 1 Person siehe 6.4.

Abbildung 6: Verpacken markierter, bestrahlter, männlicher Aedes aegypti in Freisetzungsbehälter. (A) Freigabebehälter mit Stockinette, die an einem Loch befestigt ist, das mit Abdeckband, Heftklammern und Heißkleber in die Seite des Kartonzylinders geschnitten wurde. Die Lünette ist mit einem seitlich angebrachten Abdeckbandetikett versehen. Die Lünette behält den eng gezogenen Tüllnetzbezug bei; Ein elastisches Band (nicht sichtbar) hält den Tüll auch unter der Lünette. (B) Charge von betäubten Männchen, die in einem kleinen Pappbecher in rosa Farbstoff getrommelt werden. (C) Vier Freigabebehälter im isolierten Versandcontainer. Beachten Sie, dass die Stockinette-Hüllen zur Mitte des Versandbehälters ausgerichtet sind, Verpackungsmaterialien um die Freisetzungsbehälter herum versteckt sind und Ernährungs- und Hydratationsquellen oben auf jedem Freisetzungsbehälter vorhanden sind, der von einem umgekehrten Petrischalenboden bedeckt ist, der von gekreuzten elastischen Bändern und Klebebandstücken gehalten wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Bereiten Sie Kartonfreigabebehälter vor.
- Schneiden Sie ein Loch mit einem Durchmesser von 11,5 cm in die Seite eines zylindrischen 3,9-Liter-Kartonbehälters mit Deckel in 1,5-3,0 cm Entfernung vom Boden, damit das Loch nicht vom Deckel abgedeckt wird (Abbildung 6A).
- Schneiden Sie eine 40-50 cm lange Stockinette ab und heften Sie ein Ende davon um die Innenseite des 11,5 cm großen Lochs, das in 6.1.1 geschnitten wurde. Verwenden Sie einen Standard-Bürohefter, der geöffnet ist, damit Klammern durch die Stockinette und den Karton aus dem Inneren des Behälters in eine geeignete Arbeitsfläche wie einen Block aus hartem, extrudiertem Polystyrolschaum gedrückt werden können. Crimpen Sie die Klammern mit einem flachen Schraubendreher, um die Stockinette fest am Umfang des Lochs zu befestigen, und befestigen Sie das Abdeckband über der gekräuselten Seite, um Haken zu vermeiden. Versiegeln Sie den Rand der Stockinette auf der Innenseite des Zylinders mit Heißkleber und überprüfen Sie die gesamte Baugruppe auf Fluchtlöcher.
- Erstellen Sie eine Haltelünette, indem Sie die innere Scheibe vom Deckel entfernen und ein 33 cm x 33 cm großes Quadrat aus Nylontüllnetz schneiden, das fein genug ist, um erwachsene männliche Aedes aegypti-Mücken zurückzuhalten. Platzieren Sie das Netz am offenen Ende des Zylinders und befestigen Sie die Lünette über dem Netz, um es lückenlos an Ort und Stelle zu halten. Ziehen Sie das Netz nach unten, so dass es unter der Lünette herausragt, um das Netz über das offene Ende zu bringen, und dichten Sie das hervorstehende Netz mit einem Gummiband fest gegen den Zylinder ab.
- Legen Sie ein 10 cm langes Stück Abdeckband auf die Seite der Lünette, die mit einem 8 cm langen Stück Etikettierband bedeckt ist, damit das Etikettierband leicht ausgetauscht werden kann, ohne die Lünette zu reißen.
HINWEIS: Freigabebehälter sind langlebig und können bei richtiger Handhabung >10x wiederverwendet werden. Bevor Sie jede neue Charge markierter, bestrahlter, erwachsener, männlicher Moskitos einführen, überprüfen Sie, ob die Stockinette sicher am Behälter befestigt ist, und führen Sie bei Bedarf umgehend Reparaturen durch.
- Bereiten Sie die Wiege- und Markierstation vor.
- Gießen Sie etwa 50 mg Markierungsfarbstoff in einen 240-ml-Kartonbehälter und verteilen Sie den Farbstoff als Pulverschicht gleichmäßig auf den Innenflächen des Behälters. Klopfen Sie vorsichtig, um überschüssigen Farbstoff zu verwerfen. Verwenden Sie deutlich beschriftete Becher für mehrere Farbstoffe, um die Farben getrennt zu halten.
- Tara ein 100-500 g schweres Boot auf einer elektronischen Waage von 0,0001 g; Erstellen eines Datenformulars (Tabelle 3); und kleben Sie vier Blätter Kopierpapier von 215,9 mm x 355,6 mm zusammen, um eine Arbeitsfläche von 431,8 mm x 711,2 mm zu erhalten.
| Behälter freigeben | Gewicht der Moskitos | Käfignummer | Weibchen im Batch | Anzahl der Männchen | Behälter freigeben | Gesamtmasse |
| ROSA I | 0.024 | T1 #1 | 25 | ROSA I | 2.03 | |
| ROSA I | 2.007 | T1 #1 | 7 | PINK II | 1.99 | |
| PINK II | 1.990 | T1 #1 | ROSA III | 2.03 | ||
| ROSA III | 0.026 | T1 #3 | 25 | |||
| ROSA III | 2.000 | T1 #3 | 18 |
Tabelle 3: Datentabelle der Wägestation.
- Markieren Sie quantifizierte Chargen von erwachsenen bestrahlten Männchen mit fluoreszierendem Pigment.
- Übertragen Sie erwachsene Moskitos (2,5-3,5 Tage alt) aus jedem Aufzuchtkäfig in Aspiratorfläschchen. Entfernen Sie die Nahrungsquellen aus dem Aufzuchtkäfig aus Schritt 5.2 und legen Sie den gesamten Käfig für 5-7 min in eine große CO2 -Kammer, wobei Sie die Seiten des Behälters klopfen, um Moskitos zu entfernen, die möglicherweise am Aufzuchtkäfig haften. Entfernen Sie nach Ablauf der Expositionszeit den Aufzuchtkäfig aus der Kammer und saugen Sie alle erwachsenen Moskitos in eine Reihe von Plastikaspirationsfläschchen ab.
HINWEIS: Die Verabreichung von 99,5-100% CO2 erfolgt aus einem Tank mit einem Regler, Messingwiderhaken und Silikonschläuchen, die mit einer Durchflussrate von 6 l / min in die Kammer geleitet werden. Die Anzahl der Fläschchen, die benötigt werden, um den Aufzuchtkäfig zu räumen, hängt davon ab, wie viele Moskitos sich im Käfig befinden und wie kompetent der Bediener ist, aber normalerweise sind 3-5 Fläschchen pro Käfig erforderlich. Wählen Sie einen Aspirator mit kleinen Schnellwechselfläschchen, um die Behandlung von erwachsenen Moskitos in Chargen zu erleichtern, z. B. eine mit einem 60-ml-Polystyrol-Sammelfläschchen, das mit einem 20 x 20-Mesh-Aluminiumsieb an einem Ende und einem klaren Acetatklappenventil am anderen Ende versiegelt ist. Der gesamte Käfig wird vor der Aspiration betäubt, um die Zeit für den Transfer von Moskitos in Fläschchen zu reduzieren, um den Stress für Moskitos zu reduzieren und das Protokoll handhabbar zu halten. - Sortieren Sie alle erwachsenen Moskitos aus jedem Aufzuchtkäfig nach Geschlecht.
- Die erste Durchstechflasche aus Schritt 6.3.1 wird in einer kleinen Kammer 4 min lang CO 2 ausgesetzt, dann die betäubten Mücken vorsichtig ausgeschüttelt und auf der in Schritt 6.2.2 vorbereiteten weißen Papierarbeitsfläche verteilt.
- Legen Sie eine neue leere Durchstechflasche in den Absauger, saugen Sie alle männlichen Tiere vorsichtig von der Arbeitsfläche ab und geben Sie diese Durchstechflasche zur Wiegestation (Schritt 6.3.3.). Zählen Sie alle zurückgelassenen Weibchen und saugen Sie sie in eine separate Durchstechflasche und werfen Sie sie zusammen mit allen zerquetschten Männchen weg.
- Wiederholen Sie diesen Vorgang mit den verbleibenden Durchstechflaschen aus 6.3.1, erzeugen Sie jedoch irgendwann im Geschlechtssortierprozess eine separate Durchstechflasche mit nur 25 männlichen Tieren, die ebenfalls an die Wiegestation weitergeleitet wird. Wiederholen Sie Schritt 6.3.2. für jeden Aufzuchtkäfig.
HINWEIS: Verfolgen Sie bei der Verarbeitung bestrahlter erwachsener Männchen für das Geschlecht, Wiegen und Markieren die Anzahl der Weibchen in jeder Charge, die Schlüsseldaten für die Fehlerbehebung und Qualitätssicherung der Puppengeschlechtssortierung und den gesamten Prozess sind. Wenn die weibliche Anzahl höher als erwartet ist, sollte eine zweite Person Weibchen extrahieren, während der Hauptoperator die Männchen aspiriert. Es ist wichtig, eine Stichprobe von 25 Männchen aus jedem Aufzuchtkäfig zu wiegen, um ein durchschnittliches Gewicht pro Mücke zu berechnen, das zur Schätzung der Anzahl der markierten bestrahlten Männchen verwendet wird, die am Ende des Protokolls freigesetzt werden.
- Wiegen und färben Sie Chargen von erwachsenen männlichen Moskitos.
- An der Wiegestation die erste Durchstechflasche mit erwachsenen männlichen Mücken aus der Geschlechtsstation (Abschnitt 6.3.2) für 2 min in eine kleine CO 2 -Kammer geben und die Mücken vorsichtig in das in Schritt 6.2.2 vorbereitete teerte Wiegeboot schütteln. Das Gewicht der Stechmücken ist aufzuzeichnen und die Stechmücken in den in Abschnitt 6.2.1 vorbereiteten Färbebecher zu gießen.
- Neigen und drehen Sie den Becher 1 langsam im Uhrzeigersinn und gegen den Uhrzeigersinn, so dass die Moskitos die Pulverbeschichtung auf den Innenflächen des Bechers berühren und alle leicht mit Farbstoff bestäubt werden (Abbildung 6B). Gießen Sie die markierten Moskitos in ein Wiegeboot.
- Fahren Sie schnell mit dem nächsten Schritt fort, damit sich die Moskitos nicht erholen und entkommen. Wiederholen Sie diesen Schritt, bis alle Durchstechflaschen aus Abschnitt 6.3.2 verarbeitet wurden.
ANMERKUNG: Das Gewicht der männlichen Tiere aus der separaten Durchstechflasche mit 25 männlichen Tieren, die für jeden Aufzuchtkäfig in Abschnitt 6.3.2 erzeugt wird, wird aufgezeichnet und zur Berechnung des Durchschnittsgewichts pro männlichem Tier aus diesem Käfig verwendet.
- Beladen Sie die Freisetzungsbehälter mit markiert bestrahlten erwachsenen Männchen. Das Wiegeboot mit betäubten, markierten, bestrahlten männlichen Mücken ab dem Ende von Abschnitt 6.3.3 wird leicht gefaltet. , um einen Kanal zu erstellen, und leiten Sie diesen Kanal dann durch die Stockinette-Hülse, um die Männchen in den Release-Behälter zu übertragen. Fügen Sie weiterhin Moskitos hinzu, bis etwa 2,0 g oder 1500-3000 männliche Moskitos im Freisetzungsbehälter sind und binden Sie die Stockinette-Hülle zu. Markieren Sie das Beschriftungsband auf der Lünette des Freisetzungsbehälters mit Farbstofffarbe, Behälternummer und Gesamtgewicht der Mücken und kopieren Sie diese Daten in das Formular aus Schritt 6.2.2.
HINWEIS: Der Umgang mit Moskitos in jeder Lebensphase führt zu Stress und kann das Überleben oder die Vitalität verringern. Die in diesem Protokoll beschriebene Reihe von Anästhesien könnte sich auf die Moskitos auswirken; Versuche, nicht betäubte Moskitos bei jedem Schritt zu verfolgen und abzusaugen, würden jedoch zu mehr Stress und einem nicht nachhaltigen Protokoll führen. Das Gesamtgewicht der Stechmücken in jedem Freisetzungsbehälter wird durch das in Abschnitt 6.3.3 ermittelte durchschnittliche Gewicht pro männlicher Mücke dividiert, um eine Schätzung der Anzahl der Männchen in diesem Freisetzungsbehälter abzuleiten. Jeder Freisetzungsbehälter sollte nicht mehr als 2 g Männchen enthalten, was etwa 1 großen Aufzuchtkäfig entspricht.
- Übertragen Sie erwachsene Moskitos (2,5-3,5 Tage alt) aus jedem Aufzuchtkäfig in Aspiratorfläschchen. Entfernen Sie die Nahrungsquellen aus dem Aufzuchtkäfig aus Schritt 5.2 und legen Sie den gesamten Käfig für 5-7 min in eine große CO2 -Kammer, wobei Sie die Seiten des Behälters klopfen, um Moskitos zu entfernen, die möglicherweise am Aufzuchtkäfig haften. Entfernen Sie nach Ablauf der Expositionszeit den Aufzuchtkäfig aus der Kammer und saugen Sie alle erwachsenen Moskitos in eine Reihe von Plastikaspirationsfläschchen ab.
- Änderungen des Kennzeichnungsprotokolls für einen einzelnen Bediener
- Führen Sie zuerst die Geschlechtssortierung für alle großen Käfige durch. Setzen Sie jeden großen Käfig für 4-5 min CO2 aus und saugen Sie alle Moskitos in 4-5 Durchstechflaschen ab. Jede Durchstechflasche für 2-3 min CO2 aussetzen, alle Moskitos auf die weiße Papieroberfläche kippen, die Weibchen entfernen und auszählen und die Männchen in ihren großen Populationskäfig zurückbringen.
- Wiegen und Markieren
- Beginnen Sie mit dem ersten männlichen Haftkäfig, der in Schritt 6.4.1 hergestellt wurde: Entfernen Sie die Nahrungsquelle und betäuben Sie die Männchen in einer großen CO2 -Kammer für 5-7 min. Die betäubten Männchen gleichmäßig in separate Durchstechflaschen absaugen. Wiederholen Sie diesen Schritt mit jedem Haltekäfig in der Reihenfolge, in der sie hergestellt wurden.
HINWEIS: Pro Haltekäfig werden ca. 2-3 überfüllte Fläschchen produziert. Die Verarbeitung männlicher Haltungskäfige in der Reihenfolge, in der sie hergestellt wurden, maximiert die Erholungszeit für jeden Käfig der Männchen. - Betäuben Sie die erste Durchstechflasche, die in Schritt 6.4.2.1 hergestellt wurde. für 1-2 min in einer kleinenCO2-Kammer . Gießen Sie eine kleine Anzahl von Moskitos auf die weiße Papieroberfläche, saugen Sie 25 männliche Moskitos in eine neue Durchstechflasche und verarbeiten Sie sie wie in 6.3.2, um das Durchschnittsgewicht pro Männchen für diesen Käfig zu bestimmen. Bringen Sie alle weiteren männlichen Tiere in die Durchstechflasche der Ausgangsquelle zurück oder saugen Sie sie in eine neue separate Durchstechflasche ab, die später verarbeitet wird. Fahren Sie mit dem Wiegen, Markieren und Umsetzen in die Freigabebehälter für die übrigen männlichen Tiere in der ersten Durchstechflasche fort, wie in Schritt 6.3 beschrieben. Wiederholen Sie Schritt 6.4.2.2. (mit Ausnahme der Isolierung von 25 männlichen Tieren in einer separaten Durchstechflasche) für die übrigen in Schritt 6.4.2.1 hergestellten Durchstechflaschen. in der Reihenfolge, in der sie erzeugt wurden, und gehen dann zum nächsten geschlechtssortierten Aufzuchtkäfig über, der in 6.4.1 hergestellt wurde.
HINWEIS: Arbeitsabläufe mit einer Person sind langsamer und einige männliche Moskitos müssen mehrmals betäubt werden. Suchen und entfernen Sie ständig weibliche Moskitos.
- Beginnen Sie mit dem ersten männlichen Haftkäfig, der in Schritt 6.4.1 hergestellt wurde: Entfernen Sie die Nahrungsquelle und betäuben Sie die Männchen in einer großen CO2 -Kammer für 5-7 min. Die betäubten Männchen gleichmäßig in separate Durchstechflaschen absaugen. Wiederholen Sie diesen Schritt mit jedem Haltekäfig in der Reihenfolge, in der sie hergestellt wurden.
7. Verpackung und Versand Freisetzungsbehälter von markiertem, bestrahltem, erwachsenem männlichem Aedes aegypti
- Bereiten Sie die Freigabebehälter für den Versand vor. Sobald ein Freisetzungsbehälter mit markierten Männchen gefüllt ist, legen Sie 4 mit 10% iger Saccharoselösung angefeuchtete Wattebällchen auf den Netzdeckel und bedecken Sie sie mit einem umgekehrten Boden einer Petrischale, die von zwei Gummibändern gehalten wird, die um den gesamten Behälter und über die Petrischale gespannt sind, um ein Kreuz zu bilden. Legen Sie ein Stück Klebeband über das X der beiden Gummibänder, um sie auf der umgekehrten Petrischale zu halten.
HINWEIS: Stellen Sie sicher, dass die Wattebällchen mit 10% iger Saccharoselösung nicht bis zum Tropfen gesättigt sind, was den Behälter beschädigt und Moskitos einfängt und tötet. - Packen Sie Karton-Release-Behälter in einen extrudierten Polystyrolschaum-Versandkühler. Stecken Sie 4 Belüftungslöcher durch den Kühldeckel und verschließen Sie sie mit Baumwolle, um Ameisen fernzuhalten und entflohene Moskitos zu halten. Stellen Sie 4 Freigabebehälter aufrecht in den Versandkühler, wobei die Stockinette jedes Behälters zur Mitte zeigt (Abbildung 6C). Stecken Sie Luftpolsterfolie zwischen jeden Behälter und in der Mitte, um sie zu stabilisieren. Füllen Sie den Rest des Raumes im Versandkühler mit Luftkissen oder stapeln Sie eine zweite Schicht von 4 Release-Containern direkt auf die erste Schicht und stabilisieren Sie sich ebenfalls mit Luftkissen.
HINWEIS: Die Trennbehälter sollten ausreichend stabilisiert sein, um sich beim Schütteln nicht zu bewegen. Die Temperatur im Geschirr der Verpackung ist Umgebungstemperatur. - Bereiten Sie den Versandkühler für die Lieferung vor. Verschließen Sie den Versandkühler mit dem belüfteten Deckel und legen Sie ihn in die Kartonverpackung, schließen Sie das Klebeband und versenden Sie ihn per Nachtexpress an den Freigabeort.
Ergebnisse
Eine wachsame und angemessene Mückenaufzucht besteht aus einer ausgewogenen Verfügbarkeit von Männchen und Weibchen in Koloniekäfigen, der Aufrechterhaltung von frischer Saccharoselösung und Honig sowie einer gleichbleibend hochwertigen Blutfütterung. Diese Bedingungen sorgen für dicht gepackte Eierblätter, die optimal für die Verwendung in SIT-Larvenaufzuchtpfannen geeignet sind. Die richtige Lagerung und Verwendung von getrockneten Eierblättern, wie z. B. eine systematische Etikettierung, um die Verwendung vom ältesten zum neuesten zu erleichtern, unterstützt ein gleichmäßiges Schlüpfen in allen Pfannen. Das Befüllen aller Larvenaufzuchtpfannen mit Wasser vor dem Schlüpfen kann die Zeit, für die sich die Eierblätter in den Schlupfbehältern befinden, verkürzen und eine gesunde Entwicklung fördern. Die Pflege der Larvenpfannen vom Schlüpfen bis zur Verpuppung erfordert ein sorgfältiges Engagement des Koloniepersonals, da einige Pfannen je nach Entwicklungsstadien und Umweltvariablen mehr oder weniger Nahrung oder zusätzliches Wasser benötigen. Wenn es Probleme mit dem Entwicklungsstadium bis zum geplanten Tag der Puppengeschlechtstrennung gibt, sollten Anpassungen früher im Prozess vorgenommen werden, z. B. früher oder später schlüpfen, Nahrung anpassen oder die Temperatur des Inkubators ändern.
Der Aufzuchtprozess in diesem Protokoll führt nicht dazu, dass alle Eier rechtzeitig geschlüpft sind, um sich zu Puppen zu entwickeln, die bestrahlt und zu Kontrollzwecken verwendet werden können. Zwischen 20 und 50% der in der Kolonie aufgezogenen Moskitos sind immer noch Larven, wenn die Puppen getrennt werden müssen. Diese Larven werden jedoch nicht verschwendet, sondern 24 h reifen gelassen, um zusätzliche Puppen zu bilden, die mit weiblichen Puppen aus der Trennung des Vortages kombiniert und wieder in Koloniekäfige recycelt werden können. In den Koloniekäfigen dürfen Puppen zu Erwachsenen heranreifen, sich paaren, Blut ernähren und Eier produzieren, die das SIT-Projekt unterstützen.
Das Trennen von Puppen, das Eingießen von Puppen in Petrischale, die Bestrahlung und die Unterbringung in erwachsene Käfige nach der Bestrahlung müssen an einem Tag erfolgen; Daher sollte ausreichend Zeit eingeplant werden, um alle Schritte komfortabel zu bearbeiten. Die Montage und Vorbereitung von Freigabebehältern sollte vor dem Markierungsprozess erfolgen. Wenn Versandkartons von der Freigabestelle zurückgegeben werden, sollten Freigabebehälter inspiziert und für ihre nächste Verwendung vorbereitet werden. Das Entsorgen nasser Wattebällchen, das Auslüften von Nasstrennbehältern, das Reinigen von Petrischale, das Ersetzen von Netzen und das Entfernen von elastischen Bändern aus dem Behälter, während sie nicht verwendet werden, verlängern die Lebensdauer der Freisetzungsbehälter erheblich.
Angesichts der weltweiten Realität der COVID-19-Viruspandemie wurde dieses Protokoll, bei dem es sich in der Regel um eine Mehrpersonenoperation handelt, so modifiziert, dass für jeden Schritt eine Person allein in einem Labor arbeiten kann. Die Schritte im Prozess, die am meisten durch ein Ein-Personen-Szenario behindert werden, sind die Geschlechts-, Markierungs-, Wiege- und Kolonieaufzucht-Wartungsschritte. Die Trennung von Puppen nach Geschlecht durch eine Person sollte ausreichen, wenn mehrere Separatoren gleichzeitig in verschiedenen Räumen arbeiten. In einer Pandemiesituation, in der soziale Distanzierung am Arbeitsplatz stattfindet, ist die Ausrüstung mehrerer Stationen erforderlich, um Schritte vom Geschlecht bis zum Packen durchzuführen. Abhängig von der Geschwindigkeit des Bedieners dauert eine Person ~ 4 Stunden, um 15.000 Moskitos zu sexen, und dann weitere 1-2 Stunden, um sie zu markieren, zu wiegen und zu verpacken. Ein Zwei-Personen-Szenario verringert die Zeit, in der Moskitos zur Markierung betäubt werden, und reduziert die Gesamtarbeitszeit. Doch selbst in einem Zwei-Personen-Szenario kann die Zuteilung der vollen 2,0 g Moskitos pro Freisetzungskäfig aufgrund der begrenzten Arbeitszeit während der Sedierung der Moskitos schwierig sein. Obwohl der Prozess der Reinigung und Aufbereitung von Larven- und adultem Aufzuchtmaterial extrem zeit- und arbeitsintensiv ist, kann er so unterteilt werden, dass einzelne Bediener während einer Pandemie unabhängig und sicher arbeiten können.
Die Freilassung adulter, markierter, bestrahlter Aedes aegypti-Männchen liegt außerhalb des Geltungsbereichs dieses Protokolls, wird hier jedoch kurz vorgestellt. Der Prozess der Freisetzung markierter, bestrahlter, männlicher Mücken beginnt mit der Bestimmung einer gleichmäßigen Freisetzungsverteilung der Freisetzungsbehälter auf der Grundlage von Gewichten (und damit abgeleiteter Anzahl steriler Männchen), wie in Tabelle 3 berichtet. Nachdem die Sendungen an den Vektorkontrollbezirk geliefert wurden, werden die Boxen geöffnet und die Freisetzungsbehälter auf Probleme mit der Sterblichkeit oder dem Zustand der Freisetzungsbehälter untersucht. Moskitos in den Freisetzungsbehältern können sich dann 1-2 h lang an Umgebungstemperatur und Luftfeuchtigkeit gewöhnen, bevor sie in den Behandlungsbereich transportiert werden. Freisetzungsstellen im Behandlungsgebiet werden nach intensiver Überwachung auf Hot Spots wilder Populationen von Aedes aegypti identifiziert. Der Zeitpunkt, die Häufigkeit und die Dichte der Freisetzungen werden durch die Bionomik der Art sowie durch Meteorologie, öffentliche Unterstützung und Laboraufzuchtfähigkeiten ausgeglichen.
Da bestimmte Freisetzungsbehälter auf bestimmte Freisetzungsstellen abgestimmt sind, muss das Etikett vor dem Öffnen des Freisetzungsbehälters durch Schneiden des Netzes auf der Oberseite überprüft werden, so dass der Bediener das Netz verformen kann, so dass ein Teil der Männchen entweichen kann. Diese fraktionierte Freisetzungsmethode wird an jedem zugewiesenen Freigabepunkt für den Behälter wiederholt, bis alle frei fliegenden Männchen freigelassen wurden. Dieser Vorgang wird dann für jeden Freigabecontainer an seinem jeweils zugewiesenen Freigabeort wiederholt, bis alle Container verarbeitet wurden. Optional können nach der Freisetzung der Moskitos alle toten oder behinderten Moskitos, die nicht frei gegangen sind, in Petrischalen gesammelt und beschriftet werden, um von Hand gezählt oder gewogen zu werden, um die geschätzte Anzahl freigesetzt zu korrigieren. Eine laufende und umfassende Überwachung von adulten, eiförmigen und unreifen Stadien von wilden Aedes aegypti im Zielgebiet und möglicherweise an Kontrollstellen ohne Intervention wird durchgeführt, um die Wirksamkeit der SIT-Operation zu bewerten.
Diskussion
Die Initiierung eines Kontrollprogramms mit SIT, das Strahlung verwendet, erfordert die Etablierung eines lokalen Stammes von Aedes aegypti. Dieser Schritt ist entscheidend und kann es SIT ermöglichen, sich wirklich von ähnlichen Steuerungstechnologien abzuheben. Durch die Entwicklung des Projekts aus einem lokalen Moskitostamm werden die erzeugten Männchen wahrscheinlich Verhaltensweisen haben, die es ihnen ermöglichen, sich an Umweltveränderungen und Hinweise anzupassen und wilde Weibchen in der Nähe zu lokalisieren und sich mit ihnen zu paaren. Darüber hinaus darf die Freisetzung bestrahlter lokaler Männchen keine negative öffentliche Meinung hervorrufen, verglichen mit beispielsweise der Freisetzung eines nicht-lokalen Stammes genetisch veränderter Moskitos, die beispielsweise neue Allele in die lokale Mückenpopulation einführen könnten.
Erhebliche Ressourcen aufzuwenden, um große Mengen von Moskitos zu züchten, nur um etwa die Hälfte von ihnen für Kontrollzwecke verwenden zu können, ist eine Einschränkung des Aedes aegypti SIT-Programms. Das Aufzuchtprotokoll sollte verfeinert werden, um die Reifung der Larven in definiertere Zeiträume zu verdichten, in denen die Puppen bereit sind. Dies würde es ermöglichen, mehr Puppen zum optimalen Zeitpunkt der Trennung zu sammeln. Zusätzliche zu verarbeitende Puppen erhöhen jedoch das Risiko, dass sich mehr Weibchen verpuppen, wenn die Puppen gesammelt werden, und erhöhen daher die Wahrscheinlichkeit, dass Weibchen mit Männchen in Petrischalen landen und möglicherweise freigelassen werden. Obwohl die Lebensdauer, das Blutfütterungsverhalten und das Eiablageverhalten bei bestrahlten weiblichen Aedes aegypti-Puppen bei Erwachsenen reduziert sind, ist es keine gute Strategie, Weibchen nebenbei neben bestrahlten Männchen freizulassen22. Daher sollte es eine Priorität bleiben, die Anzahl der Weibchen zu minimieren, die versehentlich getrennt, bestrahlt, markiert und mit Männchen freigelassen werden.
Der Erfolg eines SIT-Programms hängt letztendlich von einem erfolgreichen Partnerwettbewerb durch kolonieaufgezogene, bestrahlte Männchen ab. Die Erhaltung der männlichen Wettbewerbsfähigkeit beruht auf einer umfassenden experimentell abgeleiteten Auswahl der Dosis und der Maximierung des geschätzten Verhältnisses von sterilen und wilden Männchen in der Population. Die Dosisauswahl wird durch mehrere Schlüsselfaktoren bestimmt, darunter Langlebigkeit, Fruchtbarkeit, Fruchtbarkeit und Puppensterblichkeit. Es wurde beobachtet, dass männliche Moskitos eine asymptotische Fruchtbarkeitskurve aufweisen, die sich mit zunehmender Strahlung Null nähert (KJL, RLA, SCB unveröffentlichte Daten). Gleichzeitig nehmen die Langlebigkeit und Aktivität der männlichen Mücken exponentiell ab, wenn die Strahlendosis zunimmt (KJL, RLA, SCB unveröffentlichte Daten). Anstatt eine Dosis zu identifizieren, die bei Männern eine Sterilität von 99,9% ergibt, ist es daher vorzuziehen, sich auf einen niedrigeren Sterilitätsprozentsatz zu konzentrieren und gleichzeitig das Überleben zu unterstützen. Sobald ein Dosisbereich ermittelt ist, der die Langlebigkeit oder Puppensterblichkeit bestrahlter Männchen nicht von der von nicht bestrahlten Männchen unterscheidet, sollten zusätzliche Bewertungen der Fertilität durchgeführt werden, um eine Dosis zu ermitteln, die Männchen überwiegend steril, aber wettbewerbsfähig macht.
Gleichzeitig ist es wichtig, die Anzahl der männlichen Moskitos in der Population mit der der freigesetzten bestrahlten Männchen zu vergleichen. Dies kann erreicht werden, indem Männchen von verschiedenen Orten in und um das Zielfreisetzungsgebiet wiederholt vom selben Ort und vor, während und nach Beginn des SIT-Programms gesammelt werden. Eine Mark-, Release-, Recapture-Studie sollte durchgeführt werden, um das Verhältnis von wilden männlichen Moskitos zu freigesetzten Moskitos zu beurteilen. Eine Mark-, Release-, Recapture-Studie beruht auf der Freisetzung einer bekannten Anzahl markierter Moskitos von einem bestimmten Punkt und deren späterem Wiederfang an Punkten in unmittelbarer Nähe des ursprünglichen Freisetzungspunktes. Durch den Vergleich der Anzahl der zurückgefangenen Männchen und wilden Männchen in Entfernungen vom Freisetzungspunkt ist es möglich, die allgemeine Wildpopulation der Männchen in dem Gebiet zu schätzen, so dass wettbewerbsfähige Verhältnisse steriler Männchen freigelassen werden können23. Die Maximierung des Verhältnisses von sterilen: wilden Männchen kann durch Freilassung sterilerer Männchen und/oder durch Reduzierung der Wildpopulation durch klassische Kontrollmittel wie Quellenreduktion, unreife Kontrolle oder Adultizidbehandlungen erreicht werden.
Um die Wirksamkeit steriler männlicher Freisetzungen zu messen, können adulte Sammlungen chronologisch mit einem nicht-interventionellen Bereich verglichen werden. Wenn sterile Männchen freigelassen werden und die Anzahl der gesammelten Männchen und Weibchen in einem Gebiet im Verhältnis zu einem vergleichbaren Nicht-Interventionsgebiet abnimmt, kann die Hypothese aufgestellt werden, dass dies darauf zurückzuführen ist, dass die freigesetzten sterilen Männchen die lokalen fruchtbaren Männchen erfolgreich übertreffen. Dieser Effekt kann auch in Eiablagefallenbechern beobachtet werden, die sowohl an der Interventions- als auch an der Nichtinterventionsstelle eingesetzt werden. Eier können immer noch an der Interventionsstelle produziert werden, aber wenn weniger schlüpfen als die von der Nicht-Interventionsstelle, kann angenommen werden, dass sie nicht befruchtet werden, weil sich Weibchen mit sterilen Männchen paaren. Immer mehr Eiablage von unbefruchteten Eizellen könnte schließlich zu einer verminderten Eiablage führen, da Weibchen an der Interventionsstellenicht ersetzt werden 8,24.
Zukünftige Richtungen der SIT-Technologie und -Programme erweitern sich natürlich auf weitere medizinisch wichtige Mückenarten. Zum Beispiel kann diese Technologie leicht angepasst werden, um Aedes albopictus zu kontrollieren, angesichts der sehr ähnlichen Bionomik von Aedes aegypti und Aedes albopictus. Andere Krankheitsüberträgermückenarten von Interesse sind Culex quinquefasciatus, Culex tarsalis und verschiedene Anopheles-Arten. Die Verbesserung der Wirksamkeit dieser Technologie hängt davon ab, die Kapazität der zu einem bestimmten Zeitpunkt produzierten männlichen Puppen zu erhöhen, was durch genetische Manipulation oder künstliche Selektion erreicht werden könnte, und die männliche Wettbewerbsfähigkeit zu verbessern, die durch Erhöhung der Männlichkeit, Fruchtbarkeit oder Langlebigkeit erreicht werden könnte.
Letztendlich sind SIT-Programme keine Wunderwaffe zur Bekämpfung von Moskitos. Sie sind stattdessen ein Werkzeug in einer Reihe anderer Kontrolltechniken, wie z. B. IVM-Programme, die Schwächen zwischen Techniken ausgleichen. Während beispielsweise die chemische Bekämpfung eine schnelle und kostengünstige Bekämpfung bietet, fördert sie auch die Entwicklung von Resistenzen und Nichtzielmortalität. und während SIT artspezifisch ist und wahrscheinlich keine Resistenz erzeugt, müssen SIT-Männchen auf Dauer produziert und freigelassen werden, um einwandernde Populationen von außerhalb des Vektorkontrollbezirks zu kontrollieren.
Offenlegungen
Alle Autoren haben keine Interessenkonflikte angegeben.
Danksagungen
Wir danken Drs. R.-D. Xue, C. Bibbs, W. Qualls und V. Aryaprema vom Anastasia Mosquito Control District, St. Augustine, Florida, für die Partnerschaft bei der Entwicklung des SIT-Programms und Expertenwissen über die effektive operative Freisetzung steriler männlicher Aedes aegypti. Diese Forschung wurde vom USDA-ARS und dem Florida Department of Agriculture and Consumer Services (FDACS) unterstützt. Die Erwähnung von Handelsnamen oder kommerziellen Produkten in dieser Veröffentlichung dient ausschließlich dem Zweck der Bereitstellung spezifischer Informationen und impliziert keine Empfehlung oder Billigung durch USDA oder FDACS.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-1/8" wrench (1" (1 inch) = 2.54 cm) | Craftsman | CMMT44707 | |
| 1/2 pint cardstock cup (1/2 pint = 236.5 mL) | Science Supplies WLE corp | 1/2 pint | |
| 1/4" tubing - tygon | Hudson Extrusions | LLDPE1/8 X 1/4 BLK | to attach to CO2 gas regulator |
| 1/8" brass barb w/ MIP connection | B&K | BHB-85NLB | to attach to CO2 gas regulator |
| 1000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-1000 | |
| 3000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-3000 | |
| Adult large cage | Bioquip | 1450D | |
| Aspirator vials | Bioquip | 2809V | |
| Bovine liver powder | MP Biomedicals | 290039601 | |
| Brewers yeast | MP Biomericals | 02903312-CF | |
| CO2 regulator | Randor | 64003038 | |
| CO2 tank (20# canister) | Praxair | CDBEVCARB20 | |
| Collection basin | Treasure Gurus | KI-ENAMELBOWL | for separator |
| Cotton balls - large | Fisher Scientific | 22-456-883 | |
| Deli cups w/lids - 470 mL | Pactiv DELItainer | PCTYSD2516 | |
| Deli cups w/lids - 1900 mL | Berry Global | T60764 | |
| DoseReader 4 | ND0.5 and ND1.0 QA Filter Set standards | ||
| Dosimetry film | Far West Technology, Inc. | ||
| Filter paper | Millipore | AP10045S0 | |
| Flashlight aspirator | Bioquip | 2809D | |
| Forceps - fine featherweight | Bioquip | 4748 or 4750 | featherweight |
| GAFchromic | radiochromic film | ||
| Gammator M | Radiation Machinery Corporation, Parsippany, NJ | Cesium-137 irradiator | |
| Hand held mechanical aspirator | Clarke Mosquito | 13500 | |
| Lambskin condoms | Trojan | Naturalamb | |
| Large CO2 chamber | Sterilite | Walmart # 568789514 | |
| Larval rearing pans | Blue Ridge Thermoforming | 01-FG-400-3N-ABS | Dimensions: 22.375 x 17.5 x 3 (inches) |
| Magnets - 20# pull | Master magnetics | MHHH20BX | |
| Marking dye | Dayglo | ECO-11 | Aurora Pink |
| Marking dye | Dayglo | ECO-17 | Saturn Yellow |
| Mesh | Falk | T301 | |
| Pasture pipettes | Thermo Scientific | 02-708-006 | |
| Petri dishes - large | VWR International | 25384-090 CS | |
| Petri dishes - small (60 mm x 15 mm) | Fisher Brand | FB0875713A | |
| Pupa separator | J.W. Hock | 1512 | |
| Red rubber hose | Welch | 331040-5 | |
| Release containers | Science Supplies WLE corp | 1 gallon | |
| Rubber bands - cross #19 | Alliance | ALL37196 | |
| Rubber bands - latitude #64 | Skillcraft | NSN0589974 | |
| Scale | Ohaus | H-4737 | |
| Seed germination paper - Heavy stock 76# | Anchor Paper | #76 | |
| Shipping coolers- 16 x 13 x 12.5" | MrBoxonline.com | Husky Foam Cooler kit | |
| Sieve #20 | Advantech | 20BS8F | |
| Sieve #30 | Advantech | 30BS8F | |
| Small cage - Bug Dorm | MegaView | Bug Dorm-1 | |
| Small CO2 chamber | Mainstays | Walmart # 562922221 | |
| Souffle cup lid | SOLO | 41165277456 | |
| Souffle cups - 4 oz (1 oz = 29.6 mL) | SOLO | 41165024104 | |
| Sponge | ocelo | MMM7274FD | |
| Squeeze bottle | Dynalon | 3UUP6 | |
| Stereoscope | Meiji Techno | EMZ-5 | |
| Stockinette | BSN Medical | 30-1006 | |
| Styrofoam | extruded polystyrene foam | ||
| Tropical fish flake food | Tetra | 4.52 pound | |
| Vaccum chamber - desiccator | BelArt | T9FB892757 | |
| Weigh boats | Globe Scientific | 3621 |
Referenzen
- Moyes, C. L., et al. Contemporary status of insecticide resistance in the major Aedes vectors of arboviruses infecting humans. PLoS Neglected Tropical Diseases. 11 (7), 0005625 (2017).
- Baldacchino, F., et al. Control methods against invasive Aedes mosquitoes in Europe: a review. Pest Management Science. 71 (11), 1471-1485 (2015).
- Burkett, D. A., Cope, S. E., Strickman, D. A., White, G. B. The Deployed Warfighter Protection (DWFP) Research Program: Developing new public health pesticides, application technologies, and repellent systems. Journal of Integrated Pest Management. 4 (2), 1-7 (2013).
- Harwood, J. F., et al. Controlling Aedes aegypti in cryptic environments with manually carried ultra-low volume and mist blower pesticide applications. Journal of the American Mosquito Control Association. 32 (3), 217-223 (2016).
- Morrison, A. C., Zielinski-Gutierrez, E., Scott, T. W., Rosenberg, R. Defining challenges and proposing solutions for control of the virus vector Aedes aegypti. PLoS Medicine. 5 (3), 68 (2008).
- Klassen, W., Curtis, C. F., InDyck, V. A., Hendrichs, J., Robinson, A. S. History of the sterile insect technique. Sterile insect technique: principles and practice in area-wide integrated pest management. , 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector Borne and Zoonotic Diseases. 10 (3), 295-311 (2010).
- Dame, D. A., Curtis, C. F., Benedict, M. Q., Robinson, A. S., Knols, B. G. Historical applications of induced sterilisation in field populations of mosquitoes. Malaria Journal. 8, (2009).
- Bond, J. G., et al. Optimization of irradiation dose to Aedes aegypti and Ae. albopictus in a sterile insect technique program. PloS One. 14 (2), 0212520 (2019).
- Bourtzis, K., Lees, R. S., Hendrichs, J., Vreysen, M. J. B. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations. Acta Tropica. 157, 115-130 (2016).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments: JoVE. , e3579 (2014).
- Carvalho, D. O., et al. Aedes aegypti lines for combined sterile insect technique and incompatible insect technique applications: the importance of host genomic background. Entomologia experimentalis et applicata. 168 (6-7), 560-572 (2020).
- Mamai, W., et al. Aedes aegypti larval development and pupal production in the FAO/IAEA mass-rearing rack and factors influencing sex sorting efficiency. Parasite. 27, 43 (2020).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- . Methods in Aedes Research Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods%20in%20Aedes%20Research%202016.pdf (2016)
- Focks, D. A. An improved separator for the developmental stages, sexes, and species of mosquitoes (Diptera: Culicidae). Journal of Medical Entomology. 17 (6), 567-568 (1980).
- International Atomic Energy Agency. . Manual of Dosimetry in Radiotherapy. Technical Reports Series No. 110. , (1970).
- Aldridge, R. L., et al. Gamma-irradiation reduces survivorship, feeding behavior, and oviposition of female Aedes aegypti. Journal of the American Mosquito Control Association. 36 (3), 152-160 (2020).
- Cianci, D., et al. Estimating mosquito population size from mark-release-recapture data. Journal of Medical Entomology. 50 (3), 533-542 (2013).
- Knipling, E. F. . The basic principles of insect population suppression and management. , (1979).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten