Method Article
照射され、マークされたオスの ネッタイシマカ を、操作可能な滅菌昆虫技術プログラムで放出するための準備
要約
無菌昆虫技術(SIT)は、化学的防除に耐性がある可能性のある特定の医学的に重要な蚊の個体数を制御するために使用されます。ここでは、 ネッタイシマカ を対象とした運用SITプログラムにおける不妊雄蚊の大量飼育と放出準備の方法について述べる。
要約
デング熱、ジカ熱、チクングニア熱などの人間の病気の制御は、予防がないため、それらのベクターである ネッタイシマカ の制御に依存しています。蚊媒介動物の防除は、未熟および成虫期に適用される化学物質に依存することができ、これは非標的の死亡率に寄与し、さらに重要なことに、媒介動物の殺虫剤耐性をもたらす可能性がある。無菌昆虫技術(SIT)は、野生の雌と交尾して生存不可能な子孫を産む滅菌された成体雄の放出を通じて害虫の個体群を制御する方法です。この論文では、 ネッタイシマカ を制御するための運用SITプログラムで使用するために、不妊のオスを生産するプロセスについて説明します。ここでは、コロニーの飼育と維持、オスとメスの蛹の分離、成体オスの照射とマーキング、ネ ッタイシマカ の放流場所への輸送など、プログラムで使用される手順を概説します。また、手順上の警告、プログラムの制限、および将来の目標についても説明します。
概要
蚊が媒介する病原体の人間への伝染は、世界中で毎年何百万もの病気と死亡を引き起こします。ジカ熱やデング熱などの蚊が媒介する病気に対する効果的で承認されたワクチンがない場合、感染を減らす最も効果的な方法の1つは、病気媒介蚊の個体数を減らすことです。厄介なことに、伝統的に農薬の標的となっていた蚊種の数が増えており、農薬耐性のレベルが高まっています1。同時に、政府機関は以前に承認された農薬を積極的に登録抹消または禁止しており、新しい効果的な化学物質管理対策はほとんど開発されていません2,3。蚊の駆除に対するこの一連の障害は、蚊の個体数を減らすための代替の非化学的技術の探求を動機付けています。
特定の蚊種は、耐性と農薬登録の問題を制御するための課題を提示します。ネッタイシマカ(L.)は、未熟な発達と成虫の休息のためにこの種によって利用された不可解な周生生息地のために、従来の統合されたベクター管理によって制御することが非常に難しい著名な病気ベクター蚊です4,5。住宅周辺の不可解な生息地の開発に関連する課題には、農薬散布技術でこれらの場所に到達することの難しさ、および公衆衛生ベクター制御機関がこの種の効果的な統合ベクター管理(IVM)に不可欠な集中的な監視および管理活動を実施するための私有地への繰り返しのアクセスに対する一般の人々の受け入れの欠如が含まれます。
幸いなことに、他の非常に困難な昆虫種6の永続的な防除に成功したことが証明されたアプローチであるSITは、フロリダ州セントオーガスティンを拠点とする画期的な一連の実験と運用試験でネッタイシマカ問題に適用されています(KJL、RLA、SCB未発表データ)。SITは、蚊を含むさまざまな昆虫種に適用されており、深さ7,8でレビューされています。SITは、例えば電離放射線や化学物質への曝露によって不妊化されたコロニー飼育の雄の大量放出を利用して、雌の自然集団の配偶者の選択を圧倒します。野生のメスと交尾する滅菌されたオスは、オスの配偶子が被った損傷のために卵を不妊にし、十分な数が存在する場合、理論的には自然のネッタイシマカの個体群をクラッシュさせる可能性があります。
SITプログラムは、ネッタイシマカが最近再植民地化し、拡大し、ジカ熱、デング熱、チクングニア熱などのウイルスの感染に対する公衆衛生上のリスクを示しているフロリダ大西洋沿岸の都市部でネッタイシマカの個体数を減らすために開始されました。野生の雌との相性の可能性を最大化するために、プログラム9のために雄を生産するために、対象集団から野生のネッタイシマカを使用して新しいコロニーが設立されました。これは、地元で派生したコロニー飼育のオスは、地元の野生のメスと交尾するために地元の野生のオスと競争する可能性が高いという仮説に基づいていました。SITが効果的であるためには、圧倒的な数の不妊のオスがターゲットエリアに存在する必要があるだけでなく、地元の野生のメスの蚊と効果的に求愛して交尾できる必要があります。
一連の実験は、放出する不妊の雄の最適数(KJL、RLA、SCB未発表データ)と、野生の雌による生存、行動、または受容を妨げることなく雄を不妊にする最適な放射線量を決定するために実施されました(KJL、RLA、SCB未発表データ)。これらのデータは、このグループの関連出版物で発表される予定ですが、これらの調査結果のいくつかはこのプロトコルにも含まれており、他の場所で新しいSITネッタイシマカ制御プログラムの出発点として使用できる可能性があります。この種は絶えずその範囲を拡大しており、SITプログラムは、この個体群を制御するための費用効果の高い長期的な解決策となることが大いに期待されています。このプロトコルの目的は、公衆衛生ベクター制御プログラムにおいて、地元のネッタイシマカ集団の自然な繁殖サイクルを混乱させるために、屋外エリアに体系的に放出するために、滅菌されたオスのコロニー飼育のネッタイシマカを生産することです。
トランスジェニックネッタイシマカオスの生産およびネッタイシマカSITの生産ワークフロー、またはボルバキアベースの非互換性プログラムについても同様のプロトコルおよびワークフローが公開されているが、このプロトコルは、既存のプロトコルがネッタイシマカの生産、雄の蛹の分離および照射、成人男性のマーキングおよび包装、およびこのプログラムのリリースサイトへの出荷にどのように適合したかを示しています9、 10,11,12,13,14,15,16,17,18。このプロトコルのマーキングコンポーネントは、成熟した運用SITプログラムでは必要ないかもしれません。ただし、SITプログラムを確立した初期の段階で有効性を監視し、プロセス全体の品質を制御する1つの方法であるため、ここに含まれています。蚊駆除プログラムは通常、地方自治体によって運営されているため、組織の規模や資金基盤から、地域の成功を最大化するための防除戦術の調整まで、組織の多くの面で大きく異なる可能性があります。したがって、本明細書に記載されるプロトコルは、利用可能なリソースとの互換性について評価されるべきである。
プロトコル
注:このプロトコルはネ ッタイシマカ の取り扱いに固有ですが、他の蚊種に効果的になるように変更される場合があります。
1. ネッタイシマカ のコロニーの生産と維持
- 大人の ネッタイシマカ を飼育し、卵を産みます。
- 0.6 m x 0.6 m x 0.6 mの折りたたみ式アルミニウムフレーム、20 x 20グラスファイバーメッシュスクリーニングを備えた大型飼育ケージ、および1つの垂直壁にリーチインストッキネットスリーブを準備します。
- ネッタイシマカ(性比1:1)を入れた1900mLのプラスチック浴槽を各飼育ケージに入れ、スリーブを閉じて、成虫が出てこなくなるまで(つまり、約4日間)カップをそのままにしておきます。このとき、カップを取り外し、成体の飼育ケージを28〜30°C、相対湿度>50%(Rh)、12:12または14:10の明暗(L:D)サイクルに維持します。
注: ネッタイシマカ の蛹の生産は、セクション1.2に記載されています。1900 mLの浴槽内の蛹の密度は、すべての蛹が同時に空気のために上がるのに十分なスペースがあるようなものでなければなりません。 - 蛹を飼育ケージに入れてから24時間後、スポンジ芯付きの10%ショ糖溶液の容器を置き、蜂蜜に浸した10 cm x 2 cmのスポンジを各ケージのワイヤーフックから吊るして、成虫の蚊に別々の水分と栄養源を提供します。スポンジとショ糖容器の乾燥やカビの成長を監視し、必要に応じて補充または交換します。
注意: 小さな飼育ケージでは蓋の切り欠きに10 cm x 2 cmのスポンジ芯が取り付けられた120 mLのプラスチックカップを使用し、大きなケージでは12 cm x 8cmのスポンジ芯が付いた460 mLのプラスチックカップを使用します。 - 大多数の成虫が出現してから48〜72時間後、その後2〜3日ごとに各飼育ケージに血粉を提供して、採血された雌の数を多く維持して、卵の収量を最大化します。ラムスキンコンドームに50〜100 mLの除繊牛血液を入れ、温水浴で約37°Cに温めます。次に、布またはペーパータオルを使用してコンドームを軽くたたき、部分的に乾かしてから、ケージ内の紙で裏打ちされたペトリ皿に30〜60分間置きます。
注意: 使用する前に、各コンドームの内側と外側を水で2〜3倍すすぎ、潤滑剤やその他の基板を取り除き、穴がないか確認してください。コンドームは、血液を洗い流して冷たい水に入れることで、3〜5回の給餌に再利用できます。一部のコロニーではアリの蔓延が発生する可能性があるため、アクセスを制限するためにコンドームを一時停止する必要がある場合があります。 - 各採血後48〜72時間待ってから、各成体の飼育ケージに産卵カップを導入します。カップの内周に沿って平らに取り付けられた高さ8〜10 cmx幅30 cmの種子発芽紙(産卵紙)を備えたプラスチック製の460 mLカップに、ろ過した蛹水200 mL(つまり、水の幼虫と蛹を飼育)を加えて産卵カップを準備します。産卵用紙を毎日チェックし、2〜4日ごとに交換し、卵を積んだ産卵用紙を>50%Rh 19で24〜48時間乾燥させて慎重に保管します。
注:産卵カップを飼育ケージに72時間以内放置して、卵が孵化するのを防ぎます。 - 成虫飼育ケージを分解して新しい成体飼育ケージを設置する前に、最大3〜4週間維持します。
- 飼育ケージを分解するには、産卵カップを取り外して清掃し、卵を積んだ産卵用紙を保管し、ショ糖溶液容器とハニースポンジを取り外して洗浄し、ケージを凍結してすべての蚊を殺します。
- すべての蚊の体を取り除き、ペーパータオルとスポンジで精練パッドを使用して、希釈石鹸と水で各ケージの内側と外側を完全にきれいにします。次の飼育サイクルで使用する前に、クリーンケージを少なくとも24時間乾燥させてください。
注意: アレルギーにつながる可能性のある粒子を除去するには、高効率ろ過を備えた真空装置を使用してください。ショ糖溶液容器は洗浄して3〜5倍再利用できます。
- 卵からの ネッタイシマカ の幼虫の飼育
- 80 gの3:2の比率の牛肝臓粉末:ビール酵母を2200 mLの水道水に混合することにより、幼虫栄養スラリーのストックを準備します。粉砕した魚料理を準備します。魚のフレークをスパイスグラインダーに注ぎ、それが微粉末になるまで挽く。
注:このスラリーは、この実験室では 茶色 に指定されています。 - ステップ1.1.5の卵を積んだ(5,000〜10,000個の卵)産卵紙を使用して、産卵線に垂直に卵紙の3〜7 cmの部分を切り取り、粉砕した魚の餌フレークのピンチと一緒に水道水を半分満たした460 mLの容器に入れます。蓋をして、少なくとも1分間激しく攪拌します。
注:卵紙は、胚形成を可能にするために孵化プロセスを開始する前に、産卵後少なくとも7日間(ただし、孵化を減らすことができる90日以内)保管する必要があります。魚の餌に存在するバクテリアや藻類は水を急速に脱酸素化し、幼虫の発育を引き起こします。 - ステップ1.2.2の容器の内容物全体を、3 Lの水道水と50 mLの 茶色 のスラリーで準備した幼虫飼育パンに注ぎます。鍋に開始日、ひずみ情報、 表1ごとの給餌スケジュールをマークし、28〜30°C、>50%Rh、および12:12または14:10 L:Dで保管します。サイクル。
注:3 Lの水と50 mLの 茶色 の比率は、 材料の表に記載されている特定の幼虫の鍋の水深に基づいています。異なるサイズの鍋は異なる蛹密度をサポートするため、異なる量の水と 茶色 のスラリーを必要とします。 表1 の幼虫の摂食速度は範囲として与えられています。使用量の選択は、水の濁度、色、臭いなどの変数を使用した、発育中の幼虫の全体的な健康状態の経験と決定に基づいています。水上の細菌膜の存在;生きている幼虫と死んだ幼虫の数または比率;そして幼虫の運動性。3〜6日目に、 表1に従って魚介類を粉砕した未熟蚊の餌を餌とする。水を追加し、食物を減らし、プロジェクトが必要とするよりも2〜3個の余分な鍋を設置することは、不健康な幼虫の鍋を管理する方法です。
- 80 gの3:2の比率の牛肝臓粉末:ビール酵母を2200 mLの水道水に混合することにより、幼虫栄養スラリーのストックを準備します。粉砕した魚料理を準備します。魚のフレークをスパイスグラインダーに注ぎ、それが微粉末になるまで挽く。
| 日 | ボリューム栄養スラリーを追加 | 追加された水の量 | アクション |
| 1 | 50 mL (スラリー) | 3000ミリリットル | |
| 2 | (食べ物なし) | (水なし) | |
| 3 | 小さじ1/4〜1/2(粉砕魚料理) | 500-1000 mL | |
| 4 | 小さじ1/2〜3/4(粉砕魚料理) | 500-1000 mL | |
| 5 | 小さじ1/2〜3/4(粉砕魚料理) | 500-1000 mL | |
| 6 | 小さじ1/4〜1/2(粉砕魚料理) | 500-1000 mL | |
| 7 | (食べ物なし) | (水なし) | ひずみ蛹と幼虫 |
表1:ネッタイシマカ幼虫の大量飼育のための給餌スケジュール 。
2.オスの ネッタイシマカ の分離
- 幼虫の鍋から蛹を集中させます。蛹のおおよその閾値の割合に達したら、各鍋の内容物をふるい(サイズ20-40)を通して注ぎます。水道水のスクイーズボトルを使用して、蛹と幼虫をふるいから3000mLの目盛り付きプラスチックビーカーに洗い流します。
注:蛹が快適に表面に到達できるように、過密状態を避けるために、各3000mLビーカーに2〜3個の幼虫鍋のみを移す必要があります。蛹は、ステップ1.2.3で述べた温度と光の条件下で、卵の孵化後130〜140時間の間に成長すると予想されます。卵がセットアップされたのと同じ日に顕著な卵の孵化を期待してください。環境条件にもよりますが、幼虫の約20〜70%が蛹化し、6日以内にふるいにかける準備が整います。蛹を複数の3000 mLビーカーに仕切ることで、セパレーターに注ぐための管理可能な量が保証されます。 - 雄の蛹を幼虫と雌の蛹から分離します。
注: この手順は、1 人のオペレータまたは 2 人のオペレータが実行できます。- 雄の蛹を分離する単一のオペレーターの場合:
- ステップ2.1で生成された各3000mLビーカーの内容物を複数の1900mLプラスチック容器に分割して、こぼれを減らし、セパレーターに過負荷をかけます。セパレーターの基部の水門の下に硬質の浅い4000 mLの収集容器を置いて、プレートセパレーターを準備します(図1)。2つの3000mL目盛り付きプラスチックビーカーに水道水を約3/4満たします。
注意: 3000mLのプラスチック製目盛り付きビーカーの代わりにシンクホースを使用してください。それ以外の場合は、分離プロセス全体を通してビーカーを継続的に補充する必要があります。蛹分離器を操作するためのさらなる詳細は、参考文献12、20に見出すことができる。 - ガラス板の間のスペースに水を注ぎ、上部と下部のノブを時計回りまたは反時計回りに調整して、水が連続的に流れるようにすると同時に、プレートの基部から約1.25cmの高さまで溜まった水を生成します。下部ノブの開始位置をテープでマークします。立っている水が等しい高さと排水速度でガラス板の基部全体に均等に分配されたら、プレート間のスペースを通して蛹と幼虫の容器の内容物を注ぎ始めます。
注:小さな(男性)蛹と大きな(女性)蛹の間に明確な分離が存在する必要があります。それ以外の場合は、このバッチを洗い流し、上部のノブを調整してプレート間のスペースを減らします。 - セパレーターにゆっくりと水を注ぎながら、ほとんどまたはすべての幼虫が洗い流され、水門を滑り落ちて収集容器に入るまで、テープでマークされた開始位置から反時計回りに~1〜2 cmで下部ノブをペアで回転させ続けます。
注意: 片方の手で水を注ぐときに、もう一方の手でノブを一度に1つずつ回転させますが、均等に少しずつ回転させて、プレートをゆっくりと開きます。ほとんどの幼虫はすぐに洗い流されますが、オスの蛹で捕まえられた幼虫もいます。これらのストラグラー幼虫は照射されますが、発育が遅れ、蛹の焦点コホートを持つ成虫には近づきません。 - 幼虫を廃棄またはリサイクルしてコロニーに戻しますが、いずれの場合も、オスの蛹がセパレーターで洗浄を開始する前に、収集容器から取り出します。水門の底にある収集容器が別の容器に逆洗される#30ふるいを通して注ぐことによって幼虫が取り除かれている間、水の流れを止めることによってプロセスを一時停止します。
注:幼虫が最初に流れ、次に雄の蛹、最後に雌が流れます(図1)。 - オスの幼虫が洗い流されて収集容器に分離されるまで、水を注ぎ続け、下部のノブを回転させます。プロセスを一時停止して、次のステップでオスの蛹を移す前に、収集コンテナから幼虫をチェックして取り除きます。
注意: オスを分離するために必要なフラッシュの数は、注水のテンポとノブを回転させる速度によって異なります。通常、幼虫を洗い流すのに2000〜2500 mLの水、雄の蛹を洗い流すのに1000〜1500 mL、雌の蛹を洗い流すのに200〜400 mLの水が必要です。 - オスの蛹をシンクの上の#20ふるいを通して収集コンテナから注ぎます。水道水の1000 mLスクイーズボトルを使用して、別の1900 mL容器に注ぎながら、ふるいから雄の蛹を逆洗します。
- すべてのオスの蛹が分離されたら、セパレーターから水を注ぎ続け、下部のノブを調整してメスの蛹を通してフラッシュします。ステップ2.2.1.6で説明されているふるいプロセスを使用して、すべての未熟な蚊がセパレーターから洗い流されるまで、雌を別の容器に移します。女性の蛹を捨てます。バッチが処理されたら、ノブを元の開始位置に戻し、次のバッチでプロセスを繰り返します。すべてのバッチが処理されたら、セパレーターが乾くようにプレートを開いたままにします。
注意: このデバイスを使用して完全な分離はなく、忍耐と練習が必要です。頑固な蛹や幼虫は、大量の水で取り除くことができますが、それがそれらを側面に押しやるほどではなく、将来の浸水を汚染する可能性があります。
- ステップ2.1で生成された各3000mLビーカーの内容物を複数の1900mLプラスチック容器に分割して、こぼれを減らし、セパレーターに過負荷をかけます。セパレーターの基部の水門の下に硬質の浅い4000 mLの収集容器を置いて、プレートセパレーターを準備します(図1)。2つの3000mL目盛り付きプラスチックビーカーに水道水を約3/4満たします。
- 雄の蛹を分離する2人のオペレーターについては、セクション2.2.1を次のように変更します。
- 最初のオペレーター:セパレーターに水を注ぎ、ノブを段階的に回転させて、幼虫、オスの蛹、メスの蛹を分離します。
- 2番目のオペレーター:各段階が水門容器に集められたら、水門容器の内容物をふるいにかけ、幼虫、雄の蛹、および雌の蛹を複数の別々の水門収集容器に分割します。シンクホースが利用できない場合は、大きなビーカーを水でいっぱいにしてください。
- 雄の蛹を分離する単一のオペレーターの場合:
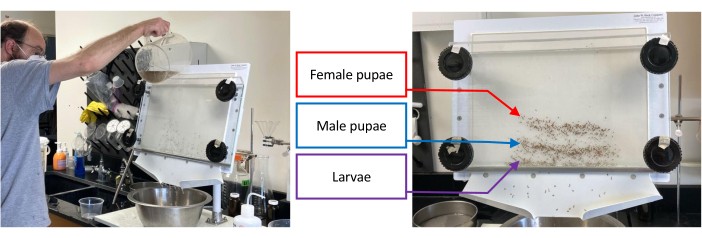
図1:未熟ネ ッタイシマカのバッチを含む蛹分離器。 分離は、ターゲットセット、つまり幼虫、雄の蛹、または雌の蛹が残っているセットから可能な限り分離されるまで、下部のノブを反時計回りに1〜2 cm回転させながらセパレーターに水を注ぐことから始まります(左の画像)。右の画像は、幼虫(下のバンド)、オスの蛹(中央のバンド)、メスの蛹(上のバンド)の分離を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
3.照射用ネ ッタイシマカ の雄の調製
- オスの蛹をプラスチック製の60 mmペトリ皿に分割します。
注:必要なペトリ皿の数は、照射可能な雄の蛹の数によって異なります:ステップ1.2の1つの幼虫飼育鍋は約1.5枚のペトリ皿を満たします。蛹の年齢は1〜40歳です。このプロトコルでは、ペトリ皿の小さい直径の深い半分は 下部と呼ばれ、大きい直径の浅い半分は 上部と呼ばれます。- ペトリ皿底部の内径に合うようにろ紙のプレカットディスクを準備します。ペトリ皿の底のそれぞれに水で湿らせたろ紙ディスクを1つ置き、輸送と照射プロセス全体を通して蛹を水和させます。
- 蛹をペトリ皿に移します。ステップ2.2.1.6で集めた雄の蛹をふるいで濾し、できるだけ少ない水で1000mLの目盛り付きビーカーに蛹を洗います。各ろ紙ディスクが単層の蛹で均一に覆われるまで、蛹をペトリ皿に慎重に注ぎます(図2A - C)。注ぎやすくするために、テーブルの端にペトリ皿を一列に並べます。
注:蛹を濾す代わりに、プラスチック製の3mLパスツールピペットの先端を蛹を収容するのに十分な大きさの直径に切り取る方法があります。ピペットを使用して、ステップ2.2.1.6で作成した容器から濾紙ディスクに直接蛹を移し、各ペトリ皿に蛹の単一の密集した層があるようにします。これは、小さなバッチでのみ実用的です。 - 変更されていない3 mLパスツールピペットを使用して、ペトリ皿の底から溜まった水を取り除き、性別ステップ(3.2)および輸送中の蛹の動きを防ぎます。

図2:照射のために蛹をペトリ皿に移す 。 (A)ふるいにかけた蛹を1000mLのプラスチックビーカーに注ぎ、逆洗する。(B)ペトリ皿への注ぎを容易にするために、ビーカーに最小限の水が保持されます。(C)蛹の単層に注ぐのを容易にするために、表面の端に沿って並んだペトリ皿。(D)蛹を積んだペトリ皿を積み重ねて固定し、照射施設に届ける。 この図の拡大版を表示するには、ここをクリックしてください。
- 女性との汚染をチェックするために蛹をセックスします。解剖スコープの下で、プローブを使用して各蛹を回転させ、男性の性別を示す大きなサイズの生殖器葉(図3)がないか腹側表面を確認します。女性を示す減少したまたは小さな生殖器葉で蛹を取り除き、正しい数を維持するために同数の男性の蛹と交換します。
注:運用プログラムでは、蚊の数が多く、照射後のケージの分離、移動、照射、および準備がすべて限られた時間で1日で行われるため、このステップは実用的ではありません。厳選されたペトリ皿からのサンプルの品質チェックは、特にSITプログラムの開発の初期段階で行うことができます。
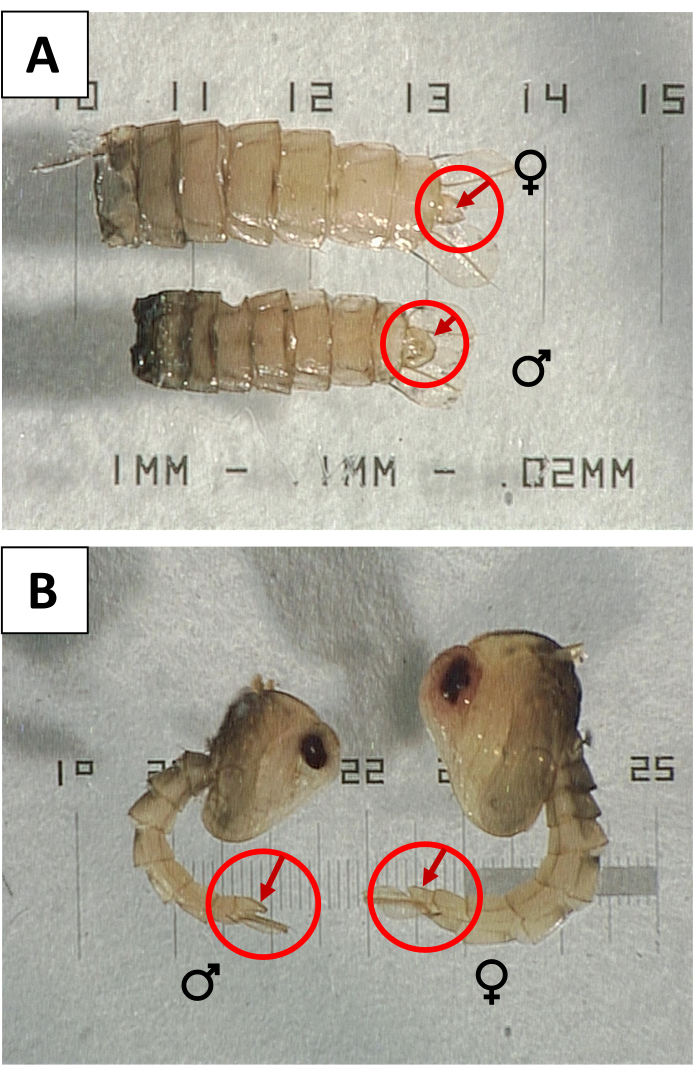
図3:生殖葉を使用した蛹の性別 。 (A)腹側および(B)女性()および男性(♀ ♂)の側面図()ネ ッタイシマカ の蛹、性器葉は性的二形性を示すことが示されている。 この図の拡大版を表示するには、ここをクリックしてください。
- ペトリ皿の上部で底を覆い、実験用テープで固定します。テープで留めたペトリ皿を弾性バンドで束ね、照射チャンバーに収まる大きさの積み重ねにし、ラベルの付いた3.8 Lの再封可能なバッグの中に密封します(図2D)。蛹を>1時間覆いのないままにしないでください。
4.オスの ネッタイシマカ の照射
- 1 cm2 の正方形のフィルムを切り取り、各正方形を個々の封筒に入れることにより、同じロットから線量測定フィルムを準備します。
注:毎日使用されるすべてのフィルムは同時にカットされます。これにより、ストレージによって引き起こされる少量の変動が減少します。各スタックに必要な正方形の数は1+(ペトリ皿の数)です。 - 検査室のタイマー、検査用テープ、永久マーカー、準備された線量測定フィルムの封筒、線量測定バッジ、および重要な情報を追跡するためのチェックリストが記載された検査室のメモシートを含む、照射施設に持ち込むキットを準備します(図4)。
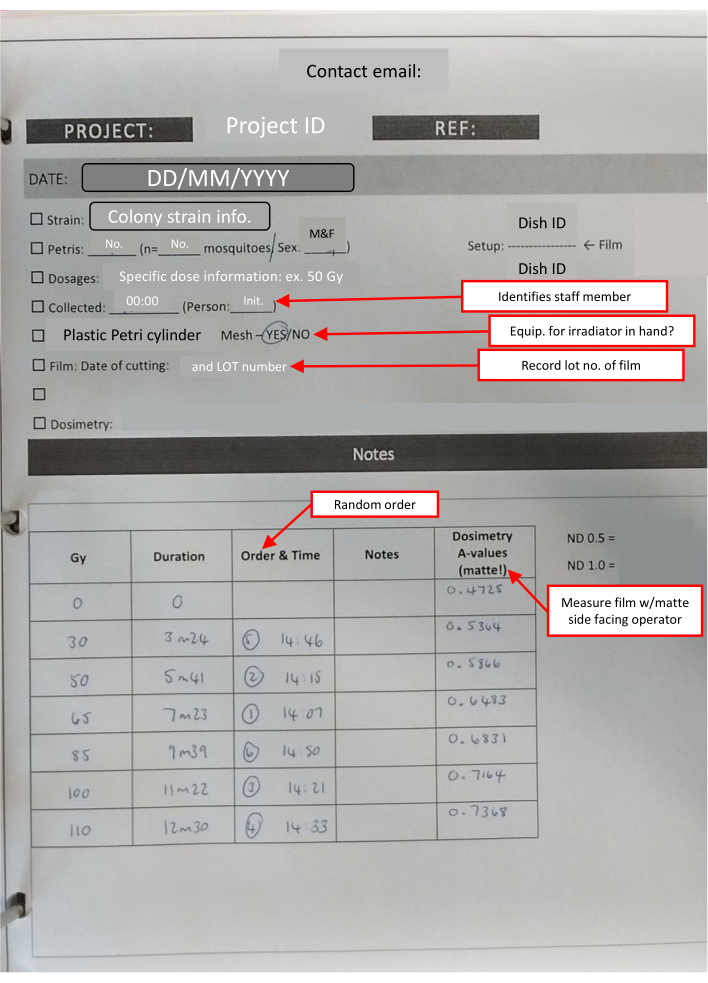
図4:用量反応セットの実験本の概要-IR シートが完成しました。 赤で囲まれたテキストボックス(赤い矢印でマーク)は、さまざまなセクションの有用なメモを示し、重要な情報を繰り返します。 この図の拡大版を表示するには、ここをクリックしてください。
- 蛹を照射施設に輸送する。ステップ3.3の雄の蛹のペトリ皿を断熱容器に入れ、直射日光を避け、輸送中はエアコンを付けて保管してください。
- 照射器で照射するシャーレのスタックを準備します。照射チャンバーに収まるように適切な数のペトリ皿を、各皿とスタックの上部と下部の中央に線量測定フィルムエンベロープで積み重ねます。封筒とスタック全体を実験用テープで固定して、こぼれを防ぎ、チャンバー内のスタックの配置を容易にします。
- 雄の蛹のペトリ皿に照射します。ペトリ皿のスタックをチャンバ内の硬質金属メッシュ上に置き、特定の照射ユニット21の以前の線量マッピングに基づいて最適な円錐露光のために正しい高さに配置する。照射器のターンテーブルを起動して照射し、同時に実験室タイマーを開始します。所望の線量を達成するために適切な間隔で照射する(実施例を 表2に示す)。
注:このプロトコルは、セシウム137照射器( 材料の表を参照)と50Gyの目標線量に基づいています。Cs-137は時間とともに減衰するため、照射率は、日常的な線量測定用のラジオクロミックフィルムと照射サンプルの約10%のアラニンを添加したアラニン線量計を使用して線量反応シリーズを実行することによって毎年調整されます。現在の線量率8.8Gy/minを考えると、50Gyの目標線量を達成するには5分41秒の曝露が必要です。ルーチンのフィルム線量測定は、ステップ4.7で説明されているように行われます。アラニンペレット線量測定は、テキサスA&M大学の国立電子ビーム研究センターまたは米国メリーランド州ゲイサーズバーグの国立標準技術研究所のいずれかで実施されます。
| 投与量(Gy) | 時間(8.8 Gy/分に基づく) |
| 0 | 該当なし |
| 10 | 1 分 8 s |
| 30 | 3 分 24 秒 |
| 50 | 5 分 41 s |
| 65 | 7 分 23 秒 |
| 85 | 9 分 39 s |
| 100 | 11 分 22 秒 |
| 110 | 12 分 30 秒 |
表2:セシウム137照射器の投与時間の例。
- 規定の時間が経過したら、照射器からペトリ皿を取り外し、スタックを慎重に解体します。すべてのペトリ皿とフィルム封筒に、スタック内の日付と場所にラベルを付けます。封筒を密封し、線量測定のために保管します。ペトリ皿を断熱容器に再梱包して、メインラボに戻します。
注:照射中に成虫が出てきたかどうかを記録し、影響を受けたペトリ皿に印を付けて、蛹が飼育ケージに入れられたときに成虫が逃げないようにします(ステップ5.2)。 - 照射後約24時間でフィルムを測定し、線量測定フィルムで照射線量を確認する。線量測定リーダーをアクティブにし、室温に平衡化させます。リーダーに付属の鉗子を使用してフィルムをロードし、製造元の指示に従って、同じバッチから照射されたフィルムと未照射のブランクフィルムを読み取ります。読取りの間にフィルムを出さずに読取り装置をゼロにし、 図5に示すデータシートの例のようにデータを記録します。
メモ: このプロトコルは、ND0.5 および ND1.0 QA フィルタセット規格に基づいています。マット面をオペレーターに向けてフィルムを測定することが重要です。
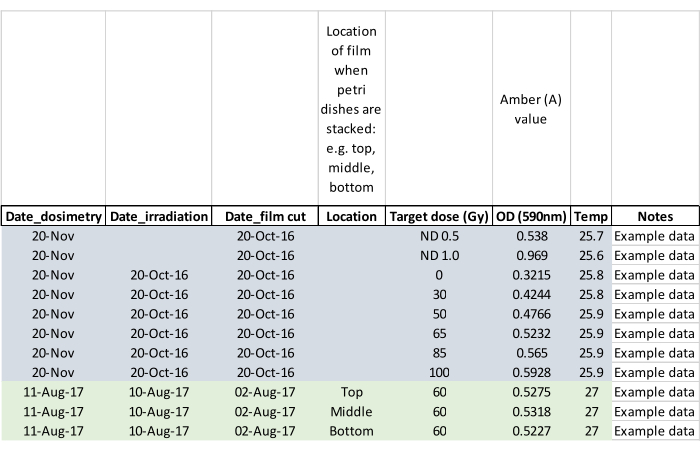
図5:サンプルデータが入力された線量測定データシート。 列見出しは、後で分析するために重要なデータを取得するようにオペレーターに促します。 この図の拡大版を表示するには、ここをクリックしてください。
5. 照射された ネッタイシマカ の成虫への飼育
- 30cm×30cm×30cmの小さなプラスチック製飼育ケージを清掃して準備し、本研究室に戻ったときに照射された蛹の準備が整うようにします。照射された雄蛹のペトリ皿2枚ごとに、飼育ケージを1枚用意します。ステップ1.1.3で説明されているように、460 mLの水道水と1つの10%ショ糖溶液容器を含む半分満たされたプラスチックカップを各飼育ケージにストックします。
- 照射施設から戻ったら直ちに照射した蛹を用意した飼育ケージに移す。スクイーズボトルの水を使用して、各ペトリ皿の蛹を各飼育ケージのプラスチックカップ内の460mLの水に注意深く洗い流します。24時間後、カップを栄養源を含む新しい清潔な飼育ケージに移し、成体の雄に照射された ネッタイシマカの残りの閉鎖を待ちます。
注:照射プロセス中に蛹が出てきた場合は、チラシの入ったペトリ皿を空のケージに入れてから、手順5.2に進みます。このケージに集められた男性を捨てなさい。蛹は、同じコホートの雌の前に雄が出現し、出現日を隔離することで雌の汚染の発生率を減らし、雄の正確な老化を確実にすることができるため、24時間後に新しい飼育ケージに移されます。
6.照射された成人ネ ッタイシマカ の男性のマーキングと計量
注: プロトコルのこのセクションでは、2 人のユーザーがタスクを実行していることを前提としています。1人の場合は,6.4を参照してください。

図6:マークされ、照射されたオスの ネッタイシマカを 放出容器に詰める。 (A)マスキングテープ、ステープル、ホットグルーでカードストックシリンダーの側面に開けられた穴にストッキネットを固定したリリースコンテナ。ベゼルは、側面にマスキングテープラベルの裏地が貼られた状態で固定されています。ベゼルはしっかりと引っ張られたチュールメッシュカバーを保持しています。ゴムバンド(見えない)もチュールをベゼルの下の所定の位置に保持しています。(B)小さなカードストックカップでピンク色の染料で転がされる過程で麻酔をかけられた男性のバッチ。(C)断熱輸送コンテナ内の4つのリリースコンテナ。ストッキネットスリーブは輸送用コンテナの中央に向けられ、梱包材はリリースコンテナの周りに押し込まれ、栄養と水分の供給源は、交差したゴムバンドとテープのビットでしっかりと保持された逆ペトリ皿の底で覆われた各リリースコンテナの上部に配置されていることに注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
- カードストックリリースコンテナを準備します。
- 蓋付きの円筒形の3.9 Lカードストックコンテナの側面に直径11.5 cmの穴を開け、穴が蓋で覆われないように、底から1.5〜3.0 cmのところに穴を開けます(図6A)。
- 長さ40〜50 cmのストッキネットを切り、6.1.1でカットされた11.5 cmの穴の内側に一端をホッチキスで留めます。ステープルをストッキネットとカードストックを通して容器の内側から、硬質押出発泡スチロールのブロックなどの適切な作業面に押し込むことができるように、開いた標準的なオフィスホッチキスを使用します。マイナスドライバーを使用してステープルを圧着し、ストッキネットを穴の周囲にしっかりと固定し、引っ掛かりを防ぐために圧着面にマスキングテープを固定します。シリンダーの内側にあるストッキネットの端をホットグルーでカードストックにシールし、アセンブリ全体に逃げ穴がないかクロスチェックします。
- 蓋から内側のディスクを取り外して保持ベゼルを作成し、成体のオスの ネッタイシマカ を保持するのに十分な細粒のナイロンチュールメッシュの33cm x 33cmの正方形を切り取ります。メッシュをシリンダーの開放端に置き、ベゼルをメッシュの上にはめ込んで、隙間なく所定の位置に保持します。メッシュを下に引いてベゼルの下に突き出し、メッシュが開放端を横切って教えられるようにし、突き出たメッシュを輪ゴムでシリンダーにしっかりと固定します。
- ベゼルの側面に10cmのマスキングテープを貼り、8cmのラベリングテープで覆い、ベゼルを破ることなく簡単にラベリングテープを交換できるようにします。
注意: リリースコンテナは耐久性があり、適切な取り扱いで>10倍に再利用できます。マーク、照射、成虫、雄の蚊の新しいバッチを導入する前に、ストッキネットが容器にしっかりと取り付けられていることを確認し、必要に応じて迅速に修理を行います。
- 計量およびマーキングステーションを準備します。
- 約50 mgのマーキング染料を240 mLのカードストック容器に注ぎ、染料を粉末のコートとして容器の内面に均等に広げます。軽くたたいて余分な染料を捨てます。色を分離しておくために、複数の染料に明確にラベル付けされたカップを使用してください。
- 100-500 gの計量ボートを0.0001 gの電子天秤に風袋引きします。データフォームを作成します(表3)。215.9mm x 355.6mmのコピー用紙を4枚テープで貼り合わせて、431.8mm x 711.2mmの作業面を作ります。
| リリースコンテナ | 蚊の重さ | ケージ番号 | バッチの女性 | 男性の数 | リリースコンテナ | 総質量 |
| ピンク I | 0.024 | D1 #1 | 25 | ピンク I | 2.03 | |
| ピンク I | 2.007 | D1 #1 | 7 | ピンクII. | 1.99 | |
| ピンクII. | 1.990 | D1 #1 | ピンク III | 2.03 | ||
| ピンク III | 0.026 | D1 #3 | 25 | |||
| ピンク III | 2.000 | D1 #3 | 18 |
表3:計量ステーションデータテーブル。
- 蛍光顔料を照射した成人男性の定量化されたバッチをマークします。
- 成虫の蚊(2.5〜3.5日齢)を各飼育ケージから吸引器バイアルに移します。ステップ5.2から飼育ケージから栄養源を取り除き、ケージ全体を大きなCO2 チャンバーに5〜7分間置き、コンテナの側面をノックして、飼育ケージにしがみついている可能性のある蚊を取り除きます。暴露時間が経過したら、飼育ケージをチャンバーから取り出し、すべての成虫の蚊を一連のプラスチック吸引バイアルに吸引します。
注:99.5-100%CO2 の投与は、レギュレーター、真ちゅう製のバーブ、シリコンチューブが6 L / minの流量でチャンバーに流されたタンクから行われます。飼育ケージをクリアするために必要なバイアルの数は、ケージ内の蚊の数とオペレーターの習熟度によって異なりますが、通常、ケージあたり3〜5本のバイアルが必要です。成虫の蚊の管理を容易にするために、小さなクイックチェンジバイアルを備えたアスピレーターを選択してください 例えば、一方の端に20 x 20メッシュのアルミニウムスクリーンで密封された60 mLポリスチレン収集バイアルを使用し、もう一方の端に透明なアセテートフラップバルブを使用します。ケージ全体を吸引前に麻酔し、蚊をバイアルに移す時間を短縮して、蚊へのストレスを軽減し、プロトコルを扱いやすく保ちます。 - 各飼育ケージからすべての成虫の蚊を性別で分類します。
- ステップ6.3.1の最初のバイアルを小さなチャンバー内のCO2 に4分間さらし、麻酔をかけた蚊を静かに振り落とし、ステップ6.2.2で準備した白い紙の作業面に広げます。
- 新しい空のバイアルを吸引器に入れ、作業面からすべての男性を注意深く吸引し、このバイアルを計量ステーションに渡します(ステップ6.3.3)。取り残された女性を集計し、別のバイアルに入れて、押しつぶされた男性と一緒に廃棄します。
- 6.3.1の残りのバイアルでこのプロセスを繰り返しますが、性別選別プロセスのある時点で、25人のオスのみを含む別のバイアルを生成し、それも計量ステーションに渡されます。手順 6.3.2 を繰り返します。飼育ケージごとに。
注:照射された成人男性を性別、計量、マーキングのために処理する際に、蛹の性別選別のトラブルシューティングと品質保証およびプロセス全体の重要なデータである各バッチの雌の数を追跡します。女性の数が予想よりも多い場合は、メインオペレーターがオスを吸引している間、2人目の人がメスを抽出する必要があります。各飼育ケージから25匹のオスのサンプルを計量して、蚊あたりの平均体重を計算することが重要であり、これはプロトコルの最後に放出された顕著な照射されたオスの数を推定するために使用されます。
- 成体のオスの蚊のバッチを計量して染色する。
- 計量ステーションで、性別ステーション(セクション6.3.2)からの成体の雄の蚊の最初のバイアルを小さなCO 2チャンバーに2分間置き、ステップ6.2.2で準備した風袋引き計量ボートに蚊を注意深く振とうします。蚊の体重を記録し、6.2.1で準備した染料カップに蚊を注ぎます。
- カップを時計回りと反時計回りにゆっくりと1回転させて回転させ、蚊がカップの内面の粉体塗装に接触し、すべて染料を軽くまぶします(図6B)。マークされた蚊を計量ボートに注ぎます。
- 蚊が回復して逃げないように、次のステップにすばやく進んでください。セクション6.3.2のすべてのバイアルが処理されるまで、この手順を繰り返します。
注:セクション6.3.2の各飼育ケージに対して生成された25匹のオスの別々のバイアルからのオスの体重が記録され、そのケージからのオスあたりの平均体重を計算するために使用されます。
- 放出容器にマークされた照射された成人男性をロードします。セクション6.3.3の終わりから、麻酔をかけ、マークを付け、照射した雄の蚊を含む計量ボートをわずかに折ります。をクリックしてチャネルを作成し、このチャネルをストッキネットスリーブに通してオスをリリースコンテナに移します。約2.0 gまたは1500〜3000匹のオスの蚊がリリースコンテナに入るまで蚊を追加し続け、ストッキネットスリーブを閉じます。剥離容器のベゼルにあるラベルテープに染料の色、容器番号、および蚊の総重量をマークし、これらのデータを手順6.2.2のフォームにコピーします。
注:あらゆるライフステージでの蚊の取り扱いはストレスを誘発し、生存率や活力を低下させる可能性があります。このプロトコルに記載されている一連の麻酔は、蚊に影響を与える可能性があります。しかし、各ステップで麻酔されていない蚊を追跡して吸引しようとすると、より大きなストレスと持続不可能なプロトコルが引き起こされます。各放出容器内の蚊の総重量を、セクション6.3.3で生成された雄の蚊あたりの平均重量で割って、その放出容器内の雄の数の推定値を導き出します。各放出容器は2g以下の雄を持つべきであり、これは約1つの大きな飼育ケージに相当する。
- 成虫の蚊(2.5〜3.5日齢)を各飼育ケージから吸引器バイアルに移します。ステップ5.2から飼育ケージから栄養源を取り除き、ケージ全体を大きなCO2 チャンバーに5〜7分間置き、コンテナの側面をノックして、飼育ケージにしがみついている可能性のある蚊を取り除きます。暴露時間が経過したら、飼育ケージをチャンバーから取り出し、すべての成虫の蚊を一連のプラスチック吸引バイアルに吸引します。
- 単一オペレーターのマーキングプロトコルの変更
- 最初にすべての大きなケージの性別選別を行います。各大きなケージをCO2 に4〜5分間さらし、すべての蚊を4〜5本のバイアルに吸引します。各バイアルをCO 2に2 〜3分間さらし、すべての蚊を白い紙の作業面に傾け、メスを取り除いて集計し、オスを大きな個体群のケージに戻します。
- 計量とマーキング
- ステップ6.4.1で作成された最初のオスの保持ケージから始めます:栄養源を取り除き、大きなCO2 チャンバーでオスを5〜7分間麻酔します。麻酔をかけた男性を別々のバイアルに均等に吸引します。各保持ケージを製造された順序でこの手順を繰り返します。
注:保持ケージごとに約2〜3個の混雑したバイアルが生成されます。オスの保持ケージを生産された順に処理すると、オスの各ケージの回復時間が最大化されます。 - ステップ6.4.2.1で作成した最初のバイアルを麻酔します。小さなCO 2チャンバーで1〜2 分間。少数の蚊を白い紙の作業面に注ぎ、25匹のオスの蚊を新しいバイアルに吸引し、6.3.2のように処理して、そのケージのオスあたりの平均体重を決定します。追加の男性をソースバイアルに戻すか、後で処理するために新しい別のバイアルに吸引します。ステップ6.3の残りの部分で説明されているように、最初のバイアル内の残りの男性の計量、マーキング、およびリリースコンテナへの移動に進みます。手順 6.4.2.2 を繰り返します。(25人の男性を別のバイアルに分離することを除く)ステップ6.4.2.1で製造された残りのバイアル用。それらが生産された順序で、そして次に6.4.1で生産された次の性別選別飼育ケージに移ります。
注:1人のワークフローは遅く、一部のオスの蚊は複数回麻酔する必要があります。常に雌の蚊を探して取り除きます。
- ステップ6.4.1で作成された最初のオスの保持ケージから始めます:栄養源を取り除き、大きなCO2 チャンバーでオスを5〜7分間麻酔します。麻酔をかけた男性を別々のバイアルに均等に吸引します。各保持ケージを製造された順序でこの手順を繰り返します。
7.マークされた、照射された、成人男性のネッタイシマカエジプトの包装および出荷リリースコンテナ
- 出荷用のリリースコンテナを準備します。放出容器がマークされたオスで満たされたら、メッシュの蓋に10%ショ糖溶液で湿らせた4つの綿球を置き、容器全体とペトリ皿の上に張られた2本の輪ゴムで所定の位置に保持されたペトリ皿の逆さの底で覆い、十字を形成します。2つの輪ゴムのXの上にマスキングテープを置き、逆さのペトリ皿の上に固定します。
注意: 10%ショ糖溶液を含むコットンボールが滴り落ちるほど飽和していないことを確認してください。 - カードストックリリースコンテナを押出発泡スチロール輸送クーラーに梱包します。クーラーの蓋に4つの通気孔を突き刺し、綿で塞いでアリを防ぎ、逃げた蚊を保ちます。各コンテナのストッキネットを中央に向けて、4つのリリースコンテナを輸送用クーラーに直立させます(図6C)。各容器の間と中央にプチプチを押し込み、安定させます。輸送用クーラーの残りのスペースをエアピローで埋めるか、4つのリリースコンテナの2番目の層を最初の層の上に直接積み重ね、同様にエアピローで安定させます。
注意: リリースコンテナは、振っても動かないように十分に安定している必要があります。パッケージ内の温度は周囲温度です。 - 配送用クーラーを配達用に準備します。換気された蓋で輸送用クーラーを密封し、段ボールのオーバーパックに入れ、テープで閉じて、夜行便でリリース場所に発送します。
結果
用心深く適切な蚊の飼育は、コロニーケージでのオスとメスのバランスのとれた可用性、新鮮なショ糖溶液と蜂蜜の維持、および一貫した高品質の血液供給で構成されています。これらの条件は、SIT幼虫飼育鍋での使用に最適な密集した卵シートを提供します。古いものから新しいものまで使用を容易にするための体系的なラベル付けなど、乾燥卵シートの適切な保管と使用は、すべての鍋で均一な孵化をサポートします。孵化前にすべての幼虫飼育鍋に水を入れると、卵シートが孵化容器に入っている時間を短縮し、健康な発育を促進することができます。孵化から蛹化までの幼虫の鍋のメンテナンスには、発達段階や環境変数に応じて多かれ少なかれ食物や追加の水が必要になる可能性があるため、コロニーの職員による慎重な関与が必要です。蛹の性別分離の予定日までに発達段階に問題がある場合は、孵化の早さや遅さ、餌の調整、インキュベーターの温度の変更など、プロセスの早い段階で調整を行う必要があります。
このプロトコルの飼育プロセスは、すべての卵が時間内に孵化し、照射して制御目的で使用できる蛹に成長するわけではありません。コロニーで飼育された蚊の20〜50%は、蛹を分離する必要がある時までにまだ幼虫です。しかし、これらの幼虫は浪費されませんが、24時間成熟させて、前日の分離から雌の蛹と組み合わせてコロニーケージに戻すことができる追加の蛹をレンダリングします。コロニーケージでは、蛹は成虫に成熟し、交尾し、採血し、SITプロジェクトを維持する卵を産むことができます。
蛹を分離し、蛹をペトリ皿に注ぎ、照射し、照射後に成虫の保持ケージに配置することは1日で行われなければなりません。したがって、すべてのステップを快適に処理するために十分な時間を割り当てる必要があります。リリースコンテナの組み立てと準備は、マーキングプロセスの前に行う必要があります。出荷箱がリリースサイトから返送された場合、リリースコンテナを検査し、次の使用に備える必要があります。濡れた綿球を廃棄し、湿式放出容器を空気で抜いて、ペトリ皿を洗浄し、メッシュを交換し、容器からゴムバンドを取り外すと、使用しないときに放出容器の寿命が大幅に延びます。
COVID-19ウイルスのパンデミックの世界的な現実を考えると、通常は複数人の操作であるこのプロトコルは、各ステップでラボで1人で作業する1人が扱いやすいように変更されました。1 人のシナリオによって最も妨げられるプロセスのステップは、性別、マーキング、計量、およびコロニー飼育の維持手順です。異なる部屋で同時に動作する複数のセパレーターがある場合は、1人で性別で蛹を分けるだけで十分です。職場で社会的距離が発生するパンデミックの状況では、性別から梱包までのステップを完了するために複数のステーションを装備する必要があります。オペレーターの速度にもよりますが、15,000匹の蚊をセックスするのに1人~4時間かかり、次にマーキング、計量、梱包にさらに1〜2時間かかります。2人のシナリオでは、マーキングのために蚊が麻酔される時間が短縮され、全体的な作業時間が短縮されます。しかし、2人のシナリオでも、蚊が鎮静されている間の作業時間が限られているため、リリースケージあたり2.0 gの蚊全体を割り当てることは困難な場合があります。仔魚や成虫の飼育資材の洗浄や準備は、非常に時間と労力がかかりますが、パンデミック時に個々のオペレーターが独立して安全に作業できるように分割することができます。
成人の、マークされた、照射された ネッタイシマカ の男性を解放することは、このプロトコルの範囲外ですが、ここでは簡単に説明します。表3に報告されているように、マークされ、照射されたオスの蚊を放出するプロセスは、 重量(したがって、推定された無菌オスの数)に基づいて放出容器の均一な放出分布を決定することから始まります。貨物がベクターコントロール地区に配達された後、箱が開かれ、リリースコンテナは、リリースコンテナの死亡率または状態に関する問題について評価されます。放出容器内の蚊は、治療領域に輸送される前に、周囲温度および湿度に1〜2時間順応させる。治療エリアの放出部位は、 ネッタイシマカの野生個体群のホットスポットを集中的に監視した後に特定されます。放出のタイミング、頻度、密度は、種の生物学、気象学、公的支援、および実験室飼育能力によってバランスが取れています。
特定の放出容器は特定の放出部位と一致するため、上部のメッシュを切断して放出容器を開く前にラベルをクロスチェックする必要があり、オペレーターがメッシュを変形させてオスの一部が逃げられるようにします。この部分放出方法は、自由に飛んでいるすべてのオスが解放されるまで、コンテナに割り当てられた各リリースポイントで繰り返されます。このプロセスは、すべてのコンテナが処理されるまで、割り当てられたリリース場所の各リリースコンテナに対して繰り返されます。任意選択で、蚊が解放された後、自由に去らなかった死んだまたは障害のある蚊をペトリ皿に集め、手で数えるようにラベルを付けるか、放出された推定数を修正するために計量することができる。SIT手術の有効性を評価するために、標的地域、およびおそらく非介入対照部位における野生ネ ッタイシマ カの成虫、卵、および未熟な段階の継続的かつ広範な監視が実施されます。
ディスカッション
放射線を利用したSITを用いた制御プログラムを開始するには、 ネッタイシマカの局所株の樹立が必要である。このステップは重要であり、SITが同様の制御技術と真に区別することができます。地元の蚊の系統からプロジェクトを開発することにより、生成されたオスは、環境の変化や手がかりに適応し、近くの野生のメスを見つけて交尾することを可能にする行動をとる可能性があります。さらに、照射された局所的な雄の放出は、例えば、例えば、局所的な蚊集団に新規対立遺伝子を導入する可能性のある遺伝子組み換え蚊の非局所株の放出と比較して、否定的な世論を生じさせないかもしれない。
大量の蚊を飼育するためにかなりの資源を費やし、その約半分を制御目的で使用できることは、 ネッタイシマカ SITプログラムの制限です。幼虫の成熟を、蛹の準備が整うより明確な時間枠に凝縮するために、飼育プロトコルを改良する必要があります。これにより、分離の最適な時期により多くの蛹を集めることができます。ただし、処理する蛹を追加すると、蛹が収集されたときにより多くの雌が蛹化するリスクが高まり、したがって、雌が雄と一緒にペトリ皿に行き着き、おそらく解放される可能性が高くなります。照射された雌の ネッタイシマカ の寿命、採血行動、産卵行動は成体では減少しますが、照射された雄と一緒に偶発的に雌を放出することは良い戦略ではありません22。したがって、男性と不注意に分離、照射、マーク、および放出される女性の数を最小限に抑えることが優先事項であり続ける必要があります。
SITプログラムの成功は、最終的にはコロニー飼育され、照射されたオスによる配偶者競争の成功にかかっています。男性の競争力を維持することは、実験的に導き出された用量の徹底的な選択と、集団における不妊:野生の男性の推定比率の最大化に依存しています。用量の選択は、寿命、生殖能力、繁殖力、および蛹の死亡率を含むいくつかの重要な要素によって決定されます。オスの蚊は、放射線が増加するにつれてゼロに近づく漸近生殖能力曲線を示すことが観察されています(KJL、RLA、SCB未発表データ)。同時に、雄の蚊の寿命と活動レベルは、放射線量が増加するにつれて指数関数的に減少します(KJL、RLA、SCBの未発表データ)。したがって、男性で99.9%の不妊をもたらす用量を特定するのではなく、生存を支持しながら、より低い不妊率に焦点を当てることが好ましい。放射線照射された男性の寿命または蛹死亡率を非放射線照射男性のそれと区別しない線量範囲が特定されたら、生殖能力に関する追加の評価を実施して、男性を圧倒的に不妊でありながら競争力のある線量を特定する必要があります。
同時に、集団内のオスの蚊の数を、放出された照射されたオスの数と比較することが重要です。これは、ターゲットリリースエリア内およびその周辺のさまざまな場所から、同じ場所から、およびSITプログラムの開始前、開始中、および開始後に繰り返しオスを収集することによって達成できます。野生のオスの蚊と放出された蚊の比率を評価するために、マーク、放出、再捕獲の研究を実施する必要があります。マーク、リリース、再捕獲の研究は、特定のポイントからの既知の数のマークされた蚊の放出と、最初の放出ポイントの周囲の近接ポイントでのその後の再捕獲に依存しています。放流地点から離れた場所で再捕獲された雄と野生雄の数を比較することにより、不妊雄の競合比率を放流できるように、その地域の雄の一般的な野生個体数を推定することができます23。不妊:野生の雄の比率を最大化することは、より多くの不妊の雄を解放することによって、および/または発生源の減少、未熟な防除、または殺虫処理などの古典的な制御手段によって野生の個体数を減らすことによって達成することができる。
無菌の男性の放出の有効性を測定するために、成人のコレクションを非介入領域と時系列で比較することができます。不妊のオスが解放され、エリア内で収集されたオスとメスの数が同等の非介入エリアと比較して減少するにつれて、それは解放された不妊のオスが地元の肥沃なオスをうまく凌駕したことによるものであると仮定できます。この効果は、介入部位と非介入部位の両方に配備された産卵トラップカップでも観察できます。介入部位ではまだ卵が産生される可能性がありますが、非介入部位の卵よりも孵化が少ない場合は、雌が不妊の雄と交尾するため、受精していないと仮定できます。未受精卵の産卵がますます増えると、介入部位の雌が交代しないため、最終的には産卵が減少する可能性があります8,24。
SIT技術とプログラムの将来の方向性は、自然に医学的に重要な蚊の種にも拡大します。例えば、この技術は、ネッタイシマカとネッタイシマカの非常によく似たバイオノミクスを考えると、ネッタイシマカを制御するために容易に適応できる可能性があります。関心のある他の疾患ベクター蚊種には、アカイエカ、アカイエカ、および様々な ハマダラカ種が含まれる。この技術の有効性を向上させるには、遺伝子操作や人工淘汰によって達成できる特定の時間に生産される雄の蛹の能力を高め、雄の競争力を向上させることに依存しています。
結局のところ、SITプログラムは蚊を制御するための特効薬ではありません。代わりに、IVMプログラムなどの他の一連の制御技術のツールであり、技術間の弱点を相互補償します。たとえば、化学的制御は迅速かつ安価な制御を提供しますが、耐性と非標的死亡率の発達も促進します。SITは種特異的であり、耐性を生み出す可能性は低いですが、SITのオスは、ベクターコントロール地区外からの移民個体群を制御するために永続的に生産および放出されなければなりません。
開示事項
すべての著者は利益相反を宣言していません。
謝辞
R.-D博士に感謝します。フロリダ州セントオーガスティンのアナスタシア蚊駆除地区のXue、C.Bibbs、W.Qualls、およびV.Aryapremaは、SITプログラムの開発におけるパートナーシップと、不妊オスの ネッタイシマカの効果的な運用放出に関する専門家の洞察を提供します。この研究は、USDA-ARSとフロリダ州農業消費者サービス省(FDACS)の支援を受けました。この出版物での商号または商用製品の言及は、特定の情報を提供することのみを目的としており、USDAまたはFDACSによる推奨または承認を意味するものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 1-1/8" wrench (1" (1 inch) = 2.54 cm) | Craftsman | CMMT44707 | |
| 1/2 pint cardstock cup (1/2 pint = 236.5 mL) | Science Supplies WLE corp | 1/2 pint | |
| 1/4" tubing - tygon | Hudson Extrusions | LLDPE1/8 X 1/4 BLK | to attach to CO2 gas regulator |
| 1/8" brass barb w/ MIP connection | B&K | BHB-85NLB | to attach to CO2 gas regulator |
| 1000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-1000 | |
| 3000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-3000 | |
| Adult large cage | Bioquip | 1450D | |
| Aspirator vials | Bioquip | 2809V | |
| Bovine liver powder | MP Biomedicals | 290039601 | |
| Brewers yeast | MP Biomericals | 02903312-CF | |
| CO2 regulator | Randor | 64003038 | |
| CO2 tank (20# canister) | Praxair | CDBEVCARB20 | |
| Collection basin | Treasure Gurus | KI-ENAMELBOWL | for separator |
| Cotton balls - large | Fisher Scientific | 22-456-883 | |
| Deli cups w/lids - 470 mL | Pactiv DELItainer | PCTYSD2516 | |
| Deli cups w/lids - 1900 mL | Berry Global | T60764 | |
| DoseReader 4 | ND0.5 and ND1.0 QA Filter Set standards | ||
| Dosimetry film | Far West Technology, Inc. | ||
| Filter paper | Millipore | AP10045S0 | |
| Flashlight aspirator | Bioquip | 2809D | |
| Forceps - fine featherweight | Bioquip | 4748 or 4750 | featherweight |
| GAFchromic | radiochromic film | ||
| Gammator M | Radiation Machinery Corporation, Parsippany, NJ | Cesium-137 irradiator | |
| Hand held mechanical aspirator | Clarke Mosquito | 13500 | |
| Lambskin condoms | Trojan | Naturalamb | |
| Large CO2 chamber | Sterilite | Walmart # 568789514 | |
| Larval rearing pans | Blue Ridge Thermoforming | 01-FG-400-3N-ABS | Dimensions: 22.375 x 17.5 x 3 (inches) |
| Magnets - 20# pull | Master magnetics | MHHH20BX | |
| Marking dye | Dayglo | ECO-11 | Aurora Pink |
| Marking dye | Dayglo | ECO-17 | Saturn Yellow |
| Mesh | Falk | T301 | |
| Pasture pipettes | Thermo Scientific | 02-708-006 | |
| Petri dishes - large | VWR International | 25384-090 CS | |
| Petri dishes - small (60 mm x 15 mm) | Fisher Brand | FB0875713A | |
| Pupa separator | J.W. Hock | 1512 | |
| Red rubber hose | Welch | 331040-5 | |
| Release containers | Science Supplies WLE corp | 1 gallon | |
| Rubber bands - cross #19 | Alliance | ALL37196 | |
| Rubber bands - latitude #64 | Skillcraft | NSN0589974 | |
| Scale | Ohaus | H-4737 | |
| Seed germination paper - Heavy stock 76# | Anchor Paper | #76 | |
| Shipping coolers- 16 x 13 x 12.5" | MrBoxonline.com | Husky Foam Cooler kit | |
| Sieve #20 | Advantech | 20BS8F | |
| Sieve #30 | Advantech | 30BS8F | |
| Small cage - Bug Dorm | MegaView | Bug Dorm-1 | |
| Small CO2 chamber | Mainstays | Walmart # 562922221 | |
| Souffle cup lid | SOLO | 41165277456 | |
| Souffle cups - 4 oz (1 oz = 29.6 mL) | SOLO | 41165024104 | |
| Sponge | ocelo | MMM7274FD | |
| Squeeze bottle | Dynalon | 3UUP6 | |
| Stereoscope | Meiji Techno | EMZ-5 | |
| Stockinette | BSN Medical | 30-1006 | |
| Styrofoam | extruded polystyrene foam | ||
| Tropical fish flake food | Tetra | 4.52 pound | |
| Vaccum chamber - desiccator | BelArt | T9FB892757 | |
| Weigh boats | Globe Scientific | 3621 |
参考文献
- Moyes, C. L., et al. Contemporary status of insecticide resistance in the major Aedes vectors of arboviruses infecting humans. PLoS Neglected Tropical Diseases. 11 (7), 0005625 (2017).
- Baldacchino, F., et al. Control methods against invasive Aedes mosquitoes in Europe: a review. Pest Management Science. 71 (11), 1471-1485 (2015).
- Burkett, D. A., Cope, S. E., Strickman, D. A., White, G. B. The Deployed Warfighter Protection (DWFP) Research Program: Developing new public health pesticides, application technologies, and repellent systems. Journal of Integrated Pest Management. 4 (2), 1-7 (2013).
- Harwood, J. F., et al. Controlling Aedes aegypti in cryptic environments with manually carried ultra-low volume and mist blower pesticide applications. Journal of the American Mosquito Control Association. 32 (3), 217-223 (2016).
- Morrison, A. C., Zielinski-Gutierrez, E., Scott, T. W., Rosenberg, R. Defining challenges and proposing solutions for control of the virus vector Aedes aegypti. PLoS Medicine. 5 (3), 68 (2008).
- Klassen, W., Curtis, C. F., InDyck, V. A., Hendrichs, J., Robinson, A. S. History of the sterile insect technique. Sterile insect technique: principles and practice in area-wide integrated pest management. , 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector Borne and Zoonotic Diseases. 10 (3), 295-311 (2010).
- Dame, D. A., Curtis, C. F., Benedict, M. Q., Robinson, A. S., Knols, B. G. Historical applications of induced sterilisation in field populations of mosquitoes. Malaria Journal. 8, (2009).
- Bond, J. G., et al. Optimization of irradiation dose to Aedes aegypti and Ae. albopictus in a sterile insect technique program. PloS One. 14 (2), 0212520 (2019).
- Bourtzis, K., Lees, R. S., Hendrichs, J., Vreysen, M. J. B. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations. Acta Tropica. 157, 115-130 (2016).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments: JoVE. , e3579 (2014).
- Carvalho, D. O., et al. Aedes aegypti lines for combined sterile insect technique and incompatible insect technique applications: the importance of host genomic background. Entomologia experimentalis et applicata. 168 (6-7), 560-572 (2020).
- Mamai, W., et al. Aedes aegypti larval development and pupal production in the FAO/IAEA mass-rearing rack and factors influencing sex sorting efficiency. Parasite. 27, 43 (2020).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- . Methods in Aedes Research Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods%20in%20Aedes%20Research%202016.pdf (2016)
- Focks, D. A. An improved separator for the developmental stages, sexes, and species of mosquitoes (Diptera: Culicidae). Journal of Medical Entomology. 17 (6), 567-568 (1980).
- International Atomic Energy Agency. . Manual of Dosimetry in Radiotherapy. Technical Reports Series No. 110. , (1970).
- Aldridge, R. L., et al. Gamma-irradiation reduces survivorship, feeding behavior, and oviposition of female Aedes aegypti. Journal of the American Mosquito Control Association. 36 (3), 152-160 (2020).
- Cianci, D., et al. Estimating mosquito population size from mark-release-recapture data. Journal of Medical Entomology. 50 (3), 533-542 (2013).
- Knipling, E. F. . The basic principles of insect population suppression and management. , (1979).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved