Method Article
Подготовка облученных и маркированных самцов комаров Aedes aegypti к высвобождению в рамках оперативной программы по стерильным методам насекомых
В этой статье
Резюме
Метод стерильных насекомых (SIT) используется для контроля конкретных, важных с медицинской точки зрения популяций комаров, которые могут быть устойчивы к химическому контролю. Здесь мы описываем метод массового выращивания и подготовки стерильных самцов комаров к выпуску в рамках оперативной программы SIT, нацеленной на комаров Aedes aegypti .
Аннотация
Борьба с такими заболеваниями человека, как лихорадка денге, Зика и чикунгунья, зависит от борьбы с их переносчиком, комаром Aedes aegypti , поскольку профилактики нет. Борьба с комарами-переносчиками может основываться на химических веществах, применяемых на незрелой и взрослой стадиях, что может способствовать смертности нецелевых и, что более важно, приводить к устойчивости переносчика к инсектицидам. Метод стерильных насекомых (SIT) - это метод контроля популяций вредителей путем выпуска стерилизованных взрослых самцов, которые спариваются с дикими самками для получения нежизнеспособного потомства. В этой статье описывается процесс производства стерильных самцов для использования в оперативной программе SIT по борьбе с комарами Aedes aegypti . Здесь изложены шаги, используемые в программе, включая выращивание и поддержание колонии, разделение самцов и самок куколок, облучение и маркировку взрослых самцов и доставку самцов Aedes aegypti к месту выпуска. Также обсуждаются процедурные оговорки, программные ограничения и будущие цели.
Введение
Передача переносимых комарами патогенов людям ежегодно приводит к миллионам случаев заболевания и смерти во всем мире. В отсутствие эффективных, одобренных вакцин против болезней, переносимых комарами, таких как вирус Зика или лихорадка денге, одним из наиболее эффективных способов сокращения передачи является сокращение популяций комаров-переносчиков болезней. К сожалению, все большее число видов комаров, традиционно подвергающихся воздействию пестицидов, демонстрируют растущие уровни устойчивости к пестицидам1. Одновременно государственные учреждения агрессивно отменили регистрацию или запретили ранее одобренные пестициды, и разрабатывается мало новых, эффективных мер химического контроля 2,3. Это созвездие препятствий для борьбы с комарами побудило к изучению альтернативных нехимических методов сокращения популяций комаров.
Некоторые виды комаров создают проблемы для контроля над вопросами устойчивости и регистрации пестицидов. Aedes aegypti (L.) является известным комаром-переносчиком болезней, которого чрезвычайно трудно контролировать с помощью традиционной интегрированной борьбы с переносчиками из-за загадочной перидоместической среды обитания, используемой этим видом для незрелого развития и отдыха взрослыхособей 4,5. Проблемы, связанные с эксплуатацией загадочной среды обитания вокруг жилых домов, включают в себя сложность охвата этих мест методами распыления пестицидов, а также потенциальное отсутствие согласия общественности на повторный доступ к частной собственности для агентств по борьбе с переносчиками болезней общественного здравоохранения для проведения интенсивных мероприятий по наблюдению и контролю, имеющих решающее значение для эффективной комплексной борьбы с переносчиками (КБПБ) для этого вида.
К счастью, SIT, подход, доказавший свою успешность для устойчивого контроля над другими очень сложными видами насекомых6, применяется к проблеме Aedes aegypti в новаторской серии экспериментов и эксплуатационных испытаний, базирующихся в Сент-Августине, штат Флорида (неопубликованные данные KJL, RLA, SCB). SIT применяется к целому ряду видов насекомых, включая комаров, и был подробно рассмотрен 7,8. SIT использует массовое высвобождение выращенных в колониях самцов, стерилизованных, например, путем воздействия ионизирующего излучения или химических веществ, чтобы подавить выбор партнера естественными популяциями самок. Стерилизованные самцы, которые спариваются с дикими самками, делают яйца бесплодными из-за повреждений, нанесенных мужским гаметам, и если они присутствуют в достаточном количестве, теоретически могут разрушить естественную популяцию Aedes aegypti.
Программа SIT была инициирована, чтобы попытаться сократить популяции Aedes aegypti в городской местности в Атлантическом побережье Флориды, где этот вид недавно повторно колонизировался и расширяется и представляет риск для общественного здравоохранения для передачи вирусов, таких как Зика, денге или чикунгунья. Чтобы максимизировать потенциал совместимости с дикими самками, была создана новая колония с использованием пойманных в дикой природе Aedes aegypti из целевой популяции для производства самцов для программы9. Это было основано на гипотезе о том, что местные, выращенные в колониях самцы с большей вероятностью будут конкурировать с местными дикими самцами для спаривания с местными дикими самками. Чтобы SIT был эффективным, не только подавляющее количество стерильных самцов должно присутствовать в целевой области, но они также должны быть способны эффективно ухаживать и спариваться с местными дикими самками комаров.
Была проведена серия экспериментов для определения оптимального количества стерильных самцов для высвобождения (неопубликованные данные KJL, RLA, SCB), а также оптимальных доз радиации, которые сделали бы самцов бесплодными, не мешая выживанию, поведению или принятию дикими самками (неопубликованные данные KJL, RLA, SCB). Эти данные появятся в смежных публикациях из этой группы, но некоторые из этих результатов также отражены в этом протоколе и могут быть использованы в качестве отправной точки для новых программ управления SIT Aedes aegypti в других местах. Этот вид постоянно расширяет свой ареал, и программы SIT показывают большие перспективы быть экономически эффективными, долгосрочными решениями для контроля этой популяции. Целью этого протокола является производство стерилизованных, мужских, выращенных в колониях комаров Aedes aegypti для систематического выпуска на открытые площадки с целью нарушения естественных репродуктивных циклов местных популяций Aedes aegypti в рамках оперативной программы борьбы с переносчиками инфекции общественного здравоохранения.
В то время как аналогичные протоколы и рабочие процессы были опубликованы для производства трансгенных самцов Aedes aegypti, а производственные процессы для Aedes SIT или программ несовместимости на основе Wolbachia были опубликованы в других местах, этот протокол иллюстрирует, как существующие протоколы были адаптированы для производства Aedes aegypti, разделения и облучения куколок самцов, маркировки и упаковки взрослых самцов и отправки на место выпуска для этой программы9, 10,11,12,13,14,15,16,17,18. Компонент маркировки этого протокола может не требоваться в зрелой оперативной программе SIT; тем не менее, он был включен здесь, потому что это один из способов мониторинга эффективности и контроля качества всего процесса в первые годы создания программы SIT. Программы борьбы с комарами, как правило, управляются местными властями, поэтому они могут широко варьироваться во многих аспектах своей организации от размера и базы финансирования до настройки тактики контроля для максимизации местного успеха. Таким образом, протокол, описанный в настоящем документе, должен быть оценен на совместимость с имеющимися ресурсами.
протокол
ПРИМЕЧАНИЕ: Этот протокол специфичен для обработки Aedes aegypti , но может быть изменен, чтобы быть эффективным для других видов комаров.
1. Производство и содержание колонии Aedes aegypti
- Выращивайте взрослых особей Aedes aegypti и производите яйца.
- Подготовьте складную алюминиевую раму размером 0,6 м x 0,6 м, большую клетку для выращивания с сеткой из стекловолокна 20 x 20 и втулку из штока на одной вертикальной стене.
- Поместите пластиковую ванну объемом 1900 мл с куколками Aedes aegypti (соотношение полов 1:1) в каждую клетку для выращивания, завяжите рукав закрытым и оставьте чашки на месте для эклозии до тех пор, пока не появятся взрослые особи (т. Е. Примерно через 4 дня). В это время снимите чашки и поддерживайте клетки для выращивания взрослых при температуре 28-30 ° C, относительной влажности >50% (Rh) и цикле 12: 12 или 14: 10 светло-темный (L: D).
ПРИМЕЧАНИЕ: Производство куколок Aedes aegypti описано в разделе 1.2. Плотность куколок в ванне объемом 1900 мл должна быть такой, чтобы было достаточно места для того, чтобы все куколки одновременно поднимались на воздух. - Через двадцать четыре часа после того, как куколок помещают в клетки для выращивания, поместите контейнер с 10% раствором сахарозы с губчатым фитилем и подвешивайте губку размером 10 см х 2 см, смоченную в меде, с проволочного крючка в каждой клетке, чтобы обеспечить отдельные источники гидратации и питания для взрослых комаров. Следите за губками и сахарозой на предмет сухости или роста плесени и пополняйте или меняйте по мере необходимости.
ПРИМЕЧАНИЕ: Используйте пластиковый стаканчик объемом 120 мл с губчатым фитилем размером 10 см х 2 см, встроенным через вырез в крышке в небольших клетках для выращивания, и пластиковый стаканчик объемом 460 мл с губчатым фитилем размером 12 см х 8 см в больших клетках. - Обеспечьте кровавую пищу в каждую клетку для выращивания через 48-72 ч после появления большинства взрослых особей и каждые 2-3 дня после этого, чтобы поддерживать высокое количество кормящихся на крови самок, чтобы максимизировать выход яйцеклеток. Наполните презерватив из овечьей кожи 50-100 мл дефибринированной бычьей крови и согрейте примерно до 37 °C в ванне с горячей водой. Затем используйте ткань или бумажное полотенце, чтобы погладить и частично высушить презерватив, прежде чем положить его на бумажную чашку Петри внутри клетки на 30-60 минут.
ПРИМЕЧАНИЕ: Перед использованием промойте внутреннюю и внешнюю часть каждого презерватива водой 2-3x, чтобы удалить смазки или другие подложки, и проверьте наличие отверстий. Презервативы можно повторно использовать для 3-5 кормлений, смывая кровь и храня их в чашке прохладной воды. Поскольку некоторые колонии могут испытывать муравьиные заражения, презервативы, возможно, придется приостановить, чтобы ограничить доступ. - Подождите 48-72 ч после каждого кровоснабжения, а затем введите чашку яйцекладки в каждую взрослую клетку для выращивания. Подготовьте стаканчики для яйцекладки, добавив 200 мл фильтрованной воды для куколок (т.е. личинки и куколки были выращены в воде) в пластиковую чашку объемом 460 мл, снабженную листом бумаги для прорастания семян высотой 8-10 см x шириной 30 см (яйцекладочная бумага), установленной вровень по внутренней окружности чашки. Ежедневно проверяйте бумаги для яйцекладки, заменяйте их каждые 2-4 дня и тщательно храните яйцекладущие бумаги, оставляя их сохнуть в течение 24-48 ч при >50%rh19.
ПРИМЕЧАНИЕ: Оставьте чашечки яйцекладки в клетках для выращивания не более чем на 72 ч, чтобы яйца не вылупились. - Поддерживайте клетки для выращивания взрослых в течение 3-4 недель, прежде чем разбить их и установить новые клетки для выращивания взрослых.
- Чтобы разбить клетку для выращивания, снимите и очистите чашку для яйцекладки, храните яйценасыщенную яйцей бумагу, удалите и очистите контейнер с раствором сахарозы и медовую губку и заморозьте клетку, чтобы убить всех комаров.
- Удалите все тела комаров и тщательно очистите внутреннюю и внешнюю часть каждой клетки разбавленным мылом и водой с помощью бумажных полотенец и чистящих подушечек губками. Дайте чистой клетке высохнуть в течение не менее 24 часов, прежде чем использовать ее в следующем цикле выращивания.
ПРИМЕЧАНИЕ: Используйте вакуумное оборудование, оснащенное высокоэффективной фильтрацией, для удаления частиц, которые могут привести к аллергии. Контейнеры для раствора сахарозы могут быть очищены и повторно использованы в 3-5 раз.
- Выращивание личинок Aedes aegypti из яиц
- Приготовьте бульон личиночной питательной суспензии, смешав 80 г в соотношении 3:2 порошка печени крупного рогатого скота: пивные дрожжи в водопроводной воде объемом 2200 мл. Приготовьте измельченный корм для рыб. Вылейте рыбные хлопья в мясорубку для специй и измельчите, пока не получится мелкий порошок.
ПРИМЕЧАНИЕ: Эта суспензия в этой лаборатории обозначена как коричневая . - Используя яйценасыщенную (5000-10000 яиц) яйцекладущую бумагу из шага 1.1.5, отрежьте 3-7 см часть яичной бумаги перпендикулярно линии яйцекладки и поместите ее в контейнер объемом 460 мл, наполовину заполненный водопроводной водой вместе с щепоткой измельченных хлопьев рыбьей пищи. Накройте крышкой и энергично перемешайте в течение не менее 1 мин.
ПРИМЕЧАНИЕ: Яичная бумага должна храниться не менее 7 дней (но не более 90 дней, что может уменьшить вылупление) после яйцекладки до начала процесса вылупления, чтобы разрешить эмбрионацию. Бактерии и водоросли, присутствующие в корме рыб, быстро дезоксигенируют воду, что вызывает развитие личинок. - Вылейте все содержимое контейнера со стадии 1.2.2 в поддон для выращивания личинок, приготовленный из 3 л водопроводной воды и 50 мл коричневой навозной жижи. Отметьте кастрюлю датой начала, информацией о штамме, графиком кормления в таблице 1 и храните при 28-30 °C, >50% относительного веса и 12:12 или 14:10 Л:D цикл.
ПРИМЕЧАНИЕ: Соотношение 3 л воды на 50 мл коричневого цвета основано на глубине воды в конкретных личиночных сковородах, упомянутых в Таблице материалов. Кастрюли разного размера будут поддерживать разную плотность куколок и, таким образом, требуют разного количества воды и коричневой суспензии. Нормы кормления личинок в таблице 1 приведены в виде диапазона; выбор используемого количества основан на опыте и определении общего состояния здоровья развивающихся личинок с использованием таких переменных, как мутность воды, цвет и запах; наличие бактериальной пленки на воде; количество или соотношение живых и мертвых личинок; и подвижность личинок. В дни с 3 по 6 кормите незрелых комаров измельченным кормом для рыб согласно таблице 1. Добавление воды, сокращение пищи и установка 2-3 дополнительных кастрюль, чем требует проект, являются способами управления нездоровыми личиночными сковородками.
- Приготовьте бульон личиночной питательной суспензии, смешав 80 г в соотношении 3:2 порошка печени крупного рогатого скота: пивные дрожжи в водопроводной воде объемом 2200 мл. Приготовьте измельченный корм для рыб. Вылейте рыбные хлопья в мясорубку для специй и измельчите, пока не получится мелкий порошок.
| День | Добавлена объемная питательная суспензия | Добавлен объем воды | Действия |
| 1 | 50 мл (навозная жижа) | 3000 мл | |
| 2 | (без питания) | (без воды) | |
| 3 | 1/4 - 1/2 ч.л. (измельченный корм для рыб) | 500-1000 мл | |
| 4 | 1/2 - 3/4 ч.л. (измельченный корм для рыб) | 500-1000 мл | |
| 5 | 1/2 - 3/4 ч.л. (измельченный корм для рыб) | 500-1000 мл | |
| 6 | 1/4 - 1/2 ч.л. (измельченный корм для рыб) | 500-1000 мл | |
| 7 | (без питания) | (без воды) | штамм куколок и личинок |
Таблица 1: График кормления для массового выращивания личинок Aedes aegypti.
2. Разделение самцов куколок Aedes aegypti
- Сконцентрируйте куколок из личиночных сковородок. Как только приблизительная пороговая пропорция куколок будет достигнута, вылейте содержимое каждой кастрюли через сито (размер 20-40). Используйте бутылку с водопроводной водой, чтобы вымыть куколок и личинок из сита в градуированный пластиковый стакан объемом 3000 мл.
ПРИМЕЧАНИЕ: Только 2-3 личиночных сковороды должны быть перенесены на каждый стакан объемом 3000 мл, чтобы избежать переполненности, чтобы куколки могли комфортно достигать поверхности. Ожидается, что куколки будут развиваться через 130-140 ч после вылупления яиц при температурных и световых условиях, упомянутых на этапе 1.2.3. Ожидайте заметного вылупления яиц в тот же день, когда яйца установлены. В зависимости от условий окружающей среды примерно 20-70% личинок окукливаются и будут готовы к просеиванию в течение 6 дней. Разделение куколок на несколько стаканов по 3000 мл обеспечивает управляемые объемы для заливки в сепаратор. - Отделите мужских куколок от личинок и женских куколок.
ПРИМЕЧАНИЕ: Этот шаг может быть выполнен одним оператором или двумя операторами.- Для одного оператора, разделяющего куколок мужского пола:
- Разбейте содержимое каждого стакана объемом 3000 мл, созданного на этапе 2.1, на несколько пластиковых контейнеров по 1900 мл, чтобы уменьшить разлив и перегрузку сепаратора. Подготовьте пластинчатый сепаратор, поместив жесткий неглубокий контейнер для сбора 4000 мл ниже шлюза в основании сепаратора (рисунок 1). Наполните два 3000 мл градуированных пластиковых стаканов примерно на 3/4, заполненных водопроводной водой.
ПРИМЕЧАНИЕ: Используйте шланг для раковины в качестве альтернативы пластиковым градуированным стаканам объемом 3000 мл. В противном случае стаканы необходимо будет постоянно заполнять на протяжении всего процесса разделения. Дополнительные сведения об эксплуатации сепаратора куколок можно найти в ссылках12,20. - Налейте воду через пространство между стеклянными пластинами и отрегулируйте верхнюю и нижнюю ручки по часовой стрелке или против часовой стрелки, чтобы вода непрерывно текла, одновременно генерируя стоячую воду на высоту примерно 1,25 см от основания пластин. Отметьте начальные положения нижних ручек скотчем. После того, как стоячая вода равномерно распределена по основанию стеклянных пластин с одинаковой высотой и скоростью слива, начинайте выливать содержимое емкостей с куколками и личинками через пространство между пластинами.
ПРИМЕЧАНИЕ: Должно присутствовать четкое разделение между маленькими (самцами) и большими (самками) куколками; в противном случае промывайте эту партию и отрегулируйте верхние ручки, чтобы уменьшить пространство между пластинами. - Медленно наливая воду через сепаратор, непрерывно поворачивайте нижние ручки парой против часовой стрелки ~ 1-2 см от исходного положения с маркировкой ленты до тех пор, пока большинство или все личинки не промытся и не скользят вниз по шлюзу в контейнер для сбора.
ПРИМЕЧАНИЕ: Поскольку одна рука используется для наливания воды, другая рука вращает ручки по одной, но одинаково и небольшими шагами, чтобы медленно открывать пластины. Большинство личинок быстро промываются, но будут некоторые личинки, пойманные с куколками мужского пола. Эти отстающие личинки будут облучены, но будут отставать в развитии и не будут закрываться для взрослых особей с очаговой когортой куколок. - Выбросьте или переработайте личинок обратно в колонию, но в любом случае извлеките их из контейнера для сбора, прежде чем самцы куколок начнут промывать через сепаратор. Приостановите процесс, прекратив поток воды, в то время как контейнер для сбора у основания шлюза очищается от личинок путем заливки через сито No 30, которое вымывается обратно в отдельный контейнер.
ПРИМЕЧАНИЕ: Личинки протекают первыми, затем самцы куколок и, наконец, самки (рисунок 1). - Продолжайте наливать воду и вращайте нижние ручки, пока личинки самцов не будут промыты и отделены в контейнер для сбора. Приостановите процесс проверки и удаления личинок из контейнера для сбора перед передачей самцов куколок на следующем этапе.
ПРИМЕЧАНИЕ: Количество смывов, необходимых для разделения самцов, зависит от темпа налива воды и скорости вращения ручек. Обычно требуется 2000-2500 мл воды, чтобы вымыть личинок, 1000-1500 мл, чтобы вымыть куколок самцов, и 200-400 мл, чтобы вымыть самок куколок. - Вылейте самцов куколок из контейнера для сбора через сито No20 над раковиной. Используйте бутылку с водопроводной водой объемом 1000 мл, чтобы вымыть самцов куколок из сита, вылив в отдельный контейнер объемом 1900 мл.
- После того, как все мужские куколки будут разделены, продолжайте заливать воду через сепаратор и отрегулируйте нижние ручки, чтобы промыть через самок куколок. Переложите самок с помощью процесса сита, описанного на этапе 2.2.1.6, в отдельный контейнер до тех пор, пока все незрелые комары не будут вымыты из сепаратора. Отбросьте куколок самок. После обработки пакета верните ручки в исходное исходное положение и повторите процесс со следующей партией. После того, как все партии будут обработаны, оставьте пластины открытыми, чтобы сепаратор мог высохнуть.
ПРИМЕЧАНИЕ: Не существует идеального разделения с помощью этого устройства, которое требует терпения и практики. Упрямые куколки или личинки могут быть вытеснены обильным потоком воды, но не до такой степени, чтобы это отталкивало их в стороны, что могло бы заразить будущие наводнения.
- Разбейте содержимое каждого стакана объемом 3000 мл, созданного на этапе 2.1, на несколько пластиковых контейнеров по 1900 мл, чтобы уменьшить разлив и перегрузку сепаратора. Подготовьте пластинчатый сепаратор, поместив жесткий неглубокий контейнер для сбора 4000 мл ниже шлюза в основании сепаратора (рисунок 1). Наполните два 3000 мл градуированных пластиковых стаканов примерно на 3/4, заполненных водопроводной водой.
- Для двух операторов, разделяющих куколки самцов, изменить раздел 2.2.1 следующим образом.
- Первый оператор: налейте воду через сепаратор и постепенно вращайте ручки, чтобы разделить личинок, самцов куколок и куколок самок.
- Второй оператор: После того, как каждая стадия собрана в шлюзовой контейнер, просейте содержимое шлюзового контейнера, чтобы разделить личинки, куколки самцов и куколок самок на несколько отдельных контейнеров для сбора шлюзов. Держите большие стаканы заполненными водой, если шланг раковины недоступен.
- Для одного оператора, разделяющего куколок мужского пола:
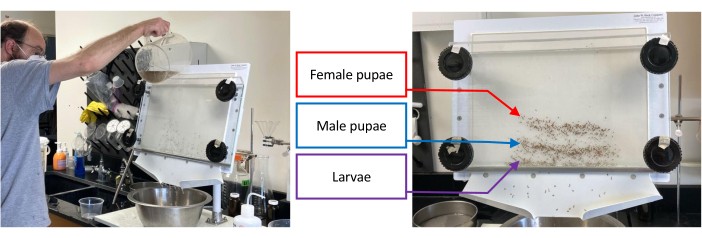
Рисунок 1: Сепаратор куколок, содержащий партию незрелых Aedes aegypti. Разделение начинается с обливания водой через сепаратор при вращении нижних ручек на 1-2 см против часовой стрелки до тех пор, пока целевой набор, т. е. личинки, самцы куколок или самки куколок, не будет максимально изолирован от оставшихся наборов (левое изображение). На правом изображении показано разделение личинок (нижняя полоса), самцов куколок (средняя полоса) и самок куколок (верхняя полоса). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Подготовка самцов куколок Aedes aegypti к облучению
- Разделите самцов куколок на пластиковые 60 мм чашки Петри.
ПРИМЕЧАНИЕ: Количество необходимых чашек Петри зависит от того, сколько самцов куколок доступно для облучения: одна сковорода для выращивания личинок с шага 1.2 наполнит примерно 1,5 чашки Петри. Возраст куколок колеблется от 1 до 40 ч. В этом протоколе меньший диаметр более глубокой половины чашки Петри называется дном, а меньший диаметр более мелкой половины называется верхом.- Подготовьте предварительно нарезанные диски из фильтровальной бумаги, чтобы они соответствовали внутреннему диаметру дна чашки Петри. Поместите один увлажненный водой бумажный диск фильтра в каждую из нижней части чашек Петри, чтобы сохранить куколки гидратированными на протяжении всей транспортировки и процесса облучения.
- Переложите куколок в чашки Петри. Процедите самцов куколок, собранных на этапе 2.2.1.6, с помощью сита и вымойте куколки в градуированный стакан объемом 1000 мл с как можно меньшим количеством воды. Осторожно вылейте куколок в чашки Петри до тех пор, пока каждый диск фильтрующей бумаги не будет равномерно покрыт одним слоем куколок (рисунок 2A - C). Расположите чашки Петри у края стола в ряд, чтобы облегчить заливку.
ПРИМЕЧАНИЕ: Альтернативой процеживанию куколок является разрезание кончика пластиковой пипетки Пастера объемом 3 мл до диаметра, достаточно большого для размещения куколок. Используйте пипетку для переноса куколок из контейнера, произведенного на этапе 2.2.1.6, непосредственно на диски фильтровальной бумаги, чтобы в каждой чашке Петри был один плотно упакованный слой куколок. Это практично только для небольших партий. - Используйте неизмененную пипетку Пастера объемом 3 мл для удаления стоячей воды со дна чашки Петри, чтобы предотвратить движение куколок во время стадии сексинга (3,2) и транспортировки.

Рисунок 2: Перенос куколок в чашки Петри для облучения. (А) Просеянные куколки выливаются и вымываются обратно в пластиковый стакан объемом 1000 мл. (B) Минимальное количество воды удерживается в стакане для облегчения наливания в чашки Петри. (C) Чашки Петри выстроились вдоль края поверхности, чтобы облегчить заливку в один слой куколок. (D) Чашки Петри, загруженные куколками, укладываются и закрепляются для доставки в установку облучения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Секс куколок для проверки на заражение самками. Под рассекающим прицелом используйте зонды для вращения каждой куколки, чтобы проверить вентральную поверхность на наличие генитальной доли большого размера (рисунок 3), указывающей на мужской пол. Удалите и выбросьте куколок с уменьшенными или маленькими генитальными долями, которые указывают на самок и замените равным количеством мужских куколок, чтобы поддерживать правильный подсчет.
ПРИМЕЧАНИЕ: В оперативной программе этот шаг непрактичен из-за большого количества комаров и того факта, что разделение, перенос, облучение и подготовка клеток после облучения выполняются за один день с ограниченным временем. Проверка качества образца из избранных блюд Петри может быть выполнена, особенно на ранних этапах разработки программы SIT.
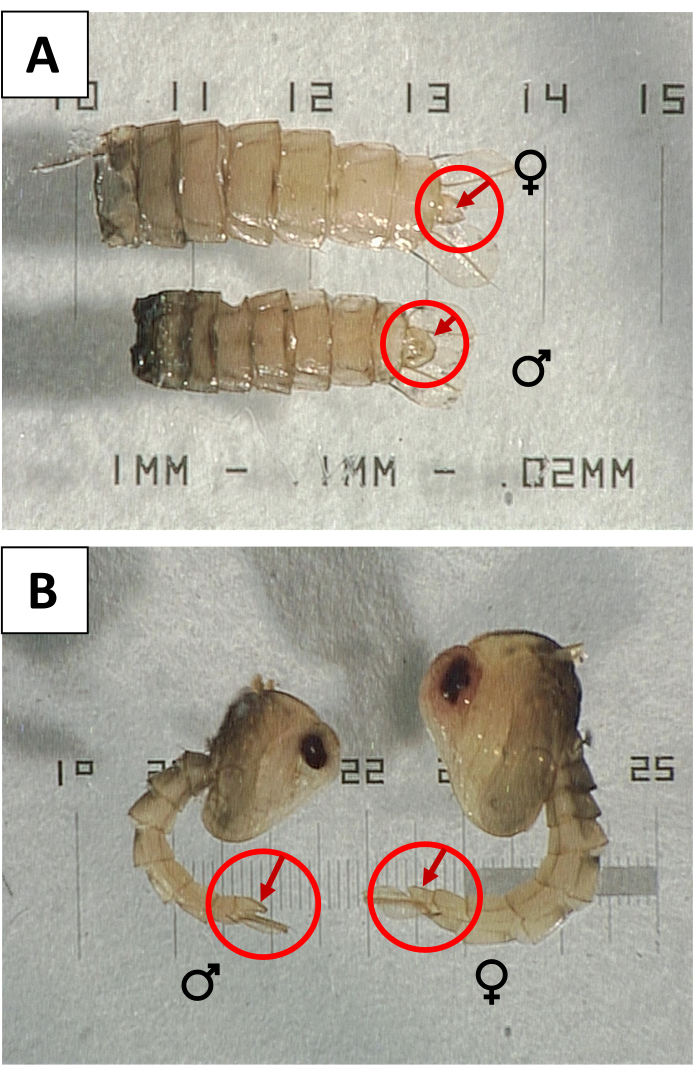
Рисунок 3: Сексинг куколок с использованием генитальной доли. (A) Вентральный и (B) боковые виды женских (♀) и мужских (♂) Aedes aegypti куколок, с генитальными долями, указанными для демонстрации полового диморфизма. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Накройте днища верхушками чаш Петри и закрепите лабораторной лентой. Соедините заклеенные чашки Петри с резинками в стопки, размер которых соответствует размеру в камеру облучения, и запечатайте внутри маркированного 3,8-литрового запечатываемого пакета (рисунок 2D). Не допускайте, чтобы куколки оставались непокрытыми в течение >1 ч.
4. Облучение самцов куколок Aedes aegypti
- Подготовьте дозиметрическую пленку из того же лота, разрезав 1 см2 квадрата пленок и поместив каждый квадрат в свой индивидуальный конверт.
ПРИМЕЧАНИЕ: Вся пленка, используемая в каждый день, вырезается одновременно. Это уменьшает небольшое количество вариаций, вызванных хранением. Количество квадратов, необходимых для каждой стопки, составляет 1+ (количество чашек Петри). - Подготовьте комплект для приема в установку облучения, который должен включать лабораторный таймер, лабораторную ленту, перманентный маркер, подготовленные конверты дозиметрической пленки, значок дозиметрии и лабораторный лист с контрольными списками для отслеживания ключевой информации (рисунок 4).
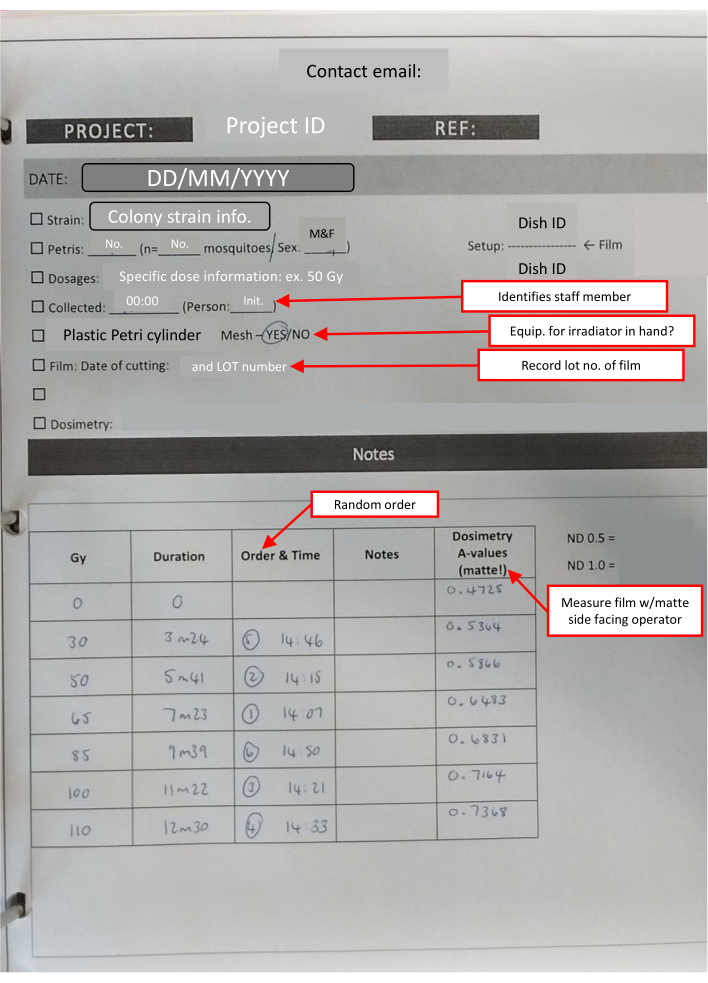
Рисунок 4: Набросок лабораторной книги - ИК-лист , заполненный для набора дозовых ответов. Текстовые поля, выделенные красным цветом (отмеченные красными стрелками), указывают на полезные примечания в различных разделах и повторяют ключевую информацию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Транспортируйте куколок в установку облучения. Поместите чашки Петри мужских куколок с шага 3.3 в изолированные контейнеры и храните вдали от прямых солнечных лучей и с кондиционером во время транспортировки.
- Подготовьте стопки чашек Петри для облучения у облучателя. Сложите соответствующее количество чашек Петри, чтобы поместиться в камеру облучения, с дозиметрической пленочной оболочкой, центрированной между каждой чашкой и в верхней и нижней части стопки. Закрепите конверты и всю стопку лабораторной лентой, чтобы предотвратить разливы и облегчить размещение штабеля в камере.
- Облучите чашки Петри мужских куколок. Поместите стопку чашек Петри на жесткую металлическую сетку в камере, чтобы расположить ее на правильной высоте для оптимального конуса воздействия на основе предыдущего дозового картирования конкретного блокаоблучения 21. Активируйте поворотный стол на облучателе и облучите, одновременно инициируя лабораторный таймер. Облучение в течение соответствующего интервала для достижения желаемой дозы (примеры приведены в таблице 2).
ПРИМЕЧАНИЕ: Этот протокол основан на облучателе цезия-137 (см. Таблицу материалов) и целевой дозе 50 Гр. Поскольку Cs-137 распадается с течением времени, мощность дозы корректируется каждый год путем выполнения серии «доза-реакция» с использованием аланиновых дозиметров, дополненных радиохромной пленкой для обычной дозиметрии и аланином примерно в 10% облученных образцов. Учитывая текущую мощность дозы 8,8 Гр/мин, достижение целевой дозы 50 Гр требует 5 мин 41 с воздействия. Обычная пленочная дозиметрия происходит, как описано в шаге 4.7. Дозиметрия гранул аланина выполняется либо в Национальном центре исследований электронного пучка в Техасском университете A & M, либо в Национальном институте стандартов и технологий в Гейтерсбурге, штат Мэриленд, США.
| Дозировка (Гр) | Время (из расчета 8,8 Гр/мин) |
| 0 | Н.А. |
| 10 | 1 мин 8 с |
| 30 | 3 мин 24 с |
| 50 | 5 мин 41 с |
| 65 | 7 мин 23 с |
| 85 | 9 мин 39 с |
| 100 | 11 мин 22 с |
| 110 | 12 мин 30 с |
Таблица 2: Пример времени дозирования для облучателя цезия-137.
- По истечении предписанного времени снимите чашки Петри с облучателя и аккуратно демонтируйте стопку. Пометьте все чашки Петри и конверты с пленкой с указанием даты и местоположения в стопке. Запечатайте конверты и храните для дозиметрии. Переупакуйте чашки Петри в изолированный контейнер для транспортировки обратно в главную лабораторию.
ПРИМЕЧАНИЕ: Запишите, появились ли взрослые особи во время облучения, и отметьте пораженную чашку Петри, чтобы взрослая особь (взрослые) не убежали, когда куколки будут помещены в клетки для выращивания (шаг 5.2). - Подтверждают дозу облучения дозиметрической пленкой, измеряя пленку примерно через 24 ч после экспозиции. Активируйте дозиметрический считыватель и позвольте ему уравновеситься до комнатной температуры. Загрузите пленку с помощью щипцов, поставляемых со считывателем, и следуйте инструкциям производителя по чтению облученной пленки, а также необлученной заготовки из той же партии. Обнулите считыватель без пленки между показаниями и запишите данные, как в примере технического описания, показанном на рисунке 5.
ПРИМЕЧАНИЕ: Этот протокол основан на стандартах ND0.5 и ND1.0 QA Filter Set. Важно измерить пленку матовой стороной, обращенной к оператору.
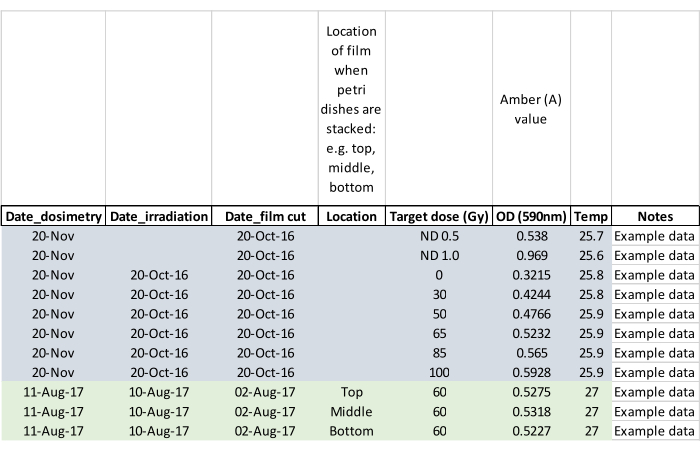
Рисунок 5: Таблица данных дозиметрии, заполненная примерными данными. Заголовки столбцов предлагают оператору захватить ключевые данные для последующего анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Выращивание облученных самцов куколок Aedes aegypti на взрослых особей
- Очистите и подготовьте небольшие пластиковые клетки для выращивания размером 30 см х 30 см х 30 см, чтобы они были готовы к облучению куколок по возвращении в основную лабораторию. На каждые 2 чашки Петри облученных кукол мужского пола готовят 1 клетку для выращивания. Приложите каждую клетку для выращивания к наполовину заполненному пластиковому стаканчику, содержащему 460 мл водопроводной воды и одному 10% контейнеру для раствора сахарозы, как описано на этапе 1.1.3.
- Немедленно перенесите облученных куколок в подготовленные клетки для выращивания после возвращения из установки облучения. Используйте бутылку с водой, чтобы тщательно вымыть куколок из каждой чашки Петри в 460 мл воды в пластиковом стаканчике в каждой клетке для выращивания. Через 24 ч перенесите чашки в новые, чистые клетки для выращивания, содержащие источник питания, и дождитесь оставшейся эклозии взрослого, облученного самца Aedes aegypti.
ПРИМЕЧАНИЕ: Если куколки появились в процессе облучения, откройте чашки Петри с листовками в пустую клетку, а затем перейдите к шагу 5.2. Выбросьте самцов, собранных в этой клетке. Куколки переносятся в новые клетки для выращивания через 24 часа, потому что самцы появляются раньше самок той же когорты, и изоляция дней появления может снизить частоту заражения самок и обеспечить точное старение самцов.
6. Маркировка и взвешивание облученных взрослых самцов Aedes aegypti
ПРИМЕЧАНИЕ: Этот раздел протокола предполагает, что задачи выполняют два человека; для 1 человека см. 6.4.

Рисунок 6: Упаковка маркированных, облученных самцов Aedes aegypti в контейнеры для высвобождения. (A) Разблокировочный контейнер с изображением штока, прикрепленного к отверстию, вырезанному в боковой части картонного цилиндра маскировочной лентой, скобами и горячим клеем. Безель находится на месте с маскировочной лентой, прикрепленной сбоку. Безель удерживает плотно натянутую тюлевую сетку; резинка (не видна) также удерживает тюль на месте под безелем. (B) Партия обезболенных самцов в процессе погружения розового красителя в небольшую картонную чашку. С) Четыре контейнера для сброса внутри изотермического транспортного контейнера. Обратите внимание, что рукава stockinette ориентированы на середину транспортного контейнера, упаковочные материалы заправлены вокруг контейнеров для выпуска, а источники питания и гидратации находятся на месте поверх каждого контейнера для выпуска, покрытого перевернутым дном чашки Петри, удерживаемым скрещенными эластичными лентами и кусочками ленты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Подготовьте контейнеры для выпуска картона.
- Вырежьте отверстие диаметром 11,5 см в боковой части цилиндрического контейнера для картона объемом 3,9 л на расстоянии 1,5-3,0 см от дна, чтобы отверстие не было закрыто крышкой (рисунок 6А).
- Вырежьте чулок длиной 40-50 см и скрепите один его конец вокруг внутренней стороны отверстия длиной 11,5 см, вырезанного в 6.1.1. Используйте стандартный офисный степлер, открытый таким образом, чтобы скобы можно было протолкнуть через шток и картон изнутри контейнера и в подходящую рабочую поверхность, такую как блок твердо экструдированного пенополистирола. Обжимайте скобы с помощью плоскоголовой отвертки, чтобы плотно закрепить шток по периметру отверстия и прикрепите маскировочную ленту к обжатой стороне, чтобы предотвратить защемления. Запечатайте край штока на внутренней стороне цилиндра на картоне горячим клеем и перекрестно проверьте весь узел на наличие аварийных отверстий.
- Создайте удерживающий безель, сняв внутренний диск с крышки и вырежьте квадрат нейлоновой тюлевой сетки размером 33 см х 33 см, достаточно тонкий, чтобы сохранить взрослых самцов комаров Aedes aegypti . Поместите сетку на открытый конец цилиндра и установите безель поверх сетки, чтобы удерживать ее на месте без зазоров. Потяните сетку вниз так, чтобы она выступала ниже безеля, чтобы сетка проходила через открытый конец, и плотно прижмите выступающую сетку к цилиндру резинкой.
- Поместите 10-сантиметровый кусок маскировочной ленты на сторону безеля, покрытую 8-сантиметровым куском этикетировочной ленты, чтобы этикетировочную ленту можно было легко заменить, не разрывая безель.
ПРИМЕЧАНИЕ: Выпускные контейнеры долговечны и могут быть повторно использованы >10x при правильном обращении. Перед введением каждой новой партии маркированных, облученных, взрослых, самцов комаров проверьте, что чулок надежно прикреплен к контейнеру, и при необходимости своевременно произведите ремонт.
- Подготовьте станцию взвешивания и маркировки.
- Вылейте примерно 50 мг маркировочного красителя в контейнер для картона объемом 240 мл и равномерно распределите краситель в виде порошка по внутренним поверхностям контейнера. Осторожно постучите, чтобы выбросить лишний краситель. Используйте четко обозначенные чашки для нескольких красителей, чтобы цвета были разделены.
- Тара весовой лодки 100-500 г на электронных весах 0,0001 г; создать форму данных (таблица 3); и склеить вместе четыре листа копировальной бумаги размером 215,9 мм x 355,6 мм, чтобы получить рабочую поверхность размером 431,8 мм x 711,2 мм.
| Разгрузочный контейнер | Вес комаров | Номер клетки | Суки в партии | Количество самцов | Разгрузочный контейнер | Общая масса |
| РОЗОВЫЙ I | 0.024 | Д1 #1 | 25 | РОЗОВЫЙ I | 2.03 | |
| РОЗОВЫЙ I | 2.007 | Д1 #1 | 7 | РОЗОВЫЙ II | 1.99 | |
| РОЗОВЫЙ II | 1.990 | Д1 #1 | РОЗОВЫЙ III | 2.03 | ||
| РОЗОВЫЙ III | 0.026 | Д1 #3 | 25 | |||
| РОЗОВЫЙ III | 2.000 | Д1 #3 | 18 |
Таблица 3: Таблица данных весовых станций.
- Маркируйте количественные партии взрослых облученных самцов флуоресцентным пигментом.
- Перенесите взрослых комаров (2,5-3,5 дня) из каждой клетки для выращивания в аспираторные флаконы. Удалите источники питания из клетки для выращивания с этапа 5.2 и поместите всю клетку в большую камеру CO2 на 5-7 минут, выбивая боковые стороны контейнера, чтобы выбить комаров, которые могут цепляться за клетку для выращивания. По истечении времени воздействия извлеките клетку для выращивания из камеры и аспирируйте всех взрослых комаров в серию пластиковых аспирационных флаконов.
ПРИМЕЧАНИЕ: Введение 99,5-100% CO2 осуществляется из резервуара с регулятором, латунной колючкой и силиконовой трубкой, направляемой в камеру со скоростью потока 6 л/мин. Количество флаконов, необходимых для очистки клетки для выращивания, зависит от того, сколько комаров находится в клетке и квалификации оператора, но обычно требуется 3-5 флаконов на клетку. Выберите аспиратор, который имеет небольшие быстросменные флаконы для облегчения управления взрослыми комарами партиями, например, один с использованием флакона для сбора полистирола объемом 60 мл, запечатанного алюминиевым экраном 20 x 20 mesh на одном конце и прозрачным клапаном ацетатной заслонки на другом. Вся клетка обезболивается перед аспирацией, чтобы сократить время переноса комаров во флаконы, чтобы уменьшить нагрузку на комаров и сохранить протокол податливым. - Сортируйте всех взрослых комаров из каждой клетки для выращивания по полу.
- Подвергайте первый флакон со стадии 6.3.1 доСО2 в небольшой камере в течение 4 мин, а затем осторожно вытряхивайте обезболенных комаров, распределяя их по рабочей поверхности белой бумаги, подготовленной на этапе 6.2.2.
- Загрузите новый пустой флакон в аспиратор, осторожно аспирируйте всех самцов с рабочей поверхности, и передайте этот флакон на станцию взвешивания (шаг 6.3.3.). Подсчитайте всех самок, оставшихся после себя, и аспирируйте их в отдельный флакон и выбросьте вместе с любыми измельченными самцами.
- Повторите этот процесс с оставшимися флаконами из 6.3.1, но в какой-то момент процесса сортировки по полу создайте отдельный флакон только с 25 самцами, который также передается на станцию взвешивания. Повторите шаг 6.3.2. для каждой клетки для выращивания.
ПРИМЕЧАНИЕ: При обработке облученных взрослых самцов для секса, взвешивания и маркировки отслеживайте количество самок в каждой партии, которые являются ключевыми данными для устранения неполадок и обеспечения качества сортировки пола куколок и всего процесса. Если число женщин выше, чем ожидалось, второй человек должен извлечь самок, в то время как основной оператор аспирирует самцов. Важно взвесить выборку из 25 самцов из каждой клетки для выращивания, чтобы рассчитать средний вес на комара, который будет использоваться для оценки количества отмеченных облученных самцов, выпущенных в конце протокола.
- Взвешивайте и окрашивайте партии взрослых самцов комаров.
- На станции взвешивания поместите первый флакон взрослых самцов комаров со станции сексинга (раздел 6.3.2) в небольшую камеру CO2 на 2 минуты и осторожно встряхните комаров в смоляную весовую лодку, подготовленную на этапе 6.2.2. Запишите вес комаров и налейте комаров в чашку для красителя, приготовленную в пункте 6.2.1.
- Медленно наклоняйте и поворачивайте чашку 1 полным вращением по часовой стрелке и против часовой стрелки так, чтобы комары контактировали с порошковым покрытием на внутренних поверхностях чашки и все слегка попылялись красителем (рисунок 6B). Вылейте отмеченных комаров в весовую лодку.
- Быстро переходите к следующему шагу, чтобы комары не выздоровели и не сбежали. Повторяйте этот шаг до тех пор, пока не будут обработаны все флаконы из раздела 6.3.2.
ПРИМЕЧАНИЕ: Вес самцов из отдельного флакона из 25 самцов, полученный для каждой клетки для выращивания в разделе 6.3.2, регистрируется и используется для расчета среднего веса на одного самца из этой клетки.
- Загрузите контейнеры для выпуска с маркированными облученными взрослыми самцами. Слегка сложите весовую лодку, содержащую обезболенных, маркированных, облученных самцов комаров, с конца раздела 6.3.3. создать канал, а затем направить этот канал через рукав штока для переноса самцов в контейнер для выпуска. Продолжайте добавлять комаров до тех пор, пока примерно 2,0 г или 1500-3000 самцов комаров не окажутся в контейнере для выпуска и не завяжите рукав чулка закрытым. На лицевой панели контейнера для высвобождения маркировочная лента наклейте цвет красителя, номер контейнера и общий вес комаров и скопируйте эти данные в форму из этапа 6.2.2.
ПРИМЕЧАНИЕ: Обращение с комарами на любом этапе жизни вызывает стресс и может снизить выживаемость или бодрость. Серия анестезий, описанных в настоящем протоколе, может повлиять на комаров; однако попытки преследовать и аспирировать комаров без анестезии на каждом этапе будут вызывать больший стресс и неустойчивый протокол. Разделить общий вес комаров в каждом контейнере для высвобождения на средний вес одного самца комара, полученного в разделе 6.3.3, чтобы получить оценку числа самцов в этом контейнере для высвобождения; в каждом выпускном контейнере должно быть не более 2 г самцов, что приравнивается примерно к 1 большой клетке для выращивания.
- Перенесите взрослых комаров (2,5-3,5 дня) из каждой клетки для выращивания в аспираторные флаконы. Удалите источники питания из клетки для выращивания с этапа 5.2 и поместите всю клетку в большую камеру CO2 на 5-7 минут, выбивая боковые стороны контейнера, чтобы выбить комаров, которые могут цепляться за клетку для выращивания. По истечении времени воздействия извлеките клетку для выращивания из камеры и аспирируйте всех взрослых комаров в серию пластиковых аспирационных флаконов.
- Изменения в протоколе маркировки для одного оператора
- Сначала проведите сортировку пола для всех больших клеток. Подвергайте каждую большую клетку воздействию CO2 в течение 4-5 мин и аспирируйте всех комаров в 4-5 ампул. Подвергайте каждый флакон воздействию CO2 в течение 2-3 минут, выложите всех комаров на рабочую поверхность белой бумаги, удалите самок и подсчитайте и верните самцов в их большую клетку популяции.
- Взвешивание и маркировка
- Начните с первой мужской клетки, полученной на этапе 6.4.1: удалите источник питания и обезболите самцов в большой камере CO2 в течение 5-7 минут. Аспирировать обезболенных самцов равномерно в отдельные флаконы. Повторите этот шаг с каждой клеткой удержания в том порядке, в котором они были изготовлены.
ПРИМЕЧАНИЕ: Приблизительно 2-3 переполненных флакона будут произведены на клетку для хранения. Обработка мужских клеток в том порядке, в котором они были изготовлены, максимизирует время восстановления для каждой клетки самцов. - Обезболить первый флакон, полученный на этапе 6.4.2.1. в течение 1-2 мин в небольшой камереСО2 . Вылейте небольшое количество комаров на рабочую поверхность белой бумаги, аспирируйте 25 самцов комаров в новый флакон и обработайте, как в 6.3.2, чтобы определить средний вес на самца для этой клетки. Вернуть любых дополнительных самцов в исходный флакон или аспират в новый отдельный флакон для последующей обработки; приступить к взвешиванию, маркировке и переносу в контейнеры для высвобождения остальных самцов в первом флаконе, как описано в остальной части этапа 6.3. Повторите шаг 6.4.2.2. (за исключением выделения 25 самцов в отдельный флакон) для остальных флаконов, изготовленных на этапе 6.4.2.1. в том порядке, в котором они были произведены, а затем переходите к следующей клетке для выращивания, отсортированной по половому признаку, произведенной в 6.4.1.
ПРИМЕЧАНИЕ: Рабочие процессы с одним человеком медленнее, и некоторые самцы комаров должны быть обезболены несколько раз. Постоянно ищите и удаляйте самок комаров.
- Начните с первой мужской клетки, полученной на этапе 6.4.1: удалите источник питания и обезболите самцов в большой камере CO2 в течение 5-7 минут. Аспирировать обезболенных самцов равномерно в отдельные флаконы. Повторите этот шаг с каждой клеткой удержания в том порядке, в котором они были изготовлены.
7. Упаковка и отгрузка контейнеров для маркировки, облучения взрослых самцов Aedes aegypti
- Подготовьте контейнеры для отгрузки. После того, как контейнер для высвобождения заполнен помеченными самцами, поместите 4 ватных шарика, смоченных 10% раствором сахарозы, на крышку сетки и накройте перевернутым дном чашки Петри, удерживаемой на месте двумя резинками, натянутыми вокруг всего контейнера и над чашкой Петри, чтобы сформировать крест. Поместите кусок маскировочной ленты на X двух резинок, чтобы держать их на месте поверх перевернутой чашки Петри.
ПРИМЕЧАНИЕ: Убедитесь, что ватные шарики с 10% раствором сахарозы не насыщаются до точки капания, что повредит контейнер и задержит и убьет комаров. - Упаковка контейнеров для выпуска картона в экструдированный охладитель из пенополистирола. Проткните 4 вентиляционных отверстия через крышку охладителя и закройте их хлопком, чтобы не допустить муравьев и удержать сбежавших комаров. Поместите 4 контейнера для выпуска вертикально в охладитель для транспортировки, причем шток каждого контейнера обращен к центру (рисунок 6C). Заверните пузырьковую пленку между каждым контейнером и в центре, чтобы стабилизировать их. Заполните остальное пространство в охладителе воздуха подушками или сложите второй слой из 4 контейнеров непосредственно поверх первого слоя и аналогичным образом стабилизируйте воздушными подушками.
ПРИМЕЧАНИЕ: Контейнеры для высвобождения должны быть достаточно стабилизированы, чтобы не перемещаться при встряхивании. Температура внутри упаковки окружающая. - Подготовьте транспортный охладитель к доставке. Запечатайте транспортный охладитель вентилируемой крышкой и поместите в картонный пакет, закройте ленту и отправьте через ночной экспресс в место выпуска.
Результаты
Бдительное и адекватное выращивание комаров состоит из хорошо сбалансированной доступности самцов и самок в колониальных клетках, поддержания свежего раствора сахарозы и меда, а также последовательного высококачественного кормления кровью. Эти условия обеспечат плотную упаковку яичных листов, оптимальных для использования в личиночных сковородках SIT. Правильное хранение и использование высушенных листов яиц, такое как систематическая маркировка для облегчения использования от самого старого до самого нового, будет поддерживать равномерное вылупление на всех сковородах. Заполнение всех поддонов для выращивания личинок водой перед вылуплением может уменьшить время, в течение которого яичные листы находятся в контейнерах для вылупления, и способствовать здоровому развитию. Поддержание личиночных сковородок от вылупления до окукливания требует тщательного участия персонала колонии, поскольку некоторым сковородкам может потребоваться больше или меньше пищи или дополнительной воды в зависимости от стадий развития и переменных окружающей среды. Если есть проблемы со стадией развития к запланированному дню разделения пола куколки, корректировки должны быть сделаны раньше в процессе, такие как вылупление раньше или позже, корректировка пищи или изменение температуры инкубатора.
Процесс выращивания в этом протоколе не приводит к тому, что все яйца вылупляются вовремя, чтобы развиться в куколок, которые могут быть облучены и использованы в целях контроля. От 20 до 50% комаров, выращенных в колониях, все еще будут личинками к тому времени, когда куколки должны быть разделены. Тем не менее, эти личинки не растрачиваются, но им дают созреть в течение 24 часов, чтобы получить дополнительные куколки, которые могут быть объединены с самками куколок из предыдущего дня разделения и переработаны обратно в клетки колонии. В клетках колонии куколкам будет позволено созревать во взрослых особей, спариваться, кормиться кровью и производить яйца, которые поддерживают проект SIT.
Отделение куколок, вливание куколок в чашки Петри, облучение и помещение во взрослые клетки после облучения должны происходить в один день; следовательно, должно быть выделено достаточное время для комфортной обработки всех этапов. Сборка и подготовка контейнеров для высвобождения должны производиться до процесса маркировки. Когда отгрузочные коробки возвращаются с места выпуска, контейнеры для выпуска должны быть проверены и подготовлены к их следующему использованию. Выброс влажных ватных шариков, проветривание контейнеров с влажным высвобождением, очистка посуды Петри, замена сетки и удаление резинок из контейнера, пока они не используются, значительно продлят срок службы контейнеров для выпуска.
Учитывая всемирную реальность вирусной пандемии COVID-19, этот протокол, который обычно представляет собой операцию с участием нескольких человек, был изменен, чтобы быть управляемым одним человеком, работающим в одиночку в лаборатории для каждого шага. Этапы процесса, которым больше всего мешает сценарий с одним человеком, - это этапы сексинга, маркировки, взвешивания и содержания колоний. Разделения куколок по полу одним человеком должно быть достаточно, если в разных помещениях одновременно работает несколько сепараторов. В условиях пандемии, когда социальное дистанцирование происходит на рабочем месте, требуется оснащение нескольких станций для выполнения шагов от сексинга до упаковки. В зависимости от скорости оператора, одному человеку требуется ~ 4 часа, чтобы полакомить 15 000 комаров, а затем еще 1-2 часа, чтобы маркировать, взвешивать и упаковывать их. Сценарий для двух человек уменьшает время, в течение которого комары подвергаются анестезии для маркировки, и сокращает общее рабочее время. Тем не менее, даже в сценарии с двумя людьми выделение полных 2,0 г комаров на клетку для выпуска может быть сложной задачей из-за ограниченного рабочего времени, пока комары успокаиваются. Хотя процесс очистки и подготовки личиночных и взрослых материалов для выращивания чрезвычайно трудоемкий и трудоемкий, его можно разделить таким образом, чтобы отдельные операторы могли работать независимо и безопасно во время пандемии.
Высвобождение взрослых, маркированных, облученных самцов Aedes aegypti выходит за рамки этого протокола, но представлено здесь вкратце. Процесс высвобождения маркированных, облученных самцов комаров начинается с определения равномерного распределения высвобождения контейнеров для высвобождения на основе веса (и, следовательно, предполагаемого числа стерильных самцов), как указано в таблице 3. После того, как грузы доставляются в район борьбы с переносчиками, ящики вскрываются, а контейнеры для высвобождения оцениваются на предмет любых проблем, связанных со смертностью или состоянием контейнеров для высвобождения. Затем комарам в контейнерах для выпуска разрешается акклиматизироваться к температуре и влажности окружающей среды в течение 1-2 ч перед транспортировкой в зону обработки. Места высвобождения в зоне обработки определяются после интенсивного наблюдения за горячими точками диких популяций Aedes aegypti. Сроки, частота и плотность выбросов уравновешиваются биономикой вида, а также метеорологией, общественной поддержкой и возможностями лабораторного выращивания.
Поскольку конкретные контейнеры для высвобождения сопоставляются с конкретными местами высвобождения, этикетка должна быть перекрестно проверена перед открытием контейнера для высвобождения путем разрезания сетки сверху, что позволяет оператору деформировать сетку таким образом, чтобы часть самцов могла вырваться. Этот метод дробного высвобождения повторяется в каждой назначенной точке выпуска контейнера до тех пор, пока не будут выпущены все свободно летающие самцы. Затем этот процесс повторяется для каждого контейнера для высвобождения в соответствующем назначенном им месте высвобождения до тех пор, пока все контейнеры не будут обработаны. По желанию, после того, как комары были выпущены, любые мертвые или инвалидные комары, которые не ушли свободно, могут быть собраны в чашки Петри и помечены для подсчета вручную или взвешены для корректировки предполагаемого количества выпущенных. Для оценки эффективности операции SIT проводится постоянное и повсеместное наблюдение за взрослыми, яйцами и незрелыми стадиями диких Aedes aegypti в целевом районе и, возможно, в контрольных участках без вмешательства.
Обсуждение
Инициирование программы управления с использованием SIT, использующей радиацию, требует установления локального штамма Aedes aegypti. Этот шаг имеет решающее значение и может позволить SIT действительно отличить себя от аналогичных технологий управления. Развивая проект из местного штамма комаров, самцы, вероятно, будут иметь поведение, которое позволяет им адаптироваться к изменениям окружающей среды и сигналам, а также находить и спариваться с дикими самками в окрестностях. Кроме того, высвобождение облученных местных самцов не может вызвать негативного общественного мнения по сравнению, скажем, с выпуском неместного штамма генетически модифицированных комаров, который может, например, ввести новые аллели в местную популяцию комаров.
Расходование значительных ресурсов на выращивание огромного количества комаров только для того, чтобы иметь возможность использовать около половины из них в целях борьбы, является ограничением программы Aedes aegypti SIT. Следует внести уточнения в протокол выращивания, чтобы конденсировать созревание личинок в более определенные временные рамки, когда куколки будут готовы. Это позволило бы собрать больше куколок в оптимальное время разделения. Тем не менее, дополнительные куколки для обработки увеличивают риск того, что больше самок пупатируются, когда куколки собраны, и, следовательно, увеличивают вероятность того, что самки окажутся в чашках Петри с самцами и, возможно, будут выпущены. Хотя продолжительность жизни, кровосодержащее поведение и поведение яйцекладки у облученных самок Aedes aegypti pupae уменьшаются у взрослых, не является хорошей стратегией случайно освобождать самок вместе с облученными самцами22. Поэтому приоритетной задачей должно оставаться сведение к минимуму числа самок, непреднамеренно разделенных, облученных, маркированных и выпущенных вместе с самцами.
Успех программы SIT в конечном итоге зависит от успешного соревнования партнеров со стороны выращенных в колониях, облученных самцов. Сохранение конкурентоспособности самцов зависит от исчерпывающего экспериментального отбора дозы и максимизации расчетного соотношения стерильных и диких самцов в популяции. Выбор дозы определяется несколькими ключевыми факторами, которые включают долголетие, фертильность, плодовитость и смертность куколок. Было замечено, что самцы комаров будут демонстрировать асимптотическую кривую фертильности, которая приближается к нулю по мере увеличения радиации (неопубликованные данные KJL, RLA, SCB). Одновременно продолжительность жизни и активность самцов комаров экспоненциально уменьшаются по мере увеличения дозы радиации (неопубликованные данные KJL, RLA, SCB). Поэтому вместо того, чтобы определять дозу, которая дает 99,9% бесплодия у мужчин, предпочтительно сосредоточиться на более низком проценте стерильности, поддерживая выживаемость. После определения диапазона доз, который не дифференцирует продолжительность жизни или смертность куколок облученных самцов от необлученных самцов, следует провести дополнительные оценки фертильности для определения дозы, которая делает самцов в подавляющем большинстве стерильными, но конкурентоспособными.
В то же время важно сравнить количество самцов комаров в популяции с количеством выпущенных облученных самцов. Это может быть достигнуто путем сбора самцов из различных мест в целевой зоне высвобождения и вокруг нее неоднократно из одного и того же места и до, во время и после начала программы SIT. Следует провести исследование по маркировке, высвобождению, повторному отлову для оценки соотношения диких самцов комаров и выпущенных комаров. Исследование маркировки, высвобождения, повторного отлова опирается на высвобождение известного количества помеченных комаров из определенной точки и их последующий отлов в точках, находящихся в непосредственной близости от первоначальной точки высвобождения. Сравнивая количество пойманных самцов и диких самцов на расстояниях от точки выпуска, можно оценить общую дикую популяцию самцов в этом районе, так что конкурентные соотношения стерильных самцов могут быть выпущены23. Максимизация соотношения стерильных и диких самцов может быть достигнута путем высвобождения большего количества стерильных самцов и / или путем сокращения дикой популяции классическими средствами контроля, такими как сокращение источника, незрелый контроль или лечение взрослыми.
Чтобы оценить эффективность стерильных мужских высвобождений, коллекции взрослых можно сравнить в хронологическом порядке с областью без вмешательства. Поскольку стерильные самцы высвобождаются, а число собранных самцов и самок в районе уменьшается по отношению к сопоставимой области, не подверженной вмешательству, то можно предположить, что это связано с тем, что выпущенные стерильные самцы успешно превосходят местных фертильных самцов. Этот эффект также может наблюдаться в чашках ловушки яйцекладки, развернутых как в местах вмешательства, так и в местах невмешательства. Яйца все еще могут быть произведены в месте вмешательства, но если вылупляется меньше, чем из участка без вмешательства, можно предположить, что они не оплодотворяются из-за самок, спаривающихся со стерильными самцами. Все больше и больше яйцекладки неоплодотворенных яиц могут в конечном итоге привести к снижению яйцекладки из-за незамещения самок в месте вмешательства 8,24.
Будущие направления технологии и программ SIT естественным образом расширяются на дополнительные важные с медицинской точки зрения виды комаров. Например, эта технология может быть легко адаптирована для контроля Aedes albopictus, учитывая очень похожую биономику Aedes aegypti и Aedes albopictus. Другие виды комаров-переносчиков болезней, представляющие интерес, включают Culex quinquefasciatus, Culex tarsalis и различные виды Anopheles . Повышение эффективности этой технологии зависит от увеличения способности самцов куколок, производимых в данный момент времени, что может быть достигнуто с помощью генетических манипуляций или искусственного отбора, и повышения конкурентоспособности самцов, что может быть достигнуто путем увеличения мужественности, фертильности или долголетия.
В конечном счете, программы SIT не являются серебряной пулей для борьбы с комарами. Вместо этого они являются инструментом в наборе других методов управления, таких как программы IVM, которые перекрестно компенсируют слабые места среди методов. Например, в то время как химический контроль обеспечивает быстрый и дешевый контроль, он также способствует развитию резистентности и нецелевой смертности; и в то время как SIT является видоспецифичным и вряд ли вызовет резистентность, самцы SIT должны быть произведены и выпущены на неограниченный срок для борьбы с иммигрирующими популяциями из-за пределов района борьбы с переносчиками.
Раскрытие информации
Все авторы заявили об отсутствии конфликта интересов.
Благодарности
Мы благодарим drs. R.-D. Xue, C. Bibbs, W. Qualls и V. Aryaprema из anastasia Mosquito Control District, St. Augustine, Florida, за партнерство в разработке программы SIT и экспертное понимание эффективного оперативного высвобождения стерильных самцов Aedes aegypti. Это исследование было поддержано USDA-ARS и Департаментом сельского хозяйства и потребительских услуг Флориды (FDACS). Упоминание торговых наименований или коммерческих продуктов в этой публикации исключительно с целью предоставления конкретной информации и не подразумевает рекомендации или одобрения со стороны USDA или FDACS.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-1/8" wrench (1" (1 inch) = 2.54 cm) | Craftsman | CMMT44707 | |
| 1/2 pint cardstock cup (1/2 pint = 236.5 mL) | Science Supplies WLE corp | 1/2 pint | |
| 1/4" tubing - tygon | Hudson Extrusions | LLDPE1/8 X 1/4 BLK | to attach to CO2 gas regulator |
| 1/8" brass barb w/ MIP connection | B&K | BHB-85NLB | to attach to CO2 gas regulator |
| 1000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-1000 | |
| 3000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-3000 | |
| Adult large cage | Bioquip | 1450D | |
| Aspirator vials | Bioquip | 2809V | |
| Bovine liver powder | MP Biomedicals | 290039601 | |
| Brewers yeast | MP Biomericals | 02903312-CF | |
| CO2 regulator | Randor | 64003038 | |
| CO2 tank (20# canister) | Praxair | CDBEVCARB20 | |
| Collection basin | Treasure Gurus | KI-ENAMELBOWL | for separator |
| Cotton balls - large | Fisher Scientific | 22-456-883 | |
| Deli cups w/lids - 470 mL | Pactiv DELItainer | PCTYSD2516 | |
| Deli cups w/lids - 1900 mL | Berry Global | T60764 | |
| DoseReader 4 | ND0.5 and ND1.0 QA Filter Set standards | ||
| Dosimetry film | Far West Technology, Inc. | ||
| Filter paper | Millipore | AP10045S0 | |
| Flashlight aspirator | Bioquip | 2809D | |
| Forceps - fine featherweight | Bioquip | 4748 or 4750 | featherweight |
| GAFchromic | radiochromic film | ||
| Gammator M | Radiation Machinery Corporation, Parsippany, NJ | Cesium-137 irradiator | |
| Hand held mechanical aspirator | Clarke Mosquito | 13500 | |
| Lambskin condoms | Trojan | Naturalamb | |
| Large CO2 chamber | Sterilite | Walmart # 568789514 | |
| Larval rearing pans | Blue Ridge Thermoforming | 01-FG-400-3N-ABS | Dimensions: 22.375 x 17.5 x 3 (inches) |
| Magnets - 20# pull | Master magnetics | MHHH20BX | |
| Marking dye | Dayglo | ECO-11 | Aurora Pink |
| Marking dye | Dayglo | ECO-17 | Saturn Yellow |
| Mesh | Falk | T301 | |
| Pasture pipettes | Thermo Scientific | 02-708-006 | |
| Petri dishes - large | VWR International | 25384-090 CS | |
| Petri dishes - small (60 mm x 15 mm) | Fisher Brand | FB0875713A | |
| Pupa separator | J.W. Hock | 1512 | |
| Red rubber hose | Welch | 331040-5 | |
| Release containers | Science Supplies WLE corp | 1 gallon | |
| Rubber bands - cross #19 | Alliance | ALL37196 | |
| Rubber bands - latitude #64 | Skillcraft | NSN0589974 | |
| Scale | Ohaus | H-4737 | |
| Seed germination paper - Heavy stock 76# | Anchor Paper | #76 | |
| Shipping coolers- 16 x 13 x 12.5" | MrBoxonline.com | Husky Foam Cooler kit | |
| Sieve #20 | Advantech | 20BS8F | |
| Sieve #30 | Advantech | 30BS8F | |
| Small cage - Bug Dorm | MegaView | Bug Dorm-1 | |
| Small CO2 chamber | Mainstays | Walmart # 562922221 | |
| Souffle cup lid | SOLO | 41165277456 | |
| Souffle cups - 4 oz (1 oz = 29.6 mL) | SOLO | 41165024104 | |
| Sponge | ocelo | MMM7274FD | |
| Squeeze bottle | Dynalon | 3UUP6 | |
| Stereoscope | Meiji Techno | EMZ-5 | |
| Stockinette | BSN Medical | 30-1006 | |
| Styrofoam | extruded polystyrene foam | ||
| Tropical fish flake food | Tetra | 4.52 pound | |
| Vaccum chamber - desiccator | BelArt | T9FB892757 | |
| Weigh boats | Globe Scientific | 3621 |
Ссылки
- Moyes, C. L., et al. Contemporary status of insecticide resistance in the major Aedes vectors of arboviruses infecting humans. PLoS Neglected Tropical Diseases. 11 (7), 0005625 (2017).
- Baldacchino, F., et al. Control methods against invasive Aedes mosquitoes in Europe: a review. Pest Management Science. 71 (11), 1471-1485 (2015).
- Burkett, D. A., Cope, S. E., Strickman, D. A., White, G. B. The Deployed Warfighter Protection (DWFP) Research Program: Developing new public health pesticides, application technologies, and repellent systems. Journal of Integrated Pest Management. 4 (2), 1-7 (2013).
- Harwood, J. F., et al. Controlling Aedes aegypti in cryptic environments with manually carried ultra-low volume and mist blower pesticide applications. Journal of the American Mosquito Control Association. 32 (3), 217-223 (2016).
- Morrison, A. C., Zielinski-Gutierrez, E., Scott, T. W., Rosenberg, R. Defining challenges and proposing solutions for control of the virus vector Aedes aegypti. PLoS Medicine. 5 (3), 68 (2008).
- Klassen, W., Curtis, C. F., InDyck, V. A., Hendrichs, J., Robinson, A. S. History of the sterile insect technique. Sterile insect technique: principles and practice in area-wide integrated pest management. , 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector Borne and Zoonotic Diseases. 10 (3), 295-311 (2010).
- Dame, D. A., Curtis, C. F., Benedict, M. Q., Robinson, A. S., Knols, B. G. Historical applications of induced sterilisation in field populations of mosquitoes. Malaria Journal. 8, (2009).
- Bond, J. G., et al. Optimization of irradiation dose to Aedes aegypti and Ae. albopictus in a sterile insect technique program. PloS One. 14 (2), 0212520 (2019).
- Bourtzis, K., Lees, R. S., Hendrichs, J., Vreysen, M. J. B. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations. Acta Tropica. 157, 115-130 (2016).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments: JoVE. , e3579 (2014).
- Carvalho, D. O., et al. Aedes aegypti lines for combined sterile insect technique and incompatible insect technique applications: the importance of host genomic background. Entomologia experimentalis et applicata. 168 (6-7), 560-572 (2020).
- Mamai, W., et al. Aedes aegypti larval development and pupal production in the FAO/IAEA mass-rearing rack and factors influencing sex sorting efficiency. Parasite. 27, 43 (2020).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- . Methods in Aedes Research Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods%20in%20Aedes%20Research%202016.pdf (2016)
- Focks, D. A. An improved separator for the developmental stages, sexes, and species of mosquitoes (Diptera: Culicidae). Journal of Medical Entomology. 17 (6), 567-568 (1980).
- International Atomic Energy Agency. . Manual of Dosimetry in Radiotherapy. Technical Reports Series No. 110. , (1970).
- Aldridge, R. L., et al. Gamma-irradiation reduces survivorship, feeding behavior, and oviposition of female Aedes aegypti. Journal of the American Mosquito Control Association. 36 (3), 152-160 (2020).
- Cianci, D., et al. Estimating mosquito population size from mark-release-recapture data. Journal of Medical Entomology. 50 (3), 533-542 (2013).
- Knipling, E. F. . The basic principles of insect population suppression and management. , (1979).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены