Method Article
Preparando mosquitos Aedes aegypti machos irradiados e marcados para liberação em um Programa Operacional de Técnica de Insetos Estéreis
Neste Artigo
Resumo
A técnica de insetos estéreis (SIT) é usada para controlar populações específicas de mosquitos clinicamente importantes que podem ser resistentes a controles químicos. Aqui, descrevemos um método de criação em massa e preparação de mosquitos machos estéreis para liberação em um programa operacional de SIT visando o mosquito Aedes aegypti .
Resumo
O controle de doenças humanas como dengue, zika e chikungunya depende do controle de seu vetor, o mosquito Aedes aegypti , pois não há prevenção. O controle de mosquitos vetores pode contar com produtos químicos aplicados nos estágios imaturo e adulto, o que pode contribuir para a mortalidade de não-alvos e, mais importante, levar à resistência a inseticidas no vetor. A técnica de insetos estéreis (SIT) é um método de controle de populações de pragas através da liberação de machos adultos esterilizados que acasalam com fêmeas selvagens para produzir descendentes inviáveis. Este trabalho descreve o processo de produção de machos estéreis para uso em um programa operacional de SIT para o controle de mosquitos Aedes aegypti . Aqui estão descritas as etapas usadas no programa, incluindo a criação e manutenção de uma colônia, a separação de pupas masculinas e femininas, a irradiação e marcação de machos adultos e o envio de machos Aedes aegypti para o local de soltura. Também são discutidas ressalvas processuais, limitações do programa e objetivos futuros.
Introdução
A transmissão de patógenos transmitidos por mosquitos para os seres humanos causa milhões de casos de doenças e mortes a cada ano em todo o mundo. Na ausência de vacinas eficazes e aprovadas para doenças transmitidas por mosquitos, como zika ou dengue, uma das maneiras mais eficazes de reduzir a transmissão é reduzir as populações de mosquitos vetores de doenças. De forma geral, um número crescente de espécies de mosquitos, tradicionalmente alvo de pesticidas, está exibindo níveis crescentes de resistência a pesticidas1. Simultaneamente, as agências governamentais têm agressivamente cancelado ou banido pesticidas previamente aprovados, e poucas medidas novas e eficazes de controle químico estão sendo desenvolvidas 2,3. Essa constelação de obstáculos ao controle de mosquitos motivou a exploração de técnicas alternativas não químicas para reduzir as populações de mosquitos.
Certas espécies de mosquitos apresentam desafios para controlar questões de resistência e registro de pesticidas. O Aedes aegypti (L.) é um proeminente mosquito vetor de doenças extremamente difícil de controlar por meio do manejo tradicional integrado de vetores devido ao habitat peridoméstico críptico explorado por esta espécie para o desenvolvimento imaturo e repouso adulto 4,5. Os desafios relacionados à exploração do habitat críptico em torno das residências incluem a dificuldade de chegar a esses locais com técnicas de pulverização de pesticidas, bem como a potencial falta de aceitação pelo público para o acesso repetido à propriedade privada para que as agências de controle de vetores de saúde pública realizem as atividades intensivas de vigilância e controle cruciais para o manejo integrado eficaz de vetores (IVM) para esta espécie.
Felizmente, o SIT, uma abordagem comprovadamente bem-sucedida para o controle duradouro de outras espécies de insetos altamente desafiadoras6, está sendo aplicada ao problema do Aedes aegypti em uma série inovadora de experimentos e ensaios operacionais baseados em St. Augustine, Flórida (dados não publicados da KJL, RLA, SCB). O SIT tem sido aplicado a uma variedade de espécies de insetos, incluindo mosquitos, e tem sido revisado em profundidade 7,8. O SIT aproveita a liberação em massa de machos criados em colônias esterilizados, por exemplo, por exposição a radiação ionizante ou produtos químicos para sobrecarregar a escolha de parceiros de populações naturais de fêmeas. Machos esterilizados que acasalam com fêmeas selvagens tornam os ovos inférteis devido aos danos sofridos pelos gametas masculinos e, se presentes em número suficiente, podem, teoricamente, colidir com a população natural de Aedes aegypti.
Um programa SIT foi iniciado para tentar reduzir as populações de Aedes aegypti em uma área urbana na costa atlântica da Flórida, onde esta espécie recentemente recolonizou e está se expandindo e apresentando um risco de saúde pública para a transmissão de vírus como Zika, dengue ou chikungunya. Para maximizar o potencial de compatibilidade com fêmeas silvestres, uma nova colônia foi estabelecida utilizando Aedes aegypti capturado na natureza da população-alvo para produzir machos para o programa9. Isso foi baseado na hipótese de que machos criados em colônias de origem local seriam mais propensos a serem competitivos com machos selvagens locais para acasalamento com fêmeas selvagens locais. Para que o SIT seja eficaz, não só um número esmagador de machos estéreis precisa estar presente na área-alvo, mas eles também têm que ser capazes de efetivamente cortejar e acasalar com mosquitos fêmeas selvagens locais.
Uma série de experimentos foi conduzida para determinar o número ideal de machos estéreis a serem liberados (dados não publicados de KJL, RLA, SCB), bem como doses ótimas de radiação que tornariam os machos inférteis sem interferir na sobrevivência, comportamento ou aceitação por fêmeas selvagens (dados não publicados de KJL, RLA, SCB). Esses dados estão disponíveis em publicações aliadas desse grupo, mas alguns desses achados também são capturados neste protocolo e podem ser usados como ponto de partida para novos programas de controle do SIT Aedes aegypti em outros lugares. Esta espécie está constantemente expandindo seu alcance, e os programas SIT mostram grande promessa de serem soluções econômicas e de longo prazo para controlar essa população. O objetivo deste protocolo é produzir mosquitos Aedes aegypti esterilizados, machos e criados em colônias para liberação sistemática em áreas externas para interromper os ciclos reprodutivos naturais das populações locais de Aedes aegypti em um programa operacional de controle de vetores de saúde pública.
Embora protocolos e fluxos de trabalho semelhantes tenham sido publicados para a produção de machos transgênicos do Aedes aegypti e fluxos de trabalho de produção para o Aedes SIT, ou programas de incompatibilidade baseados em Wolbachia, tenham sido publicados em outros lugares, este protocolo ilustra como os protocolos existentes foram adaptados para a produção, separação e irradiação de pupas masculinas do Aedes aegypti, marcação e embalagem de machos adultos e envio para o local de lançamento deste programa9, 10,11,12,13,14,15,16,17,18. O componente de marcação deste protocolo pode não ser exigido em um programa SIT operacional maduro; no entanto, foi incluído aqui porque é uma maneira de monitorar a eficácia e controlar a qualidade de todo o processo nos primeiros anos de estabelecimento do programa SIT. Os programas de controle de mosquitos são normalmente executados por autoridades locais, de modo que podem variar amplamente em muitos aspectos de sua organização, desde o tamanho e a base de financiamento até o ajuste das táticas de controle para maximizar o sucesso local. Assim, o protocolo aqui descrito deve ser avaliado quanto à compatibilidade com os recursos disponíveis.
Protocolo
NOTA: Este protocolo é específico para o manejo do Aedes aegypti, mas pode ser modificado para ser eficaz para outras espécies de mosquitos.
1. Produção e manutenção de uma colônia do Aedes aegypti
- Cria Aedes aegypti adulto e produz ovos.
- Prepare uma estrutura de alumínio dobrável de 0,6 m x 0,6 m x 0,6 m, grande gaiola de criação com peneira de malha de fibra de vidro 20 x 20 e uma manga de stockinette de alcance em uma parede vertical.
- Coloque uma banheira de plástico de 1900 mL com pupas de Aedes aegypti (proporção sexual de 1:1) em cada gaiola de criação, amarre a manga fechada e deixe os copos no lugar para eclosão até que não surjam mais adultos (ou seja, aproximadamente 4 dias). Neste momento, remova os copos e mantenha as gaiolas de criação adultas a 28-30 °C, >50% de umidade relativa (Rh) e um ciclo de 12:12 ou 14:10 claro:escuro (L:D).
NOTA: A produção de pupas de Aedes aegypti é descrita na secção 1.2. A densidade de pupas na banheira de 1900 mL deve ser tal que haja espaço suficiente para que todas as pupas subam para o ar simultaneamente. - Vinte e quatro horas após as pupas serem colocadas nas gaiolas de criação, coloque um recipiente de solução de sacarose a 10% com um pavio de esponja e suspenda uma esponja de 10 cm x 2 cm embebida em mel de um gancho de arame em cada gaiola para fornecer fontes separadas de hidratação e nutrição aos mosquitos adultos. Monitore as esponjas e o recipiente de sacarose quanto à secura ou ao crescimento do mofo e reabasteça ou troque conforme necessário.
NOTA: Use um copo de plástico de 120 mL com um pavio de esponja de 10 cm x 2 cm montado através de um recorte na tampa em pequenas gaiolas de criação e um copo de plástico de 460 mL com um pavio de esponja de 12 cm x 8 cm em gaiolas grandes. - Forneça uma refeição de sangue para cada gaiola de criação 48-72 h após a maioria dos adultos terem emergido e a cada 2-3 dias a partir de então para manter um alto número de fêmeas alimentadas com sangue para maximizar o rendimento dos ovos. Encha um preservativo de pele de cordeiro com 50-100 mL de sangue bovino desfibrinado e aqueça a aproximadamente 37 °C em um banho de água quente. Em seguida, use um pano ou papel toalha para acariciar e secar parcialmente o preservativo antes de colocá-lo em uma placa de Petri forrada de papel dentro da gaiola por 30-60 min.
NOTA: Antes de usar, lave o interior e o exterior de cada preservativo com água 2-3x para remover lubrificantes ou outros substratos e verifique se há furos. Os preservativos podem ser reutilizados para 3-5 mamadas, enxaguando o sangue e armazenando-os em um copo de água fria. Como algumas colônias podem sofrer infestações por formigas, os preservativos podem precisar ser suspensos para limitar o acesso. - Aguarde 48-72 h após cada alimentação sanguínea e, em seguida, introduza um copo de oviposição em cada gaiola de criação de adultos. Prepare os copos de oviposição adicionando 200 mL de água filtrada de pupa (ou seja, as larvas de água e as pupas foram criadas) em um copo plástico de 460 mL fornecido com uma folha de papel de germinação de sementes de 8-10 cm de altura x 30 cm de largura (papel de oviposição) ajustada ao longo da circunferência interna do copo. Verifique os papéis de oviposição diariamente, substitua-os a cada 2-4 dias e armazene cuidadosamente os papéis de oviposição carregados de ovos, deixando-os secar por 24-48 h a >50% Rh19.
NOTA: Deixar os copos de oviposição nas gaiolas de criação por um período não superior a 72 h para evitar que os ovos eclodam. - Mantenha as gaiolas de criação de adultos por até 3-4 semanas antes de quebrá-las e criar novas gaiolas de criação de adultos.
- Para quebrar uma gaiola de criação, remova e limpe o copo de oviposição, armazene o papel de oviposição carregado de ovos, remova e limpe o recipiente de solução de sacarose e a esponja de mel e congele a gaiola para matar todos os mosquitos.
- Remova todos os corpos de mosquitos e limpe completamente o interior e o exterior de cada gaiola com água e sabão diluído usando toalhas de papel e esfregando almofadas com esponjas. Deixe a gaiola limpa secar por pelo menos 24 horas antes de usá-la no próximo ciclo de criação.
NOTA: Use equipamentos de vácuo equipados com filtragem de alta eficiência para remover partículas que podem levar a alergias. Os recipientes de solução de sacarose podem ser limpos e reutilizados 3-5x.
- Criação de larvas de Aedes aegypti a partir de ovos
- Prepare um estoque de pasta nutricional larval misturando 80 g de uma proporção de 3:2 de pó de fígado bovino: levedura de cerveja em 2200 mL de água da torneira. Prepare alimentos de peixe pulverizados. Despeje flocos de peixe em um moedor de especiarias e moa até que fique um pó fino.
NOTA: Esta pasta é designada como castanha neste laboratório. - Usando papel de oviposição carregado de ovos (5.000-10.000 ovos) da etapa 1.1.5, corte uma porção de 3-7 cm do papel de ovo perpendicular à linha de oviposição e coloque-o em um recipiente de 460 mL meio cheio de água da torneira, juntamente com uma pitada de flocos de comida de peixe pulverizados. Cubra e agite vigorosamente por pelo menos 1 min.
NOTA: O papel de ovo deve ser armazenado por pelo menos 7 dias (mas não mais de 90 dias, o que pode reduzir a eclosão) pós-oviposição antes de iniciar o processo de eclosão para permitir a embrionação. Bactérias e algas presentes no alimento dos peixes desoxigenam rapidamente a água, o que desencadeia o desenvolvimento larval. - Deitar todo o conteúdo do recipiente da fase 1.2.2 numa panela de criação larval preparada com 3 L de água da torneira e 50 ml de pasta castanha . Marque a panela com a data de início, as informações da cepa, o horário de alimentação de acordo com a Tabela 1 e armazene a 28-30 °C, >50% Rh e 12:12 ou 14:10 L:D ciclo.
NOTA: A proporção de 3 L de água para 50 mL de marrom é baseada na profundidade da água nas panelas larvais específicas mencionadas na Tabela de Materiais. Panelas de tamanhos diferentes suportarão diferentes densidades de pupas e, portanto, exigirão diferentes quantidades de água e pasta marrom . As taxas de alimentação larval na Tabela 1 são dadas como um intervalo; a seleção da quantidade utilizada é baseada na experiência e determinação da saúde geral das larvas em desenvolvimento usando variáveis como turbidez, cor e odor da água; presença de filme bacteriano na água; número ou proporção de larvas vivas e mortas; e a motilidade das larvas. Nos dias 3 a 6, alimentar mosquitos imaturos pulverizou a ração de peixes de acordo com a Tabela 1. Adicionar água, reduzir alimentos e configurar 2-3 panelas extras do que o projeto requer são maneiras de gerenciar panelas larvais insalubres.
- Prepare um estoque de pasta nutricional larval misturando 80 g de uma proporção de 3:2 de pó de fígado bovino: levedura de cerveja em 2200 mL de água da torneira. Prepare alimentos de peixe pulverizados. Despeje flocos de peixe em um moedor de especiarias e moa até que fique um pó fino.
| Dia | Volume de pasta nutricional adicionada | Volume de água adicionado | Ações |
| 1 | 50 mL (chorume) | 3000 ml | |
| 2 | (sem comida) | (sem água) | |
| 3 | 1/4 - 1/2 colher de chá (alimento pulverizado para peixes) | 500-1000 ml | |
| 4 | 1/2 - 3/4 colher de chá (alimento pulverizado para peixes) | 500-1000 ml | |
| 5 | 1/2 - 3/4 colher de chá (alimento pulverizado para peixes) | 500-1000 ml | |
| 6 | 1/4 - 1/2 colher de chá (alimento pulverizado para peixes) | 500-1000 ml | |
| 7 | (sem comida) | (sem água) | pupas e larvas de estirpe |
Tabela 1: Esquema alimentar para criação em massa de larvas de Aedes aegypti.
2. Separação de pupas masculinas de Aedes aegypti
- Concentre as pupas das panelas larvares. Uma vez que a proporção limiar aproximada de pupas é atingida, despeje o conteúdo de cada panela através de uma peneira (tamanho 20-40). Use uma garrafa de água da torneira para lavar as pupas e larvas da peneira em um copo de plástico graduado de 3000 mL.
NOTA: Apenas 2-3 panelas larvais devem ser transferidas para cada copo de 3000 mL para evitar a superlotação para que as pupas possam atingir a superfície confortavelmente. Espera-se que as pupas se desenvolvam entre 130-140 h após a eclosão dos ovos sob as condições de temperatura e luz mencionadas na etapa 1.2.3. Espere uma eclosão de ovos perceptível no mesmo dia em que os ovos são configurados. Dependendo das condições ambientais, aproximadamente 20-70% das larvas terão pupado e estarão prontas para serem peneiradas dentro de 6 dias. Particionar as pupas em vários copos de 3000 mL garante volumes gerenciáveis para despejar no separador. - Sepas machos das larvas e pupas fêmeas.
NOTA: Esta etapa pode ser executada por um operador ou dois operadores.- Para um único operador que separa as pupas machos:
- Particione o conteúdo de cada copo de 3000 mL gerado na etapa 2.1 em vários recipientes plásticos de 1900 mL para reduzir o derramamento e a sobrecarga do separador. Preparar o separador de placas colocando um recipiente de coleta rígido raso de 4000 mL abaixo da eclusa na base do separador (Figura 1). Encha dois copos de plástico graduados de 3000 mL cerca de 3/4 cheios de água da torneira.
NOTA: Use uma mangueira de pia como alternativa aos copos graduados de plástico de 3000 mL. Caso contrário, os copos precisarão ser continuamente reabastecidos durante todo o processo de separação. Detalhes adicionais para operar o separador de pupas podem ser encontrados nas referências 12,20. - Despeje água através do espaço entre as placas de vidro e ajuste os botões superior e inferior no sentido horário ou anti-horário para permitir que a água flua continuamente e, ao mesmo tempo, gere água parada a uma altura de aproximadamente 1,25 cm da base das placas. Marque as posições iniciais dos botões inferiores com fita adesiva. Uma vez que a água parada é distribuída uniformemente pela base das placas de vidro com igual altura e taxa de drenagem, comece a derramar o conteúdo dos recipientes de pupas e larvas através do espaço entre as placas.
NOTA: Uma separação clara deve estar presente entre pupas pequenas (macho) e grandes (fêmea); caso contrário, lave este lote e ajuste os botões superiores para reduzir o espaço entre as placas. - Enquanto despeja lentamente a água através do separador, gire continuamente os botões inferiores como um par no sentido anti-horário ~ 1-2 cm da posição inicial marcada com fita até que a maioria ou todas as larvas tenham lavado e deslizado pela eclusa para o recipiente de coleta.
NOTA: Como uma mão está sendo usada para derramar água, a outra mão gira os botões um de cada vez, mas igualmente e em pequenos incrementos, para abrir lentamente as placas. A maioria das larvas é rapidamente lavada, mas haverá algumas larvas capturadas com as pupas masculinas. Essas larvas retardatárias serão irradiadas, mas ficarão atrasadas no desenvolvimento e não se aproximarão de adultos com a coorte focal de pupas. - Descarte ou recicle as larvas de volta para a colônia, mas, em ambos os casos, remova-as do recipiente de coleta antes que as pupas machos comecem a lavar através do separador. Pause o processo interrompendo o fluxo de água enquanto o recipiente de coleta na base da eclusa é limpo de larvas derramando através de uma peneira # 30, que é retrolavada em um recipiente separado.
NOTA: As larvas fluem primeiro, seguidas pelas pupas machos e, finalmente, pelas fêmeas (Figura 1). - Continue a derramar água e gire os botões inferiores até que as larvas masculinas sejam lavadas e separadas no recipiente de coleta. Pause o processo para verificar e remover larvas do recipiente de coleta antes da transferência das pupas machos na próxima etapa.
NOTA: O número de descargas necessárias para separar os machos depende do ritmo do derramamento de água e da velocidade com que os botões são girados. Geralmente leva 2000-2500 mL de água para lavar as larvas, 1000-1500 mL para lavar as pupas masculinas e 200-400 mL para lavar as pupas fêmeas. - Despeje as pupas machos para fora do recipiente de coleta através de uma peneira # 20 sobre uma pia. Use uma garrafa de 1000 mL de água da torneira para lavar novamente as pupas machos da peneira enquanto despeja em um recipiente separado de 1900 mL.
- Uma vez que todas as pupas machos tenham sido separadas, continue a derramar água através do separador e ajuste os botões inferiores para lavar através das pupas fêmeas. Transferir as fêmeas utilizando o processo de peneira descrito na etapa 2.2.1.6 para um recipiente separado até que todos os mosquitos imaturos sejam expulsos do separador. Descarte as pupas fêmeas. Depois que o lote tiver sido processado, retorne os botões às suas posições iniciais originais e repita o processo com o próximo lote. Uma vez que todos os lotes são processados, deixe as placas abertas para que o separador possa secar.
NOTA: Não há separação perfeita usando este dispositivo, o que requer paciência e prática. Pupas ou larvas teimosas podem ser desalojadas com um fluxo pesado de água, mas não na medida em que as empurra para os lados, o que poderia contaminar futuras inundações.
- Particione o conteúdo de cada copo de 3000 mL gerado na etapa 2.1 em vários recipientes plásticos de 1900 mL para reduzir o derramamento e a sobrecarga do separador. Preparar o separador de placas colocando um recipiente de coleta rígido raso de 4000 mL abaixo da eclusa na base do separador (Figura 1). Encha dois copos de plástico graduados de 3000 mL cerca de 3/4 cheios de água da torneira.
- Para dois operadores que separam as pupas machos, modificar o ponto 2.2.1 do seguinte modo.
- Primeiro operador: Despeje água através do separador e gire os botões incrementalmente para separar larvas, pupas machos e pupas fêmeas.
- Segundo operador: Uma vez que cada estágio é coletado no recipiente de eclusa, peneire o conteúdo do recipiente de eclusa para dividir as larvas, pupas machos e pupas fêmeas em vários recipientes de coleta de eclusas separados. Mantenha os copos grandes cheios de água se uma mangueira de pia não estiver disponível.
- Para um único operador que separa as pupas machos:
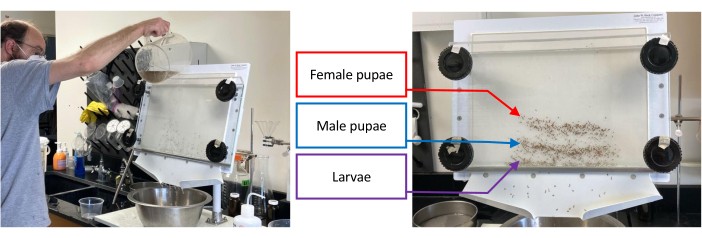
Figura 1: Separador de pupas contendo um lote de Aedes aegypti imaturo. A separação começa derramando água através do separador enquanto gira os botões inferiores 1-2 cm no sentido anti-horário até que o conjunto alvo, ou seja, larvas, pupas machos ou pupas fêmeas, tenha sido isolado o máximo possível dos conjuntos que permanecem (imagem à esquerda). A imagem à direita mostra a separação de larvas (banda mais baixa), pupas machos (banda média) e pupas fêmeas (banda superior). Por favor, clique aqui para ver uma versão maior desta figura.
3. Preparação de pupas masculinas de Aedes aegypti para irradiação
- Divida as pupas machos em placas de Petri de plástico de 60 mm.
NOTA: O número de placas de Petri necessárias depende de quantas pupas machos estão disponíveis para irradiação: uma panela de criação larval da etapa 1.2 preencherá aproximadamente 1,5 placas de Petri. A idade das pupas varia de 1 a 40 h de idade. Neste protocolo, a metade mais profunda de diâmetro menor da placa de Petri é chamada de fundo, e a metade mais rasa de maior diâmetro é chamada de topo.- Prepare discos pré-cortados de papel de filtro para caber no diâmetro interno do fundo da placa de Petri. Coloque um disco de papel de filtro umedecido com água em cada um dos fundos das placas de Petri para manter as pupas hidratadas durante todo o transporte e o processo de irradiação.
- Transfira as pupas para placas de Petri. Coe as pupas machos coletadas na etapa 2.2.1.6 com uma peneira e lave as pupas em um copo graduado de 1000 mL com o mínimo de água possível. Despeje cuidadosamente as pupas em placas de Petri até que cada disco de papel de filtro esteja uniformemente coberto com uma única camada de pupas (Figura 2A - C). Disponha as placas de Petri na borda de uma mesa em uma linha para facilitar o derramamento.
NOTA: Uma alternativa para forçar as pupas é cortar a ponta de uma pipeta Pasteur de plástico de 3 mL para um diâmetro grande o suficiente para acomodar as pupas. Use a pipeta para transferir as pupas do recipiente produzido na etapa 2.2.1.6 diretamente para os discos de papel de filtro, de modo que haja uma única camada de pupas em cada placa de Petri. Isso só é prático para pequenos lotes. - Utilize uma pipeta Pasteur de 3 ml inalterada para remover a água parada do fundo da placa de Petri para evitar o movimento da pupa durante a etapa de sexagem (3.2) e o transporte.

Figura 2: Transferência de pupas para placas de Petri para irradiação . (A) Pupas peneiradas são derramadas e retrolavadas em um copo de plástico de 1000 mL. (B) O mínimo de água é retido no copo para facilitar o derramamento em placas de Petri. (C) Placas de Petri alinhadas ao longo da borda de uma superfície para facilitar o derramamento em uma única camada de pupas. (D) As placas de Petri carregadas com pupas são empilhadas e fixadas para entrega à instalação de irradiação. Por favor, clique aqui para ver uma versão maior desta figura.
- Sexo as pupas para verificar se há contaminação com as fêmeas. Sob um escopo de dissecação, use sondas para girar cada pupa para verificar a superfície ventral de um lobo genital de tamanho grande (Figura 3) indicando o sexo masculino. Retire e descarte as pupas com lobos genitais reduzidos ou pequenos que indiquem fêmeas e substitua por um número igual de pupas machos para manter a contagem correta.
NOTA: Em um programa operacional, essa etapa não é prática devido ao grande número de mosquitos e ao fato de que a separação, a transferência, a irradiação e o preparo de gaiolas após a irradiação são todos feitos em um dia com tempo limitado. A verificação de qualidade de uma amostra de placas de Petri selecionadas pode ser feita, particularmente nas fases iniciais de desenvolvimento do programa SIT.
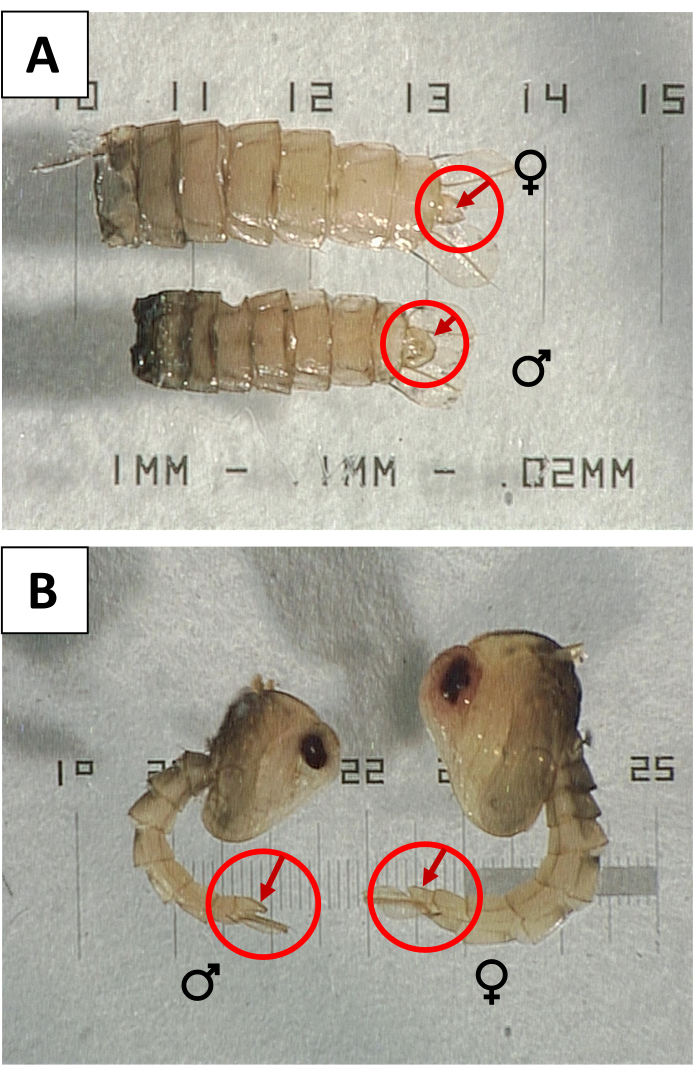
Figura 3: Pupas sexantes utilizando o lobo genital . (A) Incidências ventral e (B) lateral de pupas de Aedes aegypti femininas (♂) e masculinas ♀, com lobos genitais indicados para mostrar o dimorfismo sexual. Por favor, clique aqui para ver uma versão maior desta figura.
- Cubra os fundos com os topos das placas de Petri e prenda com fita adesiva de laboratório. Agrupar as placas de Petri coladas com faixas elásticas em pilhas dimensionadas para caber na câmara de irradiação e selar dentro de um saco reselável de 3,8 L rotulado (Figura 2D). Não permita que as pupas permaneçam descobertas por >1 h.
4. Irradiação de pupas masculinas de Aedes aegypti
- Prepare o filme de dosimetria do mesmo lote cortando 1 cm2 quadrados de filmes e colocando cada quadrado em seu envelope individual.
NOTA: Todos os filmes utilizados em cada dia são cortados ao mesmo tempo. Isso reduz a pequena quantidade de variação induzida pelo armazenamento. O número de quadrados necessários para cada pilha é 1 + (número de placas de Petri). - Prepare um kit para levar para a instalação de irradiação, que deve incluir um temporizador de laboratório, fita de laboratório, marcador permanente, envelopes preparados de filme de dosimetria, crachá de dosimetria e uma folha de anotações de laboratório com listas de verificação para acompanhar as principais informações (Figura 4).
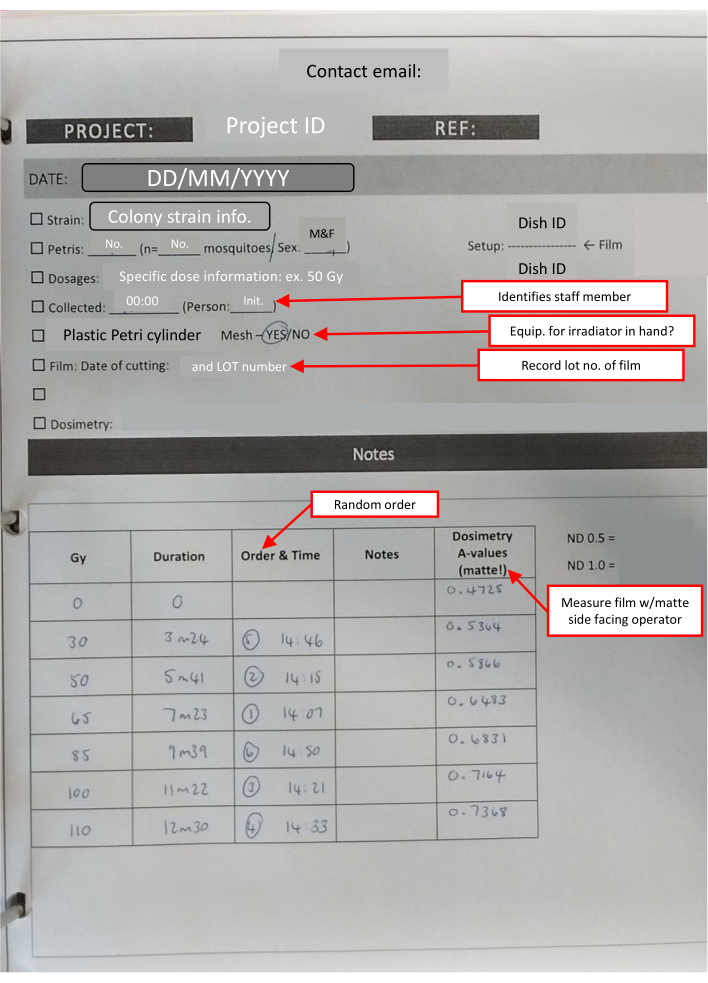
Figura 4: Esboço do livro de laboratório-folha IR preenchida para um conjunto de resposta à dose. As caixas de texto destacadas em vermelho (marcadas por setas vermelhas) indicam notas úteis sobre as diferentes seções e reiteram as principais informações. Por favor, clique aqui para ver uma versão maior desta figura.
- Transporte as pupas para a instalação de irradiação. Coloque as placas de Petri das pupas machos do passo 3.3 em recipientes isolados e armazene fora da luz solar direta e com ar condicionado durante o transporte.
- Prepare pilhas de placas de Petri para irradiação no irradiador. Empilhe o número apropriado de placas de Petri para caber na câmara de irradiação com um envelope de filme de dosimetria centralizado entre cada prato e na parte superior e inferior da pilha. Prenda os envelopes e toda a pilha com fita adesiva de laboratório para evitar derramamentos e facilitar a colocação da pilha na câmara.
- Irradiar as placas de Petri das pupas machos. Coloque a pilha de placas de Petri na malha metálica rígida na câmara para posicionar na altura correta para o cone ideal de exposição com base no mapeamento de dose anterior da unidade de irradiação específica21. Ativar a plataforma giratória no irradiador e irradiar, iniciando simultaneamente o temporizador de laboratório. Irradiar durante o intervalo adequado para atingir a dose desejada (os exemplos são apresentados na Tabela 2).
NOTA: Este protocolo é baseado em um irradiador de césio-137 (ver Tabela de Materiais) e uma dose alvo de 50 Gy. Como o Cs-137 decai com o tempo, a taxa de dose é ajustada a cada ano realizando uma série dose-resposta usando dosímetros de alanina, suplementados com filme radiocrômico para dosimetria de rotina e alanina em aproximadamente 10% das amostras irradiadas. Dada a taxa de dose atual de 8,8 Gy/min, atingir a dose alvo de 50 Gy requer 5 min, 41 s de exposição. A dosimetria de filme de rotina ocorre conforme descrito na etapa 4.7. A dosimetria de pellets de alanina é realizada no Centro Nacional de Pesquisa de Feixe de Elétrons da Texas A & M University ou no Instituto Nacional de Padrões e Tecnologia em Gaithersburg, MD, EUA.
| Dosagem (Gy) | Tempo (baseado em 8,8 Gy/min) |
| 0 | NA |
| 10 | 1 min 8 s |
| 30 | 3 min 24 s |
| 50 | 5 min 41 s |
| 65 | 7 min 23 s |
| 85 | 9 min 39 s |
| 100 | 11 min 22 s |
| 110 | 12 min 30 s |
Tabela 2: Tempos de dosagem de exemplo para o irradiador de césio-137.
- Uma vez decorrido o tempo prescrito, remova as placas de Petri do irradiador e desmonte cuidadosamente a pilha. Rotule todas as placas de Petri e envelopes de filme com a data e o local na pilha. Lacre os envelopes e guarde para dosimetria. Reembale as placas de Petri no recipiente isolado para o transporte de volta ao laboratório principal.
NOTA: Registre se os adultos surgiram durante a irradiação e marque a placa de Petri afetada para que o(s) adulto(s) não escape(m) quando as pupas forem colocadas nas gaiolas de criação (etapa 5.2). - Confirme a dose de irradiação com filme de dosimetria medindo o filme aproximadamente 24 h após a exposição. Ative o leitor de dosimetria e deixe-o equilibrar-se à temperatura ambiente. Carregue o filme usando pinças fornecidas com o leitor e siga as instruções do fabricante para ler o filme irradiado, bem como o filme em branco não irradiado do mesmo lote. Zere o leitor sem filme entre as leituras e registre os dados como na folha de dados de exemplo mostrada na Figura 5.
Observação : esse protocolo é baseado em ND0.5 e ND1.0 QA Filter Set padrões. É importante medir o filme com o lado fosco voltado para o operador.
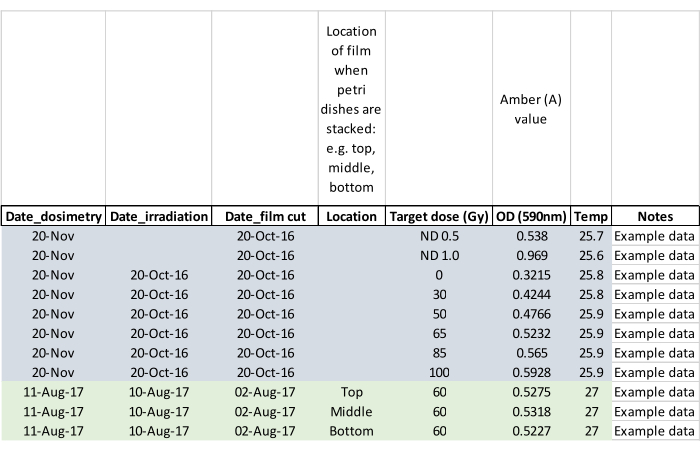
Figura 5: Folha de dados de dosimetria preenchida com dados de exemplo. Os cabeçalhos de coluna solicitam que o operador capture os principais dados para análise posterior. Por favor, clique aqui para ver uma versão maior desta figura.
5. Criação de pupas de Aedes aegypti machos irradiados em adultos
- Limpe e prepare pequenas gaiolas de criação de plástico de 30 cm x 30 cm x 30 cm para que estejam prontas para as pupas irradiadas no retorno ao laboratório principal. Para cada 2 placas de Petri de pupas machos irradiadas, prepare 1 gaiola de criação. Armazenar cada gaiola de criação com um copo de plástico meio cheio contendo 460 ml de água da torneira e um recipiente de solução de sacarose a 10%, conforme descrito na etapa 1.1.3.
- Transferir imediatamente as pupas irradiadas para as gaiolas de criação preparadas após o regresso da instalação de irradiação. Use uma garrafa de água espremer cuidadosamente as pupas de cada placa de Petri nos 460 mL de água no copo plástico em cada gaiola de criação. Após 24 h, transfira os copos para gaiolas de criação novas e limpas contendo a fonte de nutrição e aguarde a eclosão remanescente do Aedes aegypti adulto irradiado por machos.
NOTA: Se as pupas tiverem surgido durante o processo de irradiação, abra as placas de Petri com os panfletos em uma gaiola vazia e, em seguida, continue com a etapa 5.2. Descarte os machos coletados nesta gaiola. As pupas são transferidas para novas gaiolas de criação após 24 h porque os machos emergem antes das fêmeas da mesma coorte e isolar os dias de emergência pode reduzir a incidência de contaminação feminina e garantir o envelhecimento preciso dos machos.
6. Marcação e pesagem de machos adultos irradiados do Aedes aegypti
Observação : esta seção do protocolo pressupõe que duas pessoas estão conduzindo as tarefas; para 1 pessoa, ver 6.4.

Figura 6: Embalagem marcada, irradiada, macho Aedes aegypti em recipientes de liberação. (A) Recipiente de liberação mostrando a stockinette presa a um orifício cortado na lateral do cilindro de papelão com fita adesiva, grampos e cola quente. A luneta está no lugar com um suporte de etiqueta de fita afixada ao lado. O painel está retendo a tampa de malha de tule bem puxada; um elástico (não visível) também está segurando o tule no lugar sob a luneta. (B) Lote de machos anestesiados no processo de serem tombados em corante rosa em um pequeno copo de cartolina. (C) Quatro contêineres de liberação dentro de contêineres isolados. Observe que as mangas de stockinette são orientadas para o meio do contêiner de transporte, os materiais de embalagem são escondidos ao redor dos recipientes de liberação e as fontes de nutrição e hidratação estão no lugar no topo de cada recipiente de liberação coberto por um fundo de placa de Petri invertida mantido firme por elásticos cruzados e pedaços de fita. Por favor, clique aqui para ver uma versão maior desta figura.
- Preparar recipientes de liberação de cartolina.
- Corte um orifício de 11,5 cm de diâmetro na lateral de um recipiente cilíndrico de papelão de 3,9 L com tampa a 1,5-3,0 cm do fundo para que o orifício não seja coberto pela tampa (Figura 6A).
- Cortar um comprimento de 40-50 cm de stockinette e grampear uma extremidade em torno do interior do orifício de 11,5 cm cortado em 6.1.1. Use um grampeador de escritório padrão aberto para que os grampos possam ser forçados através da armazeninette e do cartolina do interior do recipiente e em uma superfície de trabalho adequada, como um bloco de espuma de poliestireno extrudado duro. Aperte os grampos usando uma chave de fenda de cabeça plana para prender firmemente a stockinette ao perímetro do orifício e prenda a fita adesiva sobre o lado amassado para evitar obstáculos. Selar a borda da stockinette no interior do cilindro para o papelão com cola quente e cruzar todo o conjunto para furos de escape.
- Crie uma luneta de retenção removendo o disco interno da tampa e corte um quadrado de 33 cm x 33 cm de malha de tule de nylon fino o suficiente para reter mosquitos Aedes aegypti machos adultos. Coloque a malha na extremidade aberta do cilindro e encaixe a luneta sobre a malha para mantê-la no lugar sem lacunas. Puxe a malha para baixo, de modo que ela se projete abaixo do painel para fazer com que a malha seja ensinada através da extremidade aberta e sele a malha saliente apertada contra o cilindro com um elástico.
- Coloque um pedaço de fita adesiva de 10 cm na lateral da luneta coberto com um pedaço de fita de etiqueta de 8 cm para que a fita de etiquetagem possa ser substituída facilmente sem rasgar a moldura.
NOTA: Os recipientes de liberação são duráveis e podem ser reutilizados >10x com o manuseio adequado. Antes de introduzir cada novo lote de mosquitos machos marcados, irradiados, adultos, verifique se a stockinette está firmemente presa ao recipiente e faça reparos imediatamente, se necessário.
- Prepare a estação de pesagem e marcação.
- Despeje aproximadamente 50 mg de corante de marcação em um recipiente de cartolna de 240 mL e espalhe o corante como uma camada de pó uniformemente ao redor das superfícies internas do recipiente. Toque suavemente para descartar o excesso de corante. Use copos claramente rotulados para vários corantes para manter as cores separadas.
- Reboque um barco de pesagem de 100-500 g em uma balança eletrônica de 0,0001 g; criar um formulário de dados (Tabela 3); e fita adesiva em conjunto com quatro folhas de papel de cópia de 215,9 mm x 355,6 mm para fazer uma superfície de trabalho de 431,8 mm x 711,2 mm.
| Contêiner de liberação | Peso dos mosquitos | Número da gaiola | Fêmeas em Lote | Número de Machos | Contêiner de liberação | Massa Total |
| ROSA I | 0.024 | D1 #1 | 25 | ROSA I | 2.03 | |
| ROSA I | 2.007 | D1 #1 | 7 | ROSA II | 1.99 | |
| ROSA II | 1.990 | D1 #1 | ROSA III | 2.03 | ||
| ROSA III | 0.026 | D1 #3 | 25 | |||
| ROSA III | 2.000 | D1 #3 | 18 |
Tabela 3: Tabela de dados da estação de pesagem.
- Marque lotes quantificados de machos adultos irradiados com pigmento fluorescente.
- Transfira mosquitos adultos (2,5-3,5 dias de idade) de cada gaiola de criação para frascos de aspirador. Remova as fontes nutricionais da gaiola de criação da etapa 5.2 e coloque toda a gaiola em uma grande câmara de CO2 por 5-7 min, batendo nas laterais do recipiente para desalojar os mosquitos que podem estar agarrados à gaiola de criação. Após o tempo de exposição, remova a gaiola de criação da câmara e aspirar todos os mosquitos adultos em uma série de frascos de aspiração de plástico.
NOTA: A administração do 99,5-100% CO2 é a partir de um tanque com um regulador, farpa de latão e tubos de silicone canalizados para a câmara a uma taxa de fluxo de 6 L / min. O número de frascos necessários para limpar a gaiola de criação depende de quantos mosquitos estão na gaiola e da proficiência do operador, mas 3-5 frascos são normalmente necessários por gaiola. Escolha um aspirador que tenha pequenos frascos de troca rápida para facilitar o manejo de mosquitos adultos em lotes, por exemplo, um usando um frasco coletor de poliestireno de 60 mL selado com tela de alumínio de malha 20 x 20 em uma extremidade e uma válvula de aba de acetato transparente na outra. Toda a gaiola é anestesiada antes da aspiração para reduzir o tempo de transferência de mosquitos para frascos para reduzir o estresse sobre os mosquitos e manter o protocolo tratável. - Separe todos os mosquitos adultos de cada gaiola de criação por sexo.
- Expor o primeiro frasco para injetáveis da etapa 6.3.1 ao CO 2 numa câmara pequena durante 4 minutos e, em seguida, agitar suavemente os mosquitos anestesiados, espalhando-os pela superfície de papel branco preparada na etapa 6.2.2.
- Carregar um novo frasco para injetáveis vazio no aspirador e aspirar cuidadosamente todos os machos da superfície de trabalho e passar este frasco para injetáveis para a estação de pesagem (passo 6.3.3.). Conte todas as fêmeas deixadas para trás e aspira-as em um frasco separado e descarte, juntamente com todos os machos esmagados.
- Repita este processo com os frascos para injetáveis restantes do ponto 6.3.1, mas em algum momento do processo de classificação por sexo, gere um frasco separado com apenas 25 machos que também é passado para a estação de pesagem. Repita a etapa 6.3.2. para cada gaiola de criação.
NOTA: Ao processar machos adultos irradiados para sexagem, pesagem e marcação, acompanhe o número de fêmeas em cada lote, que são dados-chave para solução de problemas e garantia de qualidade da classificação do sexo da pupa e de todo o processo. Se a contagem de fêmeas for maior do que o esperado, uma segunda pessoa deve extrair as fêmeas enquanto o operador principal aspira os machos. É importante pesar uma amostra de 25 machos de cada gaiola de criação para calcular um peso médio por mosquito, que será usado para estimar o número de machos irradiados marcados liberados ao final do protocolo.
- Pesar e tingir lotes de mosquitos machos adultos.
- Na estação de pesagem, colocar o primeiro frasco para injetáveis de mosquitos machos adultos da estação de sexagem (secção 6.3.2) numa pequena câmara de CO 2 durante 2 minutos e agitar cuidadosamente os mosquitos no barco de pesagem alcatroado preparado na etapa 6.2.2. Registar o peso dos mosquitos e despejá-los no copo de corante preparado em 6.2.1.
- Incline e gire lentamente o copo 1 rotação completa no sentido horário e anti-horário para que os mosquitos entrem em contato com o revestimento em pó nas superfícies internas do copo e sejam todos levemente polvilhados com corante (Figura 6B). Despeje os mosquitos marcados em um barco de pesagem.
- Prossiga rapidamente para o próximo passo para que os mosquitos não se recuperem e escapem. Repita este passo até que todos os frascos para injetáveis da secção 6.3.2 tenham sido processados.
NOTA: O peso dos machos do frasco separado de 25 machos gerado para cada gaiola de criação na secção 6.3.2 é registado e utilizado para calcular o peso médio por macho a partir dessa gaiola.
- Carregue os recipientes de liberação com machos adultos irradiados marcados. Dobrar ligeiramente o barco de pesagem que contenha mosquitos machos anestesiados, marcados, irradiados a partir do final do ponto 6.3.3. para criar um canal e, em seguida, direcionar esse canal através da manga da stockinette para transferir os machos para o recipiente de liberação. Continue a adicionar mosquitos até que aproximadamente 2,0 g ou 1500-3000 mosquitos machos estejam no recipiente de liberação e amarre a manga da stockinette fechada. Marque a fita de rotulagem no painel do recipiente de liberação com a cor do corante, o número do recipiente e o peso total dos mosquitos e copie esses dados para o formulário a partir da etapa 6.2.2.
NOTA: O manuseio de mosquitos em qualquer estágio da vida induz estresse e pode reduzir a sobrevivência ou o vigor. A série de anestesiações descritas neste protocolo pode impactar os mosquitos; no entanto, tentativas de perseguir e aspirar mosquitos não anestesiados a cada passo induziriam maior estresse e um protocolo insustentável. Dividir o peso total dos mosquitos em cada recipiente de libertação pelo peso médio por mosquito macho gerado na secção 6.3.3 para obter uma estimativa do número de machos nesse recipiente de libertação; cada recipiente de libertação não deve ter mais de 2 g de machos, o que equivale a aproximadamente 1 gaiola de criação grande.
- Transfira mosquitos adultos (2,5-3,5 dias de idade) de cada gaiola de criação para frascos de aspirador. Remova as fontes nutricionais da gaiola de criação da etapa 5.2 e coloque toda a gaiola em uma grande câmara de CO2 por 5-7 min, batendo nas laterais do recipiente para desalojar os mosquitos que podem estar agarrados à gaiola de criação. Após o tempo de exposição, remova a gaiola de criação da câmara e aspirar todos os mosquitos adultos em uma série de frascos de aspiração de plástico.
- Alterações ao protocolo de marcação para um único operador
- Realize a triagem sexual para todas as gaiolas grandes primeiro. Exponha cada gaiola grande a CO2 por 4-5 min e aspirar todos os mosquitos em 4-5 frascos. Exponha cada frasco para injetáveis a CO 2 durante2-3 min, afaste todos os mosquitos para a superfície de papel branco, remova as fêmeas e a contagem e devolva os machos à sua grande gaiola populacional.
- Pesagem e marcação
- Comece com a primeira gaiola de retenção masculina produzida na etapa 6.4.1: remova a fonte de nutrição e anestesiar os machos em uma grande câmara de CO2 por 5-7 min. Aspirar os machos anestesiados uniformemente em frascos para injetáveis separados. Repita esta etapa com cada gaiola de retenção na ordem em que foram produzidas.
NOTA: Aproximadamente 2-3 frascos para injetáveis lotados serão produzidos por gaiola de contenção. O processamento de gaiolas de retenção masculinas na ordem em que foram produzidas maximiza o tempo de recuperação para cada gaiola de machos. - Anestesiar o primeiro frasco para injetáveis produzido na etapa 6.4.2.1. por 1-2 min em uma pequena câmara de CO2 . Despeje um pequeno número de mosquitos na superfície da papelada branca, aspirar 25 mosquitos machos em um novo frasco para injetáveis e processe como em 6.3.2 para determinar o peso médio por macho para essa gaiola. Devolver quaisquer machos adicionais ao frasco para injetáveis de origem ou aspirar para um novo frasco para injetáveis separado para ser processado mais tarde; proceder à pesagem, marcação e transferir para os recipientes de libertação para o resto dos machos no primeiro frasco para injetáveis, conforme descrito no resto da etapa 6.3. Repita a etapa 6.4.2.2. (excepto para isolar 25 machos num frasco para injetáveis separado) para o resto dos frascos para injetáveis produzidos na etapa 6.4.2.1. pela ordem em que foram produzidos, passando depois para a próxima gaiola de criação classificada por sexo produzida no ponto 6.4.1.
NOTA: Os fluxos de trabalho com uma pessoa são mais lentos e alguns mosquitos machos precisarão ser anestesiados várias vezes. Procure e remova constantemente mosquitos fêmeas.
- Comece com a primeira gaiola de retenção masculina produzida na etapa 6.4.1: remova a fonte de nutrição e anestesiar os machos em uma grande câmara de CO2 por 5-7 min. Aspirar os machos anestesiados uniformemente em frascos para injetáveis separados. Repita esta etapa com cada gaiola de retenção na ordem em que foram produzidas.
7. Embalagem e expedição de contentores de Aedes aegypti machos marcados, irradiados e adultos
- Prepare os contêineres de liberação para envio. Uma vez que um recipiente de liberação é preenchido com machos marcados, coloque 4 bolas de algodão umedecidas com solução de sacarose a 10% na tampa da malha e cubra com um fundo invertido de uma placa de Petri mantida no lugar por dois elásticos esticados ao redor de todo o recipiente e sobre a placa de Petri para formar uma cruz. Coloque um pedaço de fita adesiva sobre o X dos dois elásticos para mantê-los no lugar em cima da placa de Petri invertida.
NOTA: Certifique-se de que as bolas de algodão com solução de sacarose a 10% não estejam saturadas a ponto de pingar, o que danificará o recipiente e prenderá e matará os mosquitos. - Embale os recipientes de liberação de cartolina em um refrigerador de transporte de espuma de poliestireno extrudido. Furos de ventilação Poke 4 através da tampa do refrigerador e oclua com algodão para manter as formigas fora e manter os mosquitos que escapam. Coloque 4 contêineres de liberação na vertical no refrigerador de remessa com a stockinette de cada contêiner voltada para o centro (Figura 6C). Coloque plástico bolha entre cada recipiente e no centro para estabilizá-los. Preencha o resto do espaço no refrigerador de transporte com travesseiros de ar ou empilhe uma segunda camada de 4 recipientes de liberação diretamente em cima da primeira camada e estabilize da mesma forma com travesseiros de ar.
NOTA: Os recipientes de libertação devem estar suficientemente estabilizados para não se moverem quando agitados. A temperatura dentro da embalagem é ambiente. - Prepare o refrigerador de envio para entrega. Sele o refrigerador de transporte com a tampa ventilada e coloque na embalagem de papelão, feche a fita adesiva e envie via expresso noturno para o local de liberação.
Resultados
A criação vigilante e adequada de mosquitos consiste na disponibilidade bem equilibrada de machos e fêmeas em gaiolas de colônia, manutenção de solução de sacarose fresca e mel e alimentação sanguínea consistente de alta qualidade. Essas condições fornecerão folhas de ovos densamente embaladas, ideais para uso em panelas de criação de larvas SIT. O armazenamento e o uso adequados de folhas de ovos secos, como a rotulagem sistemática para facilitar o uso do mais antigo para o mais novo, apoiarão a eclosão uniforme em todas as panelas. Encher todas as panelas de criação de larvas com água antes da eclosão pode diminuir o tempo durante o qual as folhas de ovos estão em recipientes de eclosão e promover o desenvolvimento saudável. A manutenção das larvas desde a eclosão até a pupação requer um envolvimento cuidadoso do pessoal da colônia, pois algumas panelas podem precisar de mais ou menos comida ou água adicional, dependendo dos estágios de desenvolvimento e das variáveis ambientais. Se houver problemas com o estágio de desenvolvimento até o dia programado de separação sexual da pupa, ajustes devem ser feitos mais cedo no processo, como eclodir mais cedo ou mais tarde, ajustar os alimentos ou alterar a temperatura da incubadora.
O processo de criação neste protocolo não torna todos os ovos eclodidos a tempo de se desenvolverem em pupas que possam ser irradiadas e usadas para fins de controle. Entre 20 e 50% dos mosquitos criados em colônias ainda serão larvas no momento em que as pupas precisarem ser separadas. No entanto, essas larvas não são desperdiçadas, mas deixadas amadurecer por 24 horas para renderizar pupas adicionais que podem ser combinadas com pupas fêmeas da separação do dia anterior e recicladas de volta para gaiolas de colônia. Nas gaiolas da colônia, as pupas poderão amadurecer em adultos, acasalar, alimentar o sangue e produzir ovos que sustentem o projeto SIT.
A separação de pupas, o derramamento de pupas em placas de Petri, a irradiação e a colocação em gaiolas de retenção de adultos após a irradiação devem acontecer em um dia; portanto, deve-se reservar tempo suficiente para processar todas as etapas confortavelmente. A montagem e a preparação dos recipientes de liberação devem ser feitas antes do processo de marcação. Quando as caixas de transporte são devolvidas do local de liberação, os contêineres de liberação devem ser inspecionados e preparados para seu próximo uso. Descartar bolas de algodão molhadas, arejar recipientes de liberação úmida, limpar placas de Petri, substituir malhas e remover faixas elásticas do recipiente, enquanto não estiver em uso, prolongará muito a vida útil dos recipientes de liberação.
Dada a realidade mundial da pandemia viral de COVID-19, este protocolo que é tipicamente uma operação de várias pessoas foi modificado para ser tratável por uma pessoa que trabalha sozinha em um laboratório para cada etapa. As etapas do processo que são mais prejudicadas por um cenário de uma pessoa são as etapas de sexagem, marcação, pesagem e manutenção da criação de colônias. Separar as pupas por sexo por uma pessoa deve ser suficiente se houver vários separadores operando simultaneamente em diferentes salas. Em uma situação de pandemia em que o distanciamento social ocorre no local de trabalho, equipar várias estações é necessário para concluir as etapas desde a sexagem até a embalagem. Dependendo da velocidade do operador, leva uma pessoa ~ 4 h para o sexo 15.000 mosquitos e, em seguida, outro 1-2 h para marcá-los, pesar e embalá-los. Um cenário de duas pessoas diminui o tempo durante o qual os mosquitos são anestesiados para marcação e reduz o tempo total de trabalho. No entanto, mesmo em um cenário de duas pessoas, alocar os 2,0 g completos de mosquitos por gaiola de liberação pode ser um desafio devido ao tempo de trabalho limitado enquanto os mosquitos são sedados. Embora o processo de limpeza e preparação de materiais de criação de larvas e adultos seja extremamente demorado e trabalhoso, ele pode ser particionado de modo que os operadores individuais possam trabalhar de forma independente e segura durante uma pandemia.
A liberação de machos adultos, marcados e irradiados do Aedes aegypti está fora do escopo deste protocolo, mas é apresentada aqui em resumo. O processo de liberação de mosquitos machos marcados, irradiados inicia-se pela determinação de uma distribuição uniforme de liberação dos recipientes de liberação com base nos pesos (e, portanto, no número inferido de machos estéreis), conforme relatado na Tabela 3. Depois que as remessas são entregues ao distrito de controle vetorial, as caixas são abertas e os contêineres de liberação avaliados para quaisquer problemas com mortalidade ou condição dos contêineres de liberação. Os mosquitos nos recipientes de liberação são então autorizados a se aclimatar à temperatura e umidade ambiente por 1-2 h antes do transporte para a área de tratamento. Os locais de soltura na área de tratamento são identificados após vigilância intensiva de focos de calor de populações silvestres de Aedes aegypti. O tempo, a frequência e a densidade das liberações são equilibrados pela bionomia da espécie, bem como pela meteorologia, apoio público e capacidades de criação em laboratório.
Uma vez que os recipientes de libertação específicos são combinados com locais de libertação específicos, o rótulo deve ser cruzado antes de o recipiente de libertação ser aberto, cortando a malha no topo, permitindo ao operador deformar a malha de modo a que uma parte dos machos possa escapar. Este método de liberação fracionada é repetido em cada ponto de liberação designado para o recipiente até que todos os machos que voam livremente tenham sido liberados. Esse processo é então repetido para cada contêiner de liberação em seu respectivo local de liberação atribuído até que todos os contêineres tenham sido processados. Opcionalmente, após a liberação dos mosquitos, quaisquer mosquitos mortos ou deficientes que não saíram livremente podem ser coletados em placas de Petri e rotulados para serem contados à mão ou pesados para corrigir o número estimado liberado. A vigilância contínua e generalizada dos estágios adulto, de ovos e imaturos do Aedes aegypti selvagem na área-alvo e, possivelmente, em locais de controle sem intervenção, é conduzida para avaliar a eficácia da operação do SIT.
Discussão
O início de um programa de controle com SIT que utiliza radiação requer o estabelecimento de uma cepa local de Aedes aegypti. Esta etapa é crítica e pode permitir que o SIT realmente se distinga de tecnologias de controle semelhantes. Ao desenvolver o projeto a partir de uma cepa local de mosquito, os machos gerados provavelmente terão comportamentos que lhes permitirão se adaptar às mudanças e pistas ambientais e localizar e acasalar com fêmeas selvagens nas proximidades. Além disso, a liberação de machos locais irradiados pode não gerar opinião pública negativa em comparação com, digamos, a liberação de uma cepa não local de mosquitos geneticamente modificados que poderia, por exemplo, introduzir novos alelos na população local de mosquitos.
Gastar recursos substanciais para criar grandes quantidades de mosquitos apenas para poder usar cerca de metade deles para fins de controle é uma limitação do programa SIT do Aedes aegypti . Refinamentos devem ser feitos no protocolo de criação para condensar a maturação das larvas em prazos mais definidos quando as pupas estiverem prontas. Isso permitiria que mais pupas fossem coletadas no momento ideal de separação. No entanto, pupas adicionais para processar aumenta o risco de mais fêmeas pupando quando as pupas são coletadas e, portanto, aumentando a probabilidade de as fêmeas acabarem em placas de Petri com machos e possivelmente serem liberadas. Embora a expectativa de vida, o comportamento de alimentação sanguínea e o comportamento de oviposição em pupas de Aedes aegypti irradiadas sejam reduzidos em adultos, não é uma boa estratégia liberar fêmeas incidentalmente ao lado de machos irradiados22. Portanto, deve continuar sendo uma prioridade minimizar o número de fêmeas inadvertidamente separadas, irradiadas, marcadas e liberadas com machos.
O sucesso de um programa SIT depende, em última análise, da competição bem-sucedida de parceiros por machos irradiados criados em colônias. A preservação da competitividade masculina depende da seleção exaustiva da dose derivada experimentalmente e da maximização da proporção estimada de machos estéreis: selvagens na população. A seleção da dose é determinada por vários fatores-chave que incluem longevidade, fertilidade, fecundidade e mortalidade por pupas. Observou-se que os mosquitos machos exibirão uma curva de fertilidade assintótica que se aproxima de zero à medida que a radiação aumenta (dados não publicados de KJL, RLA, SCB). Simultaneamente, a longevidade e os níveis de atividade do mosquito macho diminuem exponencialmente à medida que a dose de radiação aumenta (dados não publicados de KJL, RLA, SCB). Portanto, em vez de identificar uma dose que produza 99,9% de esterilidade em homens, é preferível concentrar-se em uma porcentagem de esterilidade mais baixa enquanto apoia a sobrevivência. Uma vez identificado um intervalo de dose que não diferencia a longevidade ou a mortalidade por pupas de machos irradiados da de machos não irradiados, avaliações adicionais sobre fertilidade devem ser realizadas para identificar uma dose que torne os machos esmagadoramente estéreis, mas competitivos.
Simultaneamente, é fundamental comparar o número de mosquitos machos na população com o de machos irradiados liberados. Isso pode ser feito coletando machos de vários locais dentro e ao redor da área de liberação alvo repetidamente do mesmo local e antes, durante e após o início do programa SIT. Um estudo de marcação, liberação e recaptura deve ser realizado para avaliar a proporção de mosquitos machos selvagens para mosquitos liberados. Um estudo de marcação, liberação e recaptura baseia-se na liberação de um número conhecido de mosquitos marcados de um ponto específico e sua posterior recaptura em pontos próximos ao redor do ponto de liberação inicial. Comparando-se o número de machos recapturados e machos silvestres a distâncias do ponto de soltura, é possível estimar a população selvagem geral de machos na área para que proporções competitivas de machos estéreis possam ser liberadas23. A maximização da proporção de machos estéreis:selvagens pode ser alcançada liberando machos mais estéreis e/ou reduzindo a população selvagem por meios clássicos de controle, como redução de fontes, controle imaturo ou tratamentos adulticidas.
Para avaliar a eficácia de liberações masculinas estéreis, as coleções adultas podem ser comparadas cronologicamente com uma área sem intervenção. À medida que machos estéreis são liberados e o número de machos e fêmeas coletados em uma área diminui em relação a uma área de não-intervenção comparável, pode-se hipotetizar que é devido aos machos estéreis liberados superarem com sucesso os machos férteis locais. Este efeito também pode ser observado em copos de armadilha de oviposição implantados nos locais de intervenção e não intervenção. Os ovos ainda podem ser produzidos no local de intervenção, mas se menos eclodem do que os do local de não intervenção, pode-se hipotetizar que eles não são fertilizados por causa do acasalamento de fêmeas com machos estéreis. Cada vez mais a oviposição de ovos não fertilizados pode, eventualmente, levar à redução da oviposição devido à não substituição de fêmeas no local de intervenção 8,24.
As direções futuras da tecnologia e dos programas SIT expandem-se naturalmente para espécies adicionais de mosquitos medicamente importantes. Por exemplo, esta tecnologia pode ser prontamente adaptada para controlar o Aedes albopictus, dada a bionomia muito semelhante do Aedes aegypti e do Aedes albopictus. Outras espécies de mosquitos vetores de doenças de interesse incluem Culex quinquefasciatus, Culex tarsalis e várias espécies de Anopheles. Melhorar a eficácia desta tecnologia depende do aumento da capacidade das pupas machos produzidas em um determinado momento, o que poderia ser alcançado através de manipulação genética ou seleção artificial, e melhorar a competitividade masculina, o que poderia ser alcançado aumentando a virilidade, fertilidade ou longevidade.
Em última análise, os programas SIT não são uma bala de prata para controlar os mosquitos. Em vez disso, eles são uma ferramenta em um conjunto de outras técnicas de controle, como programas IVM, que compensam as fraquezas entre as técnicas. Por exemplo, considerando que o controlo químico oferece um controlo rápido e barato, promove também o desenvolvimento de resistência e de mortalidade não visada; e enquanto o SIT é específico da espécie e não é susceptível de gerar resistência, os machos SIT devem ser produzidos e libertados perpetuamente para controlar as populações imigradas de fora do distrito de controlo do vector.
Divulgações
Todos os autores declararam não haver conflitos de interesse.
Agradecimentos
Agradecemos aos Drs. R.-D. Xue, C. Bibbs, W. Qualls e V. Aryaprema do Distrito de Controle de Mosquitos Anastasia, St. Augustine, Flórida, pela parceria no desenvolvimento do programa SIT e visão especializada sobre a liberação operacional efetiva de Aedes aegypti macho estéril. Esta pesquisa foi apoiada pelo USDA-ARS e pelo Departamento de Agricultura e Serviços ao Consumidor da Flórida (FDACS). A menção de nomes comerciais ou produtos comerciais nesta publicação é exclusivamente para fins de fornecer informações específicas e não implica recomendação ou endosso pelo USDA ou FDACS.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-1/8" wrench (1" (1 inch) = 2.54 cm) | Craftsman | CMMT44707 | |
| 1/2 pint cardstock cup (1/2 pint = 236.5 mL) | Science Supplies WLE corp | 1/2 pint | |
| 1/4" tubing - tygon | Hudson Extrusions | LLDPE1/8 X 1/4 BLK | to attach to CO2 gas regulator |
| 1/8" brass barb w/ MIP connection | B&K | BHB-85NLB | to attach to CO2 gas regulator |
| 1000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-1000 | |
| 3000 mL graduated plastic beakers with handle | Thermo Scientific | 1223-3000 | |
| Adult large cage | Bioquip | 1450D | |
| Aspirator vials | Bioquip | 2809V | |
| Bovine liver powder | MP Biomedicals | 290039601 | |
| Brewers yeast | MP Biomericals | 02903312-CF | |
| CO2 regulator | Randor | 64003038 | |
| CO2 tank (20# canister) | Praxair | CDBEVCARB20 | |
| Collection basin | Treasure Gurus | KI-ENAMELBOWL | for separator |
| Cotton balls - large | Fisher Scientific | 22-456-883 | |
| Deli cups w/lids - 470 mL | Pactiv DELItainer | PCTYSD2516 | |
| Deli cups w/lids - 1900 mL | Berry Global | T60764 | |
| DoseReader 4 | ND0.5 and ND1.0 QA Filter Set standards | ||
| Dosimetry film | Far West Technology, Inc. | ||
| Filter paper | Millipore | AP10045S0 | |
| Flashlight aspirator | Bioquip | 2809D | |
| Forceps - fine featherweight | Bioquip | 4748 or 4750 | featherweight |
| GAFchromic | radiochromic film | ||
| Gammator M | Radiation Machinery Corporation, Parsippany, NJ | Cesium-137 irradiator | |
| Hand held mechanical aspirator | Clarke Mosquito | 13500 | |
| Lambskin condoms | Trojan | Naturalamb | |
| Large CO2 chamber | Sterilite | Walmart # 568789514 | |
| Larval rearing pans | Blue Ridge Thermoforming | 01-FG-400-3N-ABS | Dimensions: 22.375 x 17.5 x 3 (inches) |
| Magnets - 20# pull | Master magnetics | MHHH20BX | |
| Marking dye | Dayglo | ECO-11 | Aurora Pink |
| Marking dye | Dayglo | ECO-17 | Saturn Yellow |
| Mesh | Falk | T301 | |
| Pasture pipettes | Thermo Scientific | 02-708-006 | |
| Petri dishes - large | VWR International | 25384-090 CS | |
| Petri dishes - small (60 mm x 15 mm) | Fisher Brand | FB0875713A | |
| Pupa separator | J.W. Hock | 1512 | |
| Red rubber hose | Welch | 331040-5 | |
| Release containers | Science Supplies WLE corp | 1 gallon | |
| Rubber bands - cross #19 | Alliance | ALL37196 | |
| Rubber bands - latitude #64 | Skillcraft | NSN0589974 | |
| Scale | Ohaus | H-4737 | |
| Seed germination paper - Heavy stock 76# | Anchor Paper | #76 | |
| Shipping coolers- 16 x 13 x 12.5" | MrBoxonline.com | Husky Foam Cooler kit | |
| Sieve #20 | Advantech | 20BS8F | |
| Sieve #30 | Advantech | 30BS8F | |
| Small cage - Bug Dorm | MegaView | Bug Dorm-1 | |
| Small CO2 chamber | Mainstays | Walmart # 562922221 | |
| Souffle cup lid | SOLO | 41165277456 | |
| Souffle cups - 4 oz (1 oz = 29.6 mL) | SOLO | 41165024104 | |
| Sponge | ocelo | MMM7274FD | |
| Squeeze bottle | Dynalon | 3UUP6 | |
| Stereoscope | Meiji Techno | EMZ-5 | |
| Stockinette | BSN Medical | 30-1006 | |
| Styrofoam | extruded polystyrene foam | ||
| Tropical fish flake food | Tetra | 4.52 pound | |
| Vaccum chamber - desiccator | BelArt | T9FB892757 | |
| Weigh boats | Globe Scientific | 3621 |
Referências
- Moyes, C. L., et al. Contemporary status of insecticide resistance in the major Aedes vectors of arboviruses infecting humans. PLoS Neglected Tropical Diseases. 11 (7), 0005625 (2017).
- Baldacchino, F., et al. Control methods against invasive Aedes mosquitoes in Europe: a review. Pest Management Science. 71 (11), 1471-1485 (2015).
- Burkett, D. A., Cope, S. E., Strickman, D. A., White, G. B. The Deployed Warfighter Protection (DWFP) Research Program: Developing new public health pesticides, application technologies, and repellent systems. Journal of Integrated Pest Management. 4 (2), 1-7 (2013).
- Harwood, J. F., et al. Controlling Aedes aegypti in cryptic environments with manually carried ultra-low volume and mist blower pesticide applications. Journal of the American Mosquito Control Association. 32 (3), 217-223 (2016).
- Morrison, A. C., Zielinski-Gutierrez, E., Scott, T. W., Rosenberg, R. Defining challenges and proposing solutions for control of the virus vector Aedes aegypti. PLoS Medicine. 5 (3), 68 (2008).
- Klassen, W., Curtis, C. F., InDyck, V. A., Hendrichs, J., Robinson, A. S. History of the sterile insect technique. Sterile insect technique: principles and practice in area-wide integrated pest management. , 3-36 (2005).
- Alphey, L., et al. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector Borne and Zoonotic Diseases. 10 (3), 295-311 (2010).
- Dame, D. A., Curtis, C. F., Benedict, M. Q., Robinson, A. S., Knols, B. G. Historical applications of induced sterilisation in field populations of mosquitoes. Malaria Journal. 8, (2009).
- Bond, J. G., et al. Optimization of irradiation dose to Aedes aegypti and Ae. albopictus in a sterile insect technique program. PloS One. 14 (2), 0212520 (2019).
- Bourtzis, K., Lees, R. S., Hendrichs, J., Vreysen, M. J. B. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations. Acta Tropica. 157, 115-130 (2016).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments: JoVE. , e3579 (2014).
- Carvalho, D. O., et al. Aedes aegypti lines for combined sterile insect technique and incompatible insect technique applications: the importance of host genomic background. Entomologia experimentalis et applicata. 168 (6-7), 560-572 (2020).
- Mamai, W., et al. Aedes aegypti larval development and pupal production in the FAO/IAEA mass-rearing rack and factors influencing sex sorting efficiency. Parasite. 27, 43 (2020).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- . Methods in Aedes Research Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods%20in%20Aedes%20Research%202016.pdf (2016)
- Focks, D. A. An improved separator for the developmental stages, sexes, and species of mosquitoes (Diptera: Culicidae). Journal of Medical Entomology. 17 (6), 567-568 (1980).
- International Atomic Energy Agency. . Manual of Dosimetry in Radiotherapy. Technical Reports Series No. 110. , (1970).
- Aldridge, R. L., et al. Gamma-irradiation reduces survivorship, feeding behavior, and oviposition of female Aedes aegypti. Journal of the American Mosquito Control Association. 36 (3), 152-160 (2020).
- Cianci, D., et al. Estimating mosquito population size from mark-release-recapture data. Journal of Medical Entomology. 50 (3), 533-542 (2013).
- Knipling, E. F. . The basic principles of insect population suppression and management. , (1979).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados