Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis y caracterización de nanopartículas de poli(beta aminoésteres) cargadas de ARNm con fines de vacunación
En este artículo
Resumen
Aquí, se presenta un protocolo simple para producir nanopartículas de ARNm basadas en polímeros de poli(beta aminoéster), fáciles de adaptar cambiando el ARNm encapsulado. También se describe el flujo de trabajo para sintetizar los polímeros, las nanopartículas y su caracterización esencial in vitro. También se agrega una prueba de concepto con respecto a la inmunización.
Resumen
La vacunación ha sido uno de los mayores éxitos de la sociedad moderna y es indispensable para controlar y prevenir enfermedades. Las vacunas tradicionales estaban compuestas por enteros o fracciones del agente infeccioso. Sin embargo, siguen existiendo desafíos y las nuevas tecnologías de vacunación son obligatorias. En este contexto, el uso de ARNm con fines de inmunización ha demostrado un mejor rendimiento, como lo demuestra la rápida aprobación de dos vacunas de ARNm que previenen la infección por SARS-CoV-2. Más allá del éxito en la prevención de infecciones virales, las vacunas de ARNm también se pueden utilizar para aplicaciones terapéuticas contra el cáncer.
Sin embargo, la inestabilidad del ARNm y su rápida eliminación del cuerpo debido a la presencia de nucleasas hace que su entrega desnuda no sea posible. En este contexto, las nanomedicamentos, y específicamente las nanopartículas poliméricas, son sistemas críticos de administración de ARNm. Por lo tanto, el objetivo de este artículo es describir el protocolo para la formulación y prueba de un candidato a vacuna de ARNm basado en las nanopartículas poliméricas patentadas. La síntesis y caracterización química de los polímeros poli(beta aminoésteres) utilizados, su complejación con ARNm para formar nanopartículas y su metodología de liofilización se discutirán aquí. Este es un paso crucial para disminuir los costos de almacenamiento y distribución. Por último, se indicarán las pruebas necesarias para demostrar su capacidad de transfectar in vitro y madurar células dendríticas modelo. Este protocolo beneficiará a la comunidad científica que trabaja en la vacunación debido a su alta versatilidad que permite a estas vacunas prevenir o curar una amplia variedad de enfermedades.
Introducción
Las enfermedades infecciosas han representado una grave amenaza para millones de seres humanos en todo el mundo y siguen siendo una de las principales causas de muerte en algunos países en desarrollo. La vacunación profiláctica ha sido una de las intervenciones más eficaces de la sociedad moderna para prevenir y controlar las enfermedadesinfecciosas1,2. Estos hitos críticos de la ciencia en relevancia del sigloXXhan sido señalados por la reciente pandemia mundial de Covid-19 causada por el virus SARS-CoV-23. Reconociendo la importancia de contar con vacunas eficientes para reducir la diseminación de la enfermedad, los esfuerzos cooperativos de todas las comunidades biomédicas han dado como resultado con éxito muchas vacunas profilácticas en el mercado en menos de un año4.
Tradicionalmente, las vacunas se componían de virus atenuados (vivos, de virulencia reducida) o inactivados (partículas de muerte). Sin embargo, para algunas enfermedades sin margen de errores de seguridad, las partículas virales no son posibles, y en su lugar se utilizan subunidades de proteínas. Sin embargo, las subunidades generalmente no permiten la combinación de más de un epítopo / antígeno, y se requieren adyuvantes para mejorar la potencia de vacunación5,6. Por lo tanto, la necesidad de nuevos tipos de vacunas es clara.
Como se demostró durante la pandemia actual, las nuevas vacunas candidatas basadas en ácidos nucleicos pueden ser ventajosas en términos de evitar largos procesos de desarrollo y proporcionar una alta versatilidad al tiempo que producen, al mismo tiempo, una inmunización vital para el paciente. Este es el caso de las vacunas de ARNm, que inicialmente fueron diseñadas como vacunas experimentales contra el cáncer. Gracias a su capacidad natural para producir respuestas de células T específicas de antígenos3,5,6,7. Al ser el ARNm la molécula que codifica la proteína antigénica, solo cambiando la misma, la vacuna puede adaptarse rápidamente para inmunizar otras variantes del mismo microorganismo, diferentes cepas, otros microorganismos infecciosos, o incluso convertirse en un tratamiento inmunoterapéutico contra el cáncer. Además, son ventajosos en términos de costos de producción a gran escala. Sin embargo, el ARNm tiene un obstáculo importante que dificulta su administración desnuda: su estabilidad e integridad se ven comprometidas en medios fisiológicos, llenos de nucleasas. Por esta razón, se requiere el uso de un portador nanométrico que lo proteja y vectorice el ARNm a las células presentadoras de antígenos2,8.
En este contexto, los poli(beta aminoésteres) (pBAE) son una clase de polímeros biocompatibles y biodegradables que demostraron una notable capacidad para complejar el ARNm en partículas nanométricas, gracias a sus cargas catiónicas9,10,11. Estos polímeros están compuestos por enlaces éster, lo que facilita su degradación por las esterasas en condiciones fisiológicas. Entre los candidatos a la biblioteca pBAE, los funcionalizados con oligopéptidos catiónicos finales mostraron una mayor capacidad para formar nanopartículas pequeñas para penetrar eficientemente en las células a través de la endocitosis y transfectar el material genético encapsulado. Además, gracias a su capacidad de amortiguación, la acidificación del compartimento endosómico permite el escape endosomal12,13. A saber, un tipo específico de pBAE, incluyendo partes hidrofóbicas en su columna vertebral (el llamado C6 pBAE) para mejorar su estabilidad y combinación de oligopéptidos finales (60% de polímero modificado con una tri-lisina y 40% del polímero con una tri-histidina) que transfecta selectivamente las células presentadoras de antígenos después de la administración parenteral y produce la presentación del antígeno codificado en ARNm seguido de la inmunización de ratones se ha publicado recientemente14 . Además, también se ha demostrado que estas formulaciones podrían sortear uno de los principales pasos de cuello de botella de las formulaciones de nanomedicina: la posibilidad de liofilizarlas sin perder su funcionalidad, lo que permite la estabilidad a largo plazo en ambientes secos suaves15.
En este contexto, el objetivo del protocolo actual es poner a disposición de la comunidad científica el procedimiento para la formación de las nanopartículas de ARNm, dando una descripción de los pasos críticos en el protocolo y permitiendo la producción de vacunas eficientes para la prevención de enfermedades infecciosas y aplicaciones de tratamiento tumoral.
El siguiente protocolo describe el entrenamiento completo para sintetizar polímeros poli(beta aminoésteres) modificados al final del oligopéptido - OM-pBAE que se utilizarán para la síntesis de nanopartículas. En el protocolo, también se incluye la formulación de nanopartículas. Además, también se proporcionan pasos críticos para el éxito del procedimiento y resultados representativos para garantizar que las formulaciones resultantes cumplan con las características de caracterización de control de calidad requeridas para definir un resultado positivo o negativo. Este protocolo se resume en la Figura 1.
Protocolo
1. Síntesis de polímero pBAE con oligopéptidos finales (OM-pBAE)
- Polimerización de C6-pBAE
- Añadir 5-amino-1-pentanol (38 mmol; MW = 103.16 Da) 1-hexilamina (38 mmol; MW = 101,19 Da) en un matraz de vidrio de fondo redondo (100 mL). Luego, agregue diacrilato de 1,4-butanediol (82 mmol; MW = 198,22 Da).
- Precaliente el baño de aceite de silicona a 90 °C, coloque el matraz de fondo redondo en el baño de aceite y revuelva la mezcla con la ayuda de una barra de agitación magnética durante la noche (~ 18 h). Luego, tome el producto del matraz de fondo redondo y colóquelo en el congelador a -20 ° C.
NOTA: El producto tiene la forma de un polvo pegajoso y se saca del matraz con la ayuda de una espátula. Es fundamental validar la estructura del polímero obtenido a través de 1H-RMN. Los espectros de RMN se registraron en un instrumento de 400 MHz (ver Tabla de Materiales)utilizando cloroformo-d y D2O como disolventes. Alrededor de 10 mg de cada poli(β-amino éster) se tomaron y disolvieron en 1 ml del disolvente deuterado.
- Reacción con péptidos para obtener OM-pBAE
- Agregue 25 ml de 0,1 M de HCl a los péptidos seleccionados, por ejemplo, el péptido Cys-His-His-His con ácido trifluoroacético (TFA, 200 mg), en un tubo de centrífuga de 50 ml previamente pesado que pueda soportar la liofilización y remover manualmente durante la noche para obtener una solución clara.
- Congelar la solución a -80 °C durante 1 h y liofilizar el clorhidrato peptídico resultante.
NOTA: Compruebe si el peso final corresponde al valor teórico. - Hacer una solución de C6-pBAE (0.031 mmol) en dimetilsulfóxido. Además, haga una solución del péptido clorhidrato (0.078 mmol) en dimetilsulfóxido.
- Mezcle las dos soluciones en un tubo de tapón de rosca y atornille la tapa. Revuelva la solución de mezcla en un baño de agua con una temperatura controlada de 25 °C durante 20 h con una barra de agitación magnética.
- Agregue la mezcla a 7:3 (v/v) dietil éter/acetona. Centrifugar la suspensión resultante a 25.000 x g a 4 °C para eliminar el disolvente. A continuación, lave el sólido con 7: 3 (v / v) dietil éter / acetona dos veces. Luego, seque el producto al vacío (<0.2 atm).
- Hacer una solución de 100 mg/ml del producto en dimetilsulfóxido. El producto resultante se denomina C6-péptido-pBAE. Es fundamental validar la estructura del polímero obtenido a través de 1H-RMN para confirmar la desaparición de las señales de olefina asociadas a los acrilatos terminales. Si no se utiliza, el polímero puede congelarse a -20 °C.
2. Formación de poliplexos
NOTA: Todos los procedimientos deben realizarse dentro de una habitación acondicionada para mantener una temperatura constante.
- Descongelar los polímeros C6-péptido-pBAE y vórtice la solución.
- Pipetear la mezcla de polímero hacia arriba y hacia abajo y preparar una solución de 12,5 mM (V1)en acetato de sodio (NaAc). Luego, vórtice la mezcla y espere 10 min.
- Preparar el ARNm a 0,5 mg/ml y mezclar mediante pipeteo (V2).
NOTA: Es crucial evitar el vórtice del ARNm. - Vórtice la mezcla de polímeros a la concentración final para lograr una solución homogénea entre el material de polímero en DMSO y el tampón de acetato.
NOTA: La concentración final de polímero depende de la relación N/P (grupos nitrógeno/fosfato) seleccionada. La relación N/P depende de cada ARNm específico que se vaya a utilizar. Para la encapsulación de eGFP, por ejemplo, se utilizó una relación de 25:1, como se informó anteriormente14. - Mezclar la solución de material genético y la solución de C6-peptidepBAE (25x de la concentración de ARNm) en una proporción de 1:1 (Vi = V1 + V2).
NOTA: C6-peptide-pBAE se carga en un tubo de microcentrífuga donde se agrega el ARNm mediante el pipeteo hacia arriba y hacia abajo para mezclar. Una vez preparado, las concentraciones de poliplex, ácido nucleico y C6-péptido-pBAE se diluyen a medias. - Incubar a 25 °C durante 30 min en un termobloqueo. Precipitar con agua libre de RNasa 1:2 añadiendo la muestra a un tubo de microcentrífuga precargado con agua.
- Incluya los excipientes. Añadir el mismo volumen que la mezcla de ARNm y pBAE (Vi)en HEPES 20 mM y sacarosa al 4% mediante pipeteo hacia arriba y hacia abajo. En este punto, la muestra se ha diluido 3x.
3. Poliplexos liofilización
- Congelar instantáneamente a -80 °C el congelador de la solución de polyplex anterior durante 1 h.
- Realizar el secado primario siguiendo los pasos: (1) 1 h a -60 °C y 0.001 hPa; (2) 1 h a -40 °C y 0.0001 hPa; (3) 4 h a -20 °C y 0.0001 hPa; (4) 12 h a 5 °C y 0,0001 hPa.
- Conservar inmediatamente a -20 °C para evitar la rehidratación hasta su uso.
4. Resuspensión polyplex
NOTA: Este protocolo describe el proceso utilizado para reconstruir las nanopartículas liofilizadas de péptido C6-pBAE para su uso posterior ya sea para la caracterización, el análisis in vitro o in vivo.
- Tome las nanopartículas liofilizadas de -20 ° C justo en el momento de su uso y agregue rápidamente la cantidad correspondiente de agua despirogenada (DEPC) para volver a analizar el sólido para lograr la concentración deseada.
NOTA: El volumen será el mismo que el volumen inicial de las nanopartículas si se prevé la misma concentración, pero se indicará para cada experimento. - Pipetear suavemente hasta la resuspensión total, acompañando el líquido con la pipeta.
NOTA: Asegúrese de que no quede material en la pared del vial. - Una vez disuelto, pipetear hacia arriba y hacia abajo vigorosamente, evitando burbujas.
NOTA: La muestra debe tener un aspecto transparente a translúcido, que es más evidente a concentraciones más altas. - Conservar las muestras en hielo o a 4 °C durante un periodo máximo de 24 h una vez reconstituidas. Evite la congelación.
5. Caracterización de Polyplex
- Dispersión dinámica de la luz
NOTA: El diámetro hidrodinámico (nm), el índice de polidispersidad (PDI) y la carga superficial de las nanopartículas se midieron a 25 ° C, longitud de onda láser de 633 nm y detector de señal de 173 °, utilizando un analizador de potencial Zeta (consulte la Tabla de materiales).- Diámetro hidrodinámico (nm)
- Prepare las nanopartículas mezclando ARNm y pBAE a fondo canalizando el material génico a la fracción polimérica a una concentración final de ARNm de 0,25 mg / ml como se describió anteriormente (paso 2).
- Enjuague previamente una microcubeta con medios de dilución filtrados para limpiarla completamente de impurezas. Luego, llene la cubeta con al menos 50 μL de la solución de muestra y cúbrala. A continuación, introduzca la muestra dentro del instrumento DLS, asegúrese de que la celda esté insertada correctamente.
NOTA: El medio de dilución se filtra utilizando un filtro de jeringa de 0,22 μm. - Abra el archivo de procedimiento de operación estándar (SOP) creado e introduzca el nombre de ejemplodeseado. Seleccione Medición de tamaño.
NOTA: Todos los parámetros para crear un POE para las mediciones de tamaño se proporcionan en la Tabla 1. - Ejecute la medición del tamaño de partícula utilizando DLS haciendo clic en Reproducir.
NOTA: Después de que suene el triple pitido, el análisis está completo. - Seleccione los resultados correspondientes a la muestra en la hoja de medición para obtener el tamaño de partícula promedio, la PDI promedio, la desviación estándar y los gráficos. Una vez hecho esto, retire la celda del equipo DLS.
- Retire la muestra, guárdela para el análisis de potencial zeta y limpie y enjuague la célula con agua desionizada. Finalmente, seque la cubeta limpia bajo una corriente de gas de aire comprimido.
- Carga superficial (mV)
- Prepare las nanopartículas mezclando ARNm y pBAE a fondo canalizando el material génico a la fracción polimérica a una concentración final de ARNm de 0,25 mg / ml como se describió anteriormente (paso 2, formación de Polyplex). A continuación, congele y seque la solución.
NOTA: En este caso, para la medición de la carga superficial, se recomienda encarecidamente la liofilización de la muestra antes de realizar las medidas para volver a analizar la muestra en el tampón apropiado, simulando las condiciones corporales de pH y concentración de electrolitos. - Resuspend la muestra liofilizada usando agua. Diluir la muestra 1/10 en agua (concentración final 0,025 mg/ml).
- Enjuague previamente una célula capilar plegada desechable (cubeta de potencial zeta) con medios de dilución filtrados para limpiarla completamente de impurezas. Luego, llene la cubeta con nanopartículas diluidas, usando una jeringa de 1 ml, y cubra ambos lados de los rellenos.
NOTA: La dispersión de nanopartículas tiene que llenar el volumen disponible en la cubeta (~1 mL), prestando especial atención a la formación de la burbuja, lo que podría perturbar las medidas. - Introduzca la muestra dentro de DLS; asegúrese de que la celda está insertada correctamente.
- Abra el archivo SOP creado para el análisis de potencial zeta e introduzca el nombre de ejemplodeseado. Seleccione Medición del potencial Zeta.
NOTA: Los parámetros para crear un POE para mediciones de potencial zeta se dan en la Tabla 2. - Ejecute la medición del potencial zeta utilizando DLS haciendo clic en Reproducir.
NOTA: Después del sonido del triple pitido, el análisis está completo. - Seleccione los resultados correspondientes a la muestra en la hoja de medición para obtener el potencial zeta promedio, la desviación estándar y los gráficos. Una vez hecho esto, retire la celda del equipo DLS.
- Retire la muestra y guárdela si es necesario. A continuación, limpie y enjuague la celda de la cubeta con agua desionizada, seguida de etanol y agua nuevamente. Finalmente, seque la cubeta limpia bajo una corriente de gas de aire comprimido.
NOTA: Para analizar los datos, utilice el software recomendado.
- Prepare las nanopartículas mezclando ARNm y pBAE a fondo canalizando el material génico a la fracción polimérica a una concentración final de ARNm de 0,25 mg / ml como se describió anteriormente (paso 2, formación de Polyplex). A continuación, congele y seque la solución.
- Diámetro hidrodinámico (nm)
- Análisis de seguimiento de nanopartículas (NTA)
NOTA: El diámetro hidrodinámico (nm) y la concentración de nanopartículas se midieron a una longitud de onda láser de 25 °C y 488 nm utilizando un analizador de seguimiento de nanopartículas (ver Tabla de Materiales).- NTA y preparación de muestras
- Encienda la computadora y el equipo. Primero, verifique si todos los componentes están conectados correctamente. A continuación, abra el software recomendado. El software comprobará si todos los accesorios están conectados correctamente.
- Conecte la placa superior, aquí, la celda de la junta tórica, en el módulo láser.
NOTA: No sobreenrosque esta parte. - Primero cargue la cámara con tampón y/o agua desionizada con una jeringa de 1 ml. Repita el procedimiento al menos dos veces. Evite introducir burbujas en la cámara.
- Prepare la muestra diluyendo 1/1000 en agua desionizada de la concentración utilizada en la medición del tamaño dlS. Preparar al menos 1 ml y cargarlo en una jeringa de 1 ml, evitando introducir burbujas.
- Cargue las muestras en la cámara con una jeringa. Luego, conecte el módulo láser a la cámara grande NTA.
NOTA: La cámara grande denota el espacio donde se coloca la cámara para la medición.
- Optimización de imágenes
- Primero, en el Hardware,verifique si la cámara y el láser adecuado están seleccionados.
NOTA: Aquí, solo hay una cámara y el Blue Laser 488 nm. - Comience con el nivel de cámara en 0 y pulse Iniciar cámara en la ventana Captura.
NOTA: En este punto, ajuste los siguientes parámetros. Posición del haz (se puede mover hacia arriba y hacia abajo en la pantalla). Nivel de cámara:evita los píxeles sobresaturados. Enfoque (rueda lateral):intenta enfocar lo mejor posible. Es mejor tener partículas con un halo en lugar de partículas desenfocadas. Concentración: Ajuste la concentración para que tenga entre 10 y 100 partículas por campo.
- Primero, en el Hardware,verifique si la cámara y el láser adecuado están seleccionados.
- Grabación de vídeo
- En el software, vaya a la ventana Selección de medición- SOP (abajo a la izquierda) y seleccione Medición estándar.
NOTA: Programa para realizar tres medidas de 30 s cada una (para permitir que el software realice cálculos de media y desviación estándar). Proporcione un nombre y una ruta de acceso de carpeta (en nombre de archivo base) para guardar los registros del ejemplo. Cuando los parámetros SOP estén configurados correctamente, presione Crear y ejecutar script. Una vez que se mide la primera réplica, el programa le pedirá que agregue una nueva muestra. Luego, se debe introducir otra fracción de la muestra en la cámara empujando el émbolo de la jeringa. Finalmente, repita una tercera vez para analizar la tercera réplica.
- En el software, vaya a la ventana Selección de medición- SOP (abajo a la izquierda) y seleccione Medición estándar.
- Procesamiento de vídeo
- Reajuste el umbral de ganancia y detección de pantalla una vez finalizadas las tres medidas para analizar las partículas medidas. En este momento, deben aparecer alrededor de 100 partículas en cada fotograma para realizar el análisis (se esperan cruces rojas altas y cruces azules bajas).
- Exporte los resultados en un archivo pdf una vez finalizado el análisis. Además, es posible exportar como videos y archivos de Excel.
- Limpieza de la NTA
NOTA: Cierre todas las mediciones abiertas antes de estudiar la siguiente muestra; ya que los archivos generados son enormes y dependiendo del ordenador, no es fácil mantener más de uno abierto.- Limpie la cámara NTA enjuagando repetidamente el agua antes de realizar la medición posterior hasta que no se observen partículas; posteriormente, enjuague el tampón utilizado (PBS) para continuar con las medidas.
- Enjuague el aire dentro de la cámara y séquelo con papel de grado microscópico una vez que se complete la última medición del día.
- Caracterizar el tamaño y la forma mediante Microscopía Electrónica de Transmisión (TEM). Preparar las muestras. 30 μL del volumen final es suficiente para la caracterización de TEM.
NOTA: Se pueden medir tanto las nanopartículas frescas como las liofilizadas, después de la resuspensión. - Deje caer 10 μL de muestra en una rejilla de cobre recubierta de carbono. Deja que se seque durante 10 min. Retire el exceso de líquido, si es necesario, golpeando suavemente el papel de filtro.
- Deje caer 10 μL de solución de acetato de uranilo (2% p/v) para la tinción negativa. Deja que se seque durante 1 min. Retire el exceso de líquido, si es necesario, golpeando suavemente el papel de filtro.
- Introducir la muestra en el microscopio y escanear (tensión de funcionamiento 80 kV).
NOTA: Se puede utilizar el software adecuado para un análisis más detallado de las imágenes.
- NTA y preparación de muestras
- Eficiencia de encapsulación
- Preparación de muestras
- Preparar las nanopartículas a la concentración deseada y congelarlas y secarlas. Luego, resuspend las nanopartículas y diluirlas a una concentración final de 6 μg/mL.
- Prepare 1x búfer TE a partir de la solución de stock 20x.
NOTA: Vt (Volumen total) = (número de muestras x 100 μL x 4) (número de muestras x 290 μL) + 2 mL. - Preparar tampón TE con 3 μg/μL de heparina a partir de la cepa de 100 μg/μL.
NOTA: Vt = Número de muestras x 50 μL x 2. - Preparar las normas
- Preparar un estándar de ARN que oscile entre 0,2 μg/mL y 0,025 μg/mL en 1x tampón Tris-EDTA (TE) (Tabla S1A).
NOTA: Use ARNm en el estándar de ARN en caso de que difiera del ARN ribosómico. - Preparar el estándar de ARN:pBAE con heparina (Tabla S1B). Preparar el estándar de heparina (Tabla S1C).
- Prepare una placa de 96 pocillos de la siguiente manera.
- Cargue 295 μL de tampón TE en el primer carril de una placa de 96 pocillos (tantos pozos como muestras para analizar). Luego, cargue 50 μL de 1x búfer TE en los carriles B y C (duplicados para cada muestra).
- Carga 50 μL de 1x tampón TBE con 3 μg/μL de heparina en los carriles D y E (duplicados para cada muestra). A continuación, cargue 100 μL de cada estándar en los carriles F, G y H (duplicados para cada estándar).
- Carga 5 μL de cada muestra en el carril A (la concentración en cada pozo es de 0,1 μg/mL). Mezclar adecuadamente mediante pipeteo y cargar 50 μL de cada muestra en los cuatro pocillos siguientes (dos de ellos conteniendo 50 μL de tampón 1x TE y dos más conteniendo 1x tampón TE con 3 μg/μL de heparina).
- Incubar la muestra durante 30 min a 37 °C. Prepare el reactivo RiboGreen según el protocolo del fabricante (consulte la Tabla de materiales)en 1x tampón TE.
NOTA: Diluir 1:200 y vórtice. Proteger de la luz. Vt = Número de pocillos llenos x 100 μL. - Cargue 100 μL de solución de RiboGreen en cada pozo. Detecte la fluorescencia utilizando el lector de microplacas con una longitud de onda de excitación de 500 nm y una longitud de onda de emisión de 525 nm.
- Análisis de resultados
- Preparar las tres curvas de calibración
NOTA: En primer lugar, el estándar de ARN ribosómico. Interpolar en esta curva de calibración las muestras que no contienen heparina. En segundo lugar, ARNm:pBAE con heparina. Interpolar en esta curva de calibración la muestra que tiene heparina. Tercero, la heparina. Se utiliza para asegurar que la concentración de trabajo está en el rango lineal. - Calcule la eficiencia de encapsulación (EE%) de la siguiente manera:
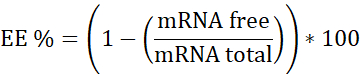
- Preparar las tres curvas de calibración
- Preparación de muestras
6. Caracterización in vitro
- Microscopía de fluorescencia para evaluación cualitativa
- Coloque la placa de 96 pocillos en el microscopio después de 24 horas de transfección. Comience a visualizar células con el objetivo 10x.
NOTA: Las células HeLa se utilizan en este caso. Las células se localizan utilizando el modo de transmisión (campo brillante), y el enfoque debe ajustarse en este momento.- Primero, aplique un balance de blancos para hacer referencia al software sobre el fondo de las muestras. Luego, adquiera una imagen para superponerla con la imagen de fluorescencia durante el análisis.
- Cambie el modo de microscopio al modo de reflexión (fluorescencia) y mueva la rueda del filtro al láser azul (488 nm) para visualizar eGFP.
NOTA: En este punto, el tiempo de exposición y la ganancia deben ajustarse. La ganancia debe ajustarse en valores entre 3 y 5 para evitar artefactos y excesos en la señal de fondo. El ajuste del tiempo de exposición depende de la eficiencia de transfección (de ms a 1 s). - Adquirir imágenes para todas las condiciones o pozos empleando el mismo tiempo de exposición para comparar todas las muestras.
- Coloque la placa de 96 pocillos en el microscopio después de 24 horas de transfección. Comience a visualizar células con el objetivo 10x.
- Citometría de flujo (FC) para evaluación cuantitativa
- Use una pipeta multicanal para preparar la placa de 96 pocillos para el experimento de citometría de flujo.
NOTA: Cuando trabaje con células semiadherentes, como en la línea celular JAWSII, recupere todo el volumen de medios y guárdelo en otra placa de 96 pocillos. No aspire a este medio ya que podría contener un número significativo de células transfectadas. - Limpie las células (las células HeLa se utilizan aquí) con 100 μL / pozo de 1x PBS y aspire. A continuación, añadir 25 μL/pocillo de tripsina e incubarlo a 37 °C durante 5 min.
- Una vez que las células se desprenden, agregue medios previamente recuperados para detener la acción de tripsina y fijar las células, agregando 31.25 μL / pozo de formalina al 10% durante 20 min (concentración final 2.5%).
NOTA: En este punto, es crucial visualizar el estado de las células por microscopía para asegurar el desprendimiento de las células. Es muy recomendable pipetear hacia arriba y hacia abajo varias veces para ayudar a las células a desprenderse y evitar su aglomeración. Esto producirá un resultado confiable. - Encienda el citómetro de flujo y el software. En el software, configure las condiciones adecuadas para el experimento (tipo de placa, volumen de la muestra y otros parámetros como agitación, enjuague entre muestras.
NOTA: Para el paso 6.2.5, el caudal debe ser de 120 μL/min. Mezcle un ciclo cada 1 minuto y enjuague un ciclo cada uno bien. La mezcla es esencial para mantener las células dispersas en el medio y permitir un mejor análisis de las células individuales. Además, es necesario enjuagar para limpiar la microfluídica del citómetro entre muestras. Finalmente, verifique si hay suficientes búferes y si todos los componentes están conectados correctamente. - Establezca los parámetros apropiados para cuantificar el porcentaje de células transfectadas positivamente.
- Primero, vea los datos de flujo en (Luz dispersa dispersa hacia adelante) FSC versus SCC (Luz dispersa lateral) gráfico de dispersión para distinguir las células de los escombros. Luego, otro diagrama de dispersión que compara la amplitud (FSC-A) versus la altura (FSC-H) se traza para bloquear y discriminar células individuales.
NOTA: La población no tratada permite cerrar las poblaciones correspondientes a células transfectadas positivamente. Luego, la cuantificación de las células transfectadas positivamente se realiza en el canal adecuado en una gráfica de histograma. Por lo tanto, las células transfectadas positivamente deben representarse como un continuo de eventos en el histograma.
- Primero, vea los datos de flujo en (Luz dispersa dispersa hacia adelante) FSC versus SCC (Luz dispersa lateral) gráfico de dispersión para distinguir las células de los escombros. Luego, otro diagrama de dispersión que compara la amplitud (FSC-A) versus la altura (FSC-H) se traza para bloquear y discriminar células individuales.
- Use una pipeta multicanal para preparar la placa de 96 pocillos para el experimento de citometría de flujo.
7. Pruebas de funcionalidad in vitro: capacidad para activar células inmunes modelo mediante el uso de ovoalbúmina (OVA) como modelo antigénico de ARNm
- Placa 10,000 células / pozo (las células JAWSII se usan aquí) en una placa de 96 pocillos el día antes de la transfección.
NOTA: Plate tantos pozos como sea necesario para tener triplicados para cada condición. Deje que las células se adhieran a la placa al menos durante 12 h (se recomienda una incubación durante la noche). - Prepare los NP de pBAE como se describe en la NOTA a continuación para transfectar 0.6 μg de ARNm por pozo.
NOTA: Como control positivo, transfecte las células utilizando un reactivo de transfección. Aquí, utilizamos 0,1 μg de ARNm por pozo y 0,25 μL del reactivo de transfección por pozo. Se compró la codificación de ARNm para OVA (ver Tabla de Materiales). Está poliadenilado, modificado con 5-metoxiuridina y optimizado para sistemas de mamíferos, y está protegido a través de un taponamiento final con estructura Cap1, un método patentado por el proveedor. - Incubar la placa de 96 pocillos durante 24 h en una incubadora de aire seco a 37 °C y 5% de CO2.
NOTA: Después de este tiempo, no aspire el medio ya que puede contener un cierto número de celdas. Recupera las células y guárdalas en otro pozo o placa. - Lave las células que quedan en el pozo con 25 μL de 1x PBS. A continuación, aspire y agregue 25 μL de tripsina e incube la placa durante 5 min a 37 ° C para separar las células. Detenga la reacción de tripsina agregando los medios previamente recuperados al pozo correspondiente.
- Centrifugar la placa a 400 x g durante 5 min a 4 °C. Aspiran los medios de comunicación. Añadir 50 μL/pomo de un PBS 1x y 2,5% de formalina. Incubarlo a 4 °C durante 20 min para fijar las células.
- Repita los pasos 7.5 y 7.5.1. Luego, agregue 50 μL / pocillo de 1x PBS y 3% BSA (tampón de bloqueo) e incube durante 30 min a 4 ° C. Una vez más, repita los pasos 7.5 y 7.5.1, y luego agregue 50 μL/pocillo del anticuerpo primario (α-OVA de ratón) en 1x PBS y 3% BSA e incube durante 30 min a 4 °C.
- Repita los pasos 7.5 y 7.5.1, y luego lave las células con 50 μL/pocillo de 1x PBS. Aspire a los medios y luego agregue la solución de anticuerpos secundarios (α-mouse-AlexaFluor488 / PerCP y Cy5.5-CD11b / APC-CD86) en 1x PBS y 3% BSA. Incubarlo durante 1 h a 4 °C.
- Centrifugar la placa a 400 x g durante 5 min. Luego, lave las células con 50 μL / pocillo de 1x PBS. A continuación, centrífuga (400 x g durante 5 min), aspire y luego resuspenda las células en 100 μL / pocillo de 1x PBS y 2.5% de formalina.
- Analícelo por citometría de flujo, como se describió anteriormente (paso 6.2).
Resultados
Síntesis y caracterización de polímeros
El procedimiento de síntesis OM-pBAE se da en la Figura 2. Como muestra la Figura 2A, el primer paso para obtener el OM-pBAE es sintetizar el C6-pBAE añadiendo las aminas (1-hexilamina y 5-amino-1-pentanol, relación 1:1) al diacrilato (diacrilato de 1,4-butanodiol). Esta reacción se lleva a cabo a 90 °C durante 20 h y con agitación constante. Posteriormente, se añade una solución de oligopép...
Discusión
Después del brote de la pandemia de Covid-19 el año pasado, la importancia de las vacunas en términos de control de enfermedades infecciosas se ha manifestado como un componente crítico8. Los esfuerzos de científicos de todo el mundo han permitido el lanzamiento al mercado de muchas vacunas. Por primera vez en la historia, las vacunas de ARNm han demostrado su éxito previamente hipotético, gracias a su rápido diseño debido a su capacidad para adaptarse a cualquier antígeno nuevo en unos<...
Divulgaciones
Los autores no tienen nada que revelar ni ningún conflicto de intereses.
Agradecimientos
Se agradece el apoyo financiero del MINECO/FEDER (subvenciones SAF2015-64927-C2-2-R, RTI2018-094734-B-C22 y COV20/01100). CGF reconoció su beca de doctorado IQS.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,4-butanediol diacrylate | Sigma Aldrich | 123048 | |
| 1-hexylamine | Sigma Aldrich | 219703 | |
| 5-amino-1-pentanol | Sigma Aldrich | 411744 | |
| Acetone | Panreac | 141007 | |
| CD11b antibody | BD | 550993 | |
| CD86 antibody | Bioligend | 105007 | |
| Chlor hydroxhyde | Panreac | 181023 | |
| Chloroform-d | Sigma Aldrich | 151823 | |
| Cys-His-His-His peptide | Ontores | Custom | |
| Cys-Lys-Lys-Lys peptide | Ontores | Custom | |
| D2O | Sigma Aldrich | 151882 | |
| DEPC reagent for Rnase free water | Sigma Aldrich | D5758 | This reagent is important to treat MilliQ water to remove any RNases of the buffers |
| Diethyl eter | Panreac | 212770 | |
| dimethyl sulfoxide | Sigma Aldrich | 276855 | |
| HEPES | Sigma Aldrich | H3375 | |
| mRNA EGFP | TriLink Technologies | L-7601 | |
| mRNA OVA | TriLink Technologies | L-7610 | |
| RiboGreen kit | ThermoFisher | R11490 | |
| sodium acetate | Sigma Aldrich | 71196 | |
| sucrose | Sigma Aldrich | S0389 | |
| Trifluoroacetic acid | Sigma Aldrich | 302031 | |
| Trypsin-EDTA | Fisher Scientific | 11570626 | |
| α-mouse AlexaFluor488 antibody | Abcam | Ab450105 | |
| Equipment | |||
| Nanoparticle Tracking Analyzer | Malvern Panalytical | NanoSight NS300 | |
| Nuclear Magnetic Ressonance Spectrometer | Varian | 400 MHz | |
| ZetaSizer | Malvern Panalytical | Nano ZS | For zeta potential and hydrodynamic size determination |
| Software | |||
| NanoSight NTA software | Malvern Panalytical | MAN0515-02-EN-00 | |
| NovoExpress Software | Agilent | Not specified | |
| ZetaSizer software | Malvern Panalytical | DTS Application | To analyze surface charge and hydrodynamic sizes |
Referencias
- Chumakov, K., Benn, C. S., Aaby, P., Kottilil, S., Gallo, R. Can existing live vaccines prevent COVID-19. Science. 368 (6496), 1187-1188 (2020).
- Zhang, C., Maruggi, G., Shan, H., Li, J. Advances in mRNA vaccines for infectious diseases. Frontiers in Immunology. 10, 1-13 (2019).
- Wherry, E. J., Jaffee, E. M., Warren, N., D'Souza, G., Ribas, A. How did we get a COVID-19 vaccine in less than 1 year. Clinical Cancer Research. 27 (8), 2136-2138 (2021).
- Folegatti, P. M., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396 (10249), 467-478 (2020).
- Geall, A. J., Mandl, C. W., Ulmer, J. B. RNA: The new revolution in nucleic acid vaccines. Seminars in Immunology. 25 (2), 152-159 (2013).
- Ulmer, J. B., Geall, A. J. Recent innovations in mRNA vaccines. Current Opinion in Immunology. 41, 18-22 (2016).
- Kranz, L. M., et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. 534 (7607), 396-401 (2016).
- Milane, L., Amiji, M. Clinical approval of nanotechnology-based SARS-CoV-2 mRNA vaccines: impact on translational nanomedicine. Drug Delivery and Translational Research. 1 (4), 3 (2020).
- Green, J. J., Langer, R., Anderson, D. G. A combinatorial polymer library approach yields insight into nonviral gene delivery. Accounts of Chemical Research. 41 (6), 749-759 (2008).
- Guerrero-Cázares, H., et al. Biodegradable polymeric nanoparticles show high efficacy and specificity at DNA delivery to human glioblastoma in vitro and in vivo. ACS Nano. 8 (5), 5141-5153 (2014).
- Kozielski, K. L., Tzeng, S. Y., Hurtado De Mendoza, B. A., Green, J. J. Bioreducible cationic polymer-based nanoparticles for efficient and environmentally triggered cytoplasmic siRNA delivery to primary human brain cancer cells. ACS Nano. 8 (4), 3232-3241 (2014).
- Segovia, N., Dosta, P., Cascante, A., Ramos, V., Borrós, S. Oligopeptide-terminated poly(β-amino ester)s for highly efficient gene delivery and intracellular localization. Acta Biomaterialia. 10 (5), 2147-2158 (2014).
- Dosta, P., Segovia, N., Cascante, A., Ramos, V., Borrós, S. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide- modified poly (beta-amino ester)s (PBAEs). Acta Biomaterialia. 20, 82-93 (2015).
- Fornaguera, C., et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Advanced Healthcare Materials. 7 (17), 180033 (2018).
- Fornaguera, C., Castells-Sala, C., Lázaro, M. &. #. 1. 9. 3. ;., Cascante, A., Borrós, S. Development of an optimized freeze-drying protocol for OM-PBAE nucleic acid polyplexes. International Journal Pharmaceutics. 569, (2019).
- Fornaguera, C., Solans, C. Analytical methods to characterize and purify polymeric nanoparticles. International Journal of Polymer Science. , (2018).
- Fornaguera, C., Solans, C. Characterization of polymeric nanoparticle dispersions for biomedical applications: size, surface charge and stability. Pharmaceutical Nanotechnology. 6 (3), 147-164 (2018).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Fan, Y. N., et al. Cationic lipid-assisted nanoparticles for delivery of mRNA cancer vaccine. Biomaterials Science. 6 (11), 3009-3018 (2018).
- Le Moignic, A., et al. Preclinical evaluation of mRNA trimannosylated lipopolyplexes as therapeutic cancer vaccines targeting dendritic cells. Journal of Controlled Release. 278, 110-121 (2018).
- Banerji, A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: Current evidence and approach. Journal of Allergy and Clinical Immunology: In Practice. 9 (4), 1423-1437 (2021).
- Kaczmarek, J. C., Kowalski, P. S., Anderson, D. G. Advances in the delivery of RNA therapeutics: from concept to clinical reality. Genome Medicine. 9 (1), 1-16 (2017).
- Dosta, P., et al. Delivery of anti-microRNA-712 to inflamed endothelial cells using poly(β-amino ester) nanoparticles conjugated with VCAM-1 targeting peptide. Advanced Healthcare Materials. , 1-11 (2021).
- Segovia, N., et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer. Advanced Healthcare Materials. 4 (2), 271-280 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados