Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Construcción de un modelo de xenoinjerto ortotópico de cáncer de pulmón de células no pequeñas que imita la progresión de la enfermedad y predice las actividades de los fármacos
En este artículo
Resumen
Este estudio presenta un modelo ortotópico de cáncer de pulmón de células no pequeñas (CPCNP) basado en la inoculación intrapulmonar de esferoides multicelulares de células fluorescentes A549-iRFP. El modelo recapitula los estadios clínicos del CPNM y responde al cisplatino, de acuerdo con la monitorización dinámica in vivo de la fluorescencia de longitud de onda larga.
Resumen
El cáncer de pulmón de células no pequeñas (CPCNP) es una enfermedad altamente letal con un microambiente tumoral complejo y heterogéneo. En la actualidad, los modelos animales comunes basados en la inoculación subcutánea de suspensiones de células cancerosas no recapitulan el microambiente tumoral en el CPCNP. En este trabajo describimos un modelo de xenoinjerto ortotópico murino de cáncer de pulmón que emplea la inoculación intrapulmonar de esferoides multicelulares tridimensionales (MCS). Específicamente, las células fluorescentes de NSCLC humano (A549-iRFP) se cultivaron en microplacas de 96 pocillos de baja adherencia con colágeno durante 3 semanas para formar MCS, que luego se inocularon intercostalmente en el pulmón izquierdo de ratones desnudos atímicos para establecer el modelo de cáncer de pulmón ortotópico.
En comparación con la línea celular A549 original, la MCS de la línea celular A549-iRFP respondió de manera similar a los medicamentos contra el cáncer. La señal fluorescente de longitud de onda larga de las células A549-iRFP se correlacionó fuertemente con marcadores comunes del crecimiento de células cancerosas, incluido el volumen de esferoides, la viabilidad celular y el nivel de proteínas celulares, lo que permitió el monitoreo dinámico del crecimiento del cáncer in vivo mediante imágenes fluorescentes. Después de la inoculación en ratones, el xenoinjerto A549-iRFP MCS progresó de manera confiable a través de fases muy parecidas a las etapas clínicas del NSCLC, incluida la expansión del tumor primario, la aparición de tumores secundarios vecinos y las metástasis de las células cancerosas en el pulmón derecho contralateral y órganos remotos. Además, el modelo respondió al fármaco de referencia contra el cáncer de pulmón, el cisplatino, con la toxicidad prevista y una progresión más lenta del cáncer. Por lo tanto, este modelo de xenoinjerto ortotópico murino de CPNM serviría como plataforma para recapitular la progresión de la enfermedad y facilitar el desarrollo de posibles fármacos contra el cáncer.
Introducción
Entre todos los trastornos oncológicos, el cáncer de pulmón no solo inflige la mayor pérdida de vidas, sino que también se cobra el segundo mayor número de nuevos pacientes cada año enlos EE. UU. Esta devastadora neoplasia maligna se erige como un obstáculo importante en la atención sanitaria moderna, lo que exige una comprensión más profunda de su intrincada biología y modalidades terapéuticas más eficaces2. El cáncer de pulmón de células no pequeñas (CPCNP) representa el 85% de los cánceres de pulmón y tiende a convertirse en tumores sólidos3. Uno de los principales desafíos en el cáncer de pulmón es el microambiente tumoral dinámico y heterogéneo, que influye profundamente en la progresión del cáncer y en las respuestas a las intervenciones terapéuticas 4,5,6. Una comprensión más profunda de la interacción entre las células cancerosas y su microambiente en las diferentes etapas del CPCNP requiere modelos patológicos refinados que recapitulen las características histológicas de la progresión del CPCNP.
En este sentido, los modelos animales ortotópicos emergen como una vía prometedora para la investigación del NSCLC. A diferencia de los modelos de xenoinjertos subcutáneos comúnmente empleados7, los modelos ortotópicos presentan células cancerosas que se inoculan directamente en el órgano de origen. En el caso del cáncer de pulmón, esto significa implantar células cancerosas directamente en el tejido pulmonar 8,9. En consecuencia, los modelos ortotópicos de cáncer de pulmón imitan mejor el microambiente tumoral nativo, incluidos los tejidos, vasos y componentes inmunitarios vecinos, mejorando así su relevancia fisiológica y clínica.
Los esferoides multicelulares tridimensionales (MCS, por sus siglas en inglés) representan otro enfoque prometedor para recapitular las características del entorno tumoral. La mayoría de los cánceres se caracterizan por su complejo microambiente tumoral, que incluye las diversas interacciones célula-célula, la matriz extracelular y los gradientes de oxígeno y nutrientes10,11. Los cultivos celulares 2D tradicionales carecen de la complejidad espacial y estructural necesaria para recapitular estas características específicas del tumor12. Por el contrario, las SQM de tamaño adecuado presentan una estructura heterogénea con un núcleo hipóxico y necrótico, que recapitula no solo el microambiente intratumoral, sino también la barrera fisiológica contra la penetración de fármacos, que es un mecanismo importante de resistencia a los fármacos en la terapia contra el cáncer 13,14,15.
Aprovechando tanto los modelos animales ortotópicos como las técnicas de cultivo de SQM, se ha inoculado SQM a ratones inmunocomprometidos para construir con éxito modelos ortotópicos de cáncer de mama y cáncer de próstata16,17. En este trabajo se presenta la metodología detallada para construir y caracterizar un modelo de xenoinjerto ortotópico murino de cáncer de pulmón. Este método emplea la inoculación intrapulmonar de MCS 3D derivado de células fluorescentes de cáncer de pulmón humano (A549-iRFP)18. Este modelo ofrece una oportunidad excepcional para observar la progresión in vivo del cáncer de pulmón a través de estadios que son muy paralelos a los cuatro estadios clínicos del CPCNP. Además, el cáncer de xenoinjerto de este modelo respondía al fármaco anticancerígeno clínicamente establecido, el cisplatino.
Protocolo
El estudio en animales se realizó con la aprobación del Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad del Pacífico (Protocolos Animales 19R10 y 22R10). Para el presente estudio se utilizaron ocho ratones machos desnudos atímicos de 5-6 semanas de edad, con un peso de 20-25 g, criados con la dieta de roedores de referencia y alojados en condiciones libres de patógenos (SPF). Las jaulas, la ropa de cama y el agua potable se esterilizaban en autoclave y se cambiaban regularmente. En la Figura 1 se muestra un esquema de la inoculación tumoral en ratones. Consulte la Tabla de Materiales para obtener detalles relacionados con todos los materiales e instrumentos utilizados en este protocolo.
1. Establecimiento de MCS tridimensional de celdas A549-iRFP
- Incubar células A549-iRFP (adenocarcinoma de pulmón humano) en una atmósfera humidificada con 5% de CO2 a 37 °C y cultivarlas en un medio de crecimiento completo DMEM que contenga 10% de suero fetal bovino, 1% de penicilina-estreptomicina y 1 μg/mL de puromicina.
- Siembre las células A549-iRFP en una microplaca esferoide de fondo redondo y fijación ultrabaja de 96 pocillos con una densidad de siembra de 4.000 células/pocillo, utilizando 100 μL de medio de crecimiento completo suplementado con colágeno al 0,3%.
- Centrifugar las microplacas a 300 × g durante 7 min a 4 °C para facilitar la formación de MCS. Examinar la morfología de la SQM bajo un microscopio para asegurar la agregación celular después de la centrifugación.
- Después de 48 h, agregue 100 μL de medio de crecimiento completo a cada pocillo para lograr un volumen total de 200 μL de medio de crecimiento por pocillo.
- Reemplace 100 μL de medio de crecimiento en cada pocillo con medio de crecimiento completo nuevo cada dos días.
2. Caracterización del MCS A549-iRFP
- Observe y obtenga imágenes de la morfología del MCS utilizando un microscopio y estime el volumen del MCS mediante simulación con el software de referencia de MATLAB basado en las imágenes del microscopio de contraste de fase.
- Abra una imagen MCS en el software ImageJ.
- Utilice las selecciones a mano alzada para seleccionar el borde del MCS y agregarlo al Administrador de ROI.
- Haga clic en Editar | Selección | Crear máscara.
- Haga clic en Editar | Invertir.
- Haga clic en Archivo | Guardar como | Tiff.
- Abra el software ReViSP.
- Abra la imagen TIFF guardada haciendo clic en Examinar.
- Haga clic en Iniciar para completar la simulación de MCS.
- Mida la señal fluorescente iRFP utilizando el sistema de imágenes infrarrojas en el canal de 700 nm y cuantifique la señal fluorescente utilizando software (por ejemplo, Image Studio).
- Abra el software Image Studio.
- En la pestaña Canales , seleccione 700 e Intensidad = 5.
- En la pestaña Controles de escaneo , seleccione 84 μm, Medio, 0,0 mm y Voltear imagen. Mantenga todo lo demás como predeterminado.
- Haga clic en Iniciar para iniciar el escaneo.
- Evalúe y cuantifique la viabilidad celular utilizando el ensayo de viabilidad celular 3D de acuerdo con el protocolo del proveedor.
- Evalúe y cuantifique la proteína celular utilizando el ensayo BCA de acuerdo con el protocolo del proveedor.
3. Selección de SQM para la inoculación tumoral
NOTA: Después de sembrar los SQM en microplacas esferoides y cultivarlos durante 2-3 semanas con un intercambio regular del medio de crecimiento, seleccione los SQM con las siguientes características apropiadas para la inoculación del tumor.
- Observe la morfología del MCS bajo un microscopio y elija el MCS con una forma redonda con bordes lisos en general, pero con 5-10 yemas rugosas (flechas en la Figura 2F) y un diámetro dentro del rango de 700-800 μm.
- Mida la fluorescencia iRFP (consulte el paso 2.2) y seleccione el MCS cuyas señales fluorescentes estén dentro de una desviación estándar del promedio.
4. Inoculación intrapulmonar de SQM
NOTA: Utilice alcohol isopropílico en aerosol al 70% para limpiar la estación quirúrgica y las herramientas antes de manipular los animales.
- Anestesiar a cada ratón con una inyección IP de 80 mg/kg de ketamina y 12 mg/kg de xilacina; Pellizque las patas del ratón con pinzas para asegurar una anestesia completa.
- Inyecte 10 μL de clorhidrato de buprenorfina (0,3 mg/mL) por vía subcutánea para reducir el dolor.
- Aplique ungüento oftálmico en los ojos para prevenir la sequedad.
- Coloque al ratón en una postura dorsal y asegure las extremidades en una posición de estiramiento con cintas.
- Esterilice la piel de la espalda con hisopos de yodo y alcohol.
- Realice una incisión de 0,5-1 cm con unas tijeras quirúrgicas en el lado posterior izquierdo (Figura 1B). Use fórceps con cuidado para separar el músculo y los tejidos grasos hasta que la pared torácica y el movimiento pulmonar sean visibles.
- Transfiera un MCS seleccionado de una microplaca a una placa de Petri de vidrio que contenga PBS helado, usando una pipeta.
- Coloque una aguja de 20 G en una jeringa de vidrio de 100 μL, preenfríela en hielo y extraiga 20 μL de una mezcla preenfriada de PBS y Matrigel (1:1 v/v).
- Utilice la jeringa para aspirar rápidamente un MCS de la placa de Petri en un volumen mínimo de la mezcla de PBS-Matrigel, manteniendo el MCS en la parte metálica de la aguja.
NOTA: Mantenga un agarre firme de la jeringa y el émbolo para evitar que el MCS se salga de la aguja. - Inserte suavemente la aguja verticalmente entre dos costillas a ~ 3 mm de profundidad e inyecte lentamente todos los 20 μL de PBS y la mezcla de Matrigel que contiene el MCS.
NOTA: Evite la fuerza excesiva durante la inserción para evitar daños en el pulmón, la vasculatura o el corazón. - Retire con cuidado la aguja y aplique una pomada antibiótica triple en la herida.
- Selle la incisión con clips quirúrgicos, que se retirarán después de 2 semanas.
NOTA: No sutura la incisión porque las líneas de sutura pueden interferir con las imágenes de fluorescencia. Los ratones desnudos son capaces de sanar de forma natural después de la cirugía. - Coloque al animal sobre una almohadilla térmica infrarroja y cúbralo con toallitas de laboratorio para mantener la temperatura corporal. Vigile al animal durante al menos 30-60 minutos hasta que se despierte y se mueva correctamente.
- Inyecte 10 μL de clorhidrato de buprenorfina (0,3 mg/mL) por vía subcutánea 3 veces al día durante las primeras 48 h para reducir el dolor.
5. Seguimiento postquirúrgico
- Mide el peso corporal cada 3-4 días.
- Mida la señal fluorescente iRFP del xenoinjerto tumoral cada 3-4 días en un sistema de imágenes de animales pequeños a un canal de 700 nm en cuatro posturas: izquierda, derecha, dorsal y ventral, mientras los ratones se mantienen bajo anestesia por inhalación de isoflurano (caudal: 1,5-2 L/min de oxígeno que contiene 1,5% de isoflurano) durante 2-3 min.
- Cuantificar la intensidad fluorescente neta del cáncer de xenoinjerto in vivo utilizando software (por ejemplo, Image Studio).
- Utilice un rectángulo fijo (A1, 200 x 125 píxeles) como ventana de muestreo para el área del pecho de los ratones.
- Utilice la función de mano libre para trazar la forma de los ratones dentro del rectángulo (A1) y medir la intensidad fluorescente (F1) en el área A1.
- Utilice otro rectángulo más pequeño (A2, 25 x 40 píxeles) para medir la fluorescencia de fondo (F2) de los ratones en la zona del muslo.
- Utilice la ecuación (1) para calcular la intensidad fluorescente neta del cáncer de xenoinjerto en cada ratón:
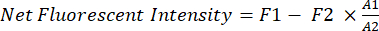 (1)
(1)
Resultados
Caracterización del MCS A549-iRFP
Los MCS A549-iRFP se cultivaron con éxito en microplacas esferoides con la ayuda de colágeno y centrifugación. Cuando la SQM alcanzó un diámetro de aproximadamente 500 μm después de 1 semana, tanto la SQM A549 como la A549-iRFP se expusieron a una variedad de medicamentos y formulaciones contra el cáncer durante 3 días y luego se mantuvieron en un medio de crecimiento sin drogas durante 4 días adicionales. El MCS A549-iRFP exhibió un patrón de respuesta m...
Discusión
La construcción de A549-iRFP MCS es un procedimiento de laboratorio sencillo y altamente reproducible y se puede traducir a la formación de MCS para múltiples líneas celulares. El SQM generado con la ayuda de la centrifugación y el colágeno exhibe una estructura más integral y similar a la de un tumor sólido en 3-4 días. Este método asegura la formación de esferoides robustos que mantienen su estructura integral durante períodos prolongados, generalmente de 2 a 3 semanas o incluso más hasta que comienzan a s...
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo contó con el apoyo de las subvenciones SAAG y SEED de la Universidad del Pacífico. Agradecemos al Dr. William Chan por otorgar acceso al sistema Odyssey Infrared Imaging 205 y al Dr. John Livesey por otorgar acceso al lector de placas SpectraMax iD3. Agradecemos a la Dra. Melanie Felmlee por el asesoramiento técnico sobre los protocolos con animales.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 µL Glass Syringe | Hamilton | Part/REF #80601 | |
| 20 G Needle | Thermo Fisher Scientific Inc. | 14 826D | |
| 96-well Ultra-Low-Attachment Spheroid Microplate | Corning | 15-100-173 | |
| A549-iRFP | Imanis Life Sciences | CL082-STAN | |
| AIN-93M Mature Rodent Diet | Research Diets, Inc. | D10012M | |
| Athymic Nude Mouse | Charles River Laboratories, Inc. | Strain Code: 490; homozygous | |
| BCA | Pierce | 23227 | |
| Buprenorphine Hydrochloride | Patterson Veterinary | NDC Number: 42023-179-05 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9683 | |
| Collagen | Gibco | A1064401 | |
| DMEM | Corning | MT10013CV | |
| Fetal Bovine Serum (FBS) | Cytiva HyClone | SH3039603 | |
| ImageJ | Open source tool (https://imagej.net/ij/) | N/A | |
| Image Studio | LI-COR | Version 5.2 | |
| Isoflurane | Patterson Veterinary | NDC Number: 17033-0091-25 | |
| Ketamine | Patterson Veterinary | NDC Number: 50989-0161-06 | |
| Microscope | Keyence | Model number: BZ-X710 | |
| Matrigel | Corning | CB-40234 | |
| Odyssey Infrared Imaging 205 System | LI-COR | Model number: 9140 | |
| PBS | Corning | MT21040CV | |
| Pearl Trilogy small animal imaging system | LI-COR | Model number: 9430 | |
| Penicillin-Streptomycin | Corning | MT30002CI | |
| Puromycin | Thermo Fisher Scientific Inc. | AAJ67236XF | |
| ReViSP software from MATLAB | Open source tool on Sourceforge (https://sourceforge.net/projects/revisp/) | N/A | |
| Surgical Clips--AutoClip System | Fine Science Tools | 12020-00 | |
| Xylazine | Patterson Veterinary | NDC Number: 61133-6017-01 |
Referencias
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA Cancer J Clin. 70 (1), 7-30 (2020).
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Travis, W. D., Brambilla, E., Riely, G. J. New pathologic classification of lung cancer: Relevance for clinical practice and clinical trials. J Clin Oncol. 31 (8), 992-1001 (2013).
- Ducote, T. J., et al. Using artificial intelligence to identify tumor microenvironment heterogeneity in non-small cell lung cancers. Lab Invest. 103 (8), 100176 (2023).
- Lim, Z. F., Ma, P. C. Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy. J Hematol Oncol. 12 (1), 134 (2019).
- Wang, D. C., Wang, W., Zhu, B., Wang, X. Lung cancer heterogeneity and new strategies for drug therapy. Annu Rev Pharmacol Toxicol. 58, 531-546 (2018).
- Peterson, J. K., Houghton, P. J. Integrating pharmacology and in vivo cancer models in preclinical and clinical drug development. Eur J Cancer. 40 (6), 837-844 (2004).
- Madero-Visbal, R. A., et al. Bioluminescence imaging correlates with tumor progression in an orthotopic mouse model of lung cancer. Surg Oncol. 21 (1), 23-29 (2012).
- Mclemore, T. L., et al. Novel intrapulmonary model for orthotopic propagation of human lung cancers in athymic nude mice. Cancer Res. 47 (19), 5132-5140 (1987).
- Zanoni, M., et al. 3d tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Semin Cancer Biol. 15 (5), 365-377 (2005).
- Chaicharoenaudomrung, N., Kunhorm, P., Noisa, P. Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. World J Stem Cells. 11 (12), 1065-1083 (2019).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. J Control Release. 164 (2), 192-204 (2012).
- Huang, B. W., Gao, J. Q. Application of 3d cultured multicellular spheroid tumor models in tumor-targeted drug delivery system research. J Control Release. 270, 246-259 (2018).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. J Biotechnol. 148 (1), 3-15 (2010).
- Sethi, P., et al. 3d tumor tissue analogs and their orthotopic implants for understanding tumor-targeting of microenvironment-responsive nanosized chemotherapy and radiation. Nanomedicine. 11 (8), 2013-2023 (2015).
- Valta, M. P., et al. Spheroid culture of lucap 136 patient-derived xenograft enables versatile preclinical models of prostate cancer. Clin Exp Metastasis. 33 (4), 325-337 (2016).
- Huang, Y., et al. Intrapulmonary inoculation of multicellular spheroids to construct an orthotopic lung cancer xenograft model that mimics four clinical stages of non-small cell lung cancer. J Pharmacol Toxicol Methods. , 106885 (2020).
- Lemjabbar-Alaoui, H., Hassan, O. U., Yang, Y. W., Buchanan, P. Lung cancer: Biology and treatment options. Biochim Biophys Acta. 1856 (2), 189-210 (2015).
- Detterbeck, F. C., Boffa, D. J., Kim, A. W., Tanoue, L. T. The eighth edition lung cancer stage classification. Chest. 151 (1), 193-203 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados