É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Construção de um modelo ortotópico de xenoenxerto de câncer de pulmão de células não pequenas imitando a progressão da doença e prevendo atividades medicamentosas
Neste Artigo
Resumo
Este estudo apresenta um modelo ortotópico de câncer de pulmão de células não pequenas (CPCNP) baseado na inoculação intrapulmonar de esferoides multicelulares de células fluorescentes A549-iRFP. O modelo recapitula os estágios clínicos do NSCLC e responde à cisplatina, de acordo com o monitoramento dinâmico in vivo da fluorescência de comprimento de onda longo.
Resumo
O câncer de pulmão de células não pequenas (CPCNP) é uma doença altamente letal com um microambiente tumoral complexo e heterogêneo. Atualmente, modelos animais comuns baseados na inoculação subcutânea de suspensões de células cancerígenas não recapitulam o microambiente tumoral no NSCLC. Descrevemos aqui um modelo de xenoenxerto de câncer de pulmão ortotópico murino que emprega a inoculação intrapulmonar de esferoides multicelulares tridimensionais (MCS). Especificamente, células fluorescentes de NSCLC humano (A549-iRFP) foram cultivadas em microplacas de 96 poços de baixa fixação com colágeno por 3 semanas para formar MCS, que foram então inoculadas intercostalmente no pulmão esquerdo de camundongos nus atímicos para estabelecer o modelo ortotópico de câncer de pulmão.
Em comparação com a linha celular A549 original, o MCS da linha celular A549-iRFP respondeu de forma semelhante aos medicamentos anticâncer. O sinal fluorescente de comprimento de onda longo das células A549-iRFP correlacionou-se fortemente com marcadores comuns de crescimento de células cancerígenas, incluindo volume esferóide, viabilidade celular e nível de proteína celular, permitindo assim o monitoramento dinâmico do crescimento do câncer in vivo por imagens fluorescentes. Após a inoculação em camundongos, o xenoenxerto A549-iRFP MCS progrediu de forma confiável através de fases muito semelhantes aos estágios clínicos do NSCLC, incluindo a expansão do tumor primário, o surgimento de tumores secundários vizinhos e as metástases de células cancerígenas para o pulmão direito contralateral e órgãos remotos. Além disso, o modelo respondeu ao medicamento anticâncer de pulmão de referência, a cisplatina, com a toxicidade antecipada e a progressão mais lenta do câncer. Portanto, este modelo de xenoenxerto ortotópico murino de NSCLC serviria como uma plataforma para recapitular a progressão da doença e facilitar o desenvolvimento de potenciais drogas anticancerígenas.
Introdução
Entre todos os distúrbios oncológicos, o câncer de pulmão não apenas inflige a maior perda de vidas, mas também reivindica o segundo maior número de novos pacientes a cada ano nos EUA1. Essa malignidade devastadora é um grande obstáculo na saúde moderna, exigindo uma compreensão mais profunda de sua intrincada biologia e modalidades terapêuticas mais eficazes2. O câncer de pulmão de células não pequenas (CPCNP) é responsável por 85% dos cânceres de pulmão e tende a evoluir para tumores sólidos3. Um dos principais desafios do câncer de pulmão é o microambiente tumoral dinâmico e heterogêneo, que influencia profundamente a progressão do câncer e as respostas às intervenções terapêuticas 4,5,6. Uma compreensão mais profunda da interação entre as células cancerígenas e seu microambiente em diferentes estágios do NSCLC exige modelos patológicos refinados que recapitulam as características histológicas da progressão do NSCLC.
Nesse sentido, os modelos animais ortotópicos surgem como um caminho promissor para a pesquisa de NSCLC. Ao contrário dos modelos de xenoenxerto subcutâneo comumente empregados7, os modelos ortotópicos apresentam células cancerígenas que são inoculadas diretamente no órgão de origem. Para o câncer de pulmão, isso significa implantar células cancerígenas diretamente no tecido pulmonar 8,9. Consequentemente, os modelos ortotópicos de câncer de pulmão imitam melhor o microambiente tumoral nativo, incluindo os tecidos, vasos e componentes imunológicos vizinhos, melhorando assim sua relevância fisiológica e clínica.
Os esferoides multicelulares tridimensionais (MCS) representam outra abordagem promissora para recapitular características do ambiente tumoral. A maioria dos cânceres é caracterizada por seu complexo microambiente tumoral, incluindo as várias interações célula-célula, a matriz extracelular e os gradientes de oxigênio e nutrientes10,11. As culturas de células 2D tradicionais carecem da complexidade espacial e estrutural para recapitular essas características específicas do tumor12. Em contraste, os MCS de tamanho adequado apresentam uma estrutura heterogênea com um núcleo hipóxico e necrótico, que recapitula não apenas o microambiente intratumoral, mas também a barreira fisiológica contra a penetração de drogas, que é um importante mecanismo de resistência a drogas na terapia antineoplásica 13,14,15.
Aproveitando os modelos animais ortotópicos e as técnicas de cultura MCS, os MCS foram inoculados em camundongos imunocomprometidos para construir com sucesso modelos ortotópicos de câncer de mama e câncer de próstata16,17. Aqui, relatamos a metodologia detalhada para construir e caracterizar um modelo de xenoenxerto ortotópico murino de câncer de pulmão. Este método emprega a inoculação intrapulmonar de MCS 3D derivado de células fluorescentes de câncer de pulmão humano (A549-iRFP)18. Este modelo oferece uma oportunidade excepcional para observar a progressão in vivo do câncer de pulmão através de estágios que se assemelham aos quatro estágios clínicos do NSCLC. Além disso, o câncer de xenoenxerto deste modelo respondeu ao medicamento anticâncer de pulmão clinicamente estabelecido, a cisplatina.
Protocolo
O estudo em animais foi realizado com a aprovação do Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade do Pacífico (Protocolos Animais 19R10 e 22R10). Oito camundongos machos atímicos nus com idade entre 5 e 6 semanas, pesando 20 a 25 g, criados com a dieta de roedores referenciada e alojados em condições livres de patógenos (FPS), foram usados para o presente estudo. Gaiolas, roupas de cama e água potável foram autoclavadas e trocadas regularmente. Um esquema de inoculação de tumor em camundongos é mostrado na Figura 1. Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais e instrumentos usados neste protocolo.
1. Estabelecimento de MCS tridimensional de células A549-iRFP
- Incube células A549-iRFP (adenocarcinoma de pulmão humano) em uma atmosfera umidificada com 5% de CO2 a 37 ° C e cultive-as em meio de crescimento completo DMEM contendo 10% de soro fetal bovino, 1% de penicilina-estreptomicina e 1 μg / mL de puromicina.
- Semeie células A549-iRFP em microplaca esferóide de fundo redondo de fixação ultrabaixa de 96 poços a uma densidade de semeadura de 4.000 células/poço, usando 100 μL de meio de crescimento completo suplementado com 0,3% de colágeno.
- Centrifugue as microplacas a 300 × g por 7 min a 4 °C para facilitar a formação do MCS. Examine a morfologia do MCS ao microscópio para garantir a agregação celular após a centrifugação.
- Após 48 h, adicione 100 μL de meio de crescimento completo a cada poço para obter um volume total de 200 μL de meio de crescimento por poço.
- Substitua 100 μL de meio de crescimento em cada poço por meio de crescimento completo fresco em dias alternados.
2. Caracterização do A549-iRFP MCS
- Observe e visualize a morfologia do MCS usando um microscópio e estime o volume do MCS por simulação com o software referenciado do MATLAB com base nas imagens do microscópio de contraste de fase.
- Abra uma imagem MCS no software ImageJ.
- Use as seleções à mão livre para selecionar a borda do MCS e adicioná-la ao ROI Manager.
- Clique em Editar | Seleção | Criar máscara.
- Clique em Editar | Inverter.
- Clique em Arquivo | Salvar como | Tiff.
- Abra o software ReViSP.
- Abra a imagem TIFF salva clicando em Procurar.
- Clique em Iniciar para concluir a simulação do MCS.
- Meça o sinal fluorescente iRFP usando o sistema de imagem infravermelha no canal de 700 nm e quantifique o sinal fluorescente usando um software (por exemplo, Image Studio).
- Abra o software Image Studio.
- Na guia Canais , selecione 700 e Intensidade = 5.
- Na guia Controles de digitalização , selecione 84 μm, Médio, 0,0 mm e Inverter imagem. Mantenha todo o resto como padrão.
- Clique em Iniciar para iniciar a digitalização.
- Avalie e quantifique a viabilidade celular usando o ensaio de viabilidade celular 3D de acordo com o protocolo do fornecedor.
- Avalie e quantifique a proteína celular usando o ensaio BCA de acordo com o protocolo do fornecedor.
3. Seleção de MCS para inoculação de tumores
NOTA: Depois que os MCS forem semeados em microplacas esferóides e cultivados por 2-3 semanas com troca regular de meio de crescimento, selecione MCS com as seguintes características apropriadas para inoculação de tumores.
- Observe a morfologia do MCS ao microscópio e escolha o MCS com uma forma redonda com bordas lisas gerais, mas com 5-10 brotamentos ásperos (setas na Figura 2F) e um diâmetro dentro da faixa de 700-800 μm.
- Meça a fluorescência iRFP (consulte a etapa 2.2) e selecione o MCS cujos sinais fluorescentes estão dentro de um desvio padrão da média.
4. Inoculação intrapulmonar de MCS
NOTA: Use spray de álcool isopropílico 70% para limpar a estação cirúrgica e as ferramentas antes de manusear os animais.
- Anestesiar cada camundongo com uma injeção IP de 80 mg/kg de cetamina e 12 mg/kg de xilazina; Aperte os pés do mouse com uma pinça para garantir a anestesia completa.
- Injete 10 μL de cloridrato de buprenorfina (0,3 mg / mL) por via subcutânea para reduzir a dor.
- Aplique pomada oftálmica nos olhos para evitar o ressecamento.
- Coloque o mouse em uma postura dorsal e prenda os membros em uma posição de alongamento com fitas.
- Esterilize a pele posterior com iodo e cotonetes com álcool.
- Corte uma incisão de 0,5-1 cm usando uma tesoura cirúrgica na parte traseira esquerda (Figura 1B). Use cuidadosamente uma pinça para separar os tecidos muscular e adiposo até que a parede torácica e o movimento pulmonar sejam visíveis.
- Transfira um MCS selecionado de uma microplaca para uma placa de Petri de vidro contendo PBS gelado, usando uma pipeta.
- Coloque uma agulha de 20 G em uma seringa de vidro de 100 μL, pré-resfrie-a em gelo e retire 20 μL de uma mistura pré-resfriada de PBS e Matrigel (1:1 v/v).
- Use a seringa para aspirar rapidamente um MCS da placa de Petri em um volume mínimo de mistura PBS-Matrigel, mantendo o MCS na parte metálica da agulha.
NOTA: Segure firmemente a seringa e o êmbolo para evitar que o MCS escorregue da agulha. - Insira suavemente a agulha verticalmente entre duas costelas até ~ 3 mm de profundidade e injete lentamente toda a mistura de 20 μL de PBS e Matrigel que contém o MCS.
NOTA: Evite força excessiva durante a inserção para evitar danos ao pulmão, vasculatura ou coração. - Remova cuidadosamente a agulha e aplique pomada antibiótica tripla na ferida.
- Sele a incisão com clipes cirúrgicos, que devem ser removidos após 2 semanas.
NOTA: Não suture a incisão, pois as linhas de sutura podem interferir na imagem de fluorescência. Os ratos nus são capazes de se curar naturalmente após a cirurgia. - Coloque o animal em uma almofada térmica infravermelha e cubra-o com lenços umedecidos de laboratório para manter a temperatura corporal. Monitore o animal por pelo menos 30-60 minutos até que ele acorde e se mova adequadamente.
- Injete 10 μL de cloridrato de buprenorfina (0,3 mg/mL) por via subcutânea 3x ao dia durante as primeiras 48 h para reduzir a dor.
5. Acompanhamento pós-cirúrgico
- Meça o peso corporal a cada 3-4 dias.
- Meça o sinal fluorescente iRFP do xenoenxerto tumoral a cada 3-4 dias em um sistema de imagem de pequenos animais no canal de 700 nm em quatro posturas: esquerda, direita, dorsal e ventral, enquanto os camundongos são mantidos sob anestesia por inalação de isoflurano (taxa de fluxo: 1,5-2 L / min de oxigênio contendo 1,5% de isoflurano) durante 2-3 min.
- Quantifique a intensidade fluorescente líquida do câncer de xenoenxerto in vivo usando software (por exemplo, Image Studio).
- Use um retângulo fixo (A1, 200 x 125 pixels) como janela de amostragem para a área do peito dos mouses.
- Use a função de mão livre para traçar a forma dos mouses dentro do retângulo (A1) e medir a intensidade fluorescente (F1) na área A1.
- Use outro retângulo menor (A2, 25 x 40 pixels) para medir a fluorescência de fundo (F2) dos camundongos na área da coxa.
- Use a equação (1) para calcular a intensidade fluorescente líquida do câncer de xenoenxerto em cada camundongo:
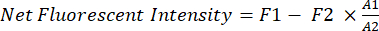 Características (1)
Características (1)
Resultados
Caracterização do A549-iRFP MCS
Os MCS A549-iRFP foram cultivados com sucesso em microplacas esferóides com a ajuda de colágeno e centrifugação. Quando o MCS atingiu um diâmetro de aproximadamente 500 μm após 1 semana, tanto o A549 quanto o A549-iRFP MCS foram expostos a uma variedade de medicamentos e formulações anticâncer por 3 dias e depois mantidos em meio de crescimento livre de medicamentos por 4 dias adicionais. O A549-iRFP MCS exibiu um padrão de resposta que espelha de perto o d...
Discussão
A construção do A549-iRFP MCS é um procedimento laboratorial simples e altamente reprodutível e pode ser traduzido para a formação de MCS para várias linhagens celulares. O MCS gerado com o auxílio de centrifugação e colágeno exibe uma estrutura mais integral e semelhante a um tumor sólido em 3-4 dias. Este método garante a formação de esferóides robustos que mantêm sua estrutura integral por longos períodos, normalmente 2-3 semanas ou até mais até que pequenos brotos comecem a surgir. Empregando cent...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado por bolsas SAAG e SEED da Universidade do Pacífico. Agradecemos ao Dr. William Chan por conceder acesso ao Sistema de Imagem Infravermelha Odyssey 205 e ao Dr. John Livesey por conceder acesso ao leitor de placas SpectraMax iD3. Agradecemos à Dra. Melanie Felmlee pelo aconselhamento técnico sobre os protocolos animais.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 µL Glass Syringe | Hamilton | Part/REF #80601 | |
| 20 G Needle | Thermo Fisher Scientific Inc. | 14 826D | |
| 96-well Ultra-Low-Attachment Spheroid Microplate | Corning | 15-100-173 | |
| A549-iRFP | Imanis Life Sciences | CL082-STAN | |
| AIN-93M Mature Rodent Diet | Research Diets, Inc. | D10012M | |
| Athymic Nude Mouse | Charles River Laboratories, Inc. | Strain Code: 490; homozygous | |
| BCA | Pierce | 23227 | |
| Buprenorphine Hydrochloride | Patterson Veterinary | NDC Number: 42023-179-05 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9683 | |
| Collagen | Gibco | A1064401 | |
| DMEM | Corning | MT10013CV | |
| Fetal Bovine Serum (FBS) | Cytiva HyClone | SH3039603 | |
| ImageJ | Open source tool (https://imagej.net/ij/) | N/A | |
| Image Studio | LI-COR | Version 5.2 | |
| Isoflurane | Patterson Veterinary | NDC Number: 17033-0091-25 | |
| Ketamine | Patterson Veterinary | NDC Number: 50989-0161-06 | |
| Microscope | Keyence | Model number: BZ-X710 | |
| Matrigel | Corning | CB-40234 | |
| Odyssey Infrared Imaging 205 System | LI-COR | Model number: 9140 | |
| PBS | Corning | MT21040CV | |
| Pearl Trilogy small animal imaging system | LI-COR | Model number: 9430 | |
| Penicillin-Streptomycin | Corning | MT30002CI | |
| Puromycin | Thermo Fisher Scientific Inc. | AAJ67236XF | |
| ReViSP software from MATLAB | Open source tool on Sourceforge (https://sourceforge.net/projects/revisp/) | N/A | |
| Surgical Clips--AutoClip System | Fine Science Tools | 12020-00 | |
| Xylazine | Patterson Veterinary | NDC Number: 61133-6017-01 |
Referências
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA Cancer J Clin. 70 (1), 7-30 (2020).
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Travis, W. D., Brambilla, E., Riely, G. J. New pathologic classification of lung cancer: Relevance for clinical practice and clinical trials. J Clin Oncol. 31 (8), 992-1001 (2013).
- Ducote, T. J., et al. Using artificial intelligence to identify tumor microenvironment heterogeneity in non-small cell lung cancers. Lab Invest. 103 (8), 100176 (2023).
- Lim, Z. F., Ma, P. C. Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy. J Hematol Oncol. 12 (1), 134 (2019).
- Wang, D. C., Wang, W., Zhu, B., Wang, X. Lung cancer heterogeneity and new strategies for drug therapy. Annu Rev Pharmacol Toxicol. 58, 531-546 (2018).
- Peterson, J. K., Houghton, P. J. Integrating pharmacology and in vivo cancer models in preclinical and clinical drug development. Eur J Cancer. 40 (6), 837-844 (2004).
- Madero-Visbal, R. A., et al. Bioluminescence imaging correlates with tumor progression in an orthotopic mouse model of lung cancer. Surg Oncol. 21 (1), 23-29 (2012).
- Mclemore, T. L., et al. Novel intrapulmonary model for orthotopic propagation of human lung cancers in athymic nude mice. Cancer Res. 47 (19), 5132-5140 (1987).
- Zanoni, M., et al. 3d tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Semin Cancer Biol. 15 (5), 365-377 (2005).
- Chaicharoenaudomrung, N., Kunhorm, P., Noisa, P. Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. World J Stem Cells. 11 (12), 1065-1083 (2019).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. J Control Release. 164 (2), 192-204 (2012).
- Huang, B. W., Gao, J. Q. Application of 3d cultured multicellular spheroid tumor models in tumor-targeted drug delivery system research. J Control Release. 270, 246-259 (2018).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. J Biotechnol. 148 (1), 3-15 (2010).
- Sethi, P., et al. 3d tumor tissue analogs and their orthotopic implants for understanding tumor-targeting of microenvironment-responsive nanosized chemotherapy and radiation. Nanomedicine. 11 (8), 2013-2023 (2015).
- Valta, M. P., et al. Spheroid culture of lucap 136 patient-derived xenograft enables versatile preclinical models of prostate cancer. Clin Exp Metastasis. 33 (4), 325-337 (2016).
- Huang, Y., et al. Intrapulmonary inoculation of multicellular spheroids to construct an orthotopic lung cancer xenograft model that mimics four clinical stages of non-small cell lung cancer. J Pharmacol Toxicol Methods. , 106885 (2020).
- Lemjabbar-Alaoui, H., Hassan, O. U., Yang, Y. W., Buchanan, P. Lung cancer: Biology and treatment options. Biochim Biophys Acta. 1856 (2), 189-210 (2015).
- Detterbeck, F. C., Boffa, D. J., Kim, A. W., Tanoue, L. T. The eighth edition lung cancer stage classification. Chest. 151 (1), 193-203 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados