A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בניית מודל קסנוגרפט אורתוטופי של סרטן ריאה מסוג תאים לא קטנים המחקה את התקדמות המחלה ומנבא פעילויות תרופתיות
In This Article
Summary
מחקר זה מציג מודל אורתוטופי של סרטן ריאות מסוג תאים לא קטנים (NSCLC) המבוסס על חיסון תוך ריאתי של ספרואידים רב-תאיים של תאי A549-iRFP פלואורסצנטיים. המודל משחזר שלבים קליניים של NSCLC ומגיב לציספלטין, על פי ניטור דינמי in vivo של פלואורסצנטיות באורך גל ארוך.
Abstract
סרטן ריאות של תאים לא קטנים (NSCLC) הוא מחלה קטלנית ביותר עם מיקרו-סביבה סרטנית מורכבת והטרוגנית. כיום, מודלים נפוצים של בעלי חיים המבוססים על חיסון תת-עורי של תרחיפים של תאים סרטניים אינם משחזרים את המיקרו-סביבה של הגידול ב- NSCLC. במאמר זה אנו מתארים מודל סרטן ריאות אורתוטופי של מורין המשתמש בחיסון תוך ריאתי של ספרואידים רב-תאיים תלת-ממדיים (MCS). באופן ספציפי, תאי NSCLC אנושיים פלואורסצנטיים (A549-iRFP) גודלו בתרבית במיקרו-צלחות בעלות חיבור נמוך של 96 בארות עם קולגן במשך 3 שבועות כדי ליצור MCS, אשר חוסנו לאחר מכן באופן בין-קוסטלי לתוך הריאה השמאלית של עכברים עירומים אתימיים כדי לבסס את מודל סרטן הריאה האורתוטופי.
בהשוואה לקו התאים המקורי של A549, MCS של קו התאים A549-iRFP הגיב באופן דומה לתרופות נגד סרטן. האות הפלואורסצנטי באורך הגל הארוך של תאי A549-iRFP נמצא בקורלציה חזקה עם סמנים נפוצים של צמיחת תאים סרטניים, כולל נפח ספרואידים, כדאיות התא ורמת החלבון התאי, ובכך מאפשר ניטור דינמי של צמיחת הסרטן in vivo על ידי הדמיה פלואורסצנטית. לאחר החיסון לעכברים, A549-iRFP MCS xenograft התקדם באופן אמין דרך שלבים דומים מאוד לשלבים הקליניים של NSCLC, כולל הרחבת הגידול הראשוני, הופעתם של גידולים משניים שכנים, וגרורות של תאים סרטניים לריאה הימנית הנגדית ולאיברים מרוחקים. יתר על כן, המודל הגיב לתרופה נגד סרטן ריאות, ציספלטין עם הרעילות הצפויה והתקדמות סרטן איטית יותר. לכן, מודל קסנוגרפט אורתוטופי זה של NSCLC ישמש פלטפורמה לשחזור התקדמות המחלה ולהקל על פיתוח תרופות אנטי-סרטניות פוטנציאליות.
Introduction
מבין כל ההפרעות האונקולוגיות, סרטן הריאות לא רק גורם לאובדן החיים הגבוה ביותר, אלא גם טוען למספר השני בגובהו של חולים חדשים מדי שנה בארה"ב1. ממאירות הרסנית זו עומדת כמכשול מרכזי בשירותי הבריאות המודרניים, ודוחקת להבנה עמוקה יותר של הביולוגיה המורכבת שלה ולשיטות טיפוליות יעילות יותר2. סרטן ריאות מסוג תאים לא קטנים (NSCLC) מהווה 85% ממקרי סרטן הריאה ונוטה להתפתח לגידולים מוצקים3. אחד האתגרים החשובים ביותר בסרטן הריאה הוא המיקרו-סביבה הדינמית וההטרוגנית של הגידול, המשפיעה עמוקות על התקדמות הסרטן ועל תגובותיו להתערבויות טיפוליות 4,5,6. הבנה מעמיקה יותר של יחסי הגומלין בין תאים סרטניים לבין המיקרו-סביבה שלהם בשלבים שונים של NSCLC דורשת מודלים פתולוגיים מעודנים המשחזרים את המאפיינים ההיסטולוגיים של התקדמות NSCLC.
בהקשר זה, מודלים אורתוטופיים של בעלי חיים מתגלים כאפיק מבטיח למחקר NSCLC. בניגוד למודלים תת-עורייםנפוצים של קסנוגרפט 7, מודלים אורתוטופיים כוללים תאים סרטניים המחוסנים ישירות לאיבר המוצא. עבור סרטן ריאות, משמעות הדבר היא השתלת תאים סרטניים ישירות לתוך רקמת הריאה 8,9. כתוצאה מכך, מודלים אורתוטופיים של סרטן ריאות מחקים טוב יותר את המיקרו-סביבה הטבעית של הגידול, כולל הרקמות, כלי הדם והמרכיבים החיסוניים השכנים, ובכך משפרים את הרלוונטיות הפיזיולוגית והקלינית שלהם.
ספרואידים רב-תאיים תלת-ממדיים (MCS) מייצגים גישה מבטיחה נוספת לשחזור תכונות של סביבת הגידול. רוב סוגי הסרטן מאופיינים במיקרו-סביבה הגידולית המורכבת שלהם, כולל אינטראקציות תא-תאים שונות, המטריצה החוץ תאית, והשיפועים בחמצן ובחומרי מזון10,11. תרביות תאים דו-ממדיות מסורתיות חסרות את המורכבות המרחבית והמבנית כדי לשחזר תכונות ספציפיות אלהלגידול 12. לעומת זאת, MCS בגודל המתאים מתאפיין במבנה הטרוגני עם ליבה היפוקסית ונמקית, אשר משחזרת לא רק את המיקרו-סביבה התוך-גידולית אלא גם את המחסום הפיזיולוגי מפני חדירת תרופות, שהוא מנגנון עיקרי של עמידות לתרופות בטיפול אנטי-סרטני 13,14,15.
תוך ניצול המודלים האורתוטופיים של בעלי חיים וטכניקות הטיפוח של MCS, MCS חוסנו לעכברים מדוכאי חיסון כדי לבנות בהצלחה מודלים אורתוטופיים של סרטן השד וסרטן הערמונית16,17. במאמר זה אנו מדווחים על המתודולוגיה המפורטת לבנייה ואפיון של מודל קסנוגרפט אורתוטופי של סרטן ריאות. שיטה זו משתמשת בחיסון תוך-ריאתי של MCS תלת-ממדי שמקורו בתאי סרטן ריאה אנושיים פלואורסצנטיים (A549-iRFP)18. מודל זה מציע הזדמנות יוצאת דופן לצפות בהתקדמות in vivo של סרטן ריאות דרך שלבים המקבילים באופן הדוק לארבעת השלבים הקליניים של NSCLC. יתר על כן, סרטן xenograft של מודל זה הגיב לתרופה נגד סרטן ריאות מבוססת קלינית, cisplatin.
Protocol
המחקר בבעלי חיים בוצע באישור הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) באוניברסיטת האוקיינוס השקט (פרוטוקולים לבעלי חיים 19R10 ו-22R10). במחקר הנוכחי נעשה שימוש בשמונה עכברים עירומים אתימיים זכרים בגילאי 5-6 שבועות, במשקל 20-25 גרם, שגודלו עם דיאטת המכרסמים הנזכרת ושוכנו בתנאים נטולי פתוגן (SPF). כלובים, מצעים ומי שתייה הוחלפו והוחלפו באופן קבוע. סכמה של חיסון גידולי בעכברים מוצגת באיור 1. עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים והמכשירים המשמשים בפרוטוקול זה.
1. הקמת MCS תלת מימדי של תאי A549-iRFP
- לדגור על תאי A549-iRFP (אדנוקרצינומה של ריאות אנושיות) באטמוספירה לחה עם 5% CO2 ב-37°C ולגדל אותם ב-DMEM בינוני לצמיחה מלאה המכיל 10% נסיוב בקר עוברי, 1% פניצילין-סטרפטומיצין ו-1 מיקרוגרם/מ"ל פורומיצין.
- זרעו תאי A549-iRFP למיקרו-פלטה ספרואידית בעלת תחתית עגולה של 96 בארות בצפיפות זריעה של 4,000 תאים/באר, תוך שימוש ב-100 מיקרוליטר של מדיום גידול מלא בתוספת 0.3% קולגן.
- צנטריפוגה את microplates ב 300 × גרם במשך 7 דקות ב 4 ° C כדי להקל על היווצרות MCS. בחן את המורפולוגיה של MCS תחת מיקרוסקופ כדי להבטיח צבירת תאים לאחר צנטריפוגה.
- לאחר 48 שעות, הוסף 100 μL של מדיום צמיחה מלא לכל באר כדי להשיג נפח כולל של 200 μL של מדיום צמיחה לכל באר.
- החלף 100 μL של מדיום גידול בכל באר עם מדיום צמיחה מלא טרי כל יומיים.
2. אפיון A549-iRFP MCS
- התבונן וצלם את המורפולוגיה של MCS באמצעות מיקרוסקופ והערך את נפח MCS על ידי סימולציה עם התוכנה המוזכרת מ- MATLAB בהתבסס על תמונות מיקרוסקופ ניגודיות פאזה.
- פתח תמונת MCS אחת בתוכנת ImageJ.
- השתמש בבחירות Freehand כדי לבחור את הקצה של MCS ולהוסיף אותו למנהל החזר ההשקעה.
- לחץ על ערוך | בחירה | צרו מסיכה.
- לחץ על ערוך | הפוך.
- לחץ על קובץ | שמירה בשם | טיף.
- פתח את תוכנת ReViSP.
- פתח את תמונת TIFF שנשמרה על-ידי לחיצה על עיון.
- לחץ על התחל כדי להשלים את סימולציית MCS.
- מדוד את האות הפלואורסצנטי iRFP באמצעות מערכת דימות אינפרא אדום בערוץ 700 ננומטר וכמת את האות הפלואורסצנטי באמצעות תוכנה (לדוגמה, Image Studio).
- תוכנת Open Image Studio.
- בכרטיסיה ערוצים, בחר 700 ועוצמה = 5.
- בכרטיסיה פקדי סריקה , בחר 84 מיקרומטר, בינוני, 0.0 מ"מ והפוך תמונה. שמור את כל השאר כברירת מחדל.
- לחץ על התחל כדי להתחיל בסריקה.
- הערך וכמת את כדאיות התא באמצעות בדיקת כדאיות התא התלת-ממדית בהתאם לפרוטוקול הספק.
- להעריך ולכמת חלבון תאי באמצעות בדיקת BCA בהתאם לפרוטוקול הספק.
3. בחירת MCS לחיסון הגידול
הערה: לאחר ש-MCS נזרעים לתוך מיקרו-צלחות ספרואידיות ומגודלים במשך 2-3 שבועות עם חילופי מדיום גידול קבועים, בחר MCS עם המאפיינים המתאימים הבאים לחיסון הגידול.
- התבוננו במורפולוגיה של MCS תחת מיקרוסקופ ובחרו MCS עם צורה עגולה עם קצוות חלקים באופן כללי, אבל עם 5-10 ניצנים מחוספסים (חצים באיור 2F) וקוטר בטווח של 700-800 מיקרומטר.
- מדוד את הפלואורסצנטיות של iRFP (עיין בשלב 2.2) ובחר את MCS שהאותות הפלואורסצנטיים שלו נמצאים בסטיית תקן אחת מהממוצע.
4. חיסון MCS תוך ריאתי
הערה: יש להשתמש בתרסיס איזופרופיל אלכוהול 70% כדי לנקות את תחנת הניתוח ואת הכלים לפני הטיפול בבעלי החיים.
- להרדים כל עכבר בהזרקת IP של 80 מ"ג/ק"ג קטמין ו-12 מ"ג/ק"ג קסילזין; צבטו את רגלי העכבר במלקחיים כדי להבטיח הרדמה מלאה.
- להזריק 10 μL של buprenorphine hydrochloride (0.3 מ"ג / מ"ל) תת עורית כדי להפחית את הכאב.
- החל משחה אופתלמית על העיניים כדי למנוע יובש.
- הניחו את העכבר בתנוחה גבית ואבטחו את הגפיים במצב מתיחה בעזרת קלטות.
- לעקר את העור האחורי עם מקלות יוד ואלכוהול.
- חתכו חתך של 0.5-1 ס"מ באמצעות מספריים כירורגיים בצד שמאל האחורי (איור 1B). השתמש בזהירות במלקחיים כדי להפריד את רקמות השריר והשומן עד שקיר החזה ותנועת הריאות נראים לעין.
- העבירו MCS נבחר אחד ממיקרו-צלחת לצלחת פטרי מזכוכית המכילה PBS קר כקרח, באמצעות פיפטה.
- חברו מחט של 20 גרם למזרק זכוכית של 100 מיקרוליטר, קררו אותם מראש על קרח ושאבו 20 מיקרוליטר של תערובת מקוררת מראש של PBS ומטריג'ל (1:1 v/v).
- השתמש במזרק כדי לשאוף במהירות MCS אחד מצלחת פטרי בנפח מינימלי של תערובת PBS-Matrigel, תוך שמירה על MCS בחלק המתכתי של המחט.
הערה: שמור על אחיזה הדוקה במזרק ובבוכנה כדי למנוע מה-MCS להחליק החוצה מהמחט. - הכנס בעדינות את המחט במאונך בין שתי עצמות צלעות לעומק ~3 מ"מ והזריק לאט את כל תערובת PBS ומטריג'ל 20 μL המכילה את MCS.
הערה: יש להימנע משימוש בכוח מופרז במהלך ההחדרה כדי למנוע נזק לריאה, לכלי הדם או ללב. - בזהירות להסיר את המחט ולהחיל משחה אנטיביוטית משולשת על הפצע.
- לאטום את החתך עם קליפים כירורגיים, אשר יוסרו לאחר 2 שבועות.
הערה: אין לתפור את החתך מכיוון שקווי התפרים עלולים להפריע להדמיית פלואורסצנטיות. העכברים העירומים מסוגלים להחלים באופן טבעי לאחר הניתוח. - הניחו את בעל החיים על כרית חום אינפרא אדום וכסו אותו במגבוני מעבדה כדי לשמור על טמפרטורת הגוף. לפקח על החיה לפחות 30-60 דקות עד שהוא מתעורר ונע כראוי.
- הזריקו 10 μL של buprenorphine hydrochloride (0.3 מ"ג / מ"ל) תת עורית 3 פעמים ביום במשך 48 השעות הראשונות כדי להפחית את הכאב.
5. ניטור לאחר ניתוח
- למדוד את משקל הגוף כל 3-4 ימים.
- מדוד את האות הפלואורסצנטי iRFP מהגידול xenograft כל 3-4 ימים על מערכת הדמיה של בעלי חיים קטנים בערוץ 700 ננומטר בארבע תנוחות: שמאל, ימין, גבי וגחוני, בעוד העכברים נשמרים תחת הרדמה על ידי שאיפת איזופלורן (קצב זרימה: 1.5-2 ליטר / דקה חמצן המכיל 1.5% איזופלורן) במשך 2-3 דקות.
- כמת את העוצמה הפלואורסצנטית נטו של סרטן xenograft in vivo באמצעות תוכנה (למשל, Image Studio).
- השתמש במלבן קבוע (A1, 200 x 125 פיקסלים) כחלון הדגימה לאזור החזה של העכברים.
- השתמש בפונקציית היד החופשית כדי לעקוב אחר צורת העכברים בתוך המלבן (A1) ולמדוד את עוצמת הפלואורסצנט (F1) באזור A1.
- השתמש במלבן קטן יותר (A2, 25 x 40 פיקסלים) כדי למדוד את פלואורסצנטיות הרקע (F2) של העכברים באזור הירך.
- השתמש במשוואה (1) כדי לחשב את עוצמת הפלואורסצנט נטו של סרטן xenograft בכל עכבר:
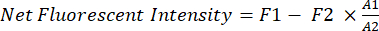 (1)
(1)
תוצאות
אפיון MCS A549-iRFP
A549-iRFP MCS תורבתו בהצלחה במיקרו-צלחות ספרואידים בעזרת קולגן וצנטריפוגה. כאשר MCS הגיע לקוטר של כ-500 מיקרומטר לאחר שבוע אחד, הן A549 והן A549-iRFP MCS נחשפו למגוון תרופות ותכשירים נגד סרטן במשך 3 ימים ולאחר מכן נשמרו במדיום גידול ללא תרופות במשך 4 ימים נוספים. A549-iRFP MCS הציג דפוס תגו...
Discussion
הבנייה של A549-iRFP MCS היא הליך מעבדה פשוט וניתן לשכפול וניתן לתרגם אותו להיווצרות MCS עבור קווי תאים מרובים. MCS שנוצר בעזרת צנטריפוגה וקולגן מציג מבנה אינטגרלי יותר דמוי גידול מוצק בתוך 3-4 ימים. שיטה זו מבטיחה היווצרות של ספרואידים חזקים השומרים על המבנה האינטגרלי שלהם לתקופות ממושכות, בדרך כלל ...
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
עבודה זו נתמכה על ידי מענקי SAAG ו- SEED מאוניברסיטת האוקיינוס השקט. אנו מודים לד"ר ויליאם צ'אן על מתן גישה למערכת Odyssey Infrared Imaging 205 ולד"ר ג'ון לייבסי על מתן גישה לקורא הלוחות SpectraMax iD3. אנו מודים לד"ר מלאני פלמלי על הייעוץ הטכני בנוגע לפרוטוקולים של בעלי חיים.
Materials
| Name | Company | Catalog Number | Comments |
| 100 µL Glass Syringe | Hamilton | Part/REF #80601 | |
| 20 G Needle | Thermo Fisher Scientific Inc. | 14 826D | |
| 96-well Ultra-Low-Attachment Spheroid Microplate | Corning | 15-100-173 | |
| A549-iRFP | Imanis Life Sciences | CL082-STAN | |
| AIN-93M Mature Rodent Diet | Research Diets, Inc. | D10012M | |
| Athymic Nude Mouse | Charles River Laboratories, Inc. | Strain Code: 490; homozygous | |
| BCA | Pierce | 23227 | |
| Buprenorphine Hydrochloride | Patterson Veterinary | NDC Number: 42023-179-05 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9683 | |
| Collagen | Gibco | A1064401 | |
| DMEM | Corning | MT10013CV | |
| Fetal Bovine Serum (FBS) | Cytiva HyClone | SH3039603 | |
| ImageJ | Open source tool (https://imagej.net/ij/) | N/A | |
| Image Studio | LI-COR | Version 5.2 | |
| Isoflurane | Patterson Veterinary | NDC Number: 17033-0091-25 | |
| Ketamine | Patterson Veterinary | NDC Number: 50989-0161-06 | |
| Microscope | Keyence | Model number: BZ-X710 | |
| Matrigel | Corning | CB-40234 | |
| Odyssey Infrared Imaging 205 System | LI-COR | Model number: 9140 | |
| PBS | Corning | MT21040CV | |
| Pearl Trilogy small animal imaging system | LI-COR | Model number: 9430 | |
| Penicillin-Streptomycin | Corning | MT30002CI | |
| Puromycin | Thermo Fisher Scientific Inc. | AAJ67236XF | |
| ReViSP software from MATLAB | Open source tool on Sourceforge (https://sourceforge.net/projects/revisp/) | N/A | |
| Surgical Clips--AutoClip System | Fine Science Tools | 12020-00 | |
| Xylazine | Patterson Veterinary | NDC Number: 61133-6017-01 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA Cancer J Clin. 70 (1), 7-30 (2020).
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Travis, W. D., Brambilla, E., Riely, G. J. New pathologic classification of lung cancer: Relevance for clinical practice and clinical trials. J Clin Oncol. 31 (8), 992-1001 (2013).
- Ducote, T. J., et al. Using artificial intelligence to identify tumor microenvironment heterogeneity in non-small cell lung cancers. Lab Invest. 103 (8), 100176 (2023).
- Lim, Z. F., Ma, P. C. Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy. J Hematol Oncol. 12 (1), 134 (2019).
- Wang, D. C., Wang, W., Zhu, B., Wang, X. Lung cancer heterogeneity and new strategies for drug therapy. Annu Rev Pharmacol Toxicol. 58, 531-546 (2018).
- Peterson, J. K., Houghton, P. J. Integrating pharmacology and in vivo cancer models in preclinical and clinical drug development. Eur J Cancer. 40 (6), 837-844 (2004).
- Madero-Visbal, R. A., et al. Bioluminescence imaging correlates with tumor progression in an orthotopic mouse model of lung cancer. Surg Oncol. 21 (1), 23-29 (2012).
- Mclemore, T. L., et al. Novel intrapulmonary model for orthotopic propagation of human lung cancers in athymic nude mice. Cancer Res. 47 (19), 5132-5140 (1987).
- Zanoni, M., et al. 3d tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Semin Cancer Biol. 15 (5), 365-377 (2005).
- Chaicharoenaudomrung, N., Kunhorm, P., Noisa, P. Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. World J Stem Cells. 11 (12), 1065-1083 (2019).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. J Control Release. 164 (2), 192-204 (2012).
- Huang, B. W., Gao, J. Q. Application of 3d cultured multicellular spheroid tumor models in tumor-targeted drug delivery system research. J Control Release. 270, 246-259 (2018).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. J Biotechnol. 148 (1), 3-15 (2010).
- Sethi, P., et al. 3d tumor tissue analogs and their orthotopic implants for understanding tumor-targeting of microenvironment-responsive nanosized chemotherapy and radiation. Nanomedicine. 11 (8), 2013-2023 (2015).
- Valta, M. P., et al. Spheroid culture of lucap 136 patient-derived xenograft enables versatile preclinical models of prostate cancer. Clin Exp Metastasis. 33 (4), 325-337 (2016).
- Huang, Y., et al. Intrapulmonary inoculation of multicellular spheroids to construct an orthotopic lung cancer xenograft model that mimics four clinical stages of non-small cell lung cancer. J Pharmacol Toxicol Methods. , 106885 (2020).
- Lemjabbar-Alaoui, H., Hassan, O. U., Yang, Y. W., Buchanan, P. Lung cancer: Biology and treatment options. Biochim Biophys Acta. 1856 (2), 189-210 (2015).
- Detterbeck, F. C., Boffa, D. J., Kim, A. W., Tanoue, L. T. The eighth edition lung cancer stage classification. Chest. 151 (1), 193-203 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved