Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük Hücreli Dışı Akciğer Kanserinde Hastalık Progresyonunu Taklit Eden ve İlaç Aktivitelerini Tahmin Eden Ortotopik Ksenogreft Modelinin Oluşturulması
Bu Makalede
Özet
Bu çalışma, floresan A549-iRFP hücrelerinin çok hücreli sferoidlerinin intrapulmoner inokülasyonuna dayanan ortotopik küçük hücreli dışı akciğer kanseri (KHDAK) modelini sunmaktadır. Model, klinik NSCLC aşamalarını özetler ve uzun dalga boylu floresanın dinamik in vivo izlemesine göre sisplatine yanıt verir.
Özet
Küçük hücreli dışı akciğer kanseri (KHDAK), karmaşık ve heterojen bir tümör mikroçevresi ile oldukça ölümcül bir hastalıktır. Şu anda, kanser hücresi süspansiyonlarının deri altı inokülasyonuna dayanan yaygın hayvan modelleri, NSCLC'deki tümör mikroçevresini özetlememektedir. Burada, üç boyutlu çok hücreli sferoidlerin (MCS) intrapulmoner inokülasyonunu kullanan bir murin ortotopik akciğer kanseri ksenogreft modelini tanımladık. Spesifik olarak, floresan insan NSCLC hücreleri (A549-iRFP), MCS oluşturmak için 3 hafta boyunca kollajen ile düşük bağlantılı 96 oyuklu mikroplakalarda kültürlendi, bunlar daha sonra ortotopik akciğer kanseri modelini oluşturmak için atimik çıplak farelerin sol akciğerine interkostal olarak aşılandı.
Orijinal A549 hücre hattı ile karşılaştırıldığında, A549-iRFP hücre hattının MCS'si, antikanser ilaçlarına benzer şekilde yanıt verdi. A549-iRFP hücrelerinin uzun dalga boylu floresan sinyali, sferoid hacmi, hücre canlılığı ve hücresel protein seviyesi dahil olmak üzere kanser hücresi büyümesinin ortak belirteçleri ile güçlü bir şekilde korelasyon gösterdi ve böylece floresan görüntüleme ile in vivo kanser büyümesinin dinamik olarak izlenmesine izin verdi. Farelere aşılandıktan sonra, A549-iRFP MCS ksenogrefti, primer tümörün genişlemesi, komşu sekonder tümörlerin ortaya çıkması ve kanser hücrelerinin kontralateral sağ akciğer ve uzak organlara metastazı dahil olmak üzere NSCLC'nin klinik aşamalarına çok benzeyen fazlar boyunca güvenilir bir şekilde ilerledi. Ayrıca model, antiakciğer kanseri ilacı olan sisplatine beklenen toksisite ve daha yavaş kanser ilerlemesi ile yanıt verdi. Bu nedenle, NSCLC'nin bu murin ortotopik ksenogreft modeli, hastalığın ilerlemesini özetlemek ve potansiyel antikanser ilaçların geliştirilmesini kolaylaştırmak için bir platform görevi görecektir.
Giriş
Tüm onkolojik bozukluklar arasında, akciğer kanseri sadece en yüksek yaşam kaybına neden olmakla kalmaz, aynı zamanda ABD'de her yıl ikinci en yüksek yeni hasta sayısını talep etmektedir1. Bu yıkıcı malignite, modern sağlık hizmetlerinde büyük bir engel olarak durmakta ve karmaşık biyolojisinin ve daha etkili terapötik modalitelerinin daha derin bir şekilde anlaşılmasını gerektirmektedir2. Küçük hücreli dışı akciğer kanseri (KHDAK), akciğer kanserinin %85'ini oluşturur ve solid tümörlere dönüşme eğilimindedir3. Akciğer kanserindeki en önemli zorluklardan biri, kanserin ilerlemesini ve terapötik müdahalelere verilen yanıtları derinden etkileyen dinamik ve heterojen tümör mikro çevresidir 4,5,6. NSCLC'nin farklı aşamalarında kanser hücreleri ve mikro çevreleri arasındaki etkileşimin daha derin bir şekilde anlaşılması, NSCLC ilerlemesinin histolojik özelliklerini özetleyen rafine patolojik modeller gerektirir.
Bu bağlamda, ortotopik hayvan modelleri, NSCLC araştırmaları için umut verici bir yol olarak ortaya çıkmaktadır. Yaygın olarak kullanılan deri altı ksenogreft modellerinin7 aksine, ortotopik modellerde doğrudan orijin organa aşılanan kanser hücreleri bulunur. Akciğer kanseri için bu, kanser hücrelerinin doğrudan akciğer dokusuna implante edilmesi anlamına gelir 8,9. Sonuç olarak, akciğer kanserinin ortotopik modelleri, komşu dokular, damarlar ve bağışıklık bileşenleri dahil olmak üzere doğal tümör mikro çevresini daha iyi taklit eder ve böylece fizyolojik ve klinik alaka düzeylerini geliştirir.
Üç boyutlu çok hücreli sferoidler (MCS), tümör ortamının özelliklerini özetlemek için umut verici bir başka yaklaşımı temsil eder. Çoğu kanser, çeşitli hücre-hücre etkileşimleri, hücre dışı matris ve oksijen ve besinlerdeki gradyanlar dahil olmak üzere karmaşık tümör mikro çevreleri ile karakterize edilir10,11. Geleneksel 2D hücre kültürleri, bu tümöre özgü özellikleri özetlemek için uzamsal ve yapısal karmaşıklıktan yoksundur12. Buna karşılık, uygun büyüklükteki MCS, hipoksik ve nekrotik bir çekirdeğe sahip heterojen bir yapıya sahiptir, bu da sadece intratümöral mikroçevreyi değil, aynı zamanda antikanser tedavisinde ilaç direncinin önemli bir mekanizması olan ilaç penetrasyonuna karşı fizyolojik bariyeri de özetler 13,14,15.
Hem ortotopik hayvan modellerinden hem de MCS kültür tekniklerinden yararlanan MCS, meme kanseri ve prostat kanserinin ortotopik modellerini başarılı bir şekilde oluşturmak için bağışıklığı baskılanmış farelere aşılanmıştır16,17. Burada, akciğer kanserinin bir murin ortotopik ksenogreft modelini oluşturmak ve karakterize etmek için ayrıntılı metodolojiyi sunuyoruz. Bu yöntem, floresan insan akciğer kanseri hücrelerinden (A549-iRFP) türetilen 3D MCS'nin intrapulmoner aşılamasını kullanır18. Bu model, NSCLC'nin dört klinik aşamasına yakından paralel olan aşamalar boyunca akciğer kanserinin in vivo ilerlemesini gözlemlemek için olağanüstü bir fırsat sunmaktadır. Ayrıca, bu modelin ksenogreft kanseri, klinik olarak belirlenmiş antiakciğer kanseri ilacı sisplatine yanıt verdi.
Protokol
Hayvan çalışması, Pasifik Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin (IACUC) onayı ile gerçekleştirildi (Hayvan Protokolleri 19R10 ve 22R10). Bu çalışma için 5-6 haftalık yaşlarında, 20-25 g ağırlığında, referans verilen Kemirgen Diyeti ile yetiştirilmiş ve patojen içermeyen (SPF) koşullar altında barındırılan sekiz erkek atimik çıplak fare kullanıldı. Kafesler, yatak takımları ve içme suyu otoklavlandı ve düzenli olarak değiştirildi. Farelerde tümör aşılamasının bir şeması Şekil 1'de gösterilmiştir. Bu protokolde kullanılan tüm malzeme ve aletlerle ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. A549-iRFP hücrelerinin üç boyutlu MCS'sinin kurulması
- A549-iRFP hücrelerini (insan akciğer adenokarsinomu) 37 ° C'de% 5 CO2 ile nemlendirilmiş bir atmosferde inkübe edin ve% 10 fetal sığır serumu,% 1 penisilin-streptomisin ve% 1 μg / mL puromisin içeren tam büyüme ortamı DMEM'de büyütün.
- A549-iRFP hücrelerini,% 0.3 kollajen ile desteklenmiş 100 μL tam büyüme ortamı kullanarak, 4.000 hücre / kuyu tohumlama yoğunluğunda 96 oyuklu ultra düşük bağlantılı, yuvarlak tabanlı küresel mikroplakaya tohumlayın.
- MCS oluşumunu kolaylaştırmak için mikroplakaları 300 × g'da 4 ° C'de 7 dakika santrifüjleyin. Santrifüjlemeden sonra hücre agregasyonunu sağlamak için MCS morfolojisini mikroskop altında inceleyin.
- 48 saat sonra, oyuk başına toplam 200 μL büyüme ortamı hacmi elde etmek için her bir oyuğa 100 μL tam büyüme ortamı ekleyin.
- Her kuyucuktaki 100 μL büyüme ortamını her gün taze tam büyüme ortamı ile değiştirin.
2. A549-iRFP MCS'nin Karakterizasyonu
- Bir mikroskop kullanarak MCS morfolojisini gözlemleyin ve görüntüleyin ve faz kontrast mikroskobu görüntülerine dayalı olarak MATLAB'ın referans yazılımı ile simülasyon yoluyla MCS hacmini tahmin edin.
- ImageJ yazılımında bir MCS görüntüsü açın.
- MCS'nin kenarını seçmek ve bunu ROI Yöneticisi'ne eklemek için Freehand seçimlerini kullanın.
- Düzenle | öğesine tıklayın Seçim | Maske Oluştur'u tıklayın.
- Düzenle | öğesine tıklayın Ters çevir.
- Dosya | Farklı Kaydet | Öğr.
- ReViSP yazılımını açın.
- Kaydedilen TIFF görüntüsünü açmak için Gözat'ı tıklatın.
- MCS simülasyonunu tamamlamak için Başlat'a tıklayın.
- 700 nm kanalında kızılötesi görüntüleme sistemini kullanarak iRFP floresan sinyalini ölçün ve yazılım (ör. Image Studio) kullanarak floresan sinyalini ölçün.
- Image Studio yazılımını açın.
- Kanallar sekmesinde 700 ve Yoğunluk = 5'i seçin.
- Scan Controls (Tarama Kontrolleri) sekmesinde 84 μm, Medium, 0,0 mm ve Flip Image (Görüntüyü Çevir) öğesini seçin. Diğer her şeyi varsayılan olarak tutun.
- Taramayı başlatmak için Başlat'a tıklayın.
- Satıcı protokolüne göre 3D hücre canlılığı testini kullanarak hücre canlılığını değerlendirin ve ölçün.
- Satıcı protokolüne göre BCA Testini kullanarak hücresel proteini değerlendirin ve nicelleştirin.
3. Tümör aşılaması için MCS seçimi
NOT: MCS, sferoid mikroplakalara ekildikten ve düzenli büyüme ortamı değişimi ile 2-3 hafta boyunca büyütüldükten sonra, tümör aşılaması için aşağıdaki uygun özelliklere sahip MCS'yi seçin.
- MCS morfolojisini mikroskop altında gözlemleyin ve genel olarak pürüzsüz kenarlı, ancak 5-10 pürüzlü tomurcuklanma ( Şekil 2F'deki oklar) ve 700-800 μm aralığında bir çapa sahip yuvarlak bir şekle sahip MCS'yi seçin.
- iRFP floresansını ölçün (bkz. adım 2.2'ye bakın) ve floresan sinyalleri ortalamanın bir standart sapması içinde olan MCS'yi seçin.
4. İntrapulmoner MCS aşılaması
NOT: Hayvanlara dokunmadan önce cerrahi istasyonu ve aletleri temizlemek için %70 izopropil alkol spreyi kullanın.
- Her fareyi 80 mg / kg ketamin ve 12 mg / kg ksilazin IP enjeksiyonu ile uyuşturun; Tam anestezi sağlamak için fare ayaklarını forseps ile sıkıştırın.
- Ağrıyı azaltmak için deri altına 10 μL buprenorfin hidroklorür (0.3 mg / mL) enjekte edin.
- Kuruluğu önlemek için gözlere oftalmik merhem sürün.
- Fareyi sırt duruşuna getirin ve uzuvları bantlarla germe pozisyonunda sabitleyin.
- Arka cildi iyot ve alkollü çubuk çubuklarıyla sterilize edin.
- Sol arka taraftan cerrahi makas kullanarak 0,5-1 cm'lik bir kesi kesin (Şekil 1B). Göğüs duvarı ve akciğer hareketi görünene kadar kas ve yağ dokularını ayırmak için dikkatlice forseps kullanın.
- Seçilen bir MCS'yi bir mikroplakadan bir pipet kullanarak buz gibi soğuk PBS içeren bir cam Petri kabına aktarın.
- 100 μL'lik bir cam şırıngaya 20 G'lik bir iğne takın, buz üzerinde önceden soğutun ve 20 μL önceden soğutulmuş PBS ve Matrigel karışımından (1:1 v/v) çekin.
- MCS'yi iğnenin metal kısmında tutarak, minimum hacimde PBS-Matrigel karışımında Petri kabından bir MCS'yi hızlı bir şekilde aspire etmek için şırıngayı kullanın.
NOT: MCS'nin iğneden kaymasını önlemek için şırıngayı ve pistonu sıkıca tutun. - İğneyi iki kaburga kemiği arasına ~ 3 mm derinliğe kadar dikey olarak nazikçe sokun ve MCS'yi içeren tüm 20 μL PBS ve Matrigel karışımını yavaşça enjekte edin.
NOT: Akciğere, damar sistemine veya kalbe zarar vermemek için yerleştirme sırasında aşırı kuvvetten kaçının. - İğneyi dikkatlice çıkarın ve yaraya üçlü antibiyotik merhem sürün.
- Kesiyonu 2 hafta sonra çıkarılacak olan cerrahi klipslerle kapatın.
NOT: Dikiş çizgileri floresan görüntülemeyi engelleyebileceğinden insizyonu dikmeyin. Çıplak fareler ameliyattan sonra doğal olarak iyileşebilir. - Hayvanı kızılötesi bir ısı yastığına yerleştirin ve vücut ısısını korumak için laboratuvar mendilleriyle örtün. Hayvanı uyanana ve düzgün hareket edene kadar en az 30-60 dakika izleyin.
- Ağrıyı azaltmak için ilk 48 saat boyunca günde 3 kez deri altına 10 μL buprenorfin hidroklorür (0.3 mg / mL) enjekte edin.
5. Ameliyat sonrası izleme
- Vücut ağırlığını her 3-4 günde bir ölçün.
- Tümör ksenogreftinden gelen iRFP floresan sinyalini her 3-4 günde bir, 700 nm kanalında küçük bir hayvan görüntüleme sisteminde dört duruşta ölçün: sol, sağ, dorsal ve ventral, fareler anestezi altında tutulurken izofluran inhalasyonu ile (akış hızı: 1.5-2 L / dak oksijen% 1.5 izofluran içerir) 2-3 dakika boyunca.
- Ksenogreft kanserinin net floresan yoğunluğunu in vivo yazılım (örneğin, Image Studio) kullanarak ölçün.
- Farelerin göğüs bölgesi için örnekleme penceresi olarak sabit bir dikdörtgen (A1, 200 x 125 piksel) kullanın.
- Dikdörtgen (A1) içindeki farelerin şeklini izlemek ve A1 alanındaki floresan yoğunluğunu (F1) ölçmek için serbest el işlevini kullanın.
- Uyluk bölgesindeki farelerin arka plan floresansını (F2) ölçmek için daha küçük başka bir dikdörtgen (A2, 25 x 40 piksel) kullanın.
- Her farede ksenogreft kanserinin net floresan yoğunluğunu hesaplamak için denklem (1) kullanın:
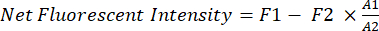 (1)
(1)
Sonuçlar
A549-iRFP MCS'nin Karakterizasyonu
A549-iRFP MCS, kollajen ve santrifüj yardımı ile sferoid mikroplakalarda başarılı bir şekilde kültürlendi. MCS 1 hafta sonra yaklaşık 500 μm çapa ulaştığında, hem A549 hem de A549-iRFP MCS, 3 gün boyunca çeşitli antikanser ilaçlarına ve formülasyonlarına maruz bırakıldı ve daha sonra 4 gün daha ilaçsız büyüme ortamında tutuldu. A549-iRFP MCS, ana A549 hücrelerininkini yakından yansıtan bir yanıt modeli sergiledi. A549 ve A549-iRFP...
Tartışmalar
A549-iRFP MCS'nin yapısı, basit ve yüksek oranda tekrarlanabilir bir laboratuvar prosedürüdür ve birden fazla hücre hattı için MCS oluşumuna çevrilebilir. Santrifüj ve kollajen yardımıyla üretilen MCS, 3-4 gün içinde daha bütünsel ve katı tümör benzeri bir yapı sergiler. Bu yöntem, tipik olarak 2-3 hafta veya küçük tomurcuklanmalar ortaya çıkmaya başlayana kadar daha uzun süreler boyunca ayrılmaz yapılarını koruyan sağlam sferoidlerin oluşumunu sağlar. Santrifüjleme ve kollajen kull...
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Pasifik Üniversitesi'nden SAAG ve SEED hibeleri ile desteklenmiştir. Odyssey Kızılötesi Görüntüleme 205 Sistemine erişim sağladığı için Dr. William Chan'a ve SpectraMax iD3 plaka okuyucusuna erişim sağladığı için Dr. John Livesey'e teşekkür ederiz. Hayvan protokolleri hakkındaki teknik tavsiyeleri için Dr. Melanie Felmlee'ye teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 µL Glass Syringe | Hamilton | Part/REF #80601 | |
| 20 G Needle | Thermo Fisher Scientific Inc. | 14 826D | |
| 96-well Ultra-Low-Attachment Spheroid Microplate | Corning | 15-100-173 | |
| A549-iRFP | Imanis Life Sciences | CL082-STAN | |
| AIN-93M Mature Rodent Diet | Research Diets, Inc. | D10012M | |
| Athymic Nude Mouse | Charles River Laboratories, Inc. | Strain Code: 490; homozygous | |
| BCA | Pierce | 23227 | |
| Buprenorphine Hydrochloride | Patterson Veterinary | NDC Number: 42023-179-05 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9683 | |
| Collagen | Gibco | A1064401 | |
| DMEM | Corning | MT10013CV | |
| Fetal Bovine Serum (FBS) | Cytiva HyClone | SH3039603 | |
| ImageJ | Open source tool (https://imagej.net/ij/) | N/A | |
| Image Studio | LI-COR | Version 5.2 | |
| Isoflurane | Patterson Veterinary | NDC Number: 17033-0091-25 | |
| Ketamine | Patterson Veterinary | NDC Number: 50989-0161-06 | |
| Microscope | Keyence | Model number: BZ-X710 | |
| Matrigel | Corning | CB-40234 | |
| Odyssey Infrared Imaging 205 System | LI-COR | Model number: 9140 | |
| PBS | Corning | MT21040CV | |
| Pearl Trilogy small animal imaging system | LI-COR | Model number: 9430 | |
| Penicillin-Streptomycin | Corning | MT30002CI | |
| Puromycin | Thermo Fisher Scientific Inc. | AAJ67236XF | |
| ReViSP software from MATLAB | Open source tool on Sourceforge (https://sourceforge.net/projects/revisp/) | N/A | |
| Surgical Clips--AutoClip System | Fine Science Tools | 12020-00 | |
| Xylazine | Patterson Veterinary | NDC Number: 61133-6017-01 |
Referanslar
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA Cancer J Clin. 70 (1), 7-30 (2020).
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Travis, W. D., Brambilla, E., Riely, G. J. New pathologic classification of lung cancer: Relevance for clinical practice and clinical trials. J Clin Oncol. 31 (8), 992-1001 (2013).
- Ducote, T. J., et al. Using artificial intelligence to identify tumor microenvironment heterogeneity in non-small cell lung cancers. Lab Invest. 103 (8), 100176 (2023).
- Lim, Z. F., Ma, P. C. Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy. J Hematol Oncol. 12 (1), 134 (2019).
- Wang, D. C., Wang, W., Zhu, B., Wang, X. Lung cancer heterogeneity and new strategies for drug therapy. Annu Rev Pharmacol Toxicol. 58, 531-546 (2018).
- Peterson, J. K., Houghton, P. J. Integrating pharmacology and in vivo cancer models in preclinical and clinical drug development. Eur J Cancer. 40 (6), 837-844 (2004).
- Madero-Visbal, R. A., et al. Bioluminescence imaging correlates with tumor progression in an orthotopic mouse model of lung cancer. Surg Oncol. 21 (1), 23-29 (2012).
- Mclemore, T. L., et al. Novel intrapulmonary model for orthotopic propagation of human lung cancers in athymic nude mice. Cancer Res. 47 (19), 5132-5140 (1987).
- Zanoni, M., et al. 3d tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Semin Cancer Biol. 15 (5), 365-377 (2005).
- Chaicharoenaudomrung, N., Kunhorm, P., Noisa, P. Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. World J Stem Cells. 11 (12), 1065-1083 (2019).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. J Control Release. 164 (2), 192-204 (2012).
- Huang, B. W., Gao, J. Q. Application of 3d cultured multicellular spheroid tumor models in tumor-targeted drug delivery system research. J Control Release. 270, 246-259 (2018).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. J Biotechnol. 148 (1), 3-15 (2010).
- Sethi, P., et al. 3d tumor tissue analogs and their orthotopic implants for understanding tumor-targeting of microenvironment-responsive nanosized chemotherapy and radiation. Nanomedicine. 11 (8), 2013-2023 (2015).
- Valta, M. P., et al. Spheroid culture of lucap 136 patient-derived xenograft enables versatile preclinical models of prostate cancer. Clin Exp Metastasis. 33 (4), 325-337 (2016).
- Huang, Y., et al. Intrapulmonary inoculation of multicellular spheroids to construct an orthotopic lung cancer xenograft model that mimics four clinical stages of non-small cell lung cancer. J Pharmacol Toxicol Methods. , 106885 (2020).
- Lemjabbar-Alaoui, H., Hassan, O. U., Yang, Y. W., Buchanan, P. Lung cancer: Biology and treatment options. Biochim Biophys Acta. 1856 (2), 189-210 (2015).
- Detterbeck, F. C., Boffa, D. J., Kim, A. W., Tanoue, L. T. The eighth edition lung cancer stage classification. Chest. 151 (1), 193-203 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır