Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Konstruktion eines orthotopen Xenotransplantatmodells für nicht-kleinzelligen Lungenkrebs, der das Fortschreiten der Krankheit nachahmt und die Wirkstoffaktivität vorhersagt
In diesem Artikel
Zusammenfassung
In dieser Studie wird ein orthotopes Modell für nicht-kleinzelligen Lungenkrebs (NSCLC) vorgestellt, das auf der intrapulmonalen Inokulation von multizellulären Sphäroiden von fluoreszierenden A549-iRFP-Zellen basiert. Das Modell rekapituliert klinische NSCLC-Stadien und spricht auf Cisplatin an, entsprechend der dynamischen In-vivo-Überwachung der langwelligen Fluoreszenz.
Zusammenfassung
Nicht-kleinzelliger Lungenkrebs (NSCLC) ist eine hochgradig tödliche Erkrankung mit einer komplexen und heterogenen Tumormikroumgebung. Derzeit rekapitulieren gängige Tiermodelle, die auf der subkutanen Inokulation von Krebszellsuspensionen basieren, die Tumormikroumgebung bei NSCLC nicht. Darin beschreiben wir ein murines orthotopes Lungenkrebs-Xenotransplantatmodell, das die intrapulmonale Inokulation von dreidimensionalen multizellulären Sphäroiden (MCS) verwendet. Konkret wurden fluoreszierende humane NSCLC-Zellen (A549-iRFP) 3 Wochen lang in 96-Well-Mikrotiterplatten mit geringer Bindung mit Kollagen kultiviert, um MCS zu bilden, die dann interkostal in die linke Lunge von athymischen Nacktmäusen inokuliert wurden, um das orthotope Lungenkrebsmodell zu etablieren.
Im Vergleich zur ursprünglichen A549-Zelllinie reagierte die MCS der A549-iRFP-Zelllinie ähnlich auf Krebsmedikamente. Das langwellige Fluoreszenzsignal der A549-iRFP-Zellen korrelierte stark mit gängigen Markern des Krebszellwachstums, einschließlich des Sphäroidvolumens, der Zellviabilität und des zellulären Proteinspiegels, und ermöglichte so eine dynamische Überwachung des Krebswachstums in vivo durch Fluoreszenzbildgebung. Nach der Inokulation in Mäuse durchlief das A549-iRFP MCS-Xenotransplantat zuverlässig Phasen, die den klinischen Stadien des NSCLC sehr ähnlich waren, einschließlich der Expansion des Primärtumors, des Auftretens benachbarter Sekundärtumoren und der Metastasen von Krebszellen in die kontralaterale rechte Lunge und entfernte Organe. Darüber hinaus reagierte das Modell auf das Benchmark-Medikament gegen Lungenkrebs, Cisplatin, mit der erwarteten Toxizität und einem langsameren Fortschreiten des Krebses. Daher würde dieses murine orthotope Xenotransplantatmodell von NSCLC als Plattform dienen, um das Fortschreiten der Krankheit zu rekapitulieren und die Entwicklung potenzieller Krebsmedikamente zu erleichtern.
Einleitung
Unter allen onkologischen Erkrankungen verursacht Lungenkrebs nicht nur den höchsten Lebensverlust, sondern fordert auch die zweithöchste Anzahl neuer Patienten pro Jahr in den USA1. Diese verheerende Malignität stellt ein großes Hindernis im modernen Gesundheitswesen dar und erfordert ein tieferes Verständnis ihrer komplizierten Biologie und wirksamere therapeutische Modalitäten2. Nicht-kleinzelliger Lungenkrebs (NSCLC) macht 85 % des Lungenkrebses aus und neigt dazu, sich zu soliden Tumoren zu entwickeln3. Eine der größten Herausforderungen bei Lungenkrebs ist die dynamische und heterogene Tumormikroumgebung, die das Fortschreiten des Krebses und das Ansprechen auf therapeutische Eingriffe tiefgreifend beeinflusst 4,5,6. Ein tieferes Verständnis des Zusammenspiels zwischen Krebszellen und ihrer Mikroumgebung in verschiedenen Stadien des NSCLC erfordert verfeinerte pathologische Modelle, die die histologischen Merkmale des NSCLC-Verlaufs rekapitulieren.
In dieser Hinsicht erweisen sich orthotope Tiermodelle als vielversprechender Weg für die NSCLC-Forschung. Im Gegensatz zu den üblicherweise verwendeten subkutanen Xenotransplantatmodellen7 weisen orthotope Modelle Krebszellen auf, die direkt in das Ursprungsorgan inokuliert werden. Bei Lungenkrebs bedeutet dies, Krebszellen direkt in das Lungengewebe zu implantieren 8,9. Folglich ahmen orthotope Modelle des Lungenkrebses die native Tumormikroumgebung, einschließlich der benachbarten Gewebe, Gefäße und Immunkomponenten, besser nach und verbessern so ihre physiologische und klinische Relevanz.
Dreidimensionale multizelluläre Sphäroide (MCS) stellen einen weiteren vielversprechenden Ansatz dar, um Merkmale der Tumorumgebung zu rekapitulieren. Die meisten Krebsarten zeichnen sich durch ihre komplexe Tumormikroumgebung aus, einschließlich der verschiedenen Zell-Zell-Interaktionen, der extrazellulären Matrix und der Gradienten in Sauerstoff und Nährstoffen10,11. Herkömmlichen 2D-Zellkulturen fehlt die räumliche und strukturelle Komplexität, um diese tumorspezifischen Merkmale zu rekapitulieren12. Im Gegensatz dazu weisen MCS geeigneter Größe eine heterogene Struktur mit einem hypoxischen und nekrotischen Kern auf, der nicht nur die intratumorale Mikroumgebung, sondern auch die physiologische Barriere gegen das Eindringen von Medikamenten rekapituliert, was ein wichtiger Mechanismus der Arzneimittelresistenz in der Krebstherapie ist 13,14,15.
Unter Ausnutzung sowohl der orthotopen Tiermodelle als auch der MCS-Kultivierungstechniken wurden MCS an immungeschwächte Mäuse geimpft, um erfolgreich orthotope Modelle von Brustkrebs und Prostatakrebs zu konstruieren 16,17. Darin berichten wir über die detaillierte Methodik zur Konstruktion und Charakterisierung eines murinen orthotopen Xenotransplantatmodells für Lungenkrebs. Bei dieser Methode wird die intrapulmonale Inokulation von 3D-MCS verwendet, das aus fluoreszierenden menschlichen Lungenkrebszellen (A549-iRFP) gewonnen wird18. Dieses Modell bietet eine außergewöhnliche Möglichkeit, das Fortschreiten von Lungenkrebs in vivo in Stadien zu beobachten, die eng mit den vier klinischen Stadien des NSCLC übereinstimmen. Darüber hinaus sprach der Xenotransplantatkrebs dieses Modells auf das klinisch etablierte Antilungenkrebsmedikament Cisplatin an.
Protokoll
Die Tierstudie wurde mit Genehmigung des Institutional Animal Care and Use Committee (IACUC) an der University of the Pacific durchgeführt (Tierprotokolle 19R10 und 22R10). Für die vorliegende Studie wurden acht männliche athyme Nacktmäuse im Alter von 5-6 Wochen mit einem Gewicht von 20-25 g verwendet, die mit der referenzierten Nagetierdiät gezüchtet und unter pathogenfreien (SPF) Bedingungen gehalten wurden. Käfige, Einstreu und Trinkwasser wurden autoklaviert und regelmäßig gewechselt. Ein Schema der Tumorinokulation bei Mäusen ist in Abbildung 1 dargestellt. In der Materialtabelle finden Sie Einzelheiten zu allen Materialien und Instrumenten, die in diesem Protokoll verwendet werden.
1. Etablierung einer dreidimensionalen MCS von A549-iRFP-Zellen
- Inkubieren Sie A549-iRFP-Zellen (humanes Lungenadenokarzinom) in einer befeuchteten Atmosphäre mit 5 % CO2 bei 37 °C und züchten Sie sie in einem vollständigen Wachstumsmedium DMEM, das 10 % fötales Rinderserum, 1 % Penicillin-Streptomycin und 1 μg/ml Puromycin enthält.
- A549-iRFP-Zellen werden in 96-Well-Mikrotiterplatten mit extrem geringer Bindung und rundem Boden bei einer Aussaatdichte von 4.000 Zellen/Well mit 100 μl vollständigem Wachstumsmedium, ergänzt mit 0,3 % Kollagen, gesät.
- Zentrifugieren Sie die Mikrotiterplatten bei 300 × g für 7 min bei 4 °C, um die MCS-Bildung zu erleichtern. Untersuchen Sie die MCS-Morphologie unter einem Mikroskop, um die Zellaggregation nach der Zentrifugation sicherzustellen.
- Geben Sie nach 48 h 100 μl vollständiges Wachstumsmedium in jede Vertiefung, um ein Gesamtvolumen von 200 μl Wachstumsmedium pro Vertiefung zu erreichen.
- Ersetzen Sie jeden zweiten Tag 100 μl Wachstumsmedium in jeder Vertiefung durch frisches, vollständiges Wachstumsmedium.
2. Charakterisierung des A549-iRFP MCS
- Beobachten und abbilden Sie die MCS-Morphologie mit einem Mikroskop und schätzen Sie das MCS-Volumen durch Simulation mit der referenzierten Software von MATLAB auf der Grundlage der Phasenkontrastmikroskopbilder.
- Öffnen Sie ein MCS-Image in der ImageJ-Software.
- Verwenden Sie die Freihandauswahl, um die Kante des MCS auszuwählen und sie dem ROI-Manager hinzuzufügen.
- Klicken Sie auf Bearbeiten | Auswahl | Maske erstellen.
- Klicken Sie auf Bearbeiten | Invertieren.
- Klicken Sie auf Datei | Speichern unter | Tiff.
- Öffnen Sie die ReViSP-Software.
- Öffnen Sie das gespeicherte TIFF-Bild, indem Sie auf Durchsuchen klicken.
- Klicken Sie auf Start , um die MCS-Simulation abzuschließen.
- Messen Sie das iRFP-Fluoreszenzsignal mit dem Infrarot-Bildgebungssystem am 700-nm-Kanal und quantifizieren Sie das Fluoreszenzsignal mit Hilfe von Software (z. B. Image Studio).
- Öffnen Sie die Image Studio-Software.
- Wählen Sie auf der Registerkarte Kanäle 700 und Intensität = 5 aus.
- Wählen Sie auf der Registerkarte "Scansteuerung " die Option "84 μm", "Mittel", "0,0 mm" und "Bild spiegeln" aus. Behalten Sie alles andere als Standard bei.
- Klicken Sie auf Start , um den Scanvorgang zu starten.
- Bewerten und quantifizieren Sie die Zellviabilität mit dem 3D-Zellviabilitätsassay gemäß dem Herstellerprotokoll.
- Bewerten und quantifizieren Sie zelluläre Proteine mit dem BCA-Assay gemäß dem Herstellerprotokoll.
3. MCS-Selektion für die Tumorinokulation
HINWEIS: Nachdem MCS in sphäroide Mikroplatten ausgesät und 2-3 Wochen lang mit regelmäßigem Austausch des Wachstumsmediums gezüchtet wurden, wählen Sie MCS mit den folgenden geeigneten Eigenschaften für die Tumorinokulation aus.
- Betrachten Sie die MCS-Morphologie unter dem Mikroskop und wählen Sie MCS mit einer runden Form mit insgesamt glatten Kanten, aber mit 5-10 rauen Knospen (Pfeile in Abbildung 2F) und einem Durchmesser im Bereich von 700-800 μm.
- Messen Sie die iRFP-Fluoreszenz (siehe Schritt 2.2) und wählen Sie den MCS aus, dessen Fluoreszenzsignale innerhalb einer Standardabweichung vom Durchschnitt liegen.
4. Intrapulmonale MCS-Inokulation
HINWEIS: Verwenden Sie 70%iges Isopropylalkoholspray, um die Operationsstation und die Werkzeuge zu reinigen, bevor Sie die Tiere anfassen.
- Anästhesie jeder Maus mit einer IP-Injektion von 80 mg/kg Ketamin und 12 mg/kg Xylazin; Kneifen Sie die Füße der Maus mit einer Pinzette zusammen, um eine vollständige Betäubung zu gewährleisten.
- Injizieren Sie 10 μl Buprenorphinhydrochlorid (0,3 mg/ml) subkutan, um die Schmerzen zu lindern.
- Tragen Sie eine Augensalbe auf die Augen auf, um Trockenheit zu verhindern.
- Bringen Sie die Maus in eine dorsale Haltung und sichern Sie die Gliedmaßen mit Bändern in einer Streckposition.
- Sterilisieren Sie die hintere Haut mit Jod- und Alkoholtupferstäbchen.
- Schneiden Sie einen 0,5-1 cm langen Schnitt mit einer chirurgischen Schere auf der linken Rückseite (Abbildung 1B). Trennen Sie das Muskel- und Fettgewebe vorsichtig mit einer Pinzette, bis die Brustwand und die Lungenbewegung sichtbar sind.
- Übertragen Sie ein ausgewähltes MCS von einer Mikroplatte mit einer Pipette in eine Petrischale aus Glas, die eiskaltes PBS enthält.
- Befestigen Sie eine 20-g-Nadel an einer 100-μl-Glasspritze, kühlen Sie sie auf Eis vor und ziehen Sie 20 μl einer vorgekühlten Mischung aus PBS und Matrigel (1:1 v/v).
- Verwenden Sie die Spritze, um schnell ein MCS aus der Petrischale in einer minimalen Menge PBS-Matrigel-Mischung zu aspirieren, wobei Sie das MCS im Metallteil der Nadel belassen.
HINWEIS: Halten Sie die Spritze und den Kolben fest im Griff, um zu verhindern, dass das MCS aus der Nadel rutscht. - Führen Sie die Nadel vorsichtig vertikal zwischen zwei Rippenknochen bis zu einer Tiefe von ~3 mm ein und injizieren Sie langsam die gesamte 20 μl PBS- und Matrigel-Mischung, die das MCS enthält.
HINWEIS: Vermeiden Sie übermäßige Krafteinwirkung während des Einführens, um Schäden an Lunge, Gefäßen oder Herz zu vermeiden. - Entfernen Sie vorsichtig die Nadel und tragen Sie eine dreifache antibiotische Salbe auf die Wunde auf.
- Versiegeln Sie den Schnitt mit chirurgischen Klammern, die nach 2 Wochen entfernt werden sollen.
HINWEIS: Naschen Sie den Schnitt nicht, da die Nahtlinien die Fluoreszenzbildgebung beeinträchtigen können. Die nackten Mäuse sind in der Lage, nach der Operation auf natürliche Weise zu heilen. - Legen Sie das Tier auf ein Infrarot-Wärmekissen und decken Sie es mit Labortüchern ab, um die Körpertemperatur zu halten. Überwachen Sie das Tier mindestens 30-60 Minuten lang, bis es aufwacht und sich richtig bewegt.
- Injizieren Sie in den ersten 48 Stunden 3x täglich 10 μl Buprenorphinhydrochlorid (0,3 mg/ml) subkutan, um die Schmerzen zu lindern.
5. Postoperative Überwachung
- Messen Sie das Körpergewicht alle 3-4 Tage.
- Messen Sie das iRFP-Fluoreszenzsignal des Tumor-Xenotransplantats alle 3-4 Tage auf einem Kleintier-Bildgebungssystem im 700-nm-Kanal in vier Haltungen: links, rechts, dorsal und ventral, während die Mäuse durch Isofluran-Inhalation (Flussrate: 1,5-2 l/min Sauerstoff mit 1,5 % Isofluran) über 2-3 Minuten unter Narkose gehalten werden.
- Quantifizieren Sie die Netto-Fluoreszenzintensität des Xenotransplantat-Krebses in vivo mit Hilfe von Software (z. B. Image Studio).
- Verwenden Sie ein festes Rechteck (A1, 200 x 125 Pixel) als Probenahmefenster für den Brustbereich der Mäuse.
- Mit der Freihandfunktion können Sie die Form der Mäuse innerhalb des Rechtecks (A1) nachzeichnen und die Fluoreszenzintensität (F1) im Bereich A1 messen.
- Verwenden Sie ein weiteres kleineres Rechteck (A2, 25 x 40 Pixel), um die Hintergrundfluoreszenz (F2) der Mäuse im Oberschenkelbereich zu messen.
- Verwenden Sie Gleichung (1), um die Netto-Fluoreszenzintensität des Xenotransplantat-Krebses bei jeder Maus zu berechnen:
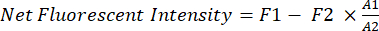 (1)
(1)
Ergebnisse
Charakterisierung von A549-iRFP MCS
A549-iRFP MCS wurden erfolgreich in sphäroiden Mikrotiterplatten mit Hilfe von Kollagen und Zentrifugation kultiviert. Als MCS nach 1 Woche einen Durchmesser von etwa 500 μm erreichte, wurden sowohl A549 als auch A549-iRFP MCS 3 Tage lang einer Vielzahl von Krebsmedikamenten und -formulierungen ausgesetzt und dann für weitere 4 Tage in einem arzneimittelfreien Wachstumsmedium gehalten. Das A549-iRFP MCS zeigte ein Reaktionsmuster, das dem der A549-Elternzellen se...
Diskussion
Die Konstruktion von A549-iRFP MCS ist ein unkompliziertes und hochgradig reproduzierbares Laborverfahren und kann auf die MCS-Bildung für mehrere Zelllinien übertragen werden. Das mit Hilfe von Zentrifugation und Kollagen erzeugte MCS weist innerhalb von 3-4 Tagen eine integralere und solidere, tumorähnliche Struktur auf. Diese Methode gewährleistet die Bildung robuster Sphäroide, die ihre integrale Struktur über längere Zeiträume beibehalten, typischerweise 2-3 Wochen oder sogar länger, bis kleine Knospen zu s...
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Diese Arbeit wurde durch SAAG- und SEED-Stipendien der University of the Pacific unterstützt. Wir danken Dr. William Chan für die Gewährung des Zugangs zum Odyssey Infrared Imaging 205 System und Dr. John Livesey für den Zugang zum SpectraMax iD3 Plattenleser. Wir danken Dr. Melanie Felmlee für die fachliche Beratung zu den Tierprotokollen.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 µL Glass Syringe | Hamilton | Part/REF #80601 | |
| 20 G Needle | Thermo Fisher Scientific Inc. | 14 826D | |
| 96-well Ultra-Low-Attachment Spheroid Microplate | Corning | 15-100-173 | |
| A549-iRFP | Imanis Life Sciences | CL082-STAN | |
| AIN-93M Mature Rodent Diet | Research Diets, Inc. | D10012M | |
| Athymic Nude Mouse | Charles River Laboratories, Inc. | Strain Code: 490; homozygous | |
| BCA | Pierce | 23227 | |
| Buprenorphine Hydrochloride | Patterson Veterinary | NDC Number: 42023-179-05 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9683 | |
| Collagen | Gibco | A1064401 | |
| DMEM | Corning | MT10013CV | |
| Fetal Bovine Serum (FBS) | Cytiva HyClone | SH3039603 | |
| ImageJ | Open source tool (https://imagej.net/ij/) | N/A | |
| Image Studio | LI-COR | Version 5.2 | |
| Isoflurane | Patterson Veterinary | NDC Number: 17033-0091-25 | |
| Ketamine | Patterson Veterinary | NDC Number: 50989-0161-06 | |
| Microscope | Keyence | Model number: BZ-X710 | |
| Matrigel | Corning | CB-40234 | |
| Odyssey Infrared Imaging 205 System | LI-COR | Model number: 9140 | |
| PBS | Corning | MT21040CV | |
| Pearl Trilogy small animal imaging system | LI-COR | Model number: 9430 | |
| Penicillin-Streptomycin | Corning | MT30002CI | |
| Puromycin | Thermo Fisher Scientific Inc. | AAJ67236XF | |
| ReViSP software from MATLAB | Open source tool on Sourceforge (https://sourceforge.net/projects/revisp/) | N/A | |
| Surgical Clips--AutoClip System | Fine Science Tools | 12020-00 | |
| Xylazine | Patterson Veterinary | NDC Number: 61133-6017-01 |
Referenzen
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA Cancer J Clin. 70 (1), 7-30 (2020).
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Travis, W. D., Brambilla, E., Riely, G. J. New pathologic classification of lung cancer: Relevance for clinical practice and clinical trials. J Clin Oncol. 31 (8), 992-1001 (2013).
- Ducote, T. J., et al. Using artificial intelligence to identify tumor microenvironment heterogeneity in non-small cell lung cancers. Lab Invest. 103 (8), 100176 (2023).
- Lim, Z. F., Ma, P. C. Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy. J Hematol Oncol. 12 (1), 134 (2019).
- Wang, D. C., Wang, W., Zhu, B., Wang, X. Lung cancer heterogeneity and new strategies for drug therapy. Annu Rev Pharmacol Toxicol. 58, 531-546 (2018).
- Peterson, J. K., Houghton, P. J. Integrating pharmacology and in vivo cancer models in preclinical and clinical drug development. Eur J Cancer. 40 (6), 837-844 (2004).
- Madero-Visbal, R. A., et al. Bioluminescence imaging correlates with tumor progression in an orthotopic mouse model of lung cancer. Surg Oncol. 21 (1), 23-29 (2012).
- Mclemore, T. L., et al. Novel intrapulmonary model for orthotopic propagation of human lung cancers in athymic nude mice. Cancer Res. 47 (19), 5132-5140 (1987).
- Zanoni, M., et al. 3d tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Semin Cancer Biol. 15 (5), 365-377 (2005).
- Chaicharoenaudomrung, N., Kunhorm, P., Noisa, P. Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. World J Stem Cells. 11 (12), 1065-1083 (2019).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. J Control Release. 164 (2), 192-204 (2012).
- Huang, B. W., Gao, J. Q. Application of 3d cultured multicellular spheroid tumor models in tumor-targeted drug delivery system research. J Control Release. 270, 246-259 (2018).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. J Biotechnol. 148 (1), 3-15 (2010).
- Sethi, P., et al. 3d tumor tissue analogs and their orthotopic implants for understanding tumor-targeting of microenvironment-responsive nanosized chemotherapy and radiation. Nanomedicine. 11 (8), 2013-2023 (2015).
- Valta, M. P., et al. Spheroid culture of lucap 136 patient-derived xenograft enables versatile preclinical models of prostate cancer. Clin Exp Metastasis. 33 (4), 325-337 (2016).
- Huang, Y., et al. Intrapulmonary inoculation of multicellular spheroids to construct an orthotopic lung cancer xenograft model that mimics four clinical stages of non-small cell lung cancer. J Pharmacol Toxicol Methods. , 106885 (2020).
- Lemjabbar-Alaoui, H., Hassan, O. U., Yang, Y. W., Buchanan, P. Lung cancer: Biology and treatment options. Biochim Biophys Acta. 1856 (2), 189-210 (2015).
- Detterbeck, F. C., Boffa, D. J., Kim, A. W., Tanoue, L. T. The eighth edition lung cancer stage classification. Chest. 151 (1), 193-203 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten