JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
비소세포폐암의 기형외형 이종이식 모델 구축: 질병 진행 모방 및 약물 활성성 예측
요약
이 연구는 형광 A549-iRFP 세포의 다세포 스페로이드의 폐 내 접종에 기반한 비소세포폐암(NSCLC) 모델을 제시합니다. 이 모델은 임상 비소세포폐암(NSCLC) 단계를 요약하고 시스플라틴(cisplatin)에 반응하며, 이는 장파장 형광의 동적 생체 내 모니터링에 따른 것입니다.
초록
비소세포폐암(NSCLC)은 복잡하고 이질적인 종양 미세환경을 가진 매우 치명적인 질병입니다. 현재 암세포 현탁액의 피하 접종에 기초한 일반적인 동물 모델은 NSCLC에서 종양 미세환경을 재현하지 못합니다. 여기에서는 3차원 다세포 스페로이드(MCS)의 폐 내 접종을 사용하는 쥐 기형외과 폐암 이종이식 모델을 설명합니다. 구체적으로, 형광 인간 비소세포폐암(A549-iRFP)을 콜라겐이 함유된 저부착 96웰 마이크로플레이트에서 3주 동안 배양하여 MCS를 형성한 후, 흉선성 누드 마우스의 왼쪽 폐에 늑간으로 접종하여 기공성 폐암 모델을 확립했습니다.
원래의 A549 세포주와 비교했을 때, A549-iRFP 세포주의 MCS는 항암제에 유사하게 반응하였다. A549-iRFP 세포의 장파장 형광 신호는 스페로이드 부피, 세포 생존율 및 세포 단백질 수준을 포함한 암세포 성장의 일반적인 마커와 강한 상관관계가 있어 형광 이미징을 통해 생체 내에서 암 성장을 동적으로 모니터링할 수 있습니다. 마우스에 접종한 후 A549-iRFP MCS 이종이식은 원발성 종양의 확장, 인접 이차성 종양의 출현, 암세포의 반대쪽 우측 폐 및 원격 장기로의 전이를 포함하여 비소세포폐암의 임상 단계와 매우 유사한 단계를 안정적으로 진행했습니다. 또한, 이 모델은 벤치마크 항폐암 약물인 시스플라틴(cisplatin)에 대해 예상되는 독성과 더 느린 암 진행으로 반응했습니다. 따라서 비소세포폐암(NSCLC)의 이 쥐 기형외생식물(murine orthotopic xenograft) 모델은 질병의 진행을 요약하고 잠재적인 항암제의 개발을 촉진하는 플랫폼 역할을 할 것입니다.
서문
모든 종양학적 질환 중에서 폐암은 가장 많은 생명을 앗아갈 뿐만 아니라 미국에서 매년 두 번째로 많은 신규 환자를 청구합니다1. 이 파괴적인 악성 종양은 현대 의료의 주요 장애물로 작용하고 있으며, 이 질환의 복잡한 생물학에 대한 더 깊은 이해와 보다 효과적인 치료 방식을 요구하고 있다2. 비소세포폐암(NSCLC)은 폐암의 85%를 차지하며 고형암으로 발전하는 경향이 있다3. 폐암에서 가장 중요한 과제 중 하나는 암의 진행과 치료적 개입에 대한 반응에 지대한 영향을 미치는 역동적이고 이질적인 종양 미세환경입니다 4,5,6. 비소세포폐암(NSCLC)의 여러 단계에서 암세포와 암세포의 미세환경 사이의 상호작용에 대한 심층적인 이해를 위해서는 비소세포폐암(NSCLC) 진행의 조직학적 특징을 요약하는 정교한 병리학적 모델이 필요합니다.
이와 관련하여, orthotopic 동물 모델은 NSCLC 연구를 위한 유망한 방법으로 부상하고 있습니다. 일반적으로 사용되는 피하 이종이식 모델7과 달리, 정형외형 모델은 기원 기관에 직접 접종되는 암세포를 특징으로 한다. 폐암의 경우, 이는 암세포를 폐 조직에 직접 이식하는 것을 의미한다 8,9. 결과적으로, 폐암의 orthotopic 모델은 인접 조직, 혈관 및 면역 구성 요소를 포함한 자연 종양 미세 환경을 더 잘 모방하여 생리학적 및 임상적 관련성을 향상시킵니다.
3차원 다세포 스페로이드(MCS)는 종양 환경의 특징을 재현하는 또 다른 유망한 접근법입니다. 대부분의 암은 다양한 세포-세포 상호 작용, 세포외 기질, 산소 및 영양소의 구배를 포함한 복잡한 종양 미세환경으로 특징지어진다10,11. 기존의 2D 세포 배양은 이러한 종양 특이적 특징을 재현할 수 있는 공간적, 구조적 복잡성이 부족합니다12. 이에 반해, 적절한 크기의 MCS는 저산소성 및 괴사성 코어를 가진 이질적인 구조를 특징으로 하며, 이는 종양 내 미세환경뿐만 아니라 항암 치료에서 약물 내성의 주요 기전인 약물 침투에 대한 생리적 장벽을 재현합니다 13,14,15.
양능성 동물 모델과 MCS 배양 기법을 모두 활용하여 면역력이 저하된 마우스에 MCS를 접종하여 유방암 및 전립선암의 정형외과 모델을 성공적으로 구축했습니다16,17. 여기에서는 폐암의 쥐 기형외생식물 이종이식 모델을 구축하고 특성화하기 위한 상세한 방법론을 보고한다. 이 방법은 형광 인간 폐암 세포(A549-iRFP)18에서 유래한 3D MCS의 폐내 접종을 사용합니다. 이 모델은 비소세포폐암(NSCLC)의 4가지 임상 단계와 밀접하게 평행한 단계를 통해 폐암의 생체 내 진행을 관찰할 수 있는 탁월한 기회를 제공합니다. 또한, 이 모델의 이종이식 암은 임상적으로 확립된 항폐암 약물인 시스플라틴(cisplatin)에 반응했습니다.
프로토콜
동물 연구는 University of the Pacific의 IACUC(Institutional Animal Care and Use Committee)의 승인을 받아 수행되었습니다(동물 프로토콜 19R10 및 22R10). 본 연구에는 체중 20-25g의 5-6주 된 8마리의 수컷 흉선성 누드 마우스가 참조된 설치류 식단으로 사육되고 병원체가 없는 (SPF) 조건에서 수용되었습니다. 케이지, 침구 및 식수는 고압 멸균되어 정기적으로 교체되었습니다. 마우스의 종양 접종 개략도는 그림 1에 나와 있습니다. 이 프로토콜에 사용된 모든 재료 및 기기와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. A549-iRFP 세포의 3차원 MCS 확립
- A549-iRFP 세포(인간 폐 선암)를 37°C에서 5%CO2 로 가습된 분위기에서 배양하고 10% 소 태아 혈청, 1% 페니실린-스트렙토마이신 및 1μg/mL 퓨로마이신을 포함하는 완전 성장 배지 DMEM에서 성장시킵니다.
- 0.3% 콜라겐이 보충된 100μL의 완전 성장 배지를 사용하여 4,000 cells/well의 파종 밀도로 A549-iRFP 세포를 96-well ultra-low attachment, round-bottom spheroid microplate에 파종합니다.
- MCS 형성을 용이하게 하기 위해 300× g 에서 4°C에서 7분 동안 마이크로플레이트를 원심분리합니다. 원심분리 후 세포 응집을 확인하기 위해 현미경으로 MCS 형태를 검사합니다.
- 48시간 후 각 웰에 100μL의 완전 성장 배지를 추가하여 웰당 총 200μL의 성장 배지 부피를 얻습니다.
- 각 웰에 있는 100μL의 성장 배지를 이틀에 한 번씩 새로운 완전 성장 배지로 교체합니다.
2. A549-iRFP MCS의 특성 분석
- 현미경을 사용하여 MCS 형태를 관찰 및 이미지화하고, 위상차 현미경 이미지를 기반으로 MATLAB에서 참조된 소프트웨어로 시뮬레이션을 통해 MCS 부피를 추정할 수 있습니다.
- ImageJ 소프트웨어에서 하나의 MCS 이미지를 엽니다.
- 자유형 선택을 사용하여 MCS의 가장자리를 선택하고 ROI Manager에 추가합니다.
- Edit(편집) | 선택 | 마스크 만들기를 클릭합니다.
- Edit(편집) | 반전.
- File(파일) | 다른 이름으로 저장 | 티파니.
- ReViSP 소프트웨어를 엽니다.
- 찾아보기를 클릭하여 저장된 TIFF 이미지를 엽니다.
- 시작을 클릭하여 MCS 시뮬레이션을 완료합니다.
- 700nm 채널에서 적외선 이미징 시스템을 사용하여 iRFP 형광 신호를 측정하고 소프트웨어(예: Image Studio)를 사용하여 형광 신호를 정량화합니다.
- Image Studio 소프트웨어를 엽니다.
- 채널 탭에서 700 및 강도 = 5를 선택합니다.
- Scan Controls(스캔 컨트롤) 탭에서 84 μm, Medium(중간), 0.0 mm(0.0 mm) 및 Flip Image(이미지 대칭 이동)를 선택합니다. 다른 모든 항목을 기본값으로 유지합니다.
- 딸깍 하는 소리 스타트 스캔을 시작합니다.
- 공급업체 프로토콜에 따라 3D cell viability assay를 사용하여 세포 생존율을 평가하고 정량화합니다.
- 공급업체 프로토콜에 따라 BCA Assay를 사용하여 세포 단백질을 평가하고 정량화합니다.
3. 종양 접종을 위한 MCS 선택
참고: MCS를 스페로이드 마이크로플레이트에 파종하고 정기적인 성장 배지 교환으로 2-3주 동안 성장시킨 후, 종양 접종에 적합한 특성을 가진 MCS를 선택하십시오.
- 현미경으로 MCS 형태를 관찰하고 전체적으로 가장자리가 매끄럽지만 5-10개의 거친 싹( 그림 2F의 화살표)과 직경이 700-800 μm 범위 내에 있는 둥근 모양의 MCS를 선택합니다.
- iRFP 형광을 측정하고(2.2단계 참조) 형광 신호가 평균의 1 표준 편차 내에 있는 MCS를 선택합니다.
4. 폐내 MCS 접종
알림: 동물을 다루기 전에 70% 이소프로필 알코올 스프레이를 사용하여 수술 스테이션과 도구를 청소하십시오.
- 80mg/kg 케타민과 12mg/kg 자일라진의 IP 주사로 각 마우스를 마취합니다. 완전한 마취를 보장하기 위해 집게로 쥐 발을 집습니다.
- 부프레노르핀 염산염(0.3mg/mL) 10μL를 피하로 주사하여 통증을 줄입니다.
- 눈의 건조를 방지하기 위해 안과 연고를 바르십시오.
- 마우스를 등쪽 자세로 놓고 테이프로 팔다리를 스트레칭 위치에 고정합니다.
- 요오드와 알코올 면봉으로 뒷 피부를 살균합니다.
- 왼쪽 뒷면을 수술용 가위로 사용하여 0.5-1cm 절개 부위를 자릅니다(그림 1B). 흉벽과 폐의 움직임이 보일 때까지 집게를 조심스럽게 사용하여 근육과 지방 조직을 분리합니다.
- 피펫을 사용하여 마이크로플레이트에서 선택한 MCS 하나를 얼음처럼 차가운 PBS가 들어 있는 유리 페트리 접시에 옮깁니다.
- 100μL 유리 주사기에 20G 바늘을 부착하고 얼음으로 예냉한 다음 PBS와 Matrigel의 사전 냉각된 혼합물 20μL(1:1v/v)를 그립니다.
- 주사기를 사용하여 페트리 접시에서 최소한의 PBS-Matrigel 혼합물로 MCS 하나를 빠르게 흡입하여 MCS를 바늘의 금속 부분에 유지합니다.
알림: MCS가 바늘에서 미끄러지지 않도록 주사기와 플런저를 단단히 잡으십시오. - 두 갈비뼈 사이에 바늘을 ~3mm 깊이까지 수직으로 부드럽게 삽입하고 MCS가 포함된 20μL PBS와 Matrigel 혼합물을 모두 천천히 주입합니다.
알림: 폐, 혈관 조직 또는 심장의 손상을 방지하기 위해 삽입하는 동안 과도한 힘을 가하지 마십시오. - 바늘을 조심스럽게 제거하고 상처 부위에 삼중 항생제 연고를 바릅니다.
- 절개 부위를 수술용 클립으로 봉합하고 2주 후에 제거합니다.
참고: 봉합사 라인이 형광 이미징을 방해할 수 있으므로 절개 부위를 봉합하지 마십시오. 벌거벗은 쥐는 수술 후 자연적으로 치유 할 수 있습니다. - 동물을 적외선 열 패드에 놓고 체온을 유지하기 위해 실험실 물티슈로 덮습니다. 동물이 깨어나 제대로 움직일 때까지 최소 30-60분 동안 동물을 모니터링하십시오.
- 통증을 줄이기 위해 처음 48시간 동안 하루에 3번 부프레노르핀 염산염(0.3mg/mL) 10μL를 피하로 주사합니다.
5. 수술 후 모니터링
- 3-4일마다 체중을 측정하십시오.
- 700nm 채널의 소동물 이미징 시스템에서 3-4일마다 왼쪽, 오른쪽, 등쪽, 배쪽의 네 가지 자세로 종양 이종이식의 iRFP 형광 신호를 측정하고, 마우스는 2-3분에 걸쳐 이소플루란 흡입(유속: 1.5% 이소플루란을 함유한 1.5-2L/min 산소)으로 마취 상태를 유지합니다.
- 소프트웨어(예: Image Studio)를 사용하여 생체 내 이종이식 암의 순 형광 강도를 정량화합니다.
- 고정 사각형(A1, 200 x 125 픽셀)을 마우스의 가슴 영역에 대한 샘플링 창으로 사용합니다.
- free-hand 함수를 사용하여 사각형(A1) 내에서 마우스의 모양을 추적하고 영역 A1의 형광 강도(F1)를 측정합니다.
- 다른 작은 사각형(A2, 25 x 40 픽셀)을 사용하여 허벅지 영역에 있는 마우스의 배경 형광(F2)을 측정합니다.
- 방정식 (1)을 사용하여 각 마우스에서 이종이식 암의 순 형광 강도를 계산합니다.
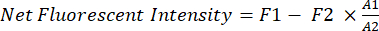 (1)
(1)
결과
A549-iRFP MCS의 특성 분석
A549-iRFP MCS는 콜라겐 및 원심분리의 도움으로 스페로이드 마이크로플레이트에서 성공적으로 배양되었습니다. MCS가 1주일 후 직경이 약 500μm에 도달했을 때, A549 및 A549-iRFP MCS는 모두 다양한 항암제 및 제형에 3일 동안 노출된 후 약물이 없는 성장 배지에서 추가로 4일 동안 유지되었습니다. A549-iRFP MCS는 모세포인 A549 세포의 반응 패턴과 매우 흡사한 반응 패턴?...
토론
A549-iRFP MCS의 구축은 간단하고 재현성이 높은 실험실 절차이며 여러 세포주에 대한 MCS 형성으로 전환될 수 있습니다. 원심분리와 콜라겐의 도움으로 생성된 MCS는 3-4일 이내에 더 통합적이고 고형 종양과 같은 구조를 나타냅니다. 이 방법은 장기간, 일반적으로 2-3주 또는 작은 싹이 나오기 시작할 때까지 더 긴 기간 동안 일체형 구조를 유지하는 강력한 스페로이드의 형성을 보장합니다. 원심분리?...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 SAAG와 퍼시픽 대학교(University of the Pacific)의 SEED 장학금으로 지원되었습니다. Odyssey Infrared Imaging 205 시스템에 대한 액세스 권한을 부여해 주신 William Chan 박사와 SpectraMax iD3 플레이트 리더에 대한 액세스 권한을 부여해 주신 John Livesey 박사에게 감사드립니다. 동물 프로토콜에 대한 기술적 조언을 해주신 Melanie Felmlee 박사님께 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 µL Glass Syringe | Hamilton | Part/REF #80601 | |
| 20 G Needle | Thermo Fisher Scientific Inc. | 14 826D | |
| 96-well Ultra-Low-Attachment Spheroid Microplate | Corning | 15-100-173 | |
| A549-iRFP | Imanis Life Sciences | CL082-STAN | |
| AIN-93M Mature Rodent Diet | Research Diets, Inc. | D10012M | |
| Athymic Nude Mouse | Charles River Laboratories, Inc. | Strain Code: 490; homozygous | |
| BCA | Pierce | 23227 | |
| Buprenorphine Hydrochloride | Patterson Veterinary | NDC Number: 42023-179-05 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9683 | |
| Collagen | Gibco | A1064401 | |
| DMEM | Corning | MT10013CV | |
| Fetal Bovine Serum (FBS) | Cytiva HyClone | SH3039603 | |
| ImageJ | Open source tool (https://imagej.net/ij/) | N/A | |
| Image Studio | LI-COR | Version 5.2 | |
| Isoflurane | Patterson Veterinary | NDC Number: 17033-0091-25 | |
| Ketamine | Patterson Veterinary | NDC Number: 50989-0161-06 | |
| Microscope | Keyence | Model number: BZ-X710 | |
| Matrigel | Corning | CB-40234 | |
| Odyssey Infrared Imaging 205 System | LI-COR | Model number: 9140 | |
| PBS | Corning | MT21040CV | |
| Pearl Trilogy small animal imaging system | LI-COR | Model number: 9430 | |
| Penicillin-Streptomycin | Corning | MT30002CI | |
| Puromycin | Thermo Fisher Scientific Inc. | AAJ67236XF | |
| ReViSP software from MATLAB | Open source tool on Sourceforge (https://sourceforge.net/projects/revisp/) | N/A | |
| Surgical Clips--AutoClip System | Fine Science Tools | 12020-00 | |
| Xylazine | Patterson Veterinary | NDC Number: 61133-6017-01 |
참고문헌
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA Cancer J Clin. 70 (1), 7-30 (2020).
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Travis, W. D., Brambilla, E., Riely, G. J. New pathologic classification of lung cancer: Relevance for clinical practice and clinical trials. J Clin Oncol. 31 (8), 992-1001 (2013).
- Ducote, T. J., et al. Using artificial intelligence to identify tumor microenvironment heterogeneity in non-small cell lung cancers. Lab Invest. 103 (8), 100176 (2023).
- Lim, Z. F., Ma, P. C. Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy. J Hematol Oncol. 12 (1), 134 (2019).
- Wang, D. C., Wang, W., Zhu, B., Wang, X. Lung cancer heterogeneity and new strategies for drug therapy. Annu Rev Pharmacol Toxicol. 58, 531-546 (2018).
- Peterson, J. K., Houghton, P. J. Integrating pharmacology and in vivo cancer models in preclinical and clinical drug development. Eur J Cancer. 40 (6), 837-844 (2004).
- Madero-Visbal, R. A., et al. Bioluminescence imaging correlates with tumor progression in an orthotopic mouse model of lung cancer. Surg Oncol. 21 (1), 23-29 (2012).
- Mclemore, T. L., et al. Novel intrapulmonary model for orthotopic propagation of human lung cancers in athymic nude mice. Cancer Res. 47 (19), 5132-5140 (1987).
- Zanoni, M., et al. 3d tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Semin Cancer Biol. 15 (5), 365-377 (2005).
- Chaicharoenaudomrung, N., Kunhorm, P., Noisa, P. Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. World J Stem Cells. 11 (12), 1065-1083 (2019).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. J Control Release. 164 (2), 192-204 (2012).
- Huang, B. W., Gao, J. Q. Application of 3d cultured multicellular spheroid tumor models in tumor-targeted drug delivery system research. J Control Release. 270, 246-259 (2018).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. J Biotechnol. 148 (1), 3-15 (2010).
- Sethi, P., et al. 3d tumor tissue analogs and their orthotopic implants for understanding tumor-targeting of microenvironment-responsive nanosized chemotherapy and radiation. Nanomedicine. 11 (8), 2013-2023 (2015).
- Valta, M. P., et al. Spheroid culture of lucap 136 patient-derived xenograft enables versatile preclinical models of prostate cancer. Clin Exp Metastasis. 33 (4), 325-337 (2016).
- Huang, Y., et al. Intrapulmonary inoculation of multicellular spheroids to construct an orthotopic lung cancer xenograft model that mimics four clinical stages of non-small cell lung cancer. J Pharmacol Toxicol Methods. , 106885 (2020).
- Lemjabbar-Alaoui, H., Hassan, O. U., Yang, Y. W., Buchanan, P. Lung cancer: Biology and treatment options. Biochim Biophys Acta. 1856 (2), 189-210 (2015).
- Detterbeck, F. C., Boffa, D. J., Kim, A. W., Tanoue, L. T. The eighth edition lung cancer stage classification. Chest. 151 (1), 193-203 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유