Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microscopie de la force atomique Enquêtes sur la reconnaissance des lésions de l'ADN dans la réparation de l'excision des nucléotides
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Here, the study of different DNA lesion recognition approaches via single molecule AFM imaging is demonstrated with the nucleotide excision repair system as an example. The procedures of DNA and protein sample preparations and experimental as well as analytical details for the AFM experiments are described.
Résumé
AFM imaging is a powerful technique for the study of protein-DNA interactions. This single molecule method allows the simultaneous resolution of different molecules and molecular assemblies in a heterogeneous sample. In the particular context of DNA interacting protein systems, different protein complex forms and their corresponding binding positions on target sites containing DNA fragments can thus be distinguished. Here, an application of AFM to the study of DNA lesion recognition in the prokaryotic and eukaryotic nucleotide excision DNA repair (NER) systems is presented. The procedures of DNA and protein sample preparations are described and experimental as well as analytical details of the experiments are provided. The data allow important conclusions on the strategies by which target site verification may be achieved by the NER proteins. Interestingly, they indicate different approaches of lesion recognition and identification for the eukaryotic NER system, depending on the type of lesion. Furthermore, distinct structural properties of the two different helicases involved in prokaryotic and eukaryotic NER result in and explain the different strategies observed for these two systems. Importantly, these experimental and analytical approaches can be applied not only to the study of DNA repair but also very similarly to other DNA interacting protein systems such as those involved in replication or transcription processes.
Introduction
La microscopie à force atomique (AFM) est une technique puissante pour l'analyse des interactions protéine-ADN 1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 . Il ne nécessite que de faibles quantités de matériel d'échantillonnage pour visualiser directement des échantillons hétérogènes avec une résolution au niveau de la molécule unique. L'hétérogénéité peut résulter de différents états conformationnels ou oligomères d'une protéine. En particulier, dans le contexte des échantillons de protéines-ADN, les complexes de protéines peuvent présenter différentes stœchiométries et / ou conformations induites par la liaison de l'ADN en général ou se liant à un site cible spécifique dans l'ADN. Les échantillons hétérogènes peuvent également contenir deux (ou plus) différents types de protéines et différents complexes de protéinesLes formes ( par exemple , constituées d'un seul type de protéines par rapport aux complexes hétéromères) peuvent interagir différemment avec l'ADN. Les études décrites ici exploitent l'imagerie AFM dans l'air sur des échantillons statiques et secs de protéines de réparation d'ADN liées à des fragments d'ADN longs (~ 900 paires de bases, pb) qui contiennent une lésion, ce qui représente une cible de ces protéines. La haute résolution moléculaire de l'AFM permet la distinction entre différents types de complexes de protéines et de déterminer les positions de liaison des protéines sur les fragments d'ADN. Fait important, les lésions sont introduites dans les substrats d'ADN à des positions bien définies. Étant donné que la position du site de lésion dans l'ADN est connue, les distributions de protéines liées à l'ADN donnent un aperçu des propriétés (différentes) de reconnaissance de lésion des complexes protéiques (différents), par exemple , à quel point ils reconnaissent un type particulier de lésion (comparé À l'ADN non endommagé) 2 , 3 , 4 , 5 , 6 . Leurs positions sur l'ADN permettent également la distinction entre les complexes de protéines liés spécifiquement aux lésions et aux complexes liés de manière non spécifique ailleurs sur l'ADN. La caractérisation séparée de ces différents types complexes (complexes liés spécifiquement à la lésion par rapport aux complexes non spécifiques) peut révéler des changements de conformation potentiels dans les complexes induits sur l'identification du site cible.
Les protéines de réparation d'ADN ciblées ici sont des hélicases qui sont responsables de la reconnaissance de lésion dans la voie de la réparation de l'excision nucléotidique (NER). Dans les bactéries, le NER est atteint par les protéines UvrA, UvrB et UvrC. UvrA est responsable de la détection initiale des lésions dans un complexe d'analyse d'ADN UvaA 2 / UvrB 2 . Lors de la vérification de la lésion par UvrB, ce complexe se convertit en UvrB monomérique lié au site de la lésion et ce complexe spécifique peut alors recruter le pEndonucléase NER rokaryote UvrC. UvrC excise un tronçon court (12-13 nt) d'ADN monocaténaire (ssDNA) contenant la lésion. L'étirement manquant est ensuite rempli par l'ADN polymérase. Enfin, l'ADN ligase scelle l'étirement nouvellement synthétisé avec l'ADN original 9 , 10 . Dans les eucaryotes, la plupart des protéines de la cascade de NER font partie du grand complexe de facteur de transcription multimérique II H (TFIIH). Après la détection initiale des lésions via le complexe trimerique CEN2-XPC-HR23B, TFIIH est recruté sur le site cible de l'ADN. Lorsque XPD dans le complexe vérifie la présence d'une lésion cible NER, les endocontases NER Eucaryotes XPG et XPF sont recrutés pour acciser un tronçon court (24-32 nt) d'ADN ssD contenant la lésion 9 , 10 . Ici, plus précisément, les hélicases UvrB et XPD provenant du NER procaryote et eucaryote, respectivement, ont été étudiés. Ces hélicases nécessitent une région non appauvrieL'ADN (une bulle d'ADN) pour filer sur l'un des deux filaments simples d'ADN et ensuite translater le long de ce brin alimenté par l'hydrolyse ATP. En plus des lésions d'ADN, une bulle d'ADN a donc été introduite dans les substrats qui fonctionnent comme site de chargement pour les protéines.
La procédure de préparation de substrats spécifiques d'ADN de lésion a été décrite précédemment 11 . Il nécessite une construction d'ADN circulaire (plasmide) avec deux sites de restriction étroitement espacés pour une nickase. Dans le cadre de cette étude, le plasmide pUC19N (2729 pb) a été utilisé (créé par le laboratoire de S. Wilson, NIEHS). Ce plasmide contient trois sites de restriction étroitement espacés pour la nickase Nt.BstNBI qui encadrent un étirement de 48 nucleotides (nt). Après incubation avec la nickase, le tronçon de ssDNA entre ces sites peut être éliminé et remplacé par un oligonucléotide contenant toute caractéristique cible. Après chaque étape, la digestion enzymatique complète est testée via un gel d'agaroseÉlectrophorèse. On peut distinguer l'ADN circulaire nickel en raison de sa mobilité électrophorétique inférieure par rapport au plasmide super-enroulé d'origine. Le dégagement de l'ADN et le remplacement de l'étirement enlevé par l'oligonucléotide spécifique du substrat peuvent être évalués par digestion avec une enzyme de restriction qui incarne le substrat exclusivement dans la région entre les nicks. La linéarisation du plasmide circulaire par l'enzyme sera donc supprimée pour l'ADN gapped et restaurée après insertion de l'oligonucléotide spécifique. Enfin, deux sites de restriction d'endonucléase (idéalement des coupeurs individuels) permettent la génération d'un substrat d'ADN linéaire, avec la longueur souhaitée et avec le site cible spécifique à une position définie ainsi qu'une bulle d'ADN à distance de la lésion soit en 5 'Ou 3' direction.
La reconnaissance des lésions par les hélicases NER peut être étudiée par imagerie AFM. Transfert d'ADN bloqué des hélicases à tLe site de lésion est visible comme un pic dans la distribution de la position de la protéine sur l'ADN et indique la reconnaissance de la lésion. Parce que la translocation de l'ADN de ces hélicases est en outre directionnelle, avec une polarité de 5 'à 3', la dépendance de la reconnaissance de la lésion sur la position du site de chargement (bulle d'ADN en amont ou en aval de la lésion) indique également si la lésion est préférentiellement reconnue Sur le brin translaté ou inversé, non translaté, ssDNA 5 , 9 . Dans les sections suivantes, les méthodes utilisées seront introduites et les résultats majeurs de ces expériences seront discutés brièvement. Il est important de noter que l'imagerie AFM peut être appliquée à l'étude de différents systèmes d'interaction de l'ADN, tels que la réplication ou la transcription de l'ADN 8 , 12 , 13 , 14 , analogue au travail exemplaire sur la réparation de l'ADN . .
Protocole
1. Préparation de l'échantillon
- Préparation de substrats d'ADN 11
- Générer un espace de ssDNA dans le plasmide
- Compléter complètement un échantillon du plasmide (ici: pUC19 modifié, pUC19N) dans un tube de réaction avec une nickase appropriée (ici: Nt.BstNBI) suivie d'une inactivation de la chaleur enzymatique, en utilisant des conditions selon le protocole du fabricant (voir la figure 1 pour un schéma présentation). Commencer par un plasmide de ~ 50 μL et ~ 500 nM pour un rendement suffisant.
- Vérifier la coupure du plasmide par électrophorèse sur gel d'agarose sur des échantillons dilués (~ 20 nM) 15 . Portez des gants pour la protection contre le colorant de liaison à l'ADN utilisé pour la visualisation de l'ADN.
NOTE: Différentes mobilités électrophorétiques permettent de distinguer l'ADN plasmidique circulaire superposé (détendu) et super-enroulé ( figure 1 ). - Supprimez l'étirement en ssDNA incisé (entre les sites nick) du plasmide parIncubation avec un excès de 10 fois de l'oligonucléotide complémentaire (oligonucléotide 1 dans le tableau 1 ), agitant à 300 tr / min pendant 30 minutes à proximité de la température de fusion de l'oligonucléotide (ici: 68 ° C pour pUC19N) dans un bloc de chaleur ( figure 1 ).
- Séparer le plasmide détourné des fragments d'ADN plus petits en utilisant un filtre à coupure de poids moléculaire de 50 kDa (MWCO) par centrifugation pendant 10 min à 10 000 xg dans une centrifugeuse à table ( Figure 1 ). Pour extraire l'ADN concentré du filtre, inverser le filtre et l'insérer dans un nouveau tube de réaction de 1,5 ml. Centrifuger pendant 3 min à 1000 x g.
- Remplir l'échantillon d'ADN concentré résultant à 500 μl avec de l'eau filtrée et désionisée, ajouter un excès supplémentaire de 5 fois d'oligonucléotide complémentaire et répéter les étapes 1.1.1.3 et 1.1.1.4 au moins 3 fois.
- Test pour un calage complet de l'ADN par incubation avec une enzyme de restriction appropriée (ici: XhoI ou BglII) à l'aide de conditiSelon la description du fabricant. Utiliser des échantillons d'ADN dilués (nickelés versus gapped) (~ 20 nM). Exécuter une électrophorèse sur gel d'agarose pour distinguer entre le plasmide linéarisé (ne contenant pas d'intervalle de ssDNA) et l'ADN non incisé (ADN gâché) en utilisant l'ADN coupé comme contrôle positif (inclure une échelle d'ADN pour référence, figure 1 ). Porter des gants.
- Recharger l'espace avec les oligonucléotides ssDNA modifiés
- Recuit le plasmide gapped par incubation avec un excès de 25 fois supérieur à un oligonucléotide phosphorylé 5 'qui contient le ou les sites cibles spécifiques de choix, incubant à ~ 45 ° C pendant 4 h ( Figure 1 ). Ici, utilisez un ssDNA de 48 nt contenant une lésion, soit une thymine adoucie à la fluorescéine, soit un dimère de cyclobutane pyrimidine (CPD), et en plus une séquence courte (8 nt) non complémentaire pour produire des bulles d'ADN (voir tableau 1 ).
- Lier de façon covalente l'insert recuit au plasmide par incubaAvec T4 ADN ligase pendant une nuit à température ambiante selon le protocole du fabricant ( Figure 1 ). Pour cette réaction, ajouter une solution stock de tampon concentrée contenant de l'ATP pour produire des conditions de tampon appropriées pour la ligase ( par exemple , utiliser un tampon de réaction UvrB: Tris-HCl 50 mM pH 7,5, MgCl2 10 mM, KCl 50 mM, DTT 5 mM, 1 mM ATP).
- Test pour l'insertion de l'oligonucléotide spécifique dans le plasmide gapped par digestion d'échantillons dilués avec une enzyme de restriction appropriée (identique à 1.1.1.6) selon le protocole du fabricant suivi d'une électrophorèse sur gel d'agarose (comme dans 1.1.1.6, figure 1 ).
- Préparation du substrat d'ADN linéaire
- Recréer l'ADN plasmidique modifié avec des enzymes de restriction (idéalement avec un seul site de restriction dans le plasmide) en utilisant les conditions recommandées par le fabricant ( figure 1 ). Cette étape produit des fragments linéaires contiennentLa modification insérée à une position définie. Ici, utilisez SspI et BspQI coupant aux positions 613 et 255 pb en amont et en aval de l'insert, respectivement, ce qui donne un fragment d'ADN de 916 pb contenant le site de lésion spécifique à ~ 30% de la longueur d'ADN.
NOTE: Pour les expériences d'imagerie AFM telles que décrites ici, des fragments d'ADN avec des longueurs comprises entre ~ 200 pb et ~ 2 000 pb sont des substrats appropriés. - Isoler le fragment cible par électrophorèse sur gel d'agarose et extraire le gel en utilisant un kit commercial. Portez des gants pour la protection.
- En option, couper le gel d'agarose avec un scalpel pour séparer l'échelle d'ADN et les voies d'échantillon diluées (les deux premières voies) des voies contenant l'ADN concentré à purifier. N'exposez que la partie gel avec les deux premières voies à l'irradiation UV en plaçant uniquement cette partie du gel sur une table UV.
- Découpez le groupe correspondant au fragment de choix avec un scalpel. Re-unir les deux parties de gel (hors onglet UVLe). Utilisez la position de la bande excisée à partir de l'échantillon dilué comme orientation pour la position de la bande du substrat d'ADN désiré. Compte tenu de la concentration plus élevée en coupant des tranches légèrement plus larges que pour le contrôle dilué.
NOTE: Parce que, ici, la reconnaissance des lésions UV a été étudiée, l'introduction de lésions UV supplémentaires par irradiation UV a été soigneusement évitée dans le substrat d'ADN par cette approche.
- Découpez le groupe correspondant au fragment de choix avec un scalpel. Re-unir les deux parties de gel (hors onglet UVLe). Utilisez la position de la bande excisée à partir de l'échantillon dilué comme orientation pour la position de la bande du substrat d'ADN désiré. Compte tenu de la concentration plus élevée en coupant des tranches légèrement plus larges que pour le contrôle dilué.
- Calculer la concentration d'ADN c à partir de l'absorption à 260 nm mesurée par un spectrophotomètre UV-Vis en utilisant la loi de Lambert-Beer avec un coefficient d'extinction molaire moyen d'ADN double brin (dsDNA) de ε 260nm ~ 6,700 M - 1 cm - 1 par pb:
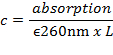
Où L est la longueur du trajet (longueur de la chambre de mesure, généralement 1 cm).
- Recréer l'ADN plasmidique modifié avec des enzymes de restriction (idéalement avec un seul site de restriction dans le plasmide) en utilisant les conditions recommandées par le fabricant ( figure 1 ). Cette étape produit des fragments linéaires contiennentLa modification insérée à une position définie. Ici, utilisez SspI et BspQI coupant aux positions 613 et 255 pb en amont et en aval de l'insert, respectivement, ce qui donne un fragment d'ADN de 916 pb contenant le site de lésion spécifique à ~ 30% de la longueur d'ADN.
- Générer un espace de ssDNA dans le plasmide
- Expression et purification des protéines
- Exprimez de manière recombinante UvrB dans E. coli et purifiez la protéine par l' affinité standard 15 du cordon de chitine et la Chromatographie d'exclusion de taille 15 comme décrit précédemment 16 .
NOTE: Le gène uvrB de Bacillus caldotenax a été clone dans le vecteur pTYB1. - Exprimez XPD dans E. coli et purifiez la protéine par l'affinité IDA 15 de nickel standard et la Chromatographie d'exclusion de taille 15 suivie d'une Chromatographie 15 d'échange d'anions, comme décrit précédemment 17 .
NOTE: Le gène de la protéine du groupe D de Chaetomium thermophilum Xeroderma pigmentosum (XPD) a été clone dans le vecteur pBADM11. C. thermophilum p44 était un cadeau génial du laboratoire de Caroline Kisker, exprimé et puriComme décrit 17 .
- Exprimez de manière recombinante UvrB dans E. coli et purifiez la protéine par l' affinité standard 15 du cordon de chitine et la Chromatographie d'exclusion de taille 15 comme décrit précédemment 16 .
2. Expérience AFM
- La préparation des échantillons
- En option, pré-incuber le substrat d'ADN à 65 ° C pendant 10 minutes dans un bloc de chaleur pour éliminer les cristaux de micro-sel potentiels qui se sont formés lors du stockage dans le réfrigérateur.
- Préparer le (s) tampon (s) de réaction à une concentration de 10 fois (tampons 10x).
NOTE: Le tampon de réaction XPD à 1x concentration contenait 20 mM de Tris-HCl pH 7,5, 10 mM de KCl, 5 mM de MgCl2, 1 mM de TCEP, 2 mM d'ATP; Le tampon de réaction 1x UvrB contenait Tris-HCl 50 mM pH 7,5, KCl 50 mM, MgCl2 10 mM, TNT 5 mM et ATP 1 mM. - Pré-incuber les protéines à une concentration plus élevée dans des conditions d'incubation appropriées pour améliorer la formation de complexes. Pré-diluer un petit volume ( par exemple , 1 μL) des protéines individuelles dans un tampon de réaction de 1x protéines à la concentration souhaitée et mélanger de petits volumes ( par exemple 1 μL) de tLes solutions de protéines individuelles dans un tube de réaction de 0,5 ml.
- Placez le tube dans un bloc de chaleur pour des températures d'incubation supérieures à la température ambiante. Choisissez un taux de concentration en fonction de la stoechiométrie complexe attendue, soit des concentrations équimolaires, soit correspondantes. Ici, incuber 1 μL de XPD (20 μM dans 1 x XPD tampon de réaction) et 1 μl de p44 (20 μM dans 1x 1xD réaction tampon) à 10 μM chacun pendant 10 minutes à 37 ° C.
- Incuber des échantillons à des concentrations appropriées de protéines et d'ADN dans un tampon de réaction protéique dans un tube de réaction de 0,5 ml. Ici, utilisez 500 nM UvrB ou 1 μM XPD + 1 μM p44 et 100 nM d'ADN. Pipettez de petits volumes pour économiser du matériel, p. Ex . 0,25 à 0,5 μl de protéine (pré diluée à une concentration d'incubation de 10 fois) et de l'ADN dans un volume total de 2,5-5 μL de tampon de réaction de 1x protéines. Ici, incuber pendant 30 min à 37 ° C dans un bloc de chaleur. Faire tourner brièvement dans un tube de réaction (~ 1 s) dans une centrifugeuse à tableE pour assurer le mélange de petits volumes.
- Dépôt d'échantillon
- Préparer un substrat de mica: couper un morceau d'environ 1 x 1 cm 2 de mica de bandes plus grandes à l'aide d'un scalpel. Déposer les couches supérieures de la matière minérale multi-couches de minéraux à l'aide d'un ruban adhésif pour révéler une surface de substrat propre, plat et atomiquement lisse.
REMARQUE: La pièce de mica peut être réutilisée pour de multiples expériences en éliminant les autres couches. - Préparer le tampon de dépôt AFM avec de l'eau filtrée désionisée, par exemple , 25 mM HEPES pH 7,5, 25 mM Na-acétate, 10 mM Mg-acétate. Filtrer par un filtre à seringue de 0,02 μm.
NOTE: Les cations divalents dans le tampon de dépôt servent à chélater les molécules d'ADN chargées négativement sur la surface du mica, qui est également chargée négativement au pH neutre. Si la concentration d'ions Mg 2+ relativement élevée dans le tampon de dépôt pose un problème pour un système protéinique-ADN particulier, en variante,La surface du mica peut être préchargée avec des groupes amino en utilisant une chimie à base de silatrane pour fournir des charges de surface positives pour l'ancrage 18 . Le dépôt d'échantillon peut ensuite être effectué dans un tampon qui ne contient pas seulement des quantités faibles de cations divalents. - Diluer l'échantillon (voir 2.1) pour le dépôt immédiat sur du mica dans un tampon de dépôt. Déposer un petit volume (ici: 20 μL).
NOTE: Les facteurs de dilution dépendent de la concentration de l'échantillon. Ici, diluer les échantillons 50-100x. En règle générale, ~ 1 nM d'ADN entraîne une bonne couverture de surface pour ~ 1000 pb. - Rincer immédiatement l'échantillon trois à quatre fois avec quelques millilitres d'eau filtrée et désionisée, nettoyer l'excès de liquide et sécher dans un courant doux d'azote. L'ensemble du processus, du dépôt d'échantillons à des échantillons séchés, peut être effectué en moins de 30 s.
- Fixez le morceau de mica sur un toboggan à microscope à l'aide d'un ruban adhésif sur ses bords.
NOTE: Différents systèmes AFM ont dDes exigences minimales pour la fixation de l'échantillon sur la scène. D'autres AFM possèdent des étages magnétiques, et les morceaux de mica sont fixés sur des disques magnétiques, par exemple en utilisant de la colle thermique. Les détails du système AFM utilisé ici peuvent être trouvés dans la Table des matériaux.
- Préparer un substrat de mica: couper un morceau d'environ 1 x 1 cm 2 de mica de bandes plus grandes à l'aide d'un scalpel. Déposer les couches supérieures de la matière minérale multi-couches de minéraux à l'aide d'un ruban adhésif pour révéler une surface de substrat propre, plat et atomiquement lisse.
- Imagerie AFM
- Placez l'échantillon (voir 2.2.5) centralement sur l'étage AFM et fixez le toboggan du microscope sur scène avec des plaquettes magnétiques.
- Insérez la pointe AFM dans le support de la pointe. Utiliser des cantilevers avec une sonde AFM (<10 nm) apte à une imagerie en mode intermittent oscillant et intermittent dans l'air. Utilisez les sondes AFM, par exemple, comme indiqué dans la table des matières . Ici (dépend de AFM), fixez la pointe dans le support sous une pince en serrant la vis de serrage (étanche aux doigts). Insérez le porte-pointe dans la tête de mesure AFM. Reposez la tête sur le dos pour cette étape.
- Placez la tête de mesure AFM en haut de l'échantillon. Les détails dépendent du modèle AFM. Ici, mAssurez-vous que la tête est stable avec ses jambes dans les indentations de la scène. Assurez-vous que le mica est situé sur la scène où la pointe de l'AFM se déplacera directement au-dessus. Les vis micrométriques à droite du plateau permettent un positionnement précis de l'échantillon.
- Alignez le laser AFM à l'arrière du porte-à-faux pour obtenir une puissance optimale du signal à partir du photodétecteur sensible à la position sur lequel le laser est réfléchi. Les détails dépendent du modèle AFM.
- Ici, tournez les roues sur le côté droit et en arrière de la tête de mesure AFM pour régler les positions x et y du laser AFM pour le diriger centralement sur la fin du porte-à-faux. Regardez le signal de réflexion dans la fenêtre vidéo AFM (si disponible, cliquez ici: appuyez sur l'icône de la caméra et choisissez Entrée: Svideo).
- Une fois positionné de manière grossière, optimisez le signal de somme du détecteur (Somme dans la fenêtre Somme et Déflecteur dans le logiciel AFM) en réglant finement la position du laser avec les deux roues (rester à la fin du porte-à-faux, le signe de sommeJe dépend du type AFM et en porte-à-faux, ici: viser la somme> 5).
- Cochez le signal de différence des diodes supérieure et inférieure du tableau des détecteurs (ici: Signal de déviation dans la fenêtre Somm et Deflection Meter) en dirigeant la réflexion laser AFM sur le centre du détecteur (ici: tournez la roue sur le côté gauche de la mesure AFM tête).
REMARQUE: les écarts par rapport à zéro indiquent la déviation du porte-à-faux en raison des interactions de surface, qui sont traduites en informations de hauteur par l'AFM. - Déterminer la fréquence de résonance en porte-à-faux par un accord de fréquence implanté dans le logiciel AFM (ici: commande syntoniser automatiquement la fenêtre du menu principal / syntoniseur). Choisissez une amplitude correspondant à une entrée de 1 V pour le piézo qui entraîne l'oscillation en porte-à-faux. Réglez la fréquence d'oscillation à légèrement (5%) inférieure à la fréquence de résonance et à zéro la phase de l'oscillation.
- Approchez la pointe de la surface de l'échantillon à l'aide du mod d'engagement brutE (ici: commande Engage dans la fenêtre du panneau maître) jusqu'à ce que le paramètre de protection (point de consigne) soit atteint. Utilisez ~ 2% de réduction de l'amplitude d'oscillation de niveau libre comme point de consigne (ici, entre Set Point 980 mV dans le panneau principal).
- Engagez bien le pointeur AFM avec la surface de l'échantillon en abaissant le point de consigne à l'aide du logiciel AFM. Viser l'imagerie en mode répulsif avec la phase d'oscillation en porte-à-faux (Phase dans la fenêtre de somme et de déflexion) juste en dessous de la phase de niveau libre (avant d'engager, ici généralement ~ 70). Ici, utilisez des points de consigne finaux typiques de l'ordre de 70 à 80% de l'amplitude du niveau libre (1 V).
- Avant de numériser, choisissez les signaux pour l'enregistrement dans le panneau de canal principal. Choisir la hauteur (Ht) et l'amplitude (Am).
- Commencez la numérisation d'échantillons (ici: la commande Do Scan in Master Panel). Utilisez une vitesse de balayage de, par exemple, 2,5 μm / s (commande Vitesse de numérisation dans le panneau principal) à des zones de surface d'image de 4 μm x 4 μm ou 8 μm x 8 μm (entrez la taille de numérisation dans le panneau maîtreL) avec des résolutions de pixels de 2 048 ou 4,096 (points de balayage et lignes de numérisation dans le panneau principal), respectivement.
- Enregistrez le fichier d'image (commande Enregistrer l'image dans le panneau principal) sans modifications appropriées (choisissez Aucun dans le panneau de canal principal / Ajustement de l'avion d'expiration).
- Pour une analyse plus approfondie, traiter l'image enregistrée. Chargez l'image (commande Parcourir les données enregistrées dans le menu Analyse AFM). Ouvrez le panneau de modification (appuyez sur M dans la partie supérieure de l'image). Appliquer un plantage en dimensions x et y à l'image haute (extension HtR) (commande XY dans la fenêtre Planefit dans Modify Panel, choisissez Planefit Order 3). Ensuite, aplatir l'image (commande Flatten in Flatten window dans Modify Panel) en choisissant Flatten Order 3.
- Exportez l'image sous la forme d'un fichier TIFF (appuyez sur Commandes dans la partie supérieure de l'image, choisissez TIFF Export 2x correspondant à une résolution de 2 048 pixels) pour une analyse plus approfondie.
3. Analyse AFM
- Volume complexe de protéines
- Pré-Sélectionnez des complexes protéiques-ADN appropriés par une inspection visuelle directe des images dans le logiciel AFM, en utilisant un schéma de couleur approprié pour maximiser les différentes apparences de différents complexes de taille (voir différentes couleurs et tailles de différents complexes dans la Figure 2 : ici: schéma de couleurs SeaLandAndFire en Le logiciel AFM). Pour les échantillons XPD, les complexes possibles incluent le ADN de XPD / p44 ainsi que l'ADN de XPD et l'ADN de p44, avec des tailles nettement différentes en raison des masses moléculaires relativement grandes et différentes de XPD (~ 95 kDa) et p44 (~ 40 kDa) .
- Mesurer les volumes de pics de protéines individuels sur l'ADN pour vérifier le type complexe. Cela peut être réalisé avec différents logiciels d'image (ici: l'outil de section du logiciel AFM).
- Mesurez la hauteur (h) et le diamètre (d) des sections des pics de protéines avec les curseurs de la fenêtre de section. Mesurez le diamètre près de la base de la section des particules.
- Déterminer le volume (V) du poisKs en utilisant des modèles mathématiques simples, par exemple , en utilisant la formule suivante, qui est basée sur un modèle de capuchon sphérique:
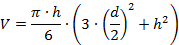
- Traduire les volumes mesurés en une masse moléculaire approximative des protéines.
- Initialement, calibrez le système AFM pour la conversion du volume en masse moléculaire (MW) en utilisant une gamme de protéines avec un poids moléculaire connu (ici: un total de 12 expériences avec entre 25 et 851 points de données ont été réalisés sur 5 protéines différentes en monomère, dimère , Trimères ou tétramères) 4 , 19 , 20 . Déposer et protéines d'image (comme décrit ci-dessus, en 2.2 et 2.3) et mesurer leurs volumes comme décrit ci-dessus (3.1.2). Tracez les volumes sur leurs poids moléculaires connus. Le graphique résultant montrera une relation linéaire entre V et MW, dont l'équation peut être obtenue parUne ligne adaptée aux données. Pour le système AFM utilisé ici, la relation suivante a été obtenue 19 :
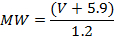
REMARQUE: cette étape ne doit pas être répétée avant chaque mesure, mais ne se fait qu'une seule fois. Le calibrage du volume au MW peut être appliqué aux images obtenues dans des conditions d'imagerie similaires en utilisant des sondes AFM avec des diamètres légèrement variables. - Sur la base de leurs volumes mesurés (3.1.2) et de l'étalonnage V-à-MW (3.1.3.1), déterminer le MW approximatif des complexes protéiques 20 , qui fournit des informations sur sa teneur moléculaire. Par exemple , pour les échantillons XPD / p44, ~ 50 kDa, ~ 100 kDa et ~ 140 kDa ont été obtenus, en cohérence avec les complexes p44-ADN (ou les pics causés par la simple superstructure de l'ADN), les pics XPD seulement et les pics XPD / p44, respectivement .
- Initialement, calibrez le système AFM pour la conversion du volume en masse moléculaire (MW) en utilisant une gamme de protéines avec un poids moléculaire connu (ici: un total de 12 expériences avec entre 25 et 851 points de données ont été réalisés sur 5 protéines différentes en monomère, dimère , Trimères ou tétramères) 4 , 19 , 20 . Déposer et protéines d'image (comme décrit ci-dessus, en 2.2 et 2.3) et mesurer leurs volumes comme décrit ci-dessus (3.1.2). Tracez les volumes sur leurs poids moléculaires connus. Le graphique résultant montrera une relation linéaire entre V et MW, dont l'équation peut être obtenue parUne ligne adaptée aux données. Pour le système AFM utilisé ici, la relation suivante a été obtenue 19 :
- Positions complexes des protéines sur l'ADN
- Déterminer l'ADNLongueur des fragments.
- Tracez les fragments d'ADN dans les images AFM, par exemple , avec la fonction de ligne libre d'un logiciel d'analyse d'image approprié (voir par exemple Table of Materials) et mesurez la longueur de la ligne.
REMARQUE: exclure les agrégats d'ADN ainsi que les fragments coupés par les marges de l'image. - Stocker et tracer les longueurs d'ADN de toute l'expérience dans un histogramme, en utilisant des analyses de données et des logiciels graphiques appropriés ( p. Ex. , Voir le tableau des matériaux ).
- Ajustez les distributions de longueur avec une courbe gaussienne dans le logiciel d'analyse de données et de graphisme pour déterminer la longueur des fragments d'ADN. Pour connaître la position du site cible d'ADN inséré (voir 1.1), n'incluez que des fragments d'ADN avec la longueur correcte dans deux écarts types du centre de la courbe de Gauss (y = y 0 + z exp (-2 (xx c ) 2 / w 2 ), où z est un facteur de norme et x c et w sont le centre etLargeur maximale totale du gaussien) dans d'autres analyses.
NOTE: La longueur d'ADN au centre de la courbe de Gauss doit être proche de la longueur théorique du fragment d'ADN (calculé en utilisant 0,34 nm / pb). Des longueurs allant jusqu'à 10% plus courtes que la valeur théorique sont typiques et sont probablement causées par les limites de résolution AFM.
- Tracez les fragments d'ADN dans les images AFM, par exemple , avec la fonction de ligne libre d'un logiciel d'analyse d'image approprié (voir par exemple Table of Materials) et mesurez la longueur de la ligne.
- Déterminer les positions des pics de protéines sur les substrats d'ADN.
- Mesurez la distance des pics de protéines à partir du fragment d'ADN plus proche, comme décrit dans 3.2.1.1 et divisez par la longueur d'ADN totale pour obtenir des distances en unités de fraction de longueur d'ADN.
- Stocker et tracer les distances mesurées dans un histogramme à l'aide d'un logiciel d'analyse et de représentation de données approprié (voir par exemple , figure 3 ). En règle générale, choisissez une taille de bac qui donne environ än des bacs pour n points de données.
NOTE: Étant donné que l'ADN ne peut être distingué ici, tracez seulement à la fraction de longueur d'ADN 0,5 (centre d'ADN fragMent). Étant donné que la liaison par l'extrémité de l'ADN n'est pas l'objet de l'étude, exclure les extrémités de l'ADN des analyses en commençant à régler les données de position légèrement après la position 0 ( par exemple , ici: binning à partir d'une fraction de longueur d'ADN de 0,02).
- Déterminer la spécificité du site cible à partir des distributions de position complexe de protéines.
- Ajuster le maximum (occurrences de liaison améliorées) dans la distribution de position avec une courbe de Gauss comme dans 3.2.1.3 mais sur la hauteur de la liaison de fond (voir la figure 3 ).
- Calculer la spécificité S pour le site spécifique par rapport au fond d'ADN non spécifique (molécules de protéines liées à des sites d'ADN non spécifiques) avec la formule suivante 21
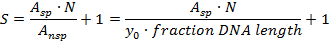
A sp : Nombre de complexes spécifiques (zone sous la courbe gaussienne)
A nsp : Nombre de complexes non spécifiques (zone de fond, C.-à-d. (Longueur d'ADN de fraction) x (hauteur d'arrière-plan moyenne y 0 ); La fraction de longueur d'ADN recouverte ici est de 0,48 pour un histogramme à partir de 0,02 longueur d'ADN)
N: nombre de sites possibles de liaison à l'ADN (ici: N = 914 excluant les extrémités de l'ADN)
- Déterminer l'ADNLongueur des fragments.
- Angle de pliage de l'ADN
- En utilisant l'outil d'angle dans un logiciel d'analyse d'image approprié, mesurez l'angle β entre deux lignes placées centralement le long du squelette de l'ADN et le centrage au pic de la protéine (voir par exemple , encadré à la figure 4 ). Mesurez les angles pour un nombre statistiquement pertinent de complexes protéine-ADN (> 50, idéalement> 100) 2 , 3 , 5 .
NOTE: L'angle de pliage de l'ADN est défini comme 180 °-β 2 , 3 , 5 . - Utilisation de l'analyse des données et du logiciel graphique(Voir Tableau des matériaux) produisent un histogramme de répartition de l'angle de virage en regroupant les angles de courbure de l'ADN.
- Ajuster la distribution de l'angle de virage avec une courbe Gauss. Si plus d'un maximum est apparu dans la distribution, choisissez l'ajustement de Gauss à pointe multiple. Le (s) centre (s) de la (les) courbe (s) gaussienne (s) donnent (s) l'angle d'angle de virage moyen de l'espèce particulière.
- Si un changement dans l'angle (s) de pliage (maxima de Gaussian fit) est évident pour des distributions, par exemple, de différentes variantes de protéines ou de différentes espèces de protéines complexes, appliquez un test t d'étudiant pour évaluer le niveau de signification du changements.
- En utilisant l'outil d'angle dans un logiciel d'analyse d'image approprié, mesurez l'angle β entre deux lignes placées centralement le long du squelette de l'ADN et le centrage au pic de la protéine (voir par exemple , encadré à la figure 4 ). Mesurez les angles pour un nombre statistiquement pertinent de complexes protéine-ADN (> 50, idéalement> 100) 2 , 3 , 5 .
Résultats
Distinction entre différents types complexes basés sur des volumes complexes de protéines
L'activité hélicase de l'hépatite NAR hépatite procaryote est stimulée par la liaison de l'ADN 22 , 23 . UvrB nécessite une région non appariée dans l'ADN (une bulle d'ADN) afin de charger correctement sur l'un des deux brins d'ADN unique. I...
Discussion
Les analyses statistiques AFM des positions contraignantes des protéines sur des fragments d'ADN longs qui contiennent des sites cibles spécifiques peuvent révéler des détails intéressants sur les stratégies particulières employées par la protéine pour reconnaître ces sites 2 , 3 , 4 , 5 , 6 . Pour interpréter les distributions de position ré...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
PUC19N, des oligonucléotides contenant du CPD et p44 ont été fournis par Samuel Wilson, Korbinian Heil et Thomas Carell, et Gudrun Michels et Caroline Kisker, respectivement. Ce travail a été soutenu par des subventions de Deutsche Forschungsgemeinschaft (DFG) FZ82 et TE-671/4 à IT.
matériels
| Name | Company | Catalog Number | Comments |
| Molecular Force Probe (MFP) 3D | Asylum Research | N/A | atomic force microscope (AFM) |
| Precision 390 | DELL | N/A | computer |
| ThermoMixer and 1.5 mL block | Eppendorf | 5382000015 | heat block for DNA preparation |
| Rotilabo Block-Heater H 250 & blocks for 0.5 mL tubes | Carl Roth GmbH | Y264.1 & Y267.1 | heat block for protein-DNA incubations |
| Mini-Sub Cell GT | Bio-Rad Laboratories GmbH | 1704467 | electrophoresis chamber with gel caster and power supply |
| Power Pac Basic | Bio-Rad Laboratories GmbH | 1645050 | electrophoresis power supply |
| Centifuge 5415 D with rotor | Eppendorf | 2262120-3 | table centrifuge |
| Ultra-Lum electronic UV transillumonator MEB-15 | Ultralum | 900-1322-02 | UV irradiation table |
| NanoDrop ND-1000 | VWR International / PEQLAB Biotechnologie GmbH | N/A | UV spectrophotometer |
| TKAX-CAD with 0.2 μm capsule filter | Unity Lab Services | N/A | water deionization and filter unit |
| Name | Company | Catalog number | Comments |
| Software | |||
| MFP software on Igor Pro | Asylum Research | N/A | AFM software |
| ImageJ (open source Java image processing) | NIH Image | N/A | Image analysis software |
| Excel (Microsoft Office) | Microsoft Corporation | N/A | data analysis software |
| Origin9 / Origin2016 | OriginLab Corporation | N/A | statistical data analysis and graphing software |
| Name | Company | Catalog number | Comments |
| Material | |||
| OMCL-AC240TS | Olympus | OMCL-AC240TS | AFM cantilevers |
| grade V-5 muscovite | SPI Supplies | 1805 | mica sheets |
| Amicon Ultra 0.5 mL 50k Ultracell | Millipore Ireland Ltd. | UFC505096 | centrifuge filters |
| NucleoSpin Extract II | Macherey-Nagel GmbH | 740 609.250 | Agarose gel extraction kit |
| Rotilabo cellulose paper type 111A | Carl Roth GmbH | AP59.1 | AFM deposition blotting paper |
| Anatop 25 (0.02 μm) | Whatman GmbH | 6809-2102 | syringe filter |
| SSpI, BspQI | New England Biolabs (NEB) | R0132, R0712 | restriction enzymes for DNA substrate preparation |
| XhoI, BglII | R0146, R0144 | restriction enzymes for DNA preparation controls | |
| nicking restriction enzyme Nt.BstNBI | New England Biolabs (NEB) | R0607 | nickase |
| T4 DNA ligase | New England Biolabs (NEB) | M0202S | Ligase |
| Tris, HEPES | Carl Roth GmbH | 4855, 9105 | buffer chemicals |
| NaCl, MgCl2, KCl, MgAcetate | Carl Roth GmbH | 3957, HN03, HN02, P026 | salt chemicals |
| NaAc | Sigma-Aldrich Chemie GmbH | 32318 | salt chemicals |
| DTT, TCEP, EDTA | 6908, HN95, 8040 | chemicals/reagents | |
| agarose, acetic acid, HCl | Carl Roth GmbH | 2267, 3738, K025 | reagents |
| ATP | Carl Roth GmbH | K054 | nucleotides |
| oligonucleotide #1 in Table 1 | Biomers | custom | complementary DNA oligonucleotide |
| oligonucleotides #2, #3, and #6 in Table 1 | Integrated DNA Technologies (IDT) | custom | fluorescein containing oligonucleotides |
| oligonucleotides #4 and #5 in Table 1 | private (available from e.g. TriLink or GlenResearch) | CPD containing oligonucleotides | |
| SafeSeal reaction tube 0.5 mL and 1.5 mL | Sarstedt | 72.704 and 72.706 | incubation tubes |
| GeneRuler 1 kb | Thermo Scientific | SM0311 | DNA ladder |
| 6x concentrate gel loading dye purple | New England Biolabs (NEB) | 51406 | DNA loading dye |
| Midori Green | Nippon Genetics Europe GmbH | 999MG28055 | DNA stain |
Références
- Janicijevic, A., Ristic, D., Wyman, C. The molecular machines of DNA repair: scanning force microscopy analysis of their architecture. J. Microsc. 212 (3), 264-272 (2003).
- Wang, H., et al. DNA bending and unbending by MutS govern mismatch recognition and specificity. Proc. Natl. Acad. Sci. USA. 100 (25), 14822-14827 (2003).
- Tessmer, I., et al. Mechanism of MutS searching for DNA mismatches and signaling repair. J. Biol. Chem. 283 (52), 36646-36654 (2008).
- Wagner, K., Moolenaar, G., van Noort, J., Goosen, N. Single-molecule analysis reveals two separate DNA-binding domains in the Escherichia coli UvrA dimer. Nucleic Acids Res. 37 (6), 1962-1972 (2009).
- Buechner, C. N., et al. Strand-specific recognition of DNA damages by XPD provides insights into nucleotide excision repair substrate versatility. J Biol. Chem. 289 (6), 3613-3624 (2014).
- Van der Linden, E., Sanchez, H., Kinoshita, E., Kanaar, R., Wyman, C. RAD50 and NBS1 form a stable complex functional in DNA binding and tethering. Nucleic Acids Res. 37 (5), 1580-1588 (2009).
- Fuentes-Perez, M. E., Dillingham, M., Moreno-Herrero, F. AFM volumetric methods for the characterization of proteins and nucleic acids. Methods. 60, 113-121 (2013).
- Shlyakhtenko, L. S., Lushnikov, A. Y., Miyagi, A., Lyubchenko, Y. L. Specificity of binding of single-stranded DNA-binding protein to its target. Biochemistry. 51, 1500-1509 (2012).
- Wirth, N., et al. Conservation and Divergence in Nucleotide Excision Repair Lesion Recognition. J. Biol. Chem. 291 (36), 18932-18946 (2016).
- Kuper, J., Kisker, C. Damage recognition in nucleotide excision DNA repair. Curr. Opin. Struct. Biol. 22, 88-93 (2012).
- Buechner, C. N., Tessmer, I. DNA substrate preparation for atomic force microscopy studies of protein-DNA interactions. J. Mol. Recognit. 26 (12), 605-617 (2013).
- Sun, Z., Tan, H. Y., Bianco, P. R., Lyubchenko, Y. L. Remodeling of RecG Helicase at the DNA Replication Fork by SSB Protein. Sci. Rep. 5, 9625 (2015).
- Billingsley, D. J., Bonass, W. A., Crampton, N., Kirkham, J., Thomson, N. H. Single-molecule studies of DNA transcription using atomic force microscopy. Phys. Biol. 9 (2), 021001 (2012).
- Maurer, S., Fritz, J., Muskhelishvili, G., Travers, A. RNA polymerase and an activator form discrete subcomplexes in a transcription initiation complex. EMBO J. 25 (16), 3784-3790 (2006).
- Sambrook, J. . Molecular Cloning: A Laboratory Manual. 1, (2012).
- Theis, K., Chen, P. J., Skorvaga, M., Van Houten, B., Kisker, C. Crystal structure of UvrB, a DNA helicase adapted for nucleotide excision repair. EMBO J. 18 (24), 6899-6907 (1999).
- Kuper, J., et al. In TFIIH, XPD helicase is exclusively devoted to DNA repair. PLoS Biol. 12 (9), e1001954 (2014).
- Shlyakhtenko, L. S., et al. Silatrane-based surface chemistry for immobilization of DNA, protein-DNA complexes and other biological materials. Ultramicroscopy. 97, 279-287 (2003).
- Roth, H. M., et al. XPB helicase regulates DNA incision by the Thermoplasma acidophilum endonuclease Bax1. DNA Repair. 11 (3), 286-293 (2012).
- Ratcliff, G. C., Erie, D. A. A Novel Single-Molecule Study to Determine Protein-Protein Association Constants. J. Am. Chem. Soc. 123 (24), 5632-5635 (2001).
- Yang, Y., Sass, L. E., Du, C., Hsieh, P., Erie, D. A. Determination of protein-DNA binding constants and specificities from statistical analyses of single molecules: MutS-DNA interactions. Nucleic Acids Res. 33 (13), 4322-4334 (2005).
- Caron, P. R., Grossman, L. Involvement of a cryptic ATPase activity of UvrB and its proteolysis product, UvrB* in DNA repair. Nucleic Acids Res. 16 (22), 10891-10902 (1988).
- Wang, H., et al. UvrB domain 4, an autoinhibitory gate for regulation of DNA binding and ATPase activity. J. Biol. Chem. 281 (22), 15227-15237 (2006).
- Chammas, O., Billingsley, D. J., Bonass, W. A., Thomson, N. H. Single-stranded DNA loops as fiducial markers for exploring DNA-protein interactions in single molecule imaging. Methods. 60 (2), 122-130 (2013).
- Truglio, J. J., et al. Structural basis for DNA recognition and processing by UvrB. Nat. Struct. Mol. Biol. 13 (4), 360-364 (2006).
- Kuper, J., Wolski, S. C., Michels, G., Kisker, C. Functional and structural studies of the nucleotide excision repair helicase XPD suggest a polarity for DNA translocation. EMBO J. 31 (2), 494-502 (2012).
- Verhoeven, E. E., Wyman, C., Moolenaar, G. F., Goosen, N. The presence of two UvrB subunits in the UvrAB complex ensures damage detection in both DNA strands. EMBO J. 21 (15), 4196-4205 (2002).
- Verhoeven, E. E., Wyman, C., Moolenaar, G. F., Hoeijmakers, J. H., Goosen, N. Architecture of nucleotide excision repair complexes: DNA is wrapped by UvrB before and after damage recognition. EMBO J. 20 (3), 601-611 (2001).
- Moolenaar, G. F., et al. The Role of ATP Binding and Hydrolysis by UvrB during Nucleotide Excision Repair. J. Biol. Chem. 275, 8044-8050 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon