Method Article
Une approche hautement évolutive pour effectuer des études écologiques sur les nématodes de Caenorhabditis Selfing
Dans cet article
Résumé
Ce protocole peut être utilisé pour effectuer des études écologiques à grande échelle sur les nématodes de Caenorhabditis auto-identifiés. Le principal avantage de cette méthode est l’organisation et l’analyse efficaces des données écologiques et moléculaires associées aux nématodes collectés dans la nature.
Résumé
Caenorhabditis elegans est l’un des principaux organismes modèles en biologie, mais ce n’est que récemment que les chercheurs se sont concentrés sur son écologie naturelle. La relative rareté de l’information sur C. elegans dans son contexte naturel provient des défis liés à l’identification du petit nématode dans la nature. Malgré ces défis, l’accent croissant mis sur l’écologie de C. elegans a entraîné une mine de nouvelles informations concernant sa vie en dehors du laboratoire. L’intensification de la recherche de C. elegans dans la nature a contribué à la découverte de nombreuses nouvelles espèces de Caenorhabditis et a révélé que les nématodes congénériques cohabitent fréquemment à l’état sauvage, où ils se nourrissent de proliférations microbiennes associées à la pourriture du matériel végétal. L’identification de nouvelles espèces a également révélé que le système d’accouplement androdioecious des mâles et des hermaphrodites autofertilisants a évolué trois fois indépendamment au sein de Caenorhabditis. Les deux autres espèces auto-entretenues, C. briggsae et C. tropicalis, partagent les avantages expérimentaux de C. elegans et ont permis des études comparatives sur la base mécaniste de traits importants, y compris l’auto-fécondation. Malgré ces progrès, il reste encore beaucoup à apprendre sur l’écologie et la diversité naturelle de ces espèces importantes. Par exemple, nous manquons encore d’informations fonctionnelles pour beaucoup de leurs gènes, ce qui ne pourrait être atteint que par une compréhension de leur écologie naturelle. Pour faciliter la recherche écologique sur les nématodes Caenorhabditis auto-autonomes, nous avons développé une méthode hautement évolutive pour collecter les nématodes dans la nature. Notre méthode utilise des plates-formes de collecte de données mobiles, des bases de données basées sur le cloud et l’environnement logiciel R pour améliorer la capacité des chercheurs à collecter des nématodes dans la nature, à enregistrer les données écologiques associées et à identifier les nématodes sauvages à l’aide de codes-barres moléculaires.
Introduction
Les deux dernières décennies ont suscité un intérêt accru pour l’écologie des nématodes de Caenorhabditis. D’après ces études, nous savons que les espèces de Caenorhabditis en liberté peuvent être isolées des micro-habitats éphémères dans les régions tempérées et tropicales, où elles se nourrissent de proliférations microbiennes associées à la décomposition du matériel végétal, parfois en sympatrie1,2,3,4,5,6,7,8 . Nous avons également appris que l’évolution convergente de l’autofertilisation s’est produite dans le genre à trois reprises, et que l’auto-fécondation est le mode de reproduction dominant pour C. briggsae, C. elegans et C. tropicalis9,10. Parmi ces selfers, C. elegans est l’un des animaux les plus étudiés sur Terre et a été utilisé par les chercheurs pour faire des progrès critiques en biologie. Il est important de noter que les autres espèces de Caenorhabditis possèdent de nombreux avantages expérimentaux de C. elegans et font rapidement progresser les études comparatives dans le genre. Cependant, la nature cryptique de ces nématodes à l’état sauvage rend difficile l’étude de leur écologie et de leur diversité naturelle, ce qui est essentiel pour comprendre les fonctions biologiques de leurs gènes et la façon dont l’évolution a façonné la diversité génétique parmi les espèces10,11.
Le plus grand défi pour étudier l’écologie des nématodes auto-autonomes de Caenorhabditis à l’état sauvage est leur petite taille; les nématodes adultes mesurent souvent 1 mm de long ou moins. Ce défi exige que les chercheurs échantillonnent des substrats dans la nature et tentent de séparer les nématodes d’intérêt des substrats en laboratoire sans pouvoir observer les animaux dans la nature. Parce que même les experts formés trouvent difficile de distinguer les nématodes Caenorhabditis auto-vivants des autres nématodes libres au microscope, les nématodes sont généralement retirés du substrat, isolés et laissés à proliférer avant d’être identifiés par l’identité de la séquence à l’aide de codes-barres moléculaires établis3,12,13,14 . Le temps et les efforts nécessaires pour traiter chaque nématode de cette manière présentent un défi organisationnel, car les chercheurs doivent être en mesure de retracer l’identité de chaque nématode isolé en laboratoire jusqu’au substrat exact et aux données écologiques associées échantillonnées sur le terrain. Ici, nous décrivons un processus étape par étape pour collecter et identifier efficacement les nématodes de Caenorhabditis auto-autoportés sur le terrain et relier fidèlement ces isolats à leurs données spatiales et écologiques associées à grande échelle.
Cette méthode de collecte augmente l’échelle et la précision des enquêtes écologiques en utilisant des plates-formes de collecte de données mobiles, des bases de données basées sur le cloud et l’environnement logiciel R. Fulcrum est une plate-forme de collecte de données personnalisable qui fonctionne avec la plupart des appareils mobiles et permet aux utilisateurs de créer des applications personnalisées pour collecter et organiser des données de localisation (https://www.fulcrumapp.com). Ce protocole fournit des instructions détaillées sur la façon d’utiliser des applications de collecte de données personnalisées pour organiser des données écologiques spatialement explicites sur le terrain et relier avec précision ces données à l’identité des nématodes isolés en laboratoire. Le protocole explique également comment identifier efficacement les nématodes Caenorhabditis auto-jacents à l’aide de codes-barres moléculaires établis. Les données de ces méthodes peuvent être traitées de manière simple et reproductible avec le progiciel R easyFulcrum15 pour explorer l’écologie et la diversité génétique des populations naturelles de Caenorhabditis.
Protocole
1. Préparation de la collecte
- Identifier un endroit pour étudier les nématodes de Caenorhabditis .
REMARQUE: Dans la plupart des régions tempérées, C. elegans et C. briggsae peuvent être facilement isolés des habitats associés à l’homme comme les champs agricoles ou les jardins ruraux et urbains1. Dans les régions subtropicales et tropicales, C. briggsae, C. elegans et C. tropicalis peuvent tous être trouvés dans les habitats associés à l’homme énumérés ci-dessus, parfois à proximité les uns des autres. Cependant, C. elegans semble préférer des habitats plus frais et plus secs que les autres espèces dans les habitats tropicaux7,8. Chacune des espèces peut également être isolée des habitats sauvages qui ne sont pas associés à l’homme, mais ces habitats sont échantillonnés moins souvent. - Créez un projet Fulcrum pour organiser les données de collecte et d’isolation avec les applications mobiles de collecte de données.
- Créez un compte avec Fulcrum en ligne à l’aide d’un contrat éducatif gratuit16. Ajoutez l’application Nematode Field Sampling à un compte Fulcrum en cliquant sur le bouton ADD APP17.
- Ajoutez l’application Nematode Isolation à un compte en cliquant sur le bouton AJOUTER UNE APPLICATION18.
REMARQUE: Il est recommandé que chaque voyage à un endroit soit organisé en tant que projet de collecte en utilisant la convention de dénomination « YearMonthLocation », par exemple, 2020FebruaryAustralia.
- Ajoutez des utilisateurs au compte Fulcrum pour leur accorder l’accès au projet de collection. Assurez-vous que chaque utilisateur télécharge l’application mobile Fulcrum pour participer au projet.
- Imprimez un ensemble d’étiquettes QR-code pour suivre les collections (C-labels) et les isolations de nématodes (S-labels) avec l’application mobile. Fixez les étiquettes C aux sacs en plastique à fermeture à glissière, roulez les sacs étiquetés en groupes de 25 et enveloppez-les d’un élastique pour l’emballage. Conservez l’ensemble des étiquettes S pour une utilisation en laboratoire.
REMARQUE: Tout au long de ce protocole, les collections (substrats du terrain) sont contenues dans des sacs ou sur des assiettes et sont étiquetées avec des étiquettes C. Les nématodes isolés sont étiquetés avec des étiquettes S. Les étiquettes C sont utilisées pour identifier des collections uniques, et les étiquettes S sont utilisées pour identifier des isolats de nématodes uniques. Ces deux types d’étiquettes sont utilisés pour établir la connexion entre une collection particulière (C-label) et les nématodes isolés de cette collection (S-labels) dans la base de données Fulcrum. Imprimez deux fois plus d’étiquettes S en tant qu’étiquettes C pour un projet de collection car, en moyenne, deux nématodes sont isolés par collection. Plus d’étiquettes S peuvent être imprimées plus tard si nécessaire. 2 500 étiquettes C uniques (dossier supplémentaire 1) et 5 000 étiquettes S uniques (dossier supplémentaire 2) sont fournies dans le supplément. - Préparez des plaques NGMA de 10 cm pour les collections et des plaques NGMA de 3,5 cm pour isoler les nématodes. Faire une assiette de 10 cm et au moins deux assiettes de 3,5 cm par collection21. Ces plaques sont ensemencées avec la souche OP50 d’Escherichia coli selon les protocoles établis. Conserver les plaques avant utilisation à 4 °C pendant 1 mois au maximum.
2. Collecte sur le terrain
REMARQUE: Les nématodes Caenorhabditis sont le plus souvent isolés à partir de matières végétales en décomposition, y compris les fruits, les noix, les graines, les gousses, les fleurs, les tiges, la litière végétale et le compost1,5,6,8. Les meilleurs substrats sont pourris et presque méconnaissables comme des fruits ou des fleurs; éviter les substrats trop secs ou humides (Figure 1). Les substrats sont collectés plus efficacement sur le terrain en travaillant par paires. La personne avec le thermomètre infrarouge sans contact sélectionnera un substrat pour le prélèvement et prélèvera l’échantillon tandis que son partenaire utilisera l’application d’échantillonnage sur le terrain des nématodes dans Fulcrum pour enregistrer les données de collecte. La paire de collecteurs répétera ce processus jusqu’à ce que le nombre souhaité d’échantillons soit collecté. La liste des documents requis pour le travail sur le terrain se trouve dans (Tableau supplémentaire 1).
- Ouvrez l’application mobile Fulcrum, sélectionnez Nematode Field Sampling dans le menu déroulant. Appuyez sur + pour démarrer un nouvel enregistrement dans le projet (Figure 2A). Prenez une photo du substrat.
- Cliquez sur la case en haut au centre pour sélectionner le bon projet de collection réalisé à l’étape 1.2 (Figure 2B). Appuyez sur le champ C-label au bas de l’enregistrement de collection et choisissez Numériser lorsque l’invite apparaît. Scannez le code-barres sur le sac de collecte à l’aide de l’appareil photo de l’appareil mobile, puis appuyez sur Terminé en haut à droite de l’écran.
- Appuyez sur le champ Substrat et sélectionnez un type de substrat dans le menu déroulant. Ajoutez des notes sur le substrat en appuyant sur le champ Notes de substrat et en saisissant manuellement des notes.
- Choisissez un paysage dans le menu déroulant. Choisissez le paysage qui représente le mieux le site d’échantillonnage.
- Choisissez une vue du ciel. Lorsque vous choisissez une vue du ciel, décrivez la visibilité du ciel sur le site d’échantillonnage (p. ex., Une vue plein ciel sans vue obstruée depuis les arbres ou d’autres structures = pleine).
- Mesurez la température de surface du substrat à l’aide du thermomètre sans contact et enregistrez la valeur dans le champ de température du substrat.
REMARQUE: Tenez le thermomètre sans contact à moins de 14 pouces du substrat pendant l’enregistrement de la température. - Mesurez la température et l’humidité ambiantes avec l’appareil portable et enregistrez ces données dans les champs appropriés.
REMARQUE: Vérifiez que le dispositif de température et d’humidité ambiantes n’est pas en attente. L’unité de mesure changera lorsque le bouton sera relâché. Gardez l’appareil dans une poche extérieure pour éviter les lectures irrégulières. - Enregistrez l’enregistrement dans Fulcrum en appuyant sur Enregistrer en haut à gauche de l’écran.
- Collectez environ une cuillère à soupe du substrat sans bâtons ni autres pièces dures en inversant le sac de collecte pour l’utiliser comme « gant » pour ramasser le substrat, puis scellez le sac. Mettez une serviette en papier dans le sac si l’échantillon est particulièrement humide.
REMARQUE: Dans les climats chauds, placez les sacs dans des glacières souples avec des emballages plus frais pour garder les collections au frais. - Une fois que tous les échantillons ont été prélevés pour la journée, nettoyez l’équipement de collecte, retirez les batteries des sondes, rechargez les batteries, recongelez les packs de congélation. Synchronisez les données de collecte de Fulcrum en appuyant sur le bouton Synchroniser en haut à gauche de l’application Nematode Field Sampling .
REMARQUE: Les téléchargements peuvent prendre plusieurs minutes sans connexion cellulaire forte, il peut donc être préférable d’attendre l’accès WiFi. Les données resteront sur les appareils mobiles et seront synchronisées avec le cloud. - Expédiez les échantillons à un établissement d’origine en les plaçant dans une boîte d’expédition de nuit. Minimiser le temps pendant lequel les échantillons sont exposés à des températures inférieures à 11 °C ou supérieures à 25 °C en expédiant des colis les jours où la cargaison est transportée.
REMARQUE: La plupart des installations d’expédition n’expédient pas de marchandises pendant la nuit les fins de semaine dans des endroits éloignés.
3. Placage des collections sur le terrain en laboratoire
REMARQUE: Cette section explique comment organiser le transfert d’échantillons de sacs de collecte étiquetés vers des plaques étiquetées. Les échantillons peuvent provenir d’un envoi de nuit ou directement du champ.
- Recevez l’expédition des collections et inspectez les sacs cassés ou toute autre preuve de dommage. Si les sacs sont cassés, jetez le matériau et nettoyez les sacs de collecte ininterrompus avec 70% d’éthanol; évitez l’étiquette C sur le sac avec l’éthanol car cela décolorera l’étiquette et la rendra difficile à lire.
- Pour chaque sac à fermeture à glissière, notez l’étiquette C sur le sac et attachez une étiquette C assortie au couvercle d’une plaque de 10 cm tachetée de bactéries OP50.
REMARQUE: Les plaques étiquetées de 10 cm sont appelées « plaques C » pour le reste du protocole. La façon la plus simple d’organiser les échantillons est de placer les sacs de prélèvement sur un banc de laboratoire avec la plaque C correspondante sur le dessus (Figure 3). - Pour chaque prélèvement, transférez environ une cuillère à soupe d’échantillon du sac de prélèvement à la plaque C à l’aide d’une cuillère en plastique propre. Ajouter l’échantillon autour de la pelouse bactérienne en forme de croissant ou d’anneau, ne pas couvrir complètement la pelouse bactérienne (Figure 4).
REMARQUE: Gardez la cuillère à soupe propre en la plaçant dans un bécher d’éthanol à 95% lorsqu’elle n’est pas utilisée. Utilisez une serviette en papier pour sécher la cuillère à soupe avant de transférer des échantillons supplémentaires. - Notez l’heure à laquelle les collections ont été transférées des sacs de collecte aux plaques C et conservez les plaques C à température ambiante (RT) pendant au moins 24 heures avant de tenter d’isoler les nématodes dans la section 4.
4. Isoler les nématodes des collections
- Ouvrez l’application Fulcrum sur l’appareil mobile et choisissez Isolation des nématodes dans le menu de l’application (Figure 5A). Créez un nouvel enregistrement d’isolement en appuyant sur l’icône + en bas à droite (Figure 5B).
- Dans le nouvel écran d’enregistrement d’isolement, confirmez le projet de collection correct en cochant le nom du projet affiché dans la zone en haut au centre. Si le mauvais projet s’affiche, appuyez sur le nom du projet pour basculer vers le bon projet (Figure 5C).
- Appuyez sur le bouton Sélectionner sous le champ étiquette C pour trouver l’étiquette C associée à l’échantillon à partir duquel les nématodes sont isolés (Figure 5D). Appuyez sur l’icône Rechercher , puis sur l’icône Scan pour scanner le code QR de l’étiquette C sur la plaque C avec l’appareil photo de l’appareil. Une fois le code QR scanné, un enregistrement C-label apparaîtra dans le champ C-label .
- Appuyez sur l’icône Appareil photo dans le champ Photos pour ouvrir l’appareil photo de l’appareil et l’utiliser pour prendre une photo de l’échantillon sur la plaque C avec le code QR visible (Figure 5E). Appuyez sur Terminé pour revenir à l’écran Isolation.
REMARQUE: Ces photos d’enregistrement d’isolement peuvent être utilisées pour explorer ultérieurement des attributs spécifiques du substrat. - Utilisez un microscope à dissection pour rechercher des nématodes sur la plaque C. Appuyez sur le champ Vers sur l’échantillon pour enregistrer la présence de nématodes sur l’échantillon (Figure 5F). Appuyez sur Oui si des nématodes sont présents sur la plaque C et appuyez sur Non si aucun nématode n’est présent.
- Appuyez sur Pistes si seules des traces de nématodes sont présentes. Si aucun nématode n’est présent, parafilmer la plaque C et la jeter dans un bac à risque biologique.
REMARQUE: Inverser la plaque C sur la poubelle des risques biologiques et tapoter doucement l’arrière de la plaque pour déloger tous les substrats échantillonnés. Cette étape facilite la recherche et l’isolement des nématodes qui peuvent se trouver sous le substrat sur la plaque C. - Si des nématodes sont présents, isolez jusqu’à cinq nématodes de la plaque C. Pour isoler un nématode, transférez un nématode de la plaque C vers une plaque S à l’aide d’un pic à fil de platine. Isolez les adultes gravides en bonne santé si possible. Cependant, isolez d’autres stades si les adultes ne sont pas trouvés.
REMARQUE: Après l’isolement, jusqu’à cinq plaques S auront chacune un seul nématode sur elles. Gardez ces plaques S avec des nématodes isolés de la même plaque C organisées ensemble dans une pile soignée loin des autres plaques S jusqu’à ce qu’elles soient entrées dans Fulcrum. - Appuyez sur le champ Plaques marquées S pour entrer la ou les plaques S utilisées pour cette isolation. Appuyez sur le + en bas à droite. Appuyez sur S-label , puis cliquez sur Scan pour ouvrir la caméra de l’appareil. Utilisez l’appareil photo de l’appareil pour scanner le code QR de l’étiquette S sur la plaque S.
REMARQUE : Assurez-vous que le code S-label correspond au code sur la plaque. Si cela correspond, appuyez sur Terminé. Si ce n’est pas le cas, appuyez sur Annuler et réanalysez jusqu’à ce qu’il corresponde, puis cliquez sur Terminé. Parfois, les codes QR des plaques voisines sont accidentellement scannés. - Après avoir entré chaque plaque S, enregistrez l’entrée avec le bouton Enregistrer en haut à droite. L’entrée sera perdue si elle n’est pas enregistrée. Appuyez sur le + en bas à droite pour ajouter plus de plaques marquées S si nécessaire jusqu’à ce que tous les nématodes isolés de la plaque C soient entrés. Après avoir ajouté toutes les plaques étiquetées S pour l’enregistrement d’isolation, appuyez sur le bouton < en haut à gauche pour revenir à l’écran d’enregistrement d’isolement.
REMARQUE: Pour annuler un enregistrement d’isolement car les erreurs ne peuvent pas être résolues, cliquez sur Annuler en haut à gauche. Cette étape ouvrira une boîte de dialogue demandant si l’enregistrement peut être ignoré sans enregistrement. Si vous le souhaitez, cliquez sur Oui, Jeter. - Appuyez sur le bouton Enregistrer en haut à droite une fois que tous les informations ont été correctement ajoutés dans l’enregistrement d’isolement. Ensuite, parafilmez les plaques S avec des nématodes isolés et mettez-les de côté dans une zone désignée pour contenir les plaques S avec des nématodes.
- Parfilmer la plaque C et la jeter dans le bac à risque biologique. Appuyez sur l’icône Synchroniser pour télécharger toutes les données sur Fulcrum.
- Triez toutes les plaques S dans l’ordre alphanumérique, puis placez les plaques S dans des boîtes en carton. Assurez-vous que les plaques S sont côté couvercle vers le bas et parafilmées. Empilez jusqu’à quatre plaques S dans une position dans la boîte et étiquetez la boîte en carton avec le nom du projet, la date, l’heure et un numéro de boîte unique.
- Conservez les boîtes étiquetées à RT. Ces isolats seront contrôlés pour la prolifération à 48 h et à nouveau à 168 h si nécessaire.
5. Exportation de plaques S à partir de Fulcrum
Remarque : Cette section explique comment exporter des étiquettes S utilisées dans le processus d’isolement à partir de la base de données du projet Fulcrum. Ces étiquettes S seront utilisées pour suivre les lignes isofémales proliférantes pendant qu’elles sont identifiées par l’identité de la séquence dans les sections 6 à 9.
- Connectez-vous au site Web Fulcrum et sélectionnez l’application Isolation des nématodes . Cliquez sur Exporter sur le côté gauche de l’écran. Cliquez pour sélectionner le projet souhaité et cochez la case Isolation des nématodes . Cliquez sur Suivant pour télécharger un fichier .zip contenant le fichier « nematode_isolation_s_labeled_plates.csv ».
- Ouvrez le fichier 'nematode_isolation_s_labeled_plates.csv' et triez-le par la colonne 'S-label' dans l’ordre croissant (le plus petit S-label sera en haut). Sélectionnez toutes les étiquettes S et copiez-les à partir de la feuille de calcul.
- Accédez au modèle de génotypage d’isolat sauvage Google Sheet (wild_isolate_genotyping_template) à l’aide d’un navigateur Web19.
- Faites une copie de cette feuille Google en cliquant avec le bouton droit de la souris sur l’onglet Modèle de génotypage , puis en sélectionnant l’option Copier dans une nouvelle feuille de calcul . Sélectionnez Ouvrir une feuille de calcul pour afficher la nouvelle feuille Google.
- Nommez cette nouvelle feuille avec le nom du projet pivot suivi de « wild_isolate_genotyping », par exemple, « 2020FebruaryAustralia_wild_isolate_genotyping ».
REMARQUE: Cette feuille est appelée « feuille de génotypage » dans le reste du protocole.
- Collez les étiquettes S copiées à partir de la colonne « nematode_isolation_s_labeled_plates.csv » « s_label » dans la colonne de la feuille de génotypage intitulée « s_label ». Vérifiez la colonne 's_label_repeat_error' pour '1's. Une valeur de '1' dans cette colonne signifie que l’étiquette S est dupliquée quelque part sur la feuille de génotypage. Si des doublons sont découverts, examinez-les et corrigez-les avant d’aller de l’avant.
- Remplissez la colonne « isolation_box_number » de la feuille de génotypage pour toutes les étiquettes S.
6. Vérifier la prolifération sur les plaques S
- Vérifiez la prolifération des animaux sur les plaques S 48 h après l’isolement (utilisez la date et l’heure du dernier isolement sur la boîte de l’étape 4.11 pour guider le moment).
REMARQUE: Les nématodes proliférants sont caractérisés par une progéniture sur la plaque S. - Si une plaque S prolifère, entrez « 1 » dans la colonne proliferation_48 de la feuille de génotypage, puis déplacez la plaque S dans une case intitulée « Prolifération de 48 h, case 1 ». Placez un maximum de 88 plaques S dans une boîte de prolifération, puis commencez à remplir une nouvelle boîte étiquetée « Prolifération de 48 h, boîte 2 ». Assurez-vous que les étiquettes S sont organisées dans l’ordre alphanumérique dans les boîtes de prolifération de 48 h.
REMARQUE: Ne pas jeter les plaques S non proliférantes; ces plaques seront vérifiées à nouveau à 168 h après l’isolement. Si vous le souhaitez, consolidez ces plaques S dans l’ordre numérique dans des cases étiquetées « 48 h non proliférant, case X », mais n’oubliez pas d’enregistrer quand la coche de 168 h doit se produire sur la nouvelle boîte. - Après avoir identifié toutes les étiquettes S proliférantes à 48 h, passez à la section 7 pour les plaques S avec prolifération à 48 h.
- Vérifiez à nouveau les plaques S qui ne proliféraient pas à 48 h après l’isolement à 168 h après l’isolement.
- Si une plaque S prolifère maintenant, entrez « 1 » dans la colonne proliferation_168 de la feuille de génotypage, puis déplacez la plaque S dans une case intitulée « Prolifération de 168 h, case 1 ».
- Placez un maximum de 88 plaques S dans une boîte de prolifération, puis commencez à remplir une nouvelle boîte étiquetée « Prolifération de 168 h, boîte 2 ». Assurez-vous d’organiser les étiquettes S dans l’ordre alphanumérique dans les boîtes de prolifération de 168 h.
- Jetez les plaques S qui n’ont pas de prolifération après 168 h. Passez à la section 7 pour les plaques S avec prolifération à 168 h.
7. Lyse des raies isofemales
REMARQUE: Cette étape utilisera l’outil de filtrage de données dans Google Sheets pour aider à imprimer des feuilles de calcul de lyse pour les plaques S dans les boîtes de prolifération. Le but des feuilles de travail de lyse est de fournir au personnel les positions correctes pour les étiquettes S dans les tubes à bandes de lyse au banc.
- Ouvrez la feuille de génotypage du projet souhaité et sélectionnez toutes les cellules en tapant Cmd+A. Cliquez sur Données > Créer un filtre pour ajouter un bouton de filtre à chaque en-tête de colonne. Utilisez les boutons Filtre pour afficher uniquement les plaques S qui seront génotypées. Par exemple, si toutes les plaques S avec prolifération à 48 h doivent être lysées: Cliquez sur le bouton Filtre dans la colonne 'proliferation_48' et sélectionnez '1'.
- Une fois que la feuille Google de génotypage a été filtrée, examinez la liste des étiquettes S affichées pour vous assurer qu’il s’agit des étiquettes S à imprimer sur la feuille de calcul.
- Dans la colonne 'strip_tube_number' de la feuille Google de génotypage, entrez un numéro unique toutes les 11 lignes.
- Entrez les numéros de tube à bande d’un projet dans l’ordre successif à partir de 1 et jamais dupliqués. Dans la strip_tube_position, entrez 2 à 12 pour chaque numéro de tube à bande.
REMARQUE: Utilisez des tubes à bande de 12 tubes pour la lyse. La première position (strip_tube_position 1) sera le contrôle, mais les contrôles ne sont pas ajoutés aux feuilles de calcul de lyse (seuls les strip_tube_positions sont ajoutés, 2-12). Au moment de la lyse, la souche témoin positive « N2 » sera ajoutée à la position 1 de chaque tube à bande paire en tant que témoin positif. Aucun ver n’est ajouté à la position 1 de chaque tube à bande impaire comme témoin négatif.
- Filtrez davantage la feuille Google de génotypage pour n’inclure que les étiquettes S dans une boîte de prolifération à lyser, puis sélectionnez les colonnes « s_label » à « lysis_notes ». Imprimez une feuille de calcul de lyse pour chaque boîte de prolifération à lyser.
- Cliquez sur le menu déroulant dans le champ Imprimer et sélectionnez Cellules sélectionnées. Cliquez sur Suivant en haut à droite, puis utilisez la boîte de dialogue pour imprimer la feuille de calcul de lyse de la zone de prolifération.
- Répétez les étapes 7.3 à 7.5 pour imprimer une feuille de calcul de lyse pour chaque boîte de prolifération.
REMARQUE: Chaque boîte de prolifération peut contenir jusqu’à 88 plaques S, ce qui correspond à huit tubes à bande de 12 puits. - Préparez des tubes à bande de 12 puits pour tous les échantillons qui seront lysés. Étiquetez un tube à bande avec un « strip_tube_number » unique attribué dans la feuille de calcul de lyse. Cette étiquette doit être apposée sur la bande de bouchon et le tube de bande pour éviter toute confusion s’ils sont séparés. Les tubes à bande EVEN ont un contrôle positif (vers N2) en position 1. Les tubes à bande ODD ont un contrôle négatif (pas de vers) en position 1.
- Constituer suffisamment de tampon de lyse (100 mM KCl, 20 mM Tris pH 8,2, 5 mM MgCl2, 0,9 % IGEPAL, 0,9 % Tween 20, 0,02 % gélatine avec protéinase K ajoutée à une concentration finale de 0,4 mg/mL) pour tous les échantillons et ajouter 5 % supplémentaires pour l’erreur de pipette. Évoluez si nécessaire.
REMARQUE: Le tampon de lyse est mieux préparé en combinant tous les ingrédients à l’exception de la protéinase K et en les congelant dans des aliquotes de 10 à 50 mL à -20 ° C. Décongeler les aliquotes et les conserver à 4 °C avant utilisation; immédiatement avant utilisation, ajouter la protéinase K et bien mélanger. Gardez le tampon de lyse sur la glace pendant que vous travaillez. - Disposez les plaques S pour un tube à bande particulier dans l’ordre en utilisant la feuille de calcul de lyse imprimée comme guide.
- Décapsulez un tube de bande et ajoutez 8 μL de tampon de lyse à chaque bouchon avec un pipetteur répétitif. Ajoutez le tampon de lyse à une bande de bouchons à la fois, car le tampon de lyse s’évaporera s’il est laissé à TA et découvert. Choisissez 3 à 5 animaux dans les plaques sources (plaque S ou plaque mère N2 pour les témoins positifs) dans les positions de capuchon appropriées indiquées sur la feuille de travail de lyse. Enregistrez les notes pour toute plaque S avec moins de 5 vers prélevés sur la lyse dans la section lysis_notes de la feuille de calcul de lyse.
- Après avoir chargé les nématodes dans chaque position du tube de bande, replacez la bande de capuchon sur le tube de bande. Faites correspondre le capuchon marqué (position 1) avec le tube marqué (position 1). Une fois bouché, centrifugez brièvement le tube à bande jusqu’à ce que les nématodes soient au fond du tube.
- Placer la bande au congélateur à -80 °C jusqu’à ce qu’elle soit complètement congelée (au moins 10 min). Répétez les étapes 7.9 à 7.11 jusqu’à ce que des nématodes soient ajoutés pour la lyse dans toutes les bandelettes. Organisez les bandes de tubes dans l’ordre numérique.
- Retirez les jeux de tubes à bande et exécutez le programme de lyse dans un thermocycleur : 1 h à 60 °C, 15 min à 95 °C, maintenez à 12 °C. Lorsque le programme de lyse est terminé, faites tourner les échantillons à 300 x g pendant 15 s à TA et conservez les lysats à -80 °C pendant 1 semaine.
- Organisez les bandes de tubes dans l’ordre numérique à l’aide de porte-plaques à 96 puits et incluez une étiquette avec un numéro de boîte de prolifération, une plage de numéros de tube à bande, la date et les initiales du chercheur. Mettez à jour les colonnes de la feuille de génotypage « lysis_date » et « lysis_notes » avec les informations de la feuille de calcul de lyse.
8. PCR des séquences SSU et ITS2
REMARQUE: Cette section fournira des instructions sur la façon d’effectuer deux PCR distinctes pour chaque plaque S lysée. Le premier ensemble d’amorces amplifie un fragment de 500 pb du gène de la petite sous-unité (SSU) de l’ADNr 18S; oECA1271 = amorce avant TACAATGGAAGGCAGCAGGC, oECA1272 = amorce inverse CCTCTGACTTTCGTTCTTGATTAA 12. Cette PCR est utilisée pour vérifier la qualité de l’ADN du modèle. La PCR amplifie la région SSU pour presque toutes les espèces de nématodes. Si la PCR SSU ne parvient pas à s’amplifier, ce résultat suggère que la qualité de la lyse est médiocre et que la lyse doit être répétée pour cette plaque S. Le deuxième ensemble d’amorces amplifie un fragment de 2 000 bp de la région interne transcrite de l’espaceur entre les gènes d’ADNr 5,8S et 28S (ITS2); oECA1687 = amorce avant CTGCGTTACTTACCACGAATTGCARAC, oECA202 = amorce inverse GCGGTATTTGCTACTACCAYYAMGATCTGC3. Le produit de PCR ITS2 est séquencé par Sanger et la séquence est utilisée pour identifier les nématodes du genre Caenorhabditis au niveau de l’espèce par similitude de séquence.
- Utilisez l’outil de filtrage de la feuille de génotypage pour afficher uniquement les étiquettes S à utiliser pour la PCR.
- Mettez à jour les pcr_plate_number et pcr_well colonnes de la feuille de génotypage. Pour éviter la dégradation du matériau de lyse, les PCR SSU et ITS2 sont exécutées en même temps.
- Utilisez les mêmes pcr_plate_number pour les PCR ITS2 et SSU, même s’il s’agit de réactions distinctes dans des plaques séparées. Ils seront distingués par des labels « SSU » ou « ITS2 ».
- Attribuez un pcr_plate_number à huit tubes à bande ou moins (un tube à bande par rangée de la plaque PCR à 96 puits, disposés dans l’ordre croissant, par exemple, le numéro de tube à bande le plus bas sur le dessus). Attribuez ensuite une pcr_plate_well à chaque étiquette S dans les tubes à bandes.
REMARQUE: Les tubes à bande sont disposés dans l’ordre croissant, le numéro de tube à bande le plus bas étant attribué à la rangée A et le nombre le plus élevé à la rangée H. La position 1 de tous les tubes à bande est attribuée à la colonne 1. Par conséquent, le tube à bande numéro 1, position 1 sera attribué à la plaque PCR numéro 1, puits A01. - Étiquetez la ou les plaques de PCR à 96 puits pour accueillir les échantillons qui seront utilisés pour la PCR. Étiquetez chaque plaque PCR avec les informations suivantes : nom du projet, type de PCR, numéro de plaque PCR et date de PCR (par exemple, 2020FebruaryAustralia_SSU_1_20200304). En outre, étiquetez la plaque avec les numéros de tube à bande qui seront chargés dans chaque rangée.
- Retirer le matériau de lyse du congélateur à -80 °C et décongeler les tubes à bande contenant le matériau de lyse sur de la glace. Pendant que le matériau de lyse est en train de décongeler, préparez les mélanges maîtres ITS2 et SSU dans des tubes séparés sur de la glace. Les recettes de PCR SSU et ITS2 se trouvent dans le tableau supplémentaire 2.
REMARQUE: Préparer 100 réactions de mélange maître PCR pour chaque plaque de 96 puits afin de permettre une erreur de pipetage. Utilisez un conique de 15 mL ou 50 mL pour maintenir le mélange maître si de grands volumes doivent être utilisés. - Vortex le mélange maître doucement jusqu’à ce que Taq soit distribué dans tout le mélange. Une fois mélangé, aliquote 38 μL du mélange maître dans les puits appropriés des plaques pcR sur glace. Utilisez des bacs stériles à fond en V à usage unique et une pipette multicanal à 12 puits pour transférer le mélange maître sur les plaques de PCR.
- Faites tourner les tubes de bande de lyse décongelés pour éliminer le matériau de lyse des bouchons. Retirez soigneusement les couvercles de tous les tubes à bande qui seront chargés dans la première plaque PCR. Utilisez une pipette multicanal à faible volume (12 puits ou 8 puits) pour ajouter 2 μL de lysat au puits approprié dans la plaque PCR. Pipettez doucement le lysat de haut en bas une fois avant de retirer les 2 μL.
REMARQUE: Vérifiez les conseils pour vous assurer qu’ils contiennent la lyse avant le transfert. N’oubliez pas de modifier les conseils entre les lignes ou les colonnes. - Couvrez la plaque PCR avec une feuille adhésive PCR et utilisez un rouleau pour créer un joint étanche. Une fois la feuille appliquée, faites tourner brièvement les plaques pcR dans une centrifugeuse. Gardez la plaque sur la glace jusqu’à ce qu’elle soit prête à fonctionner dans le thermocycleur.
- Exécutez les PCR avec le programme de thermocycleur approprié. Reportez-vous au tableau supplémentaire 2 pour plus de détails sur les programmes de PCR SSU et ITS2.
- Répétez les étapes 8.4 à 8.8 jusqu’à ce que tous les PCR soient exécutés.
- Pendant que les réactions de PCR sont en cours, versez un gel d’agarose de 100 mL à 1,5%. Chaque gel contiendra des échantillons ou une seule plaque de PCR.
- Ajouter 1,5 g d’agarose dans une fiole de 500 mL, puis ajouter 100 mL de tampon TAE 1x (tableau supplémentaire 3) et faire tourbillonner pour mélanger. Micro-ondes pour dissoudre et refroidir le gel.
- Une fois la solution refroidie, ajouter 5 μL de solution de bromure d’éthidium de 10 mg/mL et mélanger pour combiner. Versez la solution dans un plateau de coulée avec quatre peignes de 25 puits afin que le gel puisse accueillir 96 échantillons plus une échelle pour chaque rangée du gel.
REMARQUE: Le bromure d’éthidium est un mutagène puissant. Lorsque vous manipulez du bromure d’éthidium, utilisez une blouse de laboratoire, des gants résistants aux produits chimiques et des lunettes de sécurité chimique.
- Juste avant la fin de la PCR, ajoutez 6x colorant de chargement à une auge jetable et utilisez une pipette multicanal pour ajouter 2 μL de colorant de charge 6x à chaque puits d’une nouvelle plaque de PCR de 96 puits. Cette plaque sera utilisée pour charger les échantillons dans le gel. Faites suffisamment de ces plaques pour accueillir tous les échantillons.
- Lorsque les PCR sont terminées, retirez les plaques de PCR et centrifugez-les brièvement à 300 x g pendant 15 s à RT. Conservez les plaques de PCR sur de la glace jusqu’à ce que les produits de PCR puissent être épuisés sur un gel.
- Pour exécuter les produits sur un gel, utilisez une pipette multicanal à 12 puits pour ajouter 5 μL de chaque échantillon au puits approprié d’une plaque de 96 puits contenant 2 μL de colorant à chargement 6x.
- Chargez ensuite 6 μL de ce mélange dans chaque puits d’un gel récemment coulé. Chargez 6 μL de 1 Ko plus échelle dans le premier puits de chaque rangée de gel.
REMARQUE: Pour remplir les puits du gel, il peut être nécessaire d’intercaler les rangées A et B de la plaque PCR dans la première rangée du gel. Pour éviter toute confusion, notez les gel_number et gel_position dans la fiche de génotypage pour chaque échantillon de PCR.
- Placez un nouveau couvercle en aluminium sur le reste de la PCR dans la ou les plaques et conservez-les à 4 °C. Ces produits de réaction seront utilisés pour le séquençage à l’étape 9.
- Exécutez les produits PCR sur le gel à 120 V pendant 20 min. Imagez le gel et notez quelles étiquettes S donnent des produits ITS2 et/ou SSU PCR dans les colonnes « pcr_product_its2 » et « prc_product_ssu » de la fiche de génotypage. Marquez la présence d’un groupe avec un « 1 » ; marquez un « 0 » pour aucune bande.
9. Identification des nématodes avec le séquençage de Sanger et la séquence BLAST
REMARQUE: Cette section fournit des instructions pour le séquençage des amplicons ITS2 à partir des étiquettes S, l’alignement de ces séquences sur la base de données du National Center for Biotechnology Information (NCBI) à l’aide de l’algorithme BLAST et l’analyse des résultats BLAST pour identifier les nématodes sur les plaques S.
- Pour chaque échantillon positif à l’ITS2, utilisez le produit de PCR ITS2 restant pour le séquençage de Sanger à l’aide de l’amorce directe oECA306 (CACTTTCAAGCAACCCGAC). Faites en sorte que les fichiers de sortie de séquençage soient facilement liés à une étiquette S en enregistrant les colonnes « sequencing_plate » et « sequencing_well » de chaque étiquette S dans la feuille de génotypage.
- Obtenez les fichiers de sortie .seq pour chaque étiquette S à partir de la plate-forme de séquençage. Organisez les fichiers .seq d’un projet dans un répertoire unique avec des fichiers .seq pour chaque lot de séquençage situé dans des sous-répertoires.
- Ouvrez l’outil d’interface de ligne de commande et accédez au répertoire supérieur contenant les fichiers .seq en entrant la commande : cd . S’il n’existe pas déjà, créez un FASTA fusionné pour tous les fichiers .seq en entrant la commande suivante: pour dir dans */; do cd $dir; pour file dans *.seq; do echo « >"$file; cat $file; done >>.. /all_seqs.fa; cd ..; C’est fait.
REMARQUE: Ce code créera un fichier FASTA fusionné nommé 'all_seqs.fa' à partir de tous les fichiers .seq dans le répertoire du projet. Ce fichier peut être utilisé dans l’outil BLAST nucléotidique en ligne du NCBI pour aligner rapidement la séquence ITS2 de chaque étiquette S sur la base de données de séquences du NCBI. - Dans un navigateur Web, accédez au site Web NBCI BLAST20 et cliquez sur le bouton Choisir un fichier . Sélectionnez le fichier all_seqs.fa qui vient d’être créé, puis cliquez sur le bouton Séquences quelque peu similaires (BLASTn). Cliquez sur le bouton BLAST en bas de la page pour lancer la recherche BLAST.
- Mettez à jour la feuille de génotypage avec les résultats BLAST pour chaque étiquette S. Utilisez l’outil de filtrage pour faciliter la mise à jour de la feuille Google de génotypage. Cliquez sur Données > Créer un filtre pour ajouter un bouton de filtre à chaque en-tête de colonne. Filtrez la colonne sequencing_plate pour sélectionner les plaques de séquençage à mettre à jour avec les résultats BLAST.
- Utilisez le menu déroulant de la page de résultats NCBI BLAST pour vérifier les résultats de chaque séquence ITS2 de plaque S (Figure 6).
- Vérifiez qu’il n’y a pas de coups BLAST. Un ID de séquence dans la liste déroulante préfixé par * n’a pas de coups de souffle. Pour ces étiquettes S, entrez « no hit » dans la colonne manual_blast_notes de la feuille de génotypage.
- Vérifiez s’il existe une nouvelle espèce possible de Caenorhabditis . Cliquez sur le lien en haut pour visualiser l’alignement (Figure 6). Si le résultat maximal est (1) une espèce de Caenorhabditis , (2) l’alignement contient plus de cinq incohérences au centre de la séquence et (3) la couverture de la requête est supérieure à 50 %, ce résultat suggère que l’isolat pourrait être une nouvelle espèce de Caenorhabditis (Figure 7). Pour ces plaques S, entrez, les espèces du BLAST supérieur ont frappé dans la colonne « species_id », entrez un 1 dans la colonne « possible_new_caeno_sp » et « possible nouveau Caeno sp. » dans la colonne « manual_blast_notes » avec l’identité en pourcentage (par exemple, « identité possible de Nouveau Caeno sp. 89% »).
- Pour les séquences de plaque S qui blast à une espèce de Caenorhabditis , entrez le genre complet et le nom d’espèce du blast supérieur dans la colonne « species_id ». Par exemple, 'Caenorhabditis elegans'.
- Pour les séquences de plaque S qui BLAST à une espèce non-Caenorhabditis , entrez uniquement le genre de la frappe BLAST supérieure suivie de « sp. » dans la colonne « species_id ». Cette notation signifie que l’isolat est une espèce inconnue du genre nommé. Par exemple, 'Oscheius sp.'.
REMARQUE: La séquence ITS2 ne peut pas être utilisée pour identifier de manière fiable les isolats au niveau de l’espèce en dehors du genre Caenorhabditis3,13. - Entrez 1 dans la 'colonne make_strain_name' de la feuille de génotypage si 'species_id' = 'Caenorhabditis elegans', 'Caenorhabditis briggsae' ou 'Caenorhabditis tropicalis', OU 'possible_new_caeno_sp' = 1.
- Nommez les souches avec des noms uniques suivant les conventions de nomenclature Caenorhabditis , c’est-à-dire une désignation de laboratoire unique composée de 2 à 3 lettres majuscules suivies d’un nombre pour chaque souche unique23. Entrez les noms des souches dans la colonne « strain_name ».
- Une fois les souches nommées, elles peuvent être cryoconservées à l’aide des protocoles établis 24.
10. Traitement des données de collecte avec le package easyFulcrum dans R
REMARQUE : cette étape décrit comment lier les données de collecte (étiquettes C) et les données d’isolement des nématodes (étiquettes S) à l’aide du package easyFulcrum R. Le logiciel contient des fonctions qui relieront davantage les données de Fulcrum aux données de génotypage de la feuille de génotypage afin que les identités d’espèces et les noms de souches de l’étiquette S soient organisés dans un seul cadre de données.
- Créez un répertoire nommé pour le projet de collection. Organisez la structure de dossiers dans le répertoire pour qu’elle corresponde aux exigences décrites dans le package R easyFulcrum15.
- Accédez au site Web Fulcrum et connectez-vous. Exportez les données brutes du projet à partir de la base de données Fulcrum à l’aide de l’outil d’exportation de données du site Web Fulcrum sur la gauche et en cochant les cases suivantes : projeter, inclure des photos, inclure des données GPS, échantillonnage sur le terrain et isolement.
REMARQUE : Les données Fulcrum du projet seront exportées sous la forme de cinq fichiers de valeurs (.csv) séparés par des virgules. Les données complètes du projet seront réunies en une seule trame de données à l’aide du package easyFulcrum dans R. - Déplacez les cinq fichiers .csv exportés de Fulcrum dans le répertoire de projet créé à l’étape 10.1 comme indiqué dans la vignette easyFulcrum21.
- Ouvrez une session Rstudio et installez le paquet easyfulcrum dans R en entrant les commandes suivantes dans la console R 'install.packages(« devtools »)' et 'devtools::install_github(« AndersenLab/easyfulcrum »)'.
- Ouvrez un nouveau script R et suivez les instructions de la vignette easyfulcrum pour traiter les données de collecte21.
Résultats
Ce protocole a été utilisé pour collecter les nématodes Caenorhabditis à plusieurs endroits, y compris Hawaii et la Californie. Le taux de réussite de l’isolement des nématodes Caenorhabditis varie en fonction du lieu de prélèvement, du climat, de l’expérience d’échantillonnage et des types de substrats échantillonnés. Le protocole a été utilisé pour échantillonner largement les îles hawaïennes, où neuf projets de collecte ont été menés sur plusieurs années et saisons. Les taux de réussite de l’isolement pour les espèces de Caenorhabditis auto-autonomes sont presque identiques pour C. briggsae (162 des 4 506 échantillons, 3,6 %) et C. elegans (163 des 4 506 échantillons, 3,6 %), et beaucoup plus faibles pour C. tropicalis (26 sur 4 506 échantillons, 0,58 %)8. Chacune des espèces auto-autoportantes est enrichie sur des substrats de fruits et de fleurs en décomposition par rapport aux autres catégories de substrats. Échantillonnez des substrats de fruits et de fleurs en décomposition si le chercheur tente de maximiser le taux de réussite plutôt que de caractériser les préférences de substrat. Cependant, le taux de réussite varie en fonction de la qualité du substrat choisi. Par exemple, parmi les substrats de fruits et de fleurs, les substrats trop secs, humides ou frais ne produiront probablement pas de nématodes Caenorhabditis .
L’évolutivité de ce protocole de collecte est évidente d’après le nombre de collections qu’une seule paire de chercheurs peut collecter dans la nature. Par exemple, en octobre 2018, deux chercheurs utilisant ce protocole de collecte ont pu collecter un total de plus de 1 000 échantillons en 7 jours à plusieurs endroits sur deux îles hawaïennes. Cette équipe de terrain a expédié les échantillons pendant la nuit au laboratoire, où une équipe de huit chercheurs a isolé plus de 2 000 nématodes des échantillons à leur arrivée. L’un des principaux avantages de ce protocole est qu’il minimise les coûts associés à l’échantillonnage dans des endroits éloignés en réduisant l’équipement et le personnel requis sur le terrain. Grâce à ce protocole, une petite équipe sur le terrain peut se concentrer sur l’échantillonnage tandis que l’équipe d’isolement peut traiter les échantillons dans son établissement d’origine à l’aide d’équipement fragile et lourd comme des microscopes à dissection et des plaques d’agar pour isoler les nématodes. De plus, la mise en œuvre de l’application mobile de collecte de données permet de relier directement toutes les données de terrain associées aux échantillons à l’étiquette C, ce qui permet à l’équipe d’isolement de travailler indépendamment de l’équipe de terrain lors du traitement des échantillons.
Les chercheurs qui utilisent ce protocole de collecte doivent tenir compte des efforts requis pour isoler les nématodes avant un projet de collecte. Les étapes d’isolement et d’identification limitent le débit, et une petite équipe de collecte peut rapidement submerger les isolateurs d’échantillons. De plus, l’espace de laboratoire requis pour traiter de nombreuses collections peut nuire à la recherche en cours (figure 3). De plus, certains nématodes isolés nécessitent un effort supplémentaire pour le génotype. Par exemple, environ 2 % des isolats ne parviennent pas à s’amplifier avec l’ensemble d’amorces PCR SSU après la première tentative de lyse et doivent être relysés pour s’assurer que le matériau de lyse convient à l’amplification avec l’ensemble d’amorces ITS2 (Figure 8). De plus, environ 3 % des isolats ne parviennent pas à produire des séquences de qualité après une première série de séquençage de Sanger. Pour ces isolats, une autre série de lyse, de PCR ITS2 et de séquençage de Sanger est souvent nécessaire, ce qui peut augmenter le temps de main pour l’équipe d’isolement. Il est important de noter que l’identité de la séquence à elle seule n’est pas une preuve suffisante pour justifier une nouvelle espèce de Caenorhabditis (figure 7). Pour justifier correctement l’élevage d’un isolat en tant que nouvelle espèce de Caenorhabditis , des efforts supplémentaires doivent être faits pour effectuer des expériences d’accouplement et établir un spécimen typé13. Une description morphologique formelle du spécimen typé est également préférable, mais pas obligatoire3. Ensemble, ces considérations suggèrent que les chercheurs qui adoptent ce protocole de collecte bénéficieront de tests d’essai des étapes d’isolement et d’identification pour s’assurer que les ressources sont correctement allouées avant le début d’un projet de collecte. Il est important de noter que même les petits projets de collecte peuvent bénéficier de ce protocole, car le processus est hautement reproductible et les données peuvent facilement être auditées à des fins de contrôle de la qualité dans tous les groupes de laboratoires.

Figure 1: Exemples de substrat. (A) Un fruit pourri idéal est montré au centre de l’image (1), le fruit est presque méconnaissable. Moins de fruits pourris sont montrés à proximité; éviter de goûter aux fruits fraîchement tombés (2). (B) Une fleur idéalement décomposée est représentée en haut (3). Évitez de goûter aux fleurs fraîchement tombées (4). (C) La litière de feuilles sombres sous la couche supérieure de feuilles sèches est idéale lors de l’échantillonnage des nématodes de Caenorhabditis (5). Évitez d’échantillonner la litière de feuilles sèches (6). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Application mobile d’échantillonnage de champ de nématodes. (A) Écran initial après l’ouverture de l’application d’échantillonnage de champs de nématodes sur un appareil Apple dans Fulcrum. La flèche rouge en bas à droite pointe vers le bouton + utilisé pour créer un nouvel enregistrement de collection. (B) Exemple d’un nouvel enregistrement de collection affiché sur un appareil Apple. La flèche rouge pointe vers le champ « Projet » en haut de l’écran d’enregistrement de la collection. Assurez-vous de sélectionner le bon projet lors de l’échantillonnage sur le terrain. Le champ de projet correspond par défaut au dernier projet utilisé lors de la création d’enregistrements de collection ultérieurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Sacs de prélèvement et plaques de prélèvement organisés avant le placage des échantillons. Cette figure montre les échantillons dans des sacs de collecte étiquetés C sur la gauche. Chaque sac de collection est surmonté d’une plaque de 10 cm étiquetée C assortie. Sur la droite se trouvent des plaques de collecte de 10 cm qui contiennent des échantillons après leur transfert des sacs de collecte. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Une plaque de prélèvement (plaque C) avec un échantillon correctement transféré. Une plaque en C de 10 cm avec des fruits en décomposition placés sur le bord de la pelouse bactérienne. L’étiquette C est fixée au couvercle de la plaque. Veuillez cliquer ici pour voir une version agrandie de cette figure.
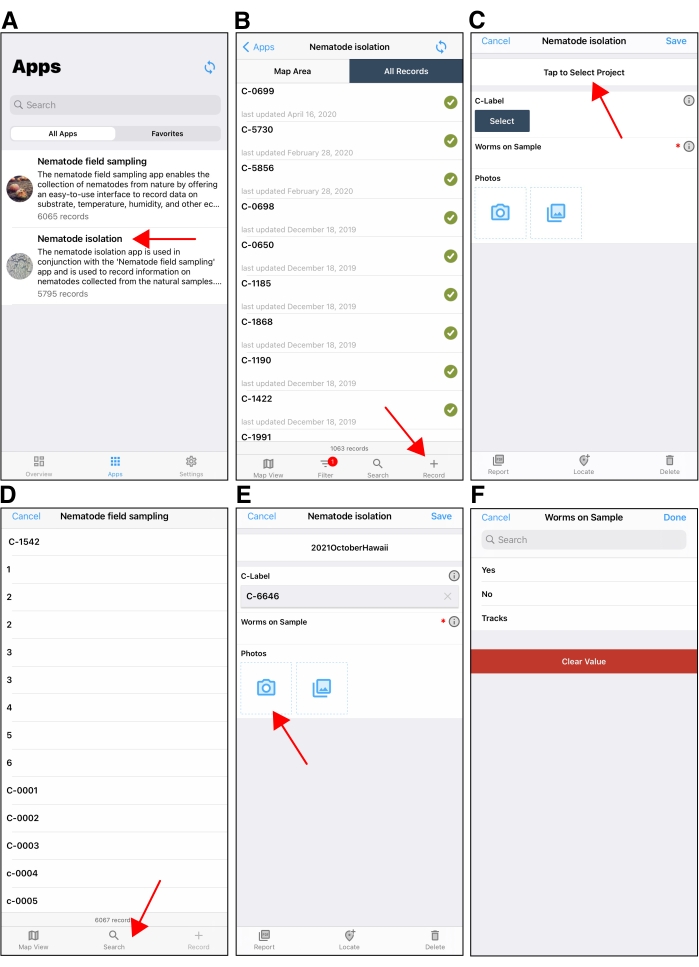
Figure 5 : L’application mobile d’isolation des nématodes. (A) Écran de sélection de l’application dans l’application mobile Fulcrum. La flèche rouge pointe vers l’application Isolation des nématodes. (B) L’écran initial après l’ouverture de l’application Nematode Isolation sur un appareil Apple dans Fulcrum. La flèche rouge en bas à droite pointe vers le bouton + utilisé pour créer un nouvel enregistrement d’isolement. (C) Exemple d’un nouvel enregistrement d’isolement affiché sur un appareil Apple. La flèche rouge pointe vers le champ « Projet » en haut de l’écran d’enregistrement d’isolement. Assurez-vous de sélectionner le bon projet lors de l’isolement. Le champ de projet correspond par défaut au dernier projet utilisé lors de la création des enregistrements d’isolement suivants. (D) Après avoir appuyé sur le champ Sélectionner sous C-label, les utilisateurs appuieront sur le bouton de recherche (flèche rouge) pour trouver l’étiquette C à partir de laquelle ils isolent les nématodes. (E) Une fois l’étiquette C sélectionnée, les utilisateurs photographieront la plaque C à l’aide de l’appareil photo. (F) Les utilisateurs saisissent ensuite s’il y a des nématodes sur la plaque C ou non. Des étiquettes S sont ajoutées à l’enregistrement d’isolement s’il y a des nématodes à isoler. Veuillez cliquer ici pour voir une version agrandie de cette figure.
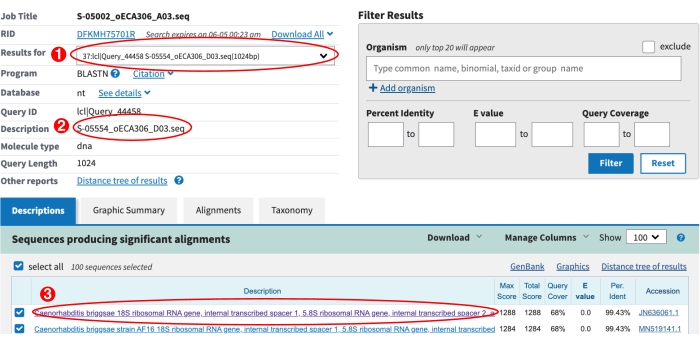
Figure 6 : Page de résultats NCBI BLAST. (1) Menu déroulant utilisé pour afficher les résultats BLAST pour toutes les séquences. (2) Description de la séquence en cours sélectionnée dans la liste déroulante. Dans ce cas, les résultats pour S-label S-05554 sont affichés. (3) Le coup BLAST supérieur pour S-05554 est affiché. Le texte violet indique que le lien permettant de visualiser cet alignement a été cliqué. Assurez-vous d’inspecter les alignements à l’œil nu pour identifier de nouvelles espèces possibles de Caenorhabditis, voir l’étape 9.8 ci-dessus. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Exemples de visualisation de l’alignement NCBI BLAST. (A) Exemple de séquence de requête ITS2 d’un isolat alignée sur une séquence de sujet C. kamaaina. (1) Le pourcentage d’identité de l’alignement (89%), qui est faible pour un coup BLAST supérieur. (2) Une incompatibilité entre la requête et la séquence d’objet (G à A). (3) Un écart de quatre paires de bases dans la séquence de sujets réalisé par l’algorithme d’alignement; les lacunes dans la requête ou l’objet indiquent un mauvais alignement. (4) Une région généralisée au centre de l’alignement avec de nombreux décalages et lacunes. Une région comme celle-ci suggère que la séquence de requête pourrait provenir d’une nouvelle espèce de Caenorhabditis. Un exemple d’alignement réel d’une nouvelle espèce, C. oiwi, qui a été découverte en 2017, est illustré. (B) Exemple d’un bon alignement entre la séquence de requête ITS2 d’un isolat et une séquence d’objet. (5) Le pourcentage d’identité de l’alignement (99%), ce qui signifie généralement que la séquence de requête provient d’un isolat de la même espèce que le sujet. (6) Une région centrale de l’alignement avec une identité parfaite. Une région comme celle-ci suggère que l’isolat de requête est probablement de la même espèce que le sujet. Veuillez cliquer ici pour voir une version agrandie de cette figure.
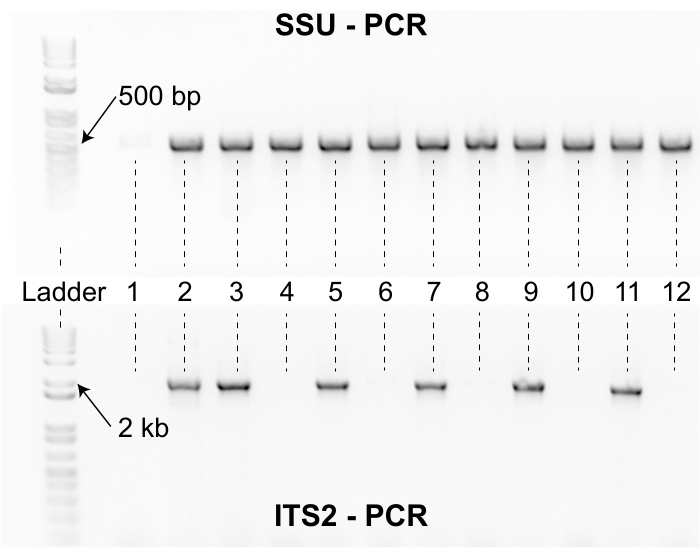
Figure 8 : Produits pcR SSU et ITS2. Le gel supérieur montre les produits PCR générés avec l’ensemble d’apprêt SSU pour 12 échantillons représentatifs. Une échelle d’ADN est incluse à gauche comme référence. Les produits de PCR SSU pour les nématodes Caenorhabditis ont une longueur d’environ 500 pb. Les échantillons 2 à 12 ont été amplifiés avec l’ensemble d’amorces SSU, mais pas l’échantillon un. L’absence d’un amplicon SSU de 500 bp pour le premier échantillon suggère que le matériau de lyse était de mauvaise qualité et que l’échantillon doit être re-lysé. Le gel inférieur montre les produits PCR générés avec l’ensemble d’apprêt ITS2 pour les mêmes 12 échantillons que ceux présentés dans le gel supérieur. L’échelle et les échantillons sont dans la même orientation pour les deux gels. Six des 12 échantillons n’ont pas été amplifiés avec l’ensemble d’amorces ITS2. Les échantillons avec des bandes SSU et ITS2 sont séquencés par Sanger et identifiés par similitude de séquence à l’aide de l’algorithme NCBI BLAST. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Étiquettes C. Un fichier PDF contenant 2500 étiquettes C uniques. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2 : Étiquettes S. Un fichier PDF contenant 5000 étiquettes S uniques. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Matériel de terrain. Une liste de colisage des matériaux utilisés sur le terrain pour échantillonner les nématodes. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 2 : Recettes de PCR et conditions du thermocycleur. Un tableau des recettes de PCR et des conditions des thermocycleurs pour les PCR ITS2 et SSU. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 3 : Recettes de tampon d’électrophorèse. Une recette pour une solution d’acide éthylènediaminetétraacétique (EDTA) à 0,5 M de pH 8,0 et la solution tampon TRIS-acétate-EDTA (TAE). Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Ce protocole contient des étapes critiques qui doivent être exécutées avec prudence. Par exemple, il est important que les équipes de terrain et d’isolement prennent soin de sélectionner le bon projet de prélèvement dans l’application avant de prélever des échantillons sur le terrain ou d’isoler les nématodes des échantillons en laboratoire. Dans le cas où le mauvais projet de collecte est sélectionné, les enregistrements de données errants sont mieux corrigés dans la base de données Fulcrum à l’aide des outils d’édition d’enregistrements en ligne. Ce processus peut être fastidieux pour de nombreux enregistrements égarés. Toutefois, la base de données conserve toutes les modifications apportées aux enregistrements afin qu’un audit complet des enregistrements de collecte et d’isolement soit possible. Les autres étapes critiques de ce protocole concernent la manipulation d’échantillons prélevés sur le terrain et les nématodes isolés à partir de ces échantillons. Pour s’assurer que les nématodes de Caenorhabditis survivent aux étapes d’échantillonnage et d’expédition, la température des échantillons doit être maintenue entre 4 °C et 25 °C. Des températures supérieures à 25 °C peuvent provoquer la stérilité chez C. elegans14. S’assurer que les échantillons sont transférés des sacs de prélèvement aux plaques de prélèvement dans les cinq jours dans la mesure du possible afin de minimiser la perte pour les nématodes. Une fois les nématodes isolés, il est essentiel qu’ils soient génotypés et cryoconservés avant de périr. Il est difficile de trouver des nématodes vivants sur les plaques S qui ont plus de deux à trois semaines, car la contamination fongique et bactérienne peut rendre les plaques S inhospitalières.
Ce protocole peut être modifié facilement pour s’adapter à différents types de données que les chercheurs peuvent vouloir recueillir sur le terrain. Par exemple, il est facile de personnaliser l’application « Nematode field sampling » avec de nouveaux champs de saisie de données à l’aide de l’interface graphique en ligne de Fulcrum pour l’édition d’applications. De plus, le package d’analyse de données, easyFulcrum, peut prendre en charge ces modifications lors du traitement des nouvelles données15. Une autre modification que les utilisateurs peuvent trouver attrayante est d’utiliser une méthode d’échantillonnage différente sur le terrain. Plutôt que d’échantillonner des substrats discrets, les chercheurs peuvent souhaiter échantillonner de plus grandes zones contenant plusieurs types de substrats. Il est préférable de traiter ces échantillons plus volumineux en laboratoire à l’aide des méthodes d’extraction de l’entonnoir ou du plateau Baermann13. Il est important de noter que l’utilisation d’étiquettes C et d’étiquettes S s’applique toujours à ces techniques et sont donc compatibles avec les applications mobiles.
Les principales limites de ce protocole concernent le temps de manipulation des nématodes avant l’isolement en laboratoire. Premièrement, le délai entre le prélèvement de l’échantillon et l’isolement des nématodes rend impossible l’enregistrement des stades de développement des nématodes sur un échantillon donné au moment du prélèvement. Deuxièmement, la fréquence des mâles et les croisements dans la nature sont des questions évolutives clés pour les nématodes Caenorhabditis auto-identifiés10. Cette méthode n’est pas bien adaptée pour répondre à ces questions, car les nématodes sont susceptibles d’avoir traversé plusieurs générations avant l’isolement. L’isolement retardé signifie qu’il est impossible de prouver directement la fréquence masculine dans la nature. De plus, le retard multigénérationnel au cours des étapes de génotypage signifie que les preuves génomiques de croisement (hétérozygotie) seront érodées avant qu’une souche de nématode puisse être séquencée. Pour identifier l’hétérozygotie dans la nature, la progéniture produite par un nématode directement isolé de la nature est utilisée pour le séquençage2. Une autre limitation potentielle de ce protocole est qu’il est biaisé vers l’identification de Caenorhabditis auto-bloquant. En effet, les nématodes isolés d’espèces auto-autonomes ont plus de chances de proliférer que les croisements obligatoires, qui ne proliféreront que si une femelle fécondée est isolée.
Cette méthode de collecte est basée sur les protocoles de collecte existants13,14. L’avancée majeure de cette technique est l’utilisation de la technologie mobile et des logiciels personnalisés pour faciliter l’organisation de grandes quantités de données écologiques et moléculaires associées à des projets de collecte à grande échelle. Les données écologiques générées à l’aide de ce protocole de collecte peuvent être utilisées pour répondre aux questions en suspens pour les populations naturelles d’espèces de Caenorhabditis. Par exemple, les données générées avec cette méthode ont été utilisées pour découvrir des préférences de niche pour l’espèce à travers les îles hawaïennes. De plus, en séquençant les génomes des nématodes cryoconservés, les chercheurs peuvent étudier comment les modèles de variation génétique sont corrélés avec les données écologiques. Des recherches de ce type peuvent révéler des signatures d’adaptation locale dans les populations de Caenorhabditis et fournir des informations importantes sur la pertinence de la variation génétique dans des contextes naturels8. Pour acquérir une compréhension fonctionnelle de nombreux gènes chez les nématodes de Caenorhabditis, des études écologiques sont probablement nécessaires11. Même pour C. elegans, une grande partie des gènes manque d’annotations fonctionnelles, bien qu’il s’agisse du premier animal multicellulaire à être séquencé et de l’un des animaux les plus étudiés sur Terre. Ce protocole de collecte a été élaboré pour aider à combler cette lacune dans les connaissances en facilitant la collecte des nématodes sauvages de Caenorhabditis et l’étude de leur écologie et de leur diversité génétique naturelle.
Déclarations de divulgation
Les auteurs ne signalent aucun conflit d’intérêts.
Remerciements
Cette recherche a été soutenue par des fonds de démarrage de l’Université Northwestern et un prix CAREER de la National Science Foundation (IOS-1751035), tous deux accordés à E.C.A.
matériels
| Name | Company | Catalog Number | Comments |
| Adhesive labels | Avery | 61533 | Printing the C-labels and S-labels |
| Agarose | Thomas Scientific | C748D75 | agarose gel preparation |
| Backpack | A backpack for each team member to hold equipment, samples, food, and water for the day. | ||
| Cardboard boxes | Fisher Scientific | AS261 | Storage of S-plates |
| Centrifuge | NA | NA | Neamtode lysis, SSU and ITS2 PCR |
| Collection bags | Zip-lock | NA | Collection of substrates |
| Digital temperature/humidity meter | Preciva | HT-86 | Measurement of ambient temperature and humidity |
| Disecting scope | NA | NA | Nematode isolation, lysis |
| Disposible reservoirs | USA Scientific | 1306-1010 | Aliquoting PCR master mixes and loading dye |
| DNA ladder, 1 KB plus | Thermo Scientific | SM0243 | Visualizing SSU and ITS2 PCR products |
| dNTPs | Thomas Scientific | CB4430-2 | PCR master mix component |
| easyFulcrum R package | NA | NA | An R package for processing collection data http://andersenlab.org/easyfulcrum/articles/easyFulcrum.html |
| EDTA solution (0.5 M pH 8.0) | NA | NA | See supplemental table 3 for recipe |
| Ethanol (95%) | NA | NA | Plating out samples, spoon sterilization |
| Ethidium bromide solution (10 mg/mL) | VWR | 97064-602 | Visualizing SSU and ITS2 PCR products |
| External battery charger for mobile device | NA | NA | External battery charger and charging cable for iPhone or Android |
| Flask (500 mL) | Fisher Scientific | FB501500 | agarose gel preparation |
| Food | NA | NA | Pack accordingly |
| Gel electrophoresis apparatus | Thermo Scientific | B2 | Visualizing SSU and ITS2 PCR products |
| Gel electrophoresis power supply | BioRad | 1645050 | Visualizing SSU and ITS2 PCR products |
| Gel loading dye, 6x | NEB | B7022S | Visualizing SSU and ITS2 PCR products |
| ITS2 primer set | NA | NA | oECA1687 = forward primer CTGCGTTACTTACCACGAATTG CARAC, oECA202 = reverse primer GCGGTATTTGCTACTACCAYYAM GATCTGC |
| ITS2 sequencing primer | NA | NA | oECA306 = forward primer CACTTTCAAGCAACCCGAC |
| Lysis buffer | NA | NA | Nematode lysis, see protocol for recipe |
| Microwave | NA | NA | agarose gel preparation |
| Mobile device | NA | NA | Charged phone in airplane mode. The Fulcrum app GPS positions are inaccurate compared to the GPS positions extracted from pictures. This setting ensures that you use less power and get more precise GPS measurements. |
| NGMA plates, 10 cm | Fisher Scientific | FB0875713 | C-plates, see Andersen et al. 2014 for NGMA plate protocol. |
| NGMA plates, 3.5 cm | Greiner Bio-One | 5662-7102Q | S-plates, see Andersen et al. 2014 for NGMA plate protocol. |
| Non-contact infrared thermometer | Etekcity | B00837ZGRY | Measurement of substrate temperature |
| Paper towels | NA | NA | Paper towels for absorbing excess moisture in a bagged sample. |
| Parafilm | Fisher Scientific | 13-374-12 | Plate sealing |
| PCR adhesive foil | VWR | 60941-126 | PCR adhesive foil |
| PCR buffer (10x) | Thomas Scientific | CB3702-7 | PCR master mix component |
| PCR plates (96-well) | Thomas Scientific | 1149K04 | SSU and ITS2 PCRs |
| Pencil | NA | NA | |
| Plastic spoons | NA | NA | Plating out samples |
| Platinum pick | NA | NA | Nematode isolation, lysis |
| Pre-labeled ziplock collection bags | NA | NA | Bundles of zip-lock plastic bags pre-labelled with C-label barcodes. Each bundle should contain 25 barcoded bags wrapped with a rubber band. |
| Proteinase K | Sigma | 3115879001 | Nematode lysis, added to lysis buffer just prior to use |
| R software | NA | NA | R software: A language and environment for statistical computing https://www.R-project.org/ |
| Soft cooler bag and ice pack | NA | NA | Collection coolers and cooler packs to keep samples cool when ambient temperature is above 25 °C. |
| Spare batteries | NA | NA | Extra batteries for sampling equipment |
| SSU primer set | NA | NA | oECA1271 = forward primer TACAATGGAAGGCAGCAGGC, oECA1272 = reverse primer CCTCTGACTTTCGTTCTTGATTAA |
| Strip tube caps (12-well) | Thomas Scientific | 1159V29 | Nematode lysis |
| Strip tubes (12-well) | Thomas Scientific | 1159V31 | Nematode lysis |
| TAE buffer (1x) | NA | NA | Visualizing SSU and ITS2 PCR products. See supplemental table 3 for recipe |
| Taq polymerase | Thomas Scientific | C775Y45 | PCR master mix component |
| Thermocycler | NA | NA | Neamtode lysis, SSU and ITS2 PCR |
| Water | NA | NA | Pack accordingly |
Références
- Frézal, L., Félix, M. -A. C. elegans outside the Petri dish. eLife. 4, 05849(2015).
- Sivasundar, A., Hey, J. Sampling from natural populations with RNAI reveals high outcrossing and population structure in Caenorhabditis elegans. Current Biology: CB. 15 (17), 1598-1602 (2005).
- Kiontke, K. C., et al. A phylogeny and molecular barcodes for Caenorhabditis, with numerous new species from rotting fruits. BMC Evolutionary Biology. 11, 339(2011).
- Petersen, C., et al. Ten years of life in compost: temporal and spatial variation of North German Caenorhabditis elegans populations. Ecology and Evolution. 5 (16), 3250-3263 (2015).
- Richaud, A., Zhang, G., Lee, D., Lee, J., Félix, M. -A. The local coexistence pattern of selfing genotypes in Caenorhabditis elegans natural metapopulations. Genetics. 208 (2), 807-821 (2018).
- Ferrari, C., Salle, R., Callemeyn-Torre, N., Jovelin, R., Cutter, A. D., Braendle, C. Ephemeral-habitat colonization and neotropical species richness of Caenorhabditis nematodes. BMC Ecology. 17 (1), 43(2017).
- Crombie, T. A., et al. Deep sampling of Hawaiian Caenorhabditis elegans reveals high genetic diversity and admixture with global populations. eLife. 8, 50465(2019).
- Crombie, T. A., et al. Local adaptation and spatiotemporal patterns of genetic diversity revealed by repeated sampling of Caenorhabditis elegans across the Hawaiian Islands. bioRxiv. , (2021).
- Noble, L. M., et al. Selfing is the safest sex for Caenorhabditis tropicalis. eLife. 10, 62587(2021).
- Cutter, A. D., Morran, L. T., Phillips, P. C. Males, Outcrossing, and Sexual Selection in Caenorhabditis Nematodes. Genetics. 213 (1), 27-57 (2019).
- Petersen, C., Dirksen, P., Schulenburg, H. Why we need more ecology for genetic models such as C. elegans. Trends in Genetics: TIG. 31 (3), 120-127 (2015).
- Haber, M., Schüngel, M., Putz, A., Müller, S., Hasert, B., Schulenburg, H. Evolutionary history of Caenorhabditis elegans inferred from microsatellites: evidence for spatial and temporal genetic differentiation and the occurrence of outbreeding. Molecular Biology and Evolution. 22 (1), 160-173 (2005).
- Barrière, A., Félix, M. -A. Isolation of C. elegans and Related Nematodes. WormBook. , https://www.ncbi.nlm.nih.gov/books/NBK19764/ (2018).
- Poullet, N., Braendle, C. Sampling and isolation of C. elegans from the natural habitat. Methods in Molecular Biology. 1327, 221-229 (2015).
- Di Bernardo, M., Crombie, T. A., Cook, D. E., Andersen, E. C. easyFulcrum: An R package to process and analyze ecological sampling data generated using the Fulcrum mobile application. PloS one. 16 (10), 0254293(2021).
- Mobile data collection & workflow automation in NCAP. , Available from: https://www.fulcrumapp.com/ (2021).
- Nematode Isolation Application. , Available from: https://www.fulcrumapp.com/apps/nematode-isolation (2021).
- Nematode Field Sampling Application. , Available from: https://www.fulcrumapp.com/apps/nematode-field-sampling (2021).
- JOVE wild_isolate-genotyping-template. , Available from: https://docs.google.com/spreadsheets/d/1oEP40jy6_K6Wkwn7Qm4iF58rTUe4JWk2zhJ20-keoOk/edit (2021).
- Nucleotide BLAST: Search nucleotide databases using a nucleotide query. , Available from: https://blast.ncbi.nim.nih.gov/Blast.cgi?PAGE_TYPE=BlastSearch (2021).
- easyFulcrum. , Available from: http://andersenlab.org/easyfulcrum/articles/easyFulcrum.html (2021).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A variant in the neuropeptide receptor npr-1 is a major determinant of Caenorhabditis elegans growth and physiology. PLoS Genetics. 10 (2), 1004156(2014).
- Tuli, M. A., Daul, A., Schedl, T. WormBook: Caenorhabditis Nomenclature. WormBook. , (2018).
- Stiernagle, T. WormBook: Maintenance of C. Elegant. WormBook. , (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon