Method Article
Une méthode efficace pour la production d’adénovirus
Résumé
Ici, nous présentons un protocole pour la production d’adénovirus en utilisant le système pAdEasy. La technologie comprend la recombinaison des plasmides pAdTrack et pAdEasy-1, l’emballage et l’amplification des adénovirus, la purification des particules adénoviraux du lysat cellulaire et du milieu de culture, le titrage viral et le test fonctionnel de l’adénovirus.
Résumé
La transduction adénovirale présente l’avantage d’une induction forte et transitoire de l’expression du gène d’intérêt dans une grande variété de types de cellules et d’organes. Cependant, la technologie adénovirale recombinante est laborieuse, longue et coûteuse. Ici, nous présentons un protocole amélioré utilisant le système pAdEasy pour obtenir des particules adénovirales purifiées qui peuvent induire une forte expression de protéine fluorescente verte (GFP) dans les cellules transduites. Les avantages de cette méthode améliorée sont une préparation plus rapide et une réduction des coûts de production par rapport à la méthode originale développée par Bert Vogelstein. Les principales étapes de la technologie adénovirale sont : (1) la recombinaison de pAdTrack-GFP avec le plasmide pAdEasy-1 dans les bactéries BJ5183 ; 2° l’emballage des particules adénoviraux; (3) l’amplification de l’adénovirus dans les cellules d’AD293 ; 4° la purification des particules adénoviraux du lysat cellulaire et du milieu de culture; et (5) le titrage viral et l’essai fonctionnel de l’adénovirus. Les améliorations apportées à la méthode originale consistent en (i) la recombinaison dans le pAdEasy-1 contenant du BJ5183 par transformation chimique de bactéries; ii) la sélection de clones recombinants par PCR « négative » et « positive »; iii) la transfection de cellules AD293 à l’aide du système de transfection K2 pour l’emballage adénoviral; iv) la précipitation avec du sulfate d’ammonium des particules virales libérées par les cellules AD293 dans le milieu de culture cellulaire; et (v) la purification du virus par ultracentrifugation discontinue en une seule étape du chlorure de césium. Une forte expression du gène d’intérêt (dans ce cas, GFP) a été obtenue dans différents types de cellules transduites (telles que les hépatocytes, les cellules endothéliales) à partir de diverses sources (humaines, bovines, murines). Le transfert de gènes à médiation adénovirale représente l’un des principaux outils de développement de thérapies géniques modernes.
Introduction
Les adénovirus sont des virus non enveloppés contenant une nucléopside et un génome d’ADN linéaire double brin1,2,3. Les adénovirus peuvent infecter un large éventail de types de cellules et l’infection ne dépend pas de la division cellulaire hôte active. Après l’infection, l’adénovirus introduit son ADN génomique dans le noyau de la cellule hôte, où il reste épichromosomique et est transcrit avec les gènes de l’hôte. Ainsi, un risque potentiel minimal de mutagenèse insertionnelle ou de régulation des oncogènes est atteint 4,5,6. Le génome adénoviral n’est pas répliqué avec le génome de l’hôte et, par conséquent, les gènes adénoviraux sont dilués dans une population cellulaire qui se divise. Parmi les avantages de la transduction adénovirale, il y a : (i) des niveaux élevés d’expression de transgene ; ii) réduction des risques liés à l’intégration de l’ADN viral dans le génome de l’hôte, en raison de l’expression épisomale; iii) la transduction d’une grande variété de types de cellules qui se divisent et qui ne se divisent pas. La plupart des adénovirus utilisés dans la recherche biomédicale sont non réplicatifs, dépourvus de la région E17,8,9. Pour leur production, une lignée cellulaire fournissant la séquence E1 (telle que HEK293) est requise. En outre, une région non essentielle pour le cycle de vie viral (E3) a été supprimée pour permettre l’insertion d’un transgène dans le génome viral; d’autres régions (E2 et E4) ont été encore supprimées dans quelques adénovirus, mais dans ces cas, un rendement diminué de production adénovirale et une faible expression du transgène ont été rapportés7.
Ici, nous présentons un protocole amélioré pour la construction, l’emballage et la purification des adénovirus à l’aide du système AdEasy. Ces améliorations ont permis l’emballage de l’adénovirus d’une manière plus rapide et plus économique par rapport à la méthode originale développée par Bert Vogelstein2,10,en raison des avantages suivants: (i) la recombinaison dans BJ5183-contenant pAdEasy-1 par transformation chimique des bactéries; ii) la sélection des clones recombinants par PCR; iii) la transfection de cellules AD293 à l’aide du système de transfection K2 pour l’emballage adénoviral; iv) la précipitation de particules adénoviraux du milieu de culture après conditionnement et amplification viraux; v) la purification adénovirale par ultracentrifugation à gradient de chlorure de césium (CsCl) en une seule étape.
Le protocole de production d’adénovirus à l’aide du système AdEasy (Figure 1) comprend les étapes suivantes :
(1) Recombinaison de pAdTrack-GFP avec pAdEasy-1 dans les bactéries BJ5183
(2) Emballage des particules adénoviraux
(3) Amplification de l’adénovirus
(4) Purification des particules adénoviraux à partir du lysat cellulaire et du milieu de culture
(5) Titrage d’adénovirus.
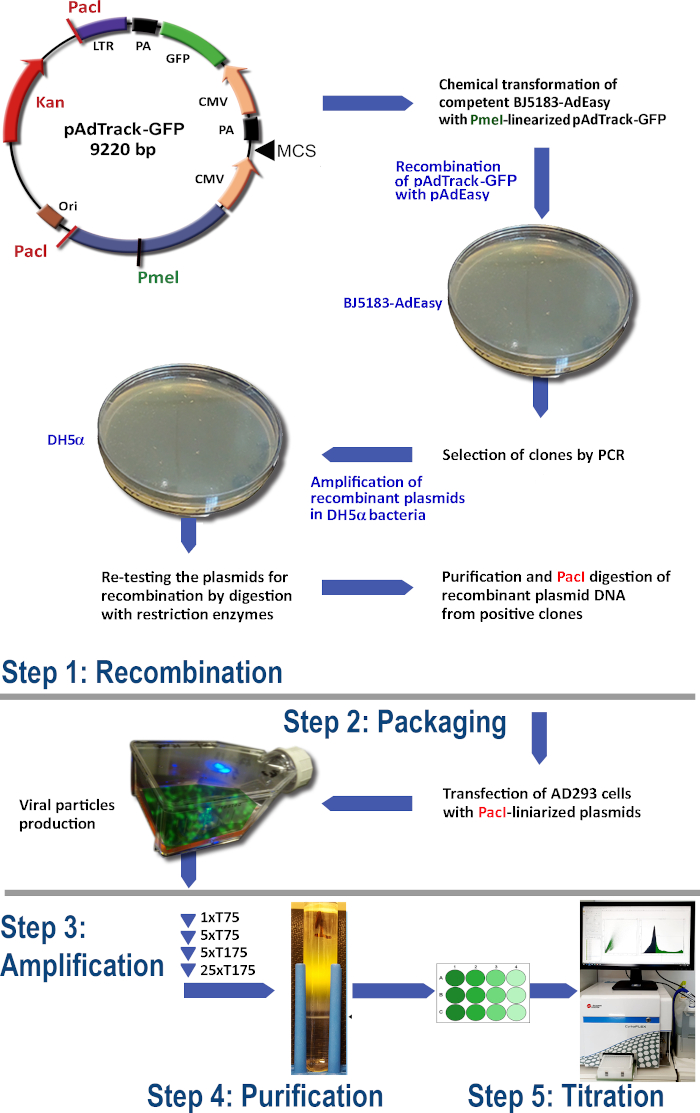
Figure 1 : La technologie de production d’adénovirus. Les principales étapes de la technologie adénovirale sont: (1) La recombinaison du pAdTrack-GFP avec le plasmide pAdEasy-1 dans les bactéries BJ5183. Les plasmides recombinés sélectionnés sont amplifiés dans les bactéries DH5α puis purifiés ; (2) L’emballage des particules adénovirales dans les cellules AD293, qui produisent des protéines adéno-E1; (3) L’amplification de l’adénovirus dans les cellules d’AD293 ; (4) La purification des particules adénoviraux du lysat cellulaire et du milieu de culture par ultracentrifugation sur un gradient de densité CsCl ; (5) Le titrage de l’adénovirus et les tests fonctionnels. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Dans ce protocole, nous avons illustré la technologie pour la production de l’adénovirus, qui peut induire l’expression de GFP dans les cellules hôtes. La GFP est déjà insérée dans l’épine dorsale du vecteur navette pAdTrack-CMV (Addgene #16405), sous un deuxième promoteur CMV et est utilisée comme gène rapporteur(Figure 1). Pour cette raison, nous avons désigné ici le vecteur pAdTrack-CMV comme pAdTrack-GFP et nous avons évalué l’expression de GFP à des fins démonstratives. Outre l’expression de la GFP, le système peut être utilisé pour surexprimer un gène d’intérêt, qui peut être cloné dans les multiples sites de clonage du pAdTrack-CMV. Un gène ou un minigène cloné dans le pAdTrack-CMV est généralement plus efficace pour l’induction d’expression par rapport à l’ADNc11. Les données ont montré une forte expression de GFP dans les cellules transduites (telles que les hépatocytes, les cellules endothéliales) provenant de diverses sources (humaines, bovines, murines). Le transfert de gènes à médiation adénovirale représente l’un des principaux outils de développement de thérapies géniques modernes.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisation