Method Article
בידוד והדמיה פלורסצנטיות עבור שחזור יחיד-חלקיקים של Chlamydomonas Centrioles
In This Article
Summary
פיתחנו אסטרטגיה טיהור וגירוש של תמונה מספר רב של centrioles ב לשכנוע סופר-רזולוציה מיקרוסקופיה של יחיד-חלקיקים ממוצע של נטיות שונות.
Abstract
Centrioles הם להרכבות גדולות macromolecular החשובים עבור ביצוע נאות של התא הבסיסי תהליכים ביולוגיים כגון חלוקת התא, התא תנועתיות או איתות התא. האצות הירוק Chlamydomonas reinhardtii הוכיחה להיות מודל תובנה במחקר של אדריכלות צנטריול פונקציה, הרכב החלבון. למרות ההתקדמות הגדולה לקראת הבנה אדריכלות centriolar, אחד האתגרים הנוכחיים היא לקביעת ההתאמה המדויקת של רכיבים centriolar בתוך מבנה מחוזות צנטריול כדי להבין טוב יותר את תפקידם ב- צנטריול להן. מגבלה משמעותית טמון ברזולוציה של מיקרוסקופ פלורסצנטיות, אשר מסבך את הפרשנות של חלבון לוקליזציה של אברון זה עם ממדים קרוב לגבול עקיפה. כדי להתמודד עם שאלה זו, אנו מספקים שיטה לטהר, תמונה מספר רב של reinhardtii ג centrioles עם נטיות שונות באמצעות מיקרוסקופ ברזולוציה-העל. טכניקה זו מאפשרת עיבוד נוסף של נתונים דרך ניאון יחיד-חלקיקים בממוצע (Fluo-SPA) בשל המספר הגדול של centrioles רכשה. Fluo-ספא יוצר ממוצעים של צבעונית centrioles reinhardtii ג ב נטיות שונות, ובכך להקל על הלוקליזציה של חלבונים שונים באיזורים תת centriolar. חשוב, בשיטה זו ניתן להחיל על התמונה centrioles מינים אחרים או הרכבות macromolecular גדולות אחרות.
Introduction
צנטריול הוא אברון אבולוציונית שנשמרת שוכנת בליבה של centrosome בתאים בעלי חיים, יכול לשמש גוף בזאלי (המכונה centrioles להלן) cilia תבנית או שוטון פרוקריוטים רבים1,2. בתור שכזה, centrioles הם קריטיים עבור התא הבסיסי הנע בין מכלול ציר לתא איתות תהליכים ביולוגיים. לכן, פגמים צנטריול הרכבה או בפונקציה קושרו עם מספר פתולוגיות האנושי כולל ciliopathies ו סרטן3.
Centrioles הם nine-fold, סימטרי, microtubule גלילי מבני זה מבוסס שלישיה הם, בדרך כלל, ~ 450 nm ארוך ו ~ 250 ננומטר רחב4,5,6,7. מיקרוסקופ אלקטרונים קונבנציונאלי וטומוגרפיה אלקטרונים הקפאה של centrioles של מינים שונים חשפו כי centrioles הם מקוטב לאורך ציר זמן שלהם עם שלושה אזורים נפרדים: אזור proximal הליבה המרכזית, אזור דיסטלי5 , 7 , 8 , 9 , 10 , 11. חשוב, כל אחד \ ת באיזורים הבאים מציג תכונות מבניות ספציפיות. ראשית, לומן של האזור proximal 100 ננומטר באורך מכיל את מבנה cartwheel מחובר על שלישיה microtubule באמצעות רכיב ראש סיכה12. שנית, 300-400 nm באורך באזור המרכז מכיל סיבי צפיפויות תכונות לומן מבניים לאורך הפנים הפנימי של microtubules: את מקשר בצורת Y, הזנב צנורית-C ו- A-צנורית דפק9. בסופו של דבר, האזור דיסטלי של nm 50 – 100 תערוכות תוספות תת דיסטלי ו דיסטלי המקיפים את החלק הדיסטלי של5,צנטריול13.
בשני העשורים האחרונים סומנו על ידי הגילוי של מספר גדל והולך של חלבונים centriolar, המוביל הערכה הנוכחית של-100 חלבונים ברורים להיות חלק ה צנטריול14,15,16, 17. למרות ההתפתחויות הללו, ההתאמה המדויקת של חלבונים אלה בתוך צנטריול נותרת חמקמקה, במיוחד בתוך אזורים תת מבניים. חשוב לציין, הקצאת לוקליזציה מדויק של מבנה מחוזות צנטריול חיונית הבנה טובה יותר של תפקידם. במובן זה, reinhardtii ג centrioles סייעו שני היבטים על ידי התכונות מבניים שונים לאורך גליל9,18,19, אשר לאחר מכן מותר delimitating הראשון חוקרים לתאם הלוקליזציה של תת-קבוצה של חלבונים באמצעות מיקרוסקופ פלואורסצנטי לאזור תת מבנית. זה כולל, לדוגמה, את החלבונים Bld12p ו Bld10p, אשר בתרגום באזור צינתור, במבנה cartwheel בפרט20,21,22,23. הרשימה של חלבונים בתיוג לשפות אחרות כוללת גם POB15, POC16, שני חלבונים הרומן המזוהה באמצעות ספקטרומטר מסה המעטרים את האזור לליבה המרכזית של reinhardtii ג centrioles17.
מאמר זה מספק תיאור מלא של השיטה שפותחה כדי לבודד תמונה reinhardtii ג centrioles הבאים סופר-רזולוציה מיקרוסקופיה, ממוצע של חלקיק בודד. כדי להשיג מטרה זו, חשוב על המגבלות הטכניות שצריך להתגבר. ראשית, טיהור צנטריול יכול להשפיע על הארכיטקטורה הכוללת, עם המבנה cartwheel לעיתים קרובות אבדו במהלך השלבים השונים של בידוד9. שנית, הממדים של צנטריול נמצאים קרוב מאוד לגבול עקיפה במיקרוסקופ אופטי. אכן, הרזולוציה לרוחב שניתן להשיג במיקרוסקופיה קונפוקלית הוא כ-200 nm24, דומה לקוטר של צנטריול את, ואת את הרזולוציה z-ציר הוא על 2-3 x נמוך יותר, המוביל אל אמצעי אחסון אנאיזוטרופי. שלישית, הטרוגניות של תיוג נוגדן וכיוון צנטריול יכול להגביל את הפרשנות צריכה להתאים לשפה חלבון באזור תת centriolar מסוים. לבסוף, centrioles קיימים רק שני עותקים לכל תא, ולכן קשה למצוא אוריינטציה ברורה וחד משמעית צנטריול לרכוש מספר גדול של תמונות. כדי לעקוף בעיות טכניות אלה, פיתחנו שיטה המסתמכת על החלת סופר-רזולוציה מיקרוסקופ על מספרים גדולים של centrioles מבודדים שמאמצים כיוונים שונים. ראשית נתאר פרוטוקול לטהר reinhardtii ג centrioles המאפשרת הטיהור של centrioles מבנית, procentrioles המכיל את cartwheel. לאחר מכן, נתאר את פרוטוקול צעד אחר צעד להתרכז centrioles על coverslips לדימות מאת קונבנציונאלי או מיקרוסקופ פלואורסצנטי סופר רזולוציה. שלב חשוב זה מאפשר הגדלת מספר centrioles עם תמונה הכיוונים מרובים. לבסוף, נתאר את הליך ביצוע יחיד-חלקיקים בממוצע על נתונים רכשה במיקרוסקופ פלואורסצנטי המקל על הגילוי של centrioles ב נטיות שונות. בסך הכל, בשיטה זו ניתן להחיל תמונה centrioles מינים שונים או הרכבות macromolecular גדולות אחרות.
Protocol
1. התקשורת לקראת תרבות reinhardtii ג ובידוד צנטריול
-
הכנת המדיה לתאים ג reinhardtii תרבות
הערה: השלבים הבאים מתארים את ההכנה של פתרונות מניות 1 x ברז בינוני (טריס-אצטט פוספט).- הכן בופר פוספט (pH 7), על ידי ערבוב 250 מ של 1 מ' K2HPO4 (174.2 g K2HPO4 השלים עד 1 ליטר עם מים מזוקקים) ~ 170 מ של 1 מ' ח'2PO4 (136.09 גרם של ח'2PO4 ב- 1 ליטר). התאם את התערובת כדי להגיע pH 7.
- להכין פתרון (40 x) על ידי ערבוב 96.8 גר' טריס, 40 מ של מאגר פוספט (pH 7) ו- 40 מ ל חומצה אצטית, והתאם את פתרון 1 ליטר עם מים מזוקקים.
- להכין פתרון ב' (40 x) באמצעות 16 גרם של NH4Cl, g 2 CaCl2ו- 4 g של MgSO4. להיות זהירים כדי להמיס CaCl2 במים מזוקקים בנפרד לפני הוספתו לרכיבים האחרים. להתאים את הפתרון 1 ליטר עם מים מזוקקים.
- להכין מאגר של יסודות קורט של הוטנר25 כדלקמן.
- עבור 1 ליטר של המאגר, להמיס כל מתחם הנפח המצוין של מים: ניתרן EDTA מלח (50 גרם 250 מ ל), ZnSO4.7H2O (22 גרם ב- 100 מ ל), H3בו3 (11.4 g ב- 200 מ ל), MnCl2.4H2O (5.06 g ב- 50 מ ל) , CoCl2.6H2O (1.61 גר' ב- 50 מ ל), CuSO4.5H2O (1.57 g ב- 50 מ ל), (NH4) 6Mo7O24.4H2O (1.10 g ב- 50 מ ל), מכל4.7H2O (ב- 4.99 g ב- 50 מ ל).
הערה: EDTA צריך להיות מומס במים רותחים, מכל4 צריך להיות מוכן אחרונה כדי למנוע חמצון. - מערבבים יחד את כל הפתרונות חוץ EDTA ומביאים לרתיחה. ואז להוסיף את EDTA, הפתרון אמור להפוך ירוק. לאחר המסת הכל, מגניב הפתרון 70 מעלות צלזיוס. בטמפרטורה זו, להוסיף 85 מ"ל של פתרון קו חם 20% (20 גר' ב- 100 מ ל). להתאים את הפתרון 1 ליטר עם מים מזוקקים בטמפרטורת החדר (RT).
- להוסיף פקק כותנה הבקבוק, לתת את הפתרון לעמוד במשך 1-2 שבועות, מנענע 1 x יום. הפתרון אמור בתחילה להיות ירוק ולאחר מכן להפוך סגול, עוזב את התמיסה חום-חלודה; הסר את התמיסה באמצעות נייר סינון עד הפתרון ברור. להקפיא את aliquots ולאחסן ב-20 ° C.
- עבור 1 ליטר של המאגר, להמיס כל מתחם הנפח המצוין של מים: ניתרן EDTA מלח (50 גרם 250 מ ל), ZnSO4.7H2O (22 גרם ב- 100 מ ל), H3בו3 (11.4 g ב- 200 מ ל), MnCl2.4H2O (5.06 g ב- 50 מ ל) , CoCl2.6H2O (1.61 גר' ב- 50 מ ל), CuSO4.5H2O (1.57 g ב- 50 מ ל), (NH4) 6Mo7O24.4H2O (1.10 g ב- 50 מ ל), מכל4.7H2O (ב- 4.99 g ב- 50 מ ל).
- להכין 1 x ברז בינוני לגדול reinhardtii ג תאים על ידי ערבוב המרכיבים הבאים: 25 mL של פתרון (40 x) ו- 25 מ של פתרון ב' (40 x) עם 1 מ"ל של יסודות קורט של הוטנר מאגר25, התאם את התערובת 1 ליטר עם מים מזוקקים. לחטא את התערובת בעזרת מסנן 0.4 מיקרומטר.
-
מדיה הכנה צנטריול טיהור
- להכין מאגר deflagellation באמצעות 5% סוכרוז ב- 10 מ מ HEPES (pH 7)-נפח סופי של 500 מ"ל מותאם עם מים מזוקקים.
- להכין 250 מ של חומצה אצטית 0.5 M.
- להכין 250 מ של 1 מ' K-צינורות מניות פתרון (pH 7.2), על ידי הוספת הראשון 50 מל של H2O כדי להמיס את האבקה צינורות, ולאחר מכן הוספת 10 קו N עד הפתרון מתחיל להתבהר. Titrate ל pH 7.2 עם 10 N ו- 1 N KOH ולהתאים את הפתרון הסופי נפח של 250 מ עם H2O.
- להכין סוכרוז 5 פתרונות (w/w) כדלקמן.
הערה: כל הפתרונות סוכרוז צריך להיות מסונן לאחר solubilization באמצעות מסנן מיקרומטר 0.4 פקוק לתוך מזרק. שימו לב כי הפתרונות 60% - ו 70%-סוכרוז שקשה solubilize, צריך להיות ממוקם בתוך אמבט המים מראש חימם ב 60 ° C כדי להקל על solubilization. לערבב כל 10 דקות עד התפרקה לחלוטין סוכרוז.- כדי להכין 25% סוכרוז, שוקלים 25 גר' סוכרוז ולהתאים את משקל 100 גרם על-ידי הוספת 10 מ מ K-צינורות (pH 7.2).
- כדי להכין 60% סוכרוז, שוקלת 60 גר' סוכרוז ולהתאים את משקל 100 גרם עם 10 מ מ K-צינורות (pH 7.2).
- היכונו סוכרוז פתרונות מעבר הצבע סוכרוז. הכן 40% סוכרוז באמצעות במשקל 40 גר' סוכרוז והתאמת הפתרון 100 גרם עם 10 מ מ K-צינורות (pH 7.2). באופן דומה, להכין 50% (w/w) 70% (w/w) סוכרוז.
- לאחסן את הפתרונות ב-20 ° C. יש להיזהר resuspend הפתרונות סוכרוז כראוי לאחר מפשיר.
- להכין 100 מ של מאגר פירוק על ידי ערבוב 1 מ HEPES (pH 7), MgCl 0.5 מ מ2, ו- 1% NP-40 ושמור אותו ב 4 º C. תמיד הכינו מתוקים מאגר זה ביום של הניסוי. הוסף אנטי-פרוטאז טבליות ביום של הבידוד צנטריול.
- להכין 1 x פוספט מאגר תמיסת מלח (PBS) (pH 7.4) על ידי ערבוב 8 גרם של NaCl, דור 2 של אשלגן כלורי, g 1.44 של Na-2-HPO-4ו- 0.24 גר'2פו ח'4 ב 800 מיליליטר מזוקקים H2O. התאם pH ל 7.4 עם HCl. הביאו את עוצמת הקול של התערובת ל- 1 L עם מזוקקים H2O.
2. בידוד של reinhardtii ג Centrioles
הערה: ראה איור 1.
-
תרבות והרחבה של תאים reinhardtii ג
- בערב ביום 1, לחסן cw15 - זן מצלחת מוצק בתרבות Erlenmeyer בקבוק המכיל 10 מ ל 1 x ברז. לגדל את התאים תחת נורות ניאון לבן (60 µE/m s2) 2-3 ימים ב- 23 ° C.
- ביום 3, לדלל את התרבות 10 x (עד 100 מ"ל) ב- 1 x ברז וגדלים התאים תחת אור 2-3 ימים ב- 23 ° C.
- יום 6, לדלל את התרבות 10 ב 1 x-x הקש כדי לקבל 1 ליטר של תרבות. לגדל את התאים תחת אור ב 23 ° C עד התרבות מגיע בצבע ירוק כהה, המציין של צפיפות תא משוער של ~ 1 x 107 תאים למ"ל26 (יום 9 – 10).
-
טיהור של reinhardtii ג centrioles
- Centrifuge cw15 - התאים ב x 600 g 10 דקות צינורות חרוט 50 מ. לשטוף את צניפה של תאים x 1 עם 50 מ של 1 x PBS, לסובב אותו ב 600 x גרם במשך 10 דקות Resuspend בגדר ב- 100 מ של מאגר deflagellation בטמפרטורת החדר עם פיפטה.
- Deflagellate התאים עם שוק ה-pH על-ידי הוספת לאט טיפות של חומצה אצטית 0.5 M pH הסופי של 4.5 – 4.7 על פגים, דגירה התאים עבור 2 דק לאט להוסיף טיפות של קו 1 N כדי לשחזר את ה-pH 7.0.
- Centrifuge התאים ב x 600 g 10 דקות להסיר את כל שוטון מנותקת. הסר את תגובת שיקוע ולאחסן בגדר על קרח. לשטוף את צניפה 2 x עם 50 מ של PBS 1 x precooled ב 4 º C. לאחר מכן, ספין בגדר ב x 600 g 10 דקות ב 4 º C.
- Resuspend בגדר ב30 מ"ל של PBS 1 x וטען לאט התליה על גבי כרית 25%-סוכרוז של 20 מ ל ללא ערבוב (איור 1B).
- ספין-x 600 g למשך 15 דקות ב 4 ° C כדי להסיר את שוטון הנותרים תגובת שיקוע; התאים מתפשטים בבית 25% סוכרוז (איור 1C). לשמור רק את התחתון ביותר 20 מ"ל (חץ אדום, איור 1C) על ידי בקפידה כ רפה בעברית את תגובת שיקוע באמצעות של העצמות.
- רחץ mL 20 הנותרים על-ידי הוספת 20 מ של PBS קר 1 x. ספין המדגם ב x 600 g 10 דקות ב 4 º C. Resuspend בגדר ב 10 מ"ל של PBS קר 1 x (ב 4 ° C). ודא כי ישנם גושים לא כך פירוק הבאים מכה כל התאים בו זמנית.
- העברה בגדר resuspended בקבוק 250 מ ל חדש. להוסיף 100 מ של המאגר פירוק בתוספת 5,000 יחידות DNase לתאים. חשוב להוסיף את המאגר פירוק התאים, לא להיפך. דגירה התערובת לשעה ב 4 ° C, ולערבב בזהירות על-ידי היפוך הבקבוק כל 15 דקות ללא יצירת בועות.
- Centrifuge התאים lysed ב x 600 g 10 דקות ב 4 ° C 50 מ ל צינור חרוטי כדי להסיר את כל שאריות תאים. אם פירוק בוצעה כראוי, בגדר התא צריך להיות לבן (איור 1D). לאסוף את תגובת שיקוע עם פיפטה, להעמיס אותם על צינור עגול-התחתון 30 מ ל המכיל כרית 60%-סוכרוז, מניחים על קרח. . ואז, לסובב את הצינור ב x 10,000 g למשך 30 דקות ב 4 º C.
הערה: סיבוב המדרגה מספר צינורות (טבלה של חומרים) עשוי להיות נחוץ, בהתאם לנפח של תגובת שיקוע. - האחות supernatant עד 1 מ"ל מעל כרית סוכרוז. שימו לב הממשק צהוב בין 1 מ"ל של תגובת שיקוע הנותרים mL 2 של כרית סוכרוז. מערבבים בעדינות את סוכרוז, את תגובת שיקוע הנותרים עם טיפ P1000 לחתוך. לא מערבולת בשלב זה; . אחרת, procentrioles יכול להיות אבוד בשלב זה. בריכה כל כריות סוכרוז ולאחסן אותם על קרח.
- להכין הדרגתי % - 70% סוכרוז 40 דקות קיר mL 38.5 צינור פוליפרופילן בהוספת בעדינות 3 מ"ל של 70% סוכרוז (ב 4 ° C), ואחריו 3 מ"ל של 50%, ואת סוף סוף, 3 מ"ל של 40% סוכרוז. לטעון את הממשקים במאגר על גבי המילוי ההדרגתי 40% - 70% סוכרוז; לעשות זאת באיטיות מכיוון סוכרוז קר הוא מאוד צמיגה. לאזן את הצינורות עם המאגר 10 מ מ K-צינורות (pH 7.2), centrifuge אותם ב 68,320 x g (למשל, עם רוטור SW32Ti) עבור 1 שעות ו-15 דקות ב 4 º C.
- לאסוף 12 x 500 שברים µL ב 4 ° C על ידי עושה חור בתחתית של הצינור עם מחט 0.8 מ מ מבלי להפריע את השכבות השונות סוכרוז. עם טיפ פיפטה P200 לחתוך, להכין aliquots 10 µL נוספים של כל שבר זה ישמש את immunofluorescence הבאות. Snap-הקפאת השברים בחנקן נוזלי.
הערה: ניתן לנתח centrioles מבודדים על ידי מיקרוסקופ כדי להבטיח ultrastructure הכללית של centrioles נשמר.
3. כימות של Centrioles מבודד על Coverslips: צנטריפוגה, Immunofluorescence
הערה: ראה באיור 2.
-
הכנת את הצינורות ואת coverslips
- השתמש 1 סיבוב המדרגה מבחנה (15 מ ל) לכל סיעה כדי לנתח שברים centriolar (12 צינורות סה כ).
- מכניסים מתאם תמיכה מותאמת אישית coverslip (נקרא מתאם להלן) ברכבת התחתית התחתונה עגול. המקום coverslip סטרילי 12 מ מ לתוך הצינור עגול-התחתון.
הערה: כאן השתמשנו coverslips 12 מ מ, אך ניתן להתאים את הפרוטוקול על coverslips 18 מ מ באמצעות צינורות סיבוב המדרגה 30 מ. - הוסף 5 מ של טרום מקורר 10 מ מ K-צינורות (pH 7.2) ב 4 º C. ודא כי coverslip לא צפה, נשאר למטה המתאם. במקום הצינורות על קרח.
-
צנטריפוגה של centrioles
- לדלל כל שבר µL 10 µL 100 קר 10 מ מ K-צינורות (pH 7.2). Resuspend דילול טוב עד להיעלמותן סוכרוז (איור 2א). לטעון כל שבר מדולל לתוך צינור עגול-התחתון.
- לסובב את הצינור ב x 10,000 g למשך 10 דקות (למשל, עם דלי מתנדנדים JS-13.1 רוטור) ב 4 º C.
- לשחזר את coverslip על-ידי הוספת התקן מכור בעבודת יד לתוך החור נוכח המחורץ קצה המתאם, תרימו את זה בעדינות.
הערה: המכשיר מכור בעבודת יד יכולה להתבצע באמצעות מחט מזרק ידני מכור של יצוק על מקל תוצרת בית (דמויות 2B-2D). - כשמגיעים העליון של הצינור עגול-התחתון, ללכוד המתאם עם אצבע בכפפה בקצה ולהסיר את coverslip עם פינצטה. הקפד לזכור באיזה צד של coverslip מכיל את centrioles. להמשיך להתייחס על coverslips עבור immunofluorescence.
-
Immunofluorescence מכתים והדמיה של מבודדים reinhardtii ג centrioles
הערה: ראה באיור 2.- להכין את החומר עבור immunofluorescence מכתים כדלקמן.
- הכנת מתלה צביעת מכסה זכוכית בתוך קופסה מעבדה שידור פוליסטירן קריסטל (60 מ"מ אורך על ידי 50 מ מ רוחב על ידי 43 מ מ גובה). למלא אותו 100% מתנול ואחסן אותו ב-20 ° C.
- הכן תא לח. בשביל זה, להרכיב את החדר לח על-ידי הצבת רקמה humidified-מים לצד הפנימי קצוות של ריבוע פטרי (איור 2E). הוסף פיסת מעבדה איטום גלישת (ראה טבלה של חומרים) עד לאמצע הפטרי שעליו תערובות נוגדן יוצב במהלך ההליך immunofluorescence (צעדים 3.3.2–3.3.3). לכסות את המכסה תא לח ברדיד אלומיניום, כדי להגן עליה מפני אור.
- Immunostain centrioles מבודדים כמו עוקב אחר.
- לתקן את coverslips עם centrioles ישירות לאחר צנטריפוגה (שלב 3.2.4) מאת המקננת בהם במשך 5 דקות בתיבה מלא עם מתנול-20 ° C (שלב 3.3.1.1).
- הסר את coverslips עם פינצטה והמקום אותם בקופסה מעבדה שקופים (ראה טבלה של חומרים) ממולא 50 מ של 1 x PBS ולשטוף אותם למשך 5 דקות בטמפרטורת החדר.
- פיפטה 60 µL של נוגדן ראשוני מיקס [ראשי נוגדנים מדולל 1% אלבומין שור (BSA) ו- 0.05% Tween-20 ב- PBS] של חתיכת מעבדה איטום גלישת בבית הבליעה לח. שכב בקפידה על coverslips על המיקס נוגדן centrioles ישירות מול הירידה. דגירה על coverslips למשך 45 דקות עם נוגדנים העיקרי.
הערה: נוגדנים העיקריים ששימשו להפקת התוצאות נציג הם ארנב polyclonal Bld12 (1:300) ואת העכבר α-טובולין (DM1A) (1:300). - הסר את coverslips ולשטוף אותם למשך 5 דקות ב- 1 x הציבורית, כפי שמתואר בשלב 3.3.2.2. דגירה על coverslips למשך 45 דקות עם נוגדנים משניים ב- PBS המכיל 1% BSA ל- 0.05% Tween-20.
הערה: נוגדנים משניים ששימשו להפקת התוצאות נציג הם עז אנטי עכבר מצמידים אלקסה 488 (1:1, 000) העז נגד הארנב מצמידים אלקסה 568 (1:1, 000). - הסר את coverslips ולשטוף אותם למשך 5 דקות ב- 1 x הציבורית, כפי שמתואר בשלב 3.3.2.2.
- הר על coverslips על משטח זכוכית על-ידי הוספת µL 3 של הרכבה בינונית בשקופית והצבת בקפידה על coverslips למעלה (centrioles מול המדיום הרכבה). לאטום את הקצה coverslip עם לק.
- תמונה של centrioles מבודד על מיקרוסקופ קונפוקלי ב 63 X שמן המטרה עם אנונימיים של 1.4 תוך יישום deconvolution27 (ראה טבלה של חומרים).
הערה: כאן, ההגדרות הבאות שימשו: 500 – 545 nm 488 אלקסה, 580-635 ננומטר על אלקסה 568.
- להכין את החומר עבור immunofluorescence מכתים כדלקמן.
4. ריכוז של Centrioles במרכז Coverslips
הערה: ראה איור 3.
-
הכנת חומרים
- הכן צינור עגול-תחתית זכוכית 15 מ"ל על קרח, מתאם תמיכה מותאמת אישית coverslip (נקרא מתאם בעתיד, .stl קובץ הניתנים 1 קובץ משלים), רכז מותאם אישית (קובץ .stl מספק כ- 2 הקבצים המשלימים) וכן 10 מ מ K-צינורות (pH 7.2) ב 4 º C.
- להכין פולי-D-ליזין (PDL)-מצופה coverslips. לדלל 10 x 1 מ"ג/מ"ל PDL מניות הפתרון עם H2O. ראשית, לשטוף את coverslips עם 70% EtOH, הסר האתנול, ולתת ש-coverslips יבש. מעיל על coverslips עם PDL, דגירה אותם למשך 30 דקות בטמפרטורת החדר. לשטוף את coverslips 3 x עם מים ולתת להן להתייבש.
הערה: המעיל coverslips עם PDL כדי להגדיל את מספר centrioles מבודדים לצרף coverslips.
-
צנטריפוגה
- המקום של coverslip סטרילי 12 מ מ על גבי הפסקה, התחתון-סוף במסוע, שמירה של PDL מעיל עם הפנים למטה. קאפ coverslip על-ידי הצבת את המתאם ישירות על גבי. היפוך ברכבת התחתית התחתונה סיבוב ומניחים אותו על רכז, coverslip, ועל מתאם.
- בעדינות לדחוף את ההרכב עם פינצטה עד שהוא מגיע לתחתית הצינור עגול-התחתון, להפוך את הצינור. להוסיף 10 מ מ K-צינורות מאגר (pH 7.2) ברכבת התחתית התחתונה עגול עד שזה מגיע לפסגת במסוע. ודא כי לא נותרו בועות בתוך הגליל המרכזי של במסוע.
- בעדינות להוסיף 100 µL 10 מ מ K-צינורות מאגר (pH 7.2) aliquot אחד המכיל צנטריול מועשר שבר ומערבבים היטב את עוצמת הקול.
- להסיר µL 100 מ מ 10 K-צינורות מאגר (pH 7.2) במרכז החלול של במסוע ולהוסיף µL 100 של השבר centriolar מועשר במאגר 10 מ מ K-צינורות (pH 7.2) במרכז החלול של רכז, לדאוג כי התוכן נשאר במרכז החלול.
- צנטריפוגה ב x 10,000 ג'י 10 דקות (למשל, עם דלי מתנדנדים JS-13.1 רוטור) ומפרידה טרום מקורר-4 מעלות צלזיוס.
- הסר את רכז עם פינצטה.
- לשחזר את coverslip על-ידי הוספת התקן מכור בעבודת יד לתוך החור נוכח המחורץ קצה המתאם, תרימו את זה בעדינות. כשמגיעים העליון של הצינור עגול-התחתון, ללכוד המתאם עם אצבע בכפפה בקצה ולהסיר את coverslip עם פינצטה. הקפד לזכור באיזה צד של coverslip מכילים centrioles. להמשיך להתייחס על coverslips עבור immunofluorescence.
הערה: ניתן לבצע המכשיר מכור בעבודת יד עם מחט מזרק ידני מכור של יצוק על מקל תוצרת בית (דמויות 2B-D). - לבצע קיבוע immunofluorescence מכתים של centrioles מרוכז כפי שנעשה צעד 3.3.2–3.3.4.
5. יחיד-חלקיקים ממוצע
הערה: ראה איור 4.
- הדמיה עבור יחיד-חלקיקים ממוצע
- הר coverslip בשקופית בעזרת אמצעי קבוע נגד דהייה הרכבה. לבצע הדמיה במיקרוסקופ (2D SIM) תאורה מובנית באמצעות מטרה CFI עדשה אפוכרומטית TIRF (100 X, נה 1.49, WD 0.12 מ"מ), גב מואר מצלמת EM CCD.
הערה: הזמן רכישה הוגדר 100 ms-מצלמה לקרוא מתוך 3 מגה-הרץ. עדשה X 2.5 שימש עבור הדמיה SIM.
הערה: ערכת הנתונים המובאים כאן נרכשה במיקרוסקופ SIM תלת-ממדי (ראה טבלה של חומרים). - תמונה centrioles על ידי רכישת אוסף גדול של תמונות הכוללת צנטריול הכולל את האות, על-ידי הגדרת המיקום העליון והתחתון של Z-המחסנית מעל ומתחת האות צנטריול, בהתאמה. המשך פרויקט הערימה ולבצע יחיד-חלקיקים בממוצע לפי שלבים 5.2 ו- 5.3.
- הר coverslip בשקופית בעזרת אמצעי קבוע נגד דהייה הרכבה. לבצע הדמיה במיקרוסקופ (2D SIM) תאורה מובנית באמצעות מטרה CFI עדשה אפוכרומטית TIRF (100 X, נה 1.49, WD 0.12 מ"מ), גב מואר מצלמת EM CCD.
- הקרנה במחסנית
- פתח של אוסף התמונות עם ImageJ. ולאחר מכן לחץ על 'תמונה ← ערימות ← Z פרוייקט'. להגדיר את סוג ההקרנה כמהמקסימום עוצמה'.
- להפוך את התמונה על ידי לחיצה על 'לערוך ← ' היפוך ''. להציל את התחזית שנוצר (תבנית. tif).
- יחיד-חלקיקים יישור עם Scipion
- ליצור פרוייקט חדש Scipion על-ידי הקשה על האדום ' לחצןצור פרוייקט' בחלק העליון של הדף. בלוח השמאלי, לחץ פעמיים על 'יבוא ← ייבוא micrographs'.
- למלא 'ספריית קבצים' , 'דפוס ' שדות לפי נתוני מדריך שמות. לשמור על הפרמטרים של ברירת המחדל. לחץ על 'בצע'.
- לחץ פעמיים על 'חלקיקים ← איסוף ← xmipp3 - המדריך בוחר (שלב 1)'. לחץ על סמל זכוכית המגדלת קרוב לשדה 'קלט micrographs' ובחר את micrographs מיובא מ שלב 5.3.1. לחץ על 'בצע'.
- בחלון שנפתח, בחר חלקיקים מתוך micrographs שונות על ידי לחיצה עליהם. לאחר סיום כל micrograph, לחץ על הכפתור האדום '+ נקודות ציון'.
- לחץ פעמיים על "חלקיקים ← תמצית ← xmipp3 - תמצית חלקיקים". לחץ על סמל זכוכית המגדלת קרוב לשדה 'קואורדינטות קלט' , בחר את הקואורדינטות שנאספו משלב 5.3.4. למלא את 'חלקיק בתיבה גודל (px)' על-פי ממדי חלקיקים. הכרטיסיה 'Preprocess' , הגדר את הסרת אבק: אין (זה יכול ליצור חפצים); היפוך ניגודיות: אין (רקע חלקיקים שחור, לבן); היפוך פאזה: לא (מקושר תיקון CTF); לנרמל: כן.
- לאחר מכן, לחץ על 'הפעלה'. העבודה, בדוק החלקיקים שחולצו על ידי בחירת התיבה של העבודה (גבולות הופכים להיות עבה יותר) ולחץ על 'ניתוח תוצאות (השמאלית התחתונה של התפריט הראשי).
- לחץ פעמיים על '← 2D ליישר ← xmipp3 - להתיישר עם cl2d'. לחץ על סמל זכוכית המגדלת קרוב לשדה "קלט חלקיקים" ובחר את החלקיקים שחולצו מהשלב 5.3.5. אל תשתמש תמונת ייחוס. לחץ על 'בצע'.
- לחץ פעמיים על ' ← 2D ליישר ← xmipp3 ← יותר - החל יישור 2d'. לחץ על סמל זכוכית המגדלת קרוב לשדה "קלט חלקיקים" ובחר את החלקיקים מסודרים מ שלב 5.3.7.
- לחץ על 'הפעלה' כמו שלב 5.3.6. התוצאות ניתן לבדוק על ידי לחיצה על 'ניתוח תוצאות' לאחר בחירת תיבת העבודה.
- לחץ פעמיים על 'חלקיקים ← מסכת ← xmipp3 - להחיל מסיכה 2d'.
- לחץ על סמל זכוכית המגדלת קרוב לשדה "קלט חלקיקים" ובחר את החלקיקים מסודרים מ שלב 5.3.9. 'מסיכת מקור' מוגדרת 'גאומטריה'. לאחר מכן, הגדר את הפרמטרים של המסכה כסוג המסכה: מעגלית; רדיוס (px): מחפש מחלקיק אחד (צנטריול) ללא שום דבר סביבו, לחץ על 'שרביט הקסם ' הסמל בצד שמאל אשר פותח חלון כדי לעזור למצוא את הערך המושלם; מרכז shift: לא (אם החלקיק ממורכזת לחלוטין) או כן (אם החלקיק הוא זז); היסט X-מרכז: בהתאם למיקום של חלקיקים; הסטת Y-מרכז: בהתאם למיקום של חלקיקים. לחץ על 'בצע'.
- השתמש בלחצן ' לנתח תוצאות ' כדי לבדוק אם המסכה מוחל כראוי. אם לא, לחץ לחיצה ימנית על העבודה 'החל מסיכה 2d' ובחר 'עריכה'. לשנות את הפרמטרים של המסיכה (גודל ו/או משמרות) ולהפעיל אותה שוב עם "לבצע" כפתור.
- לחץ פעמיים על '← 2D Classify ← xmipp3 - cl2d'.
- לחץ על סמל זכוכית המגדלת קרוב לשדה "קלט חלקיקים" ובחר את החלקיקים רעולי פנים משלב 5.3.11. מספר כיתות צריכה להיות כדי להשיג כ 50 חלקיקים כל שיעור. לחץ על 'בצע'.
- בדקו את התוצאות על-ידי לחיצה על לחצן ' לנתח תוצאות ' . בחלון שנפתח, לחץ על הסמל 'עין' ממש ליד "מה להראות".
- החלון החדש מאפשרת הפיקוח של המעמדות שנוצרו על-ידי בחירת 'Classes2D' בתפריט 'קוביית מידע' . בדוק את התוכן של כל מחלקה על-ידי בחירת 'Class00N_Particles' באותו התפריט. לבדוק את כל כיתה לזהות אילו מכילים חלקיקים רק רע. חזור לתצוגה ' ' 'Classes2D' ובחר את השיעורים עם חלקיקים טוב על-ידי לחיצה על כל אחד. . זה ניתן לבחור בכמה כיתות על ידי שמירה על מקש 'Ctrl' לחוץ בעת הבחירה.
- כאשר כל מחלקות עם חלקיקים טוב נבחרו, לחץ על '+ חלקיקים' כדי ליצור קבוצת משנה עם החלקיקים.
- באותו החלון, בחר כמה סטים של מחלקות אשר מייצגים נטיות שונות של החלקיקים. צור קבוצת משנה חדשה על ידי לחיצה על '+ ממוצעים'.
- עבור כל כיוון/ממוצע שנבחרו, לעשות כדלקמן.
- לחץ פעמיים על '← 2D ליישר ← xmipp3 - להתיישר עם cl2d'.
- לחץ על סמל זכוכית המגדלת קרוב לשדה "קלט חלקיקים" ובחר את החלקיקים טוב מהשלב 5.3.17. הגדר 'שימוש תמונת ייחוס' 'כן'. לחץ על סמל זכוכית המגדלת קרוב השדה 'תמונת ייחוס' , לחץ על בצד שמאל חץ לבן לעבודה 'צור ערכת משנה' מהשלב 5.3.18 ובחר בתמונה כדי להשתמש בו כנקודת התייחסות. לחץ פעמיים על אובייקט כדי לפתוח אותו בחלון נפרד ולבדוק איזה אובייקט זה. לחץ על 'בצע'.
- לחץ פעמיים על ' ← 2D ליישר ← xmipp3 ← יותר - החל יישור 2d'. לחץ על סמל זכוכית המגדלת קרוב לשדה "קלט חלקיקים" ובחר את החלקיקים מסודרים מהשלב 5.3.19.2.
- לחץ על 'בצע'.
- בדוק את תוצאת היישור ('לנתח תוצאות '); זה יראה את החלקיקים מסודרים לבין הממוצע של חלקיקים אלה.
- אם הממוצע הוא טוב, החלקיקים הם כל מונחה באופן זהה, להציל את הממוצע על ידי לחיצה על ' מתקדם ← ImageJ' ולשמור את התמונה עם ImageJ.
- אם ניתן לשפר את הממוצע, בחר את כל התמונות מונחה היטב וליצור קבוצת משנה חדשה עם לחצן '+ חלקיקים' . לחזור על השלבים 5.3.19.1–5.3.19.4 עד המשנה ינוקו (רע החלקיקים הוסר). בכל פעם היישור ביצעה (שלב 5.3.19.2), ההפניה מוגדר הממוצע שנוצר האחרון (מתוך איטרציה כדי איטרציה, העליות איכות ממוצעת).
תוצאות
Reinhardtii ג צנטריול בידוד:
כדי לבודד centrioles, cw15- reinhardtii ג תאים היו גדלו בתרבות נוזלי במשך מספר ימים תחת אור, לאחר מכן מגורען על ידי צנטריפוגה ב x 600 גרם במשך 10 דקות Pelleted תאים נשטפו 1 x עם PBS ו resuspended ב deflagellation מאגר לפני deflagellation על ידי ביצוע הלם pH באמצעות חומצה אצטית 0.5 M pH הסופי של 4.5 – 4.7 למשך 2 דקות(איור 1). תוספת של 1 קו N שימש כדי לשחזר את ה-pH 7.0. להפריד שוטון מנותקת תא גופות, תאים deflagellated היו centrifuged תחילה להסיר את עיקר שוטון. בגדר ואז שטף 2 x עם PBS, resuspended ב- 30 מ של PBS לפני טעינתו לאט על כרית 25%-סוכרוז (איור 1B). הצינור היה טוו ב x 600 g למשך 15 דקות ב 4 ° C כדי להסיר את מרבית שוטון מנותקת. לאחר צנטריפוגה, הגופים תא היו פרושות כרית סוכרוז (איור 1C) והחלים על-ידי הסרת כ 30 מ של תגובת שיקוע (עד החץ האדום איור 1C). ML 20 וכתוצאה מכך התאים שטף היו לאחר מכן resuspended ב- 20 מ של PBS קר, centrifuged ב x 600 g למשך 10 דקות. בשלב הבא, תגובת שיקוע אבדו, התאים היו לגמרי resuspended ב- 10 מ"ל ל- PBS. התאים הועברו בקבוק 250 מ ל, המאגר פירוק נוסף על התאים resuspended בעת ובעונה אחת. DNase היה להוסיף את פירוק, מודגרות עבור h 1-4 מעלות צלזיוס. לאחר צעד צנטריפוגה כדי להסיר שאריות תאים (ראה בגדר לבן איור 1D), תגובת שיקוע היה אסף, מועמסים בזהירות על כרית 60%-סוכרוז 2 מ"ל לפני צנטריפוגה ב x 10,000 g למשך 30 דקות ב 4 º C. שימו לב כי עבור 100 מ של פירוק, 8 שפופרות 15 מ"ל שימשו כדי לבצע שלב זה, המתייחס מ"ל של פירוק מאגר טעון על 2 מ של סוכרוז למחזור. לאחר צנטריפוגה, רוב תגובת שיקוע הוסר עד 1 מ"ל מעל הכרית. 1 מ"ל של תגובת שיקוע הנותרים היה אז אספו עם כרית 2 מ"ל מעורב ואז איחדו כדי לקבל נפח סופי של 24 mL. הבריכה ואז נטען ב- 40%, 50%, 70%-סוכרוז שיפוע ו סובב ב 68,320 x g עבור 1 שעות ו-15 דקות ב 4 º C. לבסוף centrioles מבודדים שנאספו על-ידי יצירת חור בחלק התחתון של הצינור צנטריפוגה באמצעות מחט, הטיפות נאספו בחלקים µL 12 x 500. בשל צפיפות גבוהה סוכרוז שונים, הירידה נוצר באיטיות על ההתחלה (70% סוכרוז) ולאחר מכן יותר במהירות (40% סוכרוז).
Immunofluorescence של Centrioles מבודדים
כדי להעריך את האיכות של ההליך בידוד, 10 µL של כל שבר הדרגה שנאסף היה אז centrifuged אל coverslip באמצעות מתאם תמיכה coverslip (איור 2 א-2D). חשוב, כדי להסיר בבטחה את coverslip, התקן מותאם אישית מכור תוכנן (איור 2B). בשלב הבא, coverslips נותחו על ידי immunofluorescence. נוגדנים נגד CrSAS-6(Bld12p) שימשו במחקר זה כדי להצביע על קיומו של מבנה cartwheel וα-טובולין (DMA1) כדי לסמן את הקיר centriolar. על-ידי ספירת מספר centrioles אשר היו חיוביות עבור CrSAS-6 וα-טובולין לכל שדה ראייה, ואז לחשב את המספר הכולל של centrioles לכל שברים, ניתן היה לקבוע שברים אילו היו מועשרים לתעשיית מבודד centrioles ( איור 2F-2 H). מעניין, שברים 6 היו מועשר עבור centrioles (איור 2F , דור 2, שברים #1 – 6), לשיא של שבר #3, בעוד שברים האחרונה היו לא, המציין כי הטיהור עבד. שימו לב כי בניסוי מסוים זה, centrioles סה כ- 95% היו חיוביים עבור CrSAS-6 וα-טובולין ב שבר #3. אפשרות זו מציינת centrioles המבודדים ביותר נשמר גלגלונים שלהם. אם אין העשרה של centrioles הוא ציין בחלקים הראשון, ההליך בידוד לא עבד ולא לחזור. שימו לב כי כמה חתיכות השוטוניים יכול להיות שנצפו בעיקר בחלקים ללא centrioles.
הבא, כדי לחשב את המספר הכולל של centrioles לכל µL, יש להכפיל את מספר צנטריול לכל שדה ראייה על ידי היחס כפי שהוצג באיור 2H. תוצאה מספר צריך לחלק מכן האחסון של השבר המשמש את immunofluorescence כדי לקבל את מספר centrioles לכל µL. בהליך זה בידוד מסוים, השבר מועשר ביותר הכיל כ 37 centrioles על שטח של 0.00846 מ מ2 (עם נוף של תחום של 92 x 92 מיקרומטר2). פני השטח של מקטע הצינור היה 7.5 מ"מ ברדיוס עם פני שטח כולל של 176 מ מ2. היחס המתאים אז היה 176/0.00846 = 20,803.8, אז סך של centrioles 769,740 (37 פרק 20, 803.8) ב- 10 µL. לפיכך, מספר centrioles ב 1 µL היה 76,974.
ריכוז של Centrioles מבודד על Coverslips:
הגדלת מספר centrioles לכל שדה מגדילה את הסיכוי של זיהוי הכיוון צנטריול ברורה וחד משמעית, כמו גם להגדיל את הסיכוי של גילוי אוריינטציות דומות יכול לשמש עוד חלקיק הליכי חישוב ממוצע רגיל. כמו centrioles של שברים מרוכזים הם עדיין דליל-coverslip, פיתחנו כלי עזר צנטריפוגה להתרכז centrioles באמצע coverslip (איור 3א) בשם רכז. שימו לב: קובץ .stl עם הצעדים מדויק עבור הדפסה תלת-ממדית מסופק עם כתב היד הזה.
ראשית, coverslip אחד של 12 מ"מ היה רכוב על במסוע (איור 3ב). המתאם הונח על גבי coverslip, ברכבת התחתית התחתונה סיבוב הפוך והניח על מתאם שהורכב ועל רכז. הצינור עגול-התחתון היה אז בעדינות. הפוך, ובכך לאפשר את טעינת המדגם (פרוטוקול שלב 4.2). Centrioles היו אז centrifuged ב x 10,000 ג'י 10 דקות ב 4 º C. לאחר מכן, centrioles נתון immunofluorescence, צבעונית עבור CrSAS-6/Bld12p וα-טובולין (איור 3C-3E). חשוב, בלי רכז, centrioles כ-30 נראו לכל שדה ראייה (איור 3C), ואילו 183 centrioles היו נצפים שדה ראייה במסוע היה בשימוש (איור 3D-3F). שימו לב כי centrioles מכוסה רק בדיסק של 4 מ מ קוטר באמצע coverslip. תוצאה זו ממחישה כי הצעד ריכוז עובד ומאפשרת העשרת 6-fold של centrioles באזור מוגדר של coverslips, ובכך להקל את הזיהוי שלהם והדמיה.
יחיד-חלקיקים פלורסנט בממוצע של בודדים Reinhardtii ג Centrioles:
. הנה, באמצעות מיקרוסקופ SIM שיכול להגיע רזולוציה של 120 ננומטר, centrioles ישאר לכל monoglutamylated טובולין (GT335, איור 4), שינוי טובולין נוכח centriolar microtubules, היו שבעורך24. Reinhardtii ג centrioles הם בערך 500 ננומטר, תמיד בזוגות וארוך מצאו לעיתים קרובות עם הקשורים, לאחרונה משוכפלים גופות probasal (המכונה procentrioles להלן), תילומי סיבים הקשורים microtubule19. לפיכך, הרכבה סופית זו היה גדול כ 1 מיקרומטר. מסיבה זו, וכדי תמונה של centrioles בשלמותם, אנו ממליצים על רכישת ערימה-Z ב- centrioles מבודדים.
כאן, לאחר הרכישה, תמונה סופית נוצר על ידי ביצוע של הטלה בעוצמה מרבית באמצעות ImageJ28 (תמונה/אוספים/ת פרויקט/מקס הטלה בעוצמה, איור 4B). מתמונות כאלה, ניתוח חד-חלקיקים באמצעות תוכנה מיקרוסקופיית אלקטרונים הקפאה בוצע כדי להספיק לשיעור של centrioles עם אוריינטציות דומות ולאחר מכן בממוצע בוצעה. כדי לעשות זאת, צבע התמונה היה הפוך קודם כדי להמחיש טוב יותר את האובייקטים (איור 4C). Centrioles היו בחר באופן ידני בקופסת ממורכז מעל כל חלקיק באמצעות זמינה בחופשיות Scipion תוכנה29 המשלבת מספר תוכניות מיקרוסקופ אלקטרונים כגון Xmipp3 (איור 4D). שימו לב כי הגודל של תיבת יוגדר על-ידי המשתמש. הנה, קופסאות 50x50 פיקסלים עבור גודל פיקסל של 31.84 ננומטר שימשו. בשלב הבא, כל החלקיקים היו חילוץ (איור 4E) וכל שימוש Xmipp3 (איור 4F). בשלב הבא, מסכה מעגלית של 12 פיקסלים ברדיוס הוחל לבודד כל צנטריול מן centriolar-הזוג (איור 4G). החלקיקים סווגו ואז, באמצעות Xmipp3, כדי ליצור מספר ממוצעים. רק כיתה הומוגנית ממוצעים נשמרו, כלומר חלקיקים המתפצלים מתוך הממוצעים מחלקה היו נשלל באופן ידני. שלב זה חזר על עצמו על מנת ליצור ממוצע של כמעט מושלם עבור כל הכיוון שבחרת. אחרי חמש חזרות, נוצרו שתי מחלקות של ממוצעים: תצוגה העליון מאובייקטים 63 (איור 4H) וצד נוף 98 חלקיקים (איור 4אני) של monoglutamylated centrioles. הממדים של האובייקט נקבעו על ידי מדידת המרחק בין פסגות של הפרופיל מגרש בעוצמה לאורך האות monoglutamylation.
חשוב, אורך ממוצע הכיתה הצדדית הוא 260 ננומטר בקוטר של 250 ננומטר, להשוות האות טובולין monoglutamylated נמדד שהוצג כדי להתאים לשפה לאזור של 286 ± 33 ננומטר אורך בתוך תוכו של ה צנטריול17.
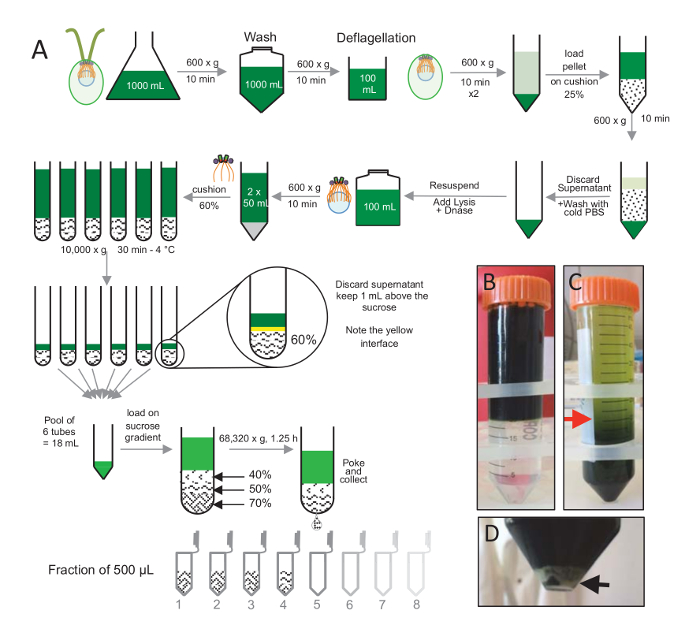
איור 1 : טיהור של Reinhardtii ג centrioles. (א) זהו ייצוג סכמטי של כל שלב מובילים את בידודה של reinhardtii ג centrioles. זה כולל שלבים נציג של פרוטוקול (B) לפני ו- (ג) לאחר צנטריפוגה אל מעבר הצבע 25%-סוכרוז. החץ האדום בחלונית C מציין את אמצעי האחסון המינימלית כדי לשמור לאחר צנטריפוגה. (D) לוח זה מראה את גלולה לבנה של תאים lysed לאחר צנטריפוגה. החץ השחור מציין בגדר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
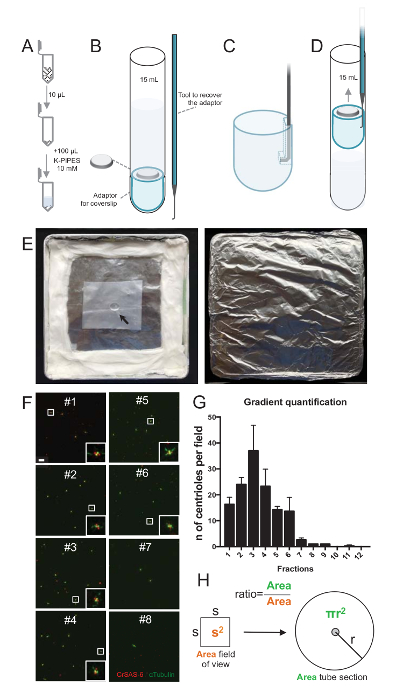
איור 2 : הגדרת צנטריפוגה כדי לבצע immunofluorescence על מבודדים centrioles. (א) 10 µL של כל שבר שנאספו הוא מדולל לראשונה ב- 100 µL 10 מ מ K-צינורות (pH 7.2). (B) הוא ייצוג סכמטי של המכשירים צנטריפוגה, המקיף צינור עגול-התחתון 15 מ"ל, coverslip של 12 מ מ, מתאם עבור coverslip, ואת מכשיר מכור מחוייט לשחזר את coverslip לאחר צנטריפוגה. לוחות C ו- D הצג ציורי המסביר כיצד לשחזר את coverslip לאחר צנטריפוגה. (ג) מקום הכלי מכור לתוך החור נוכח המחורץ קצה מתאם ו- (ד) משוך בעדינות. (E) אלה תמונות של החדר לח הדרושים לביצוע הדמיה immunofluorescence. החץ מציין את coverslip 12 מ מ. (F) אלה הם נציג קונאפוקלית תמונות ב- 63 X (זום 2) של שברים הדרגתיות #1-8, שנאספו במהלך ההליך טיהור, מוכתם CrSAS-6 (אדום) וα-טובולין (ירוק). ההזחה המתאימות לאזור המצוין על-ידי תיבה לבנה בתצוגות הגדלה נמוכה יותר. סרגל קנה מידה = 10 מיקרומטר. (G) זהו הגרף המייצג את מספר centrioles חיובי עבור CrSAS-6 וα-טובולין לכל שדה ראייה של כל שבר. הערה את העשרת שברים #1-6. המספר הממוצע של centrioles לכל שדה ב כל שבר: #1 = 16.3 ± 4.7, #2 = 24.0 ± 4.6, #3 = ± 37.0 17.0, #4 = ± 23.3 11.4, #5 = 14.3 ± 2.1, #6 = ± 13.7 9.3, #7 = 2.7 ± 1.2, #8 = ± 1.0 0.0, #9 = ± 1.0 0.0, #10 = ± 0.0 0.0, #11 = 0.3 ± 0.6, #12 = 0.0 ± 0.0. עבור כל שבר, 3 שדות אקראיים היו עם תמונה. שימו לב, בעת ספירת השבר מועשר ביותר #3, מצאנו כי 95% centrioles הם חיוביים עבור CrSAS-6 וα-טובולין (n = 205 centrioles). (H) של היחס בין מספר הנוכחים בשטח מדודה של micrographs centrioles משמש כדי לחשב את המספר הכולל של centrioles שנמצא באזור של הצינור. ניתן לחשב את מספר צנטריול לכל µL שברים µL במקור centrifuged 10. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
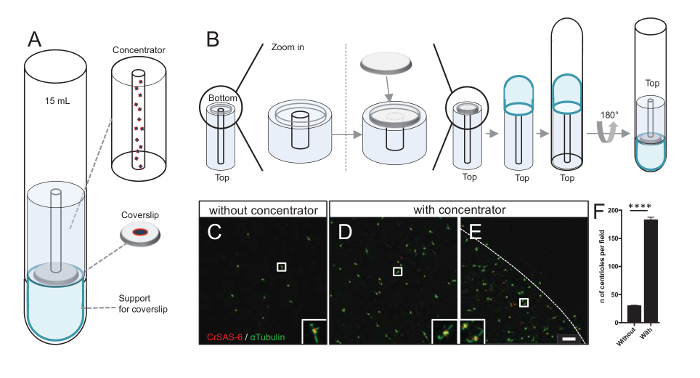
איור 3 : Centrioles מבודדים הם centrifuged באמצעות ריכוז. (A) לוח זה מראה ההתקנים צנטריפוגה צריך להתרכז centrioles על coverslips לפני immunofluorescence, כולל צינור עגול-התחתון 15 מ"ל, רכז, coverslip 12 מ מ עם מנגנון מתאם תמיכה. (B) לוח זה מראה את השלבים כדי להרכיב את המכשיר צנטריפוגה. C-E מראות תמונות קונאפוקלית של centrioles עבור CrSAS-6 (אדום) וα-טובולין (ירוק) (C) ללא או (D-E) מוכתם במסוע. ההזחה המתאימות לאזור המצוין על-ידי תיבה לבנה בתצוגות הגדלה נמוכה יותר. סרגל קנה מידה הוא 10 מיקרומטר. הערה כי centrioles מועשר באמצע coverslip (הקו המנוקד מייצג את הגבול של אזור מרוכז). (F) הגרף הזה מייצג את מספר centrioles לכל שדה ראייה ללא ועם במסוע. המבט שדות אקראיים חמש נותחו. המספר הממוצע של centrioles הוא, ללא רכז, 29.8 ± 2.9, ועם רכז, 182.6 ± 11.5, P < 0.0001. מובהקות סטטיסטית הוערכה על ידי אינטראקצית t-מבחן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
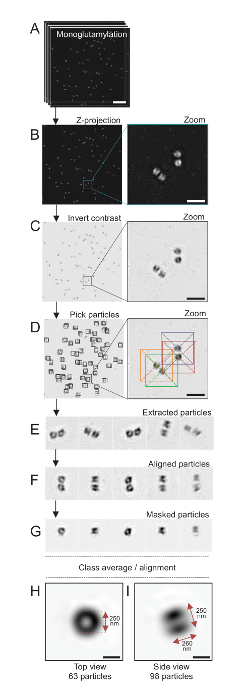
איור 4 : יחיד-חלקיקים בממוצע על מבודדים Reinhardtii ג centrioles. (א) לוח זה מראה Z תמונות בערימה של centrioles מוכתם GT335 והיא רכשה באמצעות מיקרוסקופ ה-SIM. (B) הלוחות הללו מציגות תחזית Z בעוצמה מירבית של תמונות מוערמות. סרגל קנה מידה = 1 מיקרומטר. (ג) אלה לוחות הצג תמונה ייצוגית עם ניגודיות הפוך. שיבוץ מייצג של זום-להמחיש את centrioles יותר טוב. (ד) אלה החלקיקים הצג לוחות האיסוף. שיבוץ מציין כיצד החלקיקים היו הרים. (E) אלו הן דוגמאות 5 שחולצו חלקיקים. (F) לוח זה מראה את החלקיקים לאחר יישור. (G) לוח זה מראה את החלקיקים לאחר החלת מסכה. לוחות H , אני אראה ממוצעים שיעור שני: תצוגה (H) מלמעלה (חלקיקי 63) ו- (אני) תצוגה בצד (חלקיקי 98). החיצים זוגי לציין את הממדים של האות GT335. סרגל קנה מידה = 250 ננומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
קובץ משלים 1. אנא לחץ כאן כדי להוריד את הקובץ.
קובץ משלים 2. אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
אחד האתגרים בביולוגיה הוא לפענח את ההתאמה המדויקת של חלבונים בהקשר אדריכלי. צנטריול הוא מבנה אידיאלי כדי להחיל שיטות אלה, כפי הארכיטקטורה נחקרה באמצעות טומוגרפיה הקפאה אלקטרונים, חושף תכונות מעניינות ultrastructural לאורכו. עם זאת, בשל המידות קרוב מגבלת רזולוציה במיקרוסקופ אופטי, קשה למקם בדיוק חלבון מאת immunofluorescence לאזור תת מבנית של צנטריול באמצעות מיקרוסקופים קונבנציונאלי30.
רזולוציית במיקרוסקופ אופטי הוא מוגבל על ידי בשבירת קרני האור שנותן, בערך, רוחבי ברזולוציה מקסימלית של 200 ננומטר מיקרוסקופ אופטי24. עם זאת, מגבלה זו כבר by-passed על ידי אחד של פריצות הדרך הגדולות של 20 השנים האחרונות מיקרוסקופ אופטי: המצאת שיטות סופר רזולוציה. גישות אלה יכולים ליצור תמונות מעבר לגבולות עקיפה ברזולוציות שונות: 120 ננומטר עבור SIM, כ-50 nm עבור דלדול פליטה מאולצת (STED) ו- 20-40 ננומטר עבור מולקולה בודדת לוקליזציה מיקרוסקופ (SMLM)24. ההתפתחויות של מיקרוסקופ ברזולוציה סופר, מחוזות משנה מבניים צנטריול תמצאו בר-השגה. עם זאת, בפועל, זה עדיין קשה לקבוע במדויק הלוקליזציה של חלבון לרכיב המבני עבור הסיבה העיקרית כי centrioles בוגרת קיימים רק שני עותקים לכל תא ויש אוריינטציות אקראי, מה שהופך את הפרשנות של לוקליזציה קשה. מסיבה זו, פרוטוקול הוקם המאפשר לחוקרים תמונה על ידי סופר רזולוציה מספר גדול של centrioles, יגדיל את הסיכוי לצפות אוריינטציות חד משמעיים. חשוב, כפי בשיטה זו נסמכת על השימוש centrioles מבודדים, אנו מספקים שיטה לטהר ללא פגע reinhardtii ג centrioles המכילות בוגרת centrioles ו- procentrioles.
בסופו של דבר, בשל הטווח של אוריינטציות צנטריול זה יכול לדימות עם פרוטוקול זה, ניתוח חד-חלקיק יכול להיות מיושם באמצעות מיקרוסקופ אלקטרונים תוכנה. התוצאה הדור של מחלקות הממוצע של centrioles בכיוון מסוים. חשוב, אלה תמונות דו-ממד וכתוצאה מכך ואז ניתן להעריך הלוקליזציה של חלבון ספציפי לאורך צנטריול. אכן, בשיטה זו ניתן להחיל תמונות סופר-ברזולוציה כפול-צבע, צבע אחד יכול לשמש כדי לחשוף השלד צנטריול (למשל, טובולין), בעוד אחרים הצבע ניתן לייחס centriolar חלבון ספציפי. על-ידי חיסור את הממוצעים שהושג עם צבע אחד או בשני צבעים, הוא הופך להיות יותר קל לרשום חלבון לאורך צנטריול (proximal, מרכזי או דיסטלי). שימו לב כי בין שני הערוצים במדויק יש ליישר כדי למנוע כל פרשנויות מטעה. יתר על כן, ממוצעים של תצוגות העליון יסייעו לפענח אם חלבון. רגישה בפנים centriolar לומן, לאורך הקיר microtubule או החוצה את צנטריול.
בשיטה זו יש יתרון לאמת הלוקליזציה של חלבונים מסוימים זה יכול להיות קשה להתאים לשפה אחרת בשל תיוג הטרוגנית. שימו לב כי שיטות אחרות כדי למפות חלבונים בתוך centrioles תוארו בכתבי correlative תלת-ממדי SIM/SMLM עם, למשל, להעריך את כיווני ספציפית של centrioles על-ידי קביעת הפרופיל אליפטית של סמן ויוצרים הטורוס סביב צנטריול מאת SIM הדמיה. שימוש בפרמטר זה, אפשרי להתאים לשפה חלבון עם דיוק של 4 – 5 nm30. שימו לב גם כי השיטה המתוארת כאן משתמש centrioles מבודדים עם procentrioles ללא פגע, סימן כי הארכיטקטורה צנטריול הוא כנראה במידה רבה והתפאורה. עם זאת, נוכל לפסול חלק מהתכונות אדריכליים הם והפריעו במהלך טיהור, כגון צנטריול קוטר משתנה עם הריכוז של קטיונים דו ערכיים כפי מוגבר עם הבידוד של האדם centrosome5.
אחד הצעדים הקריטיים של פרוטוקול המוצג כאן הוא לקבל centrioles מבודדים מספיק מרוכז נוטה Fluo-ספא שונים הכיוונים. לשם כך, תחילה ודא את הטוהר ואת היעילות של ההליך בידוד צנטריול. ריכוז נמוך של centrioles מבודדים תמנע נאות הדמיה ועיבוד תמונה נוספת. למטרה זו, אנו מספקים שיטה להעשיר את מספר centrioles לכל שדה ראייה. בהתאם למספר centrioles ב השבר בשימוש, האחסון שטעון במסוע צריך להיות מותאם, עם נפח מירבי של 250 µL.
חשוב, שיטה זו פותחה עבור חומה תא פחות תאים cw15-סי reinhardtii . זן זה, מאפשרת השבריריות של דופן התא של פירוק תקין של התאים, לפיכך, לשחרור התוכן שלה. פרוטוקול זה אינו יעיל עבור פראי-סוג reinhardtii ג תאים, כמו קיר התא מונעת פירוק תקין של. אסטרטגיות אלטרנטיביות כגון sonication או של דגירה מראש של התאים עם autolysin, אנזים זה יכול לבזות את דופן התא31, יצטרך לשים במקום לשנות קיר התא לפני החלת פרוטוקול בידוד המוצג כאן.
זה יכול לשמש עם סוגים שונים של מיקרוסקופים, ועד מיקרוסקופ קונפוקלי קונבנציונאלי מיקרוסקופים סופר רזולוציה תפוקה גבוהה ייעודי. שימו לב כשאתם עושים את SMLM, מאגר מיוחד נדרש עבור הדמיה נכונה, לפיכך, חדר מותאם של coverslip 12 מ מ עם המאגר מעל coverslip אמור לשמש. הדמיה לאחר מכן יבוצעו עם מיקרוסקופים הפוכה. אם הסידור מיקרוסקופ אינו מאפשר coverslip של 12 מ מ, ניתן ליישם את הפרוטוקול המובאת כאן coverslips 18 מ מ באמצעות צינור עגול-התחתון 30 מ ל ו מתאם ששונה רכז. חשוב גם הערה כי האיכות של השחזור האחרון ב- SMLM תהיה תלויה האיכות של ההכתמה ושל הנוגדן העיקרי בשימוש, כמו גם השיטה של קיבעון.
לסיכום, אנו מספקים שיטה שבה ניתן להחיל על התמונה centrioles רבים אחריו על ידי Fluo-ספא שתפיק ממוצעים של centrioles ב נטיות שונות, ובכך מסייעת למקם חלבון centriolar עם דיוק. חשוב לציין, בשיטה זו ניתן להחיל באופן כללי יותר centrioles מבודדים מפני זנים אחרים, organelles אחרים, או מכלולים macromolecular גדולים. בסופו של דבר, הגישה הכנה לדוגמה המוצגת כאן, בשילוב עם האחרונים פיתוח אלגוריתמים לניתוח יחיד-חלקיקים של SMLM פלורסנט נתונים32, יכול לפתוח עוד שיפור מולקולרית הקרטוגרפיה של גדול macromolecular הרכבות.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים פייר Gönczy, את BioImaging & אופטיקה פלטפורמה (BIOP) ב אקול פוליטכניק Fédérale דה לוזאן (EPFL), לוזאן, שווייץ, שבו נרכשו הדימויים centrioles ה-SIM. ניקולאי Klena Davide Gambarotto נתמכים על ידי המועצה האירופית למחקר (ERC) התחלתי גרנט (StG) 715289 (דגש) ו- Maeva Le Guennec, פול Guichard, תוכנית בידור האמל מאת PP00P3_157517 השוויצרי הלאומי למדע קרן (SNSF). Susanne Borgers נתמך על ידי באוניברסיטת ג'נבה.
Materials
| Name | Company | Catalog Number | Comments |
| Mouse monoclonal anti-apha tubulin (clone DM1A) | Abcam | ab7291 | dilution 1:300 |
| DNaseI | Roche | 10104159001 | |
| 12 mm coverslips | Roth | YX03.1 | |
| 18 mm coverslips | Roth | LH23.1 | |
| K2HPO4 | Fluka | 60355 | |
| KH2PO4 | Fluka | 60230 | |
| Tris base | Biosolve Chimie SARL | 0020092391BS | |
| acetic acid | Carlo Erba Reagents | 524520 | |
| NH4Cl | Sigma | A-4514 | |
| CaCl2 | Sigma | C-7902 | |
| MgSO4 | Sigma | 63140-500G-F | |
| steritop filter | Millipore | SCGPT05RE | |
| sucrose | Sigma | S7903-1KG | |
| HEPES | AppliChem PanReac | A3724,0250 | |
| PIPES | Sigma | P6757-500G | |
| MgCl2 | ACROS ORGANICS | 197530010 | |
| NP-40 | AppliChem PanReac | A1694,0250 | |
| Round-bottom (Kimble) tubes 15 mL | Fisherscientific | 09-500-34 | |
| Round-bottom (Kimble) tubes 30 mL | Fisherscientific | 09-500-37 | |
| cover glass staining rack | Thomas scientific | 8542E40 | |
| crystal polystyrene transmission lab box | FISHERS | 11712944 | |
| Methanol | VWR | 20864.32 | |
| BSA | Roche | 10735086001 | |
| Triton X100 | Roth | 3051.3 | |
| goat anti-mouse coupled to Alexa 488 | invitrogen | A11029 | dilution 1:1,000 |
| goat anti-rabbit coupled to Alexa 568 | invitrogen | A11036 | dilution 1:1,000 |
| mounting medium | abcam | ab188804 | |
| Tube, thinwall polypropylene | Beckman Coulter | 326823 | |
| Poly-D-Lysine 1 mg/mL | SIGMA | A-003-E | |
| Mouse monoclonal anti-Polyglutamylation modification mAb (GT335) | Adipogen | AG-20B-0020 | dilution 1:1,000 |
| glycerol mounting medium with DAPI and DABCO | Abcam | ab188804 | |
| 50 mL conical tubes | Falcon | 14-432-22 | |
| Eppendorf 5810R centrifuge | Eppendorf | 5811000622 | |
| Beckman JS-13.1 swinging bucket rotor | Beckman Coulter | 346963 | |
| Beckman SW 32Ti rotor | Beckman Coulter | 369694 | |
| parafilm | Bemis | 13-374-10 | |
| Leica TCS SP8 with Hyvolution mode | Leica | ||
| OSRAM L18W/954 LUMILUX | Luxe Daylight/ OSRAM | ||
| Whatman filter paper | Sigma | WHA1001325 | |
| CrSAS-6/Bld12 antibody | dilution 1:300 (Hamel el al., 2014) | ||
| Scipion | http://scipion.i2pc.es/ | ||
| EM CCD camera (Andor iXON DU897) | Andor |
References
- Bornens, M. The centrosome in cells and organisms. Science. 335 (6067), 422-426 (2012).
- Nigg, E. A., Holland, A. J. Once and only once: mechanisms of centriole duplication and their deregulation in disease. Nature Reviews Molecular Cell Biology. 19 (5), 297-312 (2018).
- Nigg, E. A., Raff, J. W. Centrioles, centrosomes, and cilia in health and disease. Cell. 139 (4), 663-678 (2009).
- Gönczy, P. Towards a molecular architecture of centriole assembly. Nature Reviews Molecular Cell Biology. 13 (7), 425-435 (2012).
- Paintrand, M., Moudjou, M., Delacroix, H., Bornens, M. Centrosome organization and centriole architecture: their sensitivity to divalent cations. Journal of Structural Biology. 108 (2), 107-128 (1992).
- Winey, M., O'Toole, E. Centriole structure. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Dippell, R. V. The development of basal bodies in paramecium. Proceedings of the National Academy of Sciences of the United States of America. 61 (2), 461 (1968).
- Allen, R. D. The morphogenesis of basal bodies and accessory structures of the cortex of the ciliated protozoan Tetrahymena pyriformis. The Journal of Cell Biology. 40 (3), 716-733 (1969).
- Li, S., Fernandez, J. -. J., Marshall, W. F., Agard, D. A. Three-dimensional structure of basal body triplet revealed by electron cryo-tomography. The EMBO Journal. 31 (3), 552-562 (2012).
- Guichard, P., Chrétien, D., Marco, S., Tassin, A. -. M. Procentriole assembly revealed by cryo-electron tomography. The EMBO Journal. 29 (9), 1565-1572 (2010).
- Guichard, P., et al. Native architecture of the centriole proximal region reveals features underlying its 9-fold radial symmetry. Current Biology. 23 (17), 1620-1628 (2013).
- Hirono, M. Cartwheel assembly. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Bornens, M., Paintrand, M., Berges, J., Marty, M. C., Karsenti, E. Structural and chemical characterization of isolated centrosomes. Cell Motility and the Cytoskeleton. 8 (3), 238-249 (1987).
- Keller, L. C., Romijn, E. P., Zamora, I., Yates, J. R., Marshall, W. F. Proteomic analysis of isolated chlamydomonas centrioles reveals orthologs of ciliary-disease genes. Current Biology. 15 (12), 1090-1098 (2005).
- Kilburn, C. L., et al. New Tetrahymena basal body protein components identify basal body domain structure. The Journal of Cell Biology. 178 (6), 905-912 (2007).
- Bauer, M., Cubizolles, F., Schmidt, A., Nigg, E. A Quantitative analysis of human centrosome architecture by targeted proteomics and fluorescence imaging. The EMBO Journal. 35 (19), 1-15 (2016).
- Hamel, V., et al. Identification of Chlamydomonas Central Core Centriolar Proteins Reveals a Role for Human WDR90 in Ciliogenesis. Current Biology. 27 (16), 2486-2498 (2017).
- Cavalier-Smith, T. basal body and flagellar development during the vegetative cell cycle and the sexual cycle of Chlamydomonas reinhardii. Journal of Cell Science. 16 (3), 529 (1974).
- Geimer, S., Melkonian, M. The ultrastructure of the Chlamydomonas reinhardtii basal apparatus: identification of an early marker of radial asymmetry inherent in the basal body. Journal of Cell Science. 117, 2663-2674 (2004).
- Nakazawa, Y., Hiraki, M., Kamiya, R., Hirono, M. SAS-6 is a cartwheel protein that establishes the 9-fold symmetry of the centriole. Current Biology. 17 (24), 2169-2174 (2007).
- Hamel, V., et al. Correlative multicolor 3D SIM and STORM microscopy. Biomedical Optics Express. 5 (10), 3326 (2014).
- Guichard, P., et al. Cell-free reconstitution reveals centriole cartwheel assembly mechanisms. Nature Communications. 8, 14813 (2017).
- Hiraki, M., Nakazawa, Y., Kamiya, R., Hirono, M. Bld10p constitutes the cartwheel-spoke tip and stabilizes the 9-fold symmetry of the centriole. Current Biology. 17 (20), 1778-1783 (2007).
- Sahl, S. J., Hell, S. W., Jakobs, S. Fluorescence nanoscopy in cell biology. Nature Reviews Molecular Cell Biology. 18 (11), 685-701 (2017).
- Hutner, S. H., Provasoli, L., Schatz, A., Haskins, C. P. Some Approaches to the Study of the Role of Metals in the Metabolism of Microorganisms. Proceedings of the American Philosophical Society. 94 (2), 152-170 (1950).
- Keller, L. C., Marshall, W. F. Isolation and proteomic analysis of chlamydomonas centrioles. Methods in Molecular Biology. 432 (1), 289-300 (2008).
- Borlinghaus, R. T., Kappel, C. HyVolution-the smart path to confocal super-resolution. Nature Methods. 13 (3), (2016).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- de la Rosa-Trevín, J. M., et al. Scipion: A software framework toward integration, reproducibility and validation in 3D electron microscopy. Journal of Structural Biology. 195 (1), 93-99 (2016).
- Gartenmann, L., et al. A combined 3D-SIM/SMLM approach allows centriole proteins to be localized with a precision of ∼4-5 nm. Current Biology. 27 (19), 1054-1055 (2017).
- Jaenicke, L., Kuhne, W., Spessert, R., Wahle, U., Waffenschmidt, S. Cell-wall lytic enzymes (autolysins) of Chlamydomonas reinhardtii are (hydroxy)proline-specific proteases. European Journal of Biochemistry. 170 (1-2), 485-491 (1987).
- Salas, D., et al. Angular reconstitution-based 3D reconstructions of nanomolecular structures from superresolution light-microscopy images. Proceedings of the National Academy of Sciences of the United States of America. 114 (35), 9273-9278 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved