Method Article
Imagem de fluorescência para a reconstrução da único-partícula de Chlamydomonas centríolos e isolamento
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nós desenvolvemos uma estratégia para purificar e um grande número de centríolos em diferentes orientações favoráveis para microscopia de super-resolução e único-partícula média da imagem.
Resumo
Centríolos são grandes conjuntos macromoleculares importantes para a boa execução dos processos biológicos fundamentais da célula, como divisão celular, motilidade celular ou sinalização celular. A alga verde Chlamydomonas reinhardtii provou para ser um modelo perspicaz no estudo da arquitetura do centríolo, função e composição de proteína. Apesar de grandes avanços em direção centriolar arquitetura de compreensão, um dos desafios atuais é para determinar a localização exacta do centriolar componentes dentro de regiões estruturais do centríolo a fim de melhor compreender o seu papel na biogênese centríolo. Uma grande limitação encontra-se na resolução da microscopia de fluorescência, o que dificulta a interpretação da localização da proteína nesta organela com dimensões próximo do limite de difração. Para abordar esta questão, estamos fornecendo um método para purificar e um grande número de c. reinhardtii centríolos de imagem com diferentes orientações usando microscopia de super-resolução. Esta técnica permite a transformação de dados por meio de fluorescente single-partícula média (Fluo-SPA) devido ao grande número de centríolos adquirida. Fluo-SPA gera médias de manchado c. reinhardtii centríolos em diferentes orientações, facilitando assim a localização de proteínas distintas em centriolar sub-regiões. Importante, esse método pode ser aplicado para centríolos imagem de outras espécies ou outros grandes conjuntos macromoleculares.
Introdução
O centríolo é uma organela evolutivamente conservada que reside no núcleo do centrossoma em células animais e pode atuar como um corpo basal (referido como centríolos daqui por diante) para cílios modelo ou flagelos em muitos eucariotos1,2. Como tal, centríolos são críticos para processos biológicos fundamentais da célula, que vão desde a montagem do eixo para sinalização de células. Portanto, defeitos na Assembleia centriole ou função têm sido associados com várias patologias humanas, incluindo câncer e ciliopathies3.
Centríolos são nine-fold, simétrico, microtubule triplet-com base em estruturas cilíndricas que são, normalmente, ~ 450 nm de comprimento e ~ 250 nm de largura4,5,6,7. Microscopia convencional e tomografia computadorizada do cryo-elétron de centríolos de diferentes espécies têm revelado que os centríolos são polarizados ao longo do seu eixo longo com três regiões distintas: uma região proximal, um núcleo central e uma região distal5 , 7 , 8 , 9 , 10 , 11. importante, cada uma dessas regiões apresenta características estruturais específicas. Primeiro, o lúmen da região proximal 100 nm de comprimento contém a estrutura de estrelinha ligada ao tripleto microtubule através da cabeça de alfinete elemento12. Em segundo lugar, a região central de 300 – 400 nm de comprimento contém fibrosas densidades nas lúmen e características estruturais ao longo da face interna dos microtúbulos: o vinculador em forma de Y, a cauda do túbulo-C e o túbulo-A9de stub. Finalmente, a região distal 50 – 100 nm exibe sub distais e distais apêndices que circundam a parte distal do centríolo5,13.
Nas últimas duas décadas foram marcadas pela descoberta de um número crescente de proteínas centriolar, levando a uma estimativa atual de cerca de 100 proteínas distintas, sendo parte do centríolo14,15,16, 17. apesar destes avanços, a localização exacta destas proteínas dentro o centríolo continua elusiva, particularmente dentro estruturais sub-regiões. Importante, atribuindo uma localização exacta para regiões estruturais do centríolo é crucial para um melhor entendimento da sua função. A este respeito, c. reinhardtii centríolos têm sido fundamentais para ambos os aspectos pelo primeiro delimitando as características estruturais diferentes ao longo do cilindro9,18,19, que então permitiu pesquisadores de correlacionar a localização de um subconjunto de proteínas usando microscopia fluorescente para uma região sub estrutural. Isso inclui, por exemplo, as proteínas Bld12p e Bld10p, que localizar na região proximal e na estrutura do carrinho em particular20,21,22,23. A lista das proteínas subestrutura localizada também inclui POB15 e POC16, duas novas proteínas identificadas por espectrometria de massa que decoram a região do núcleo central de c. reinhardtii centríolos17.
Este documento fornece uma descrição completa do método desenvolvido para isolar e c. reinhardtii centríolos para microscopia de super-resolução subsequentes e único-partícula média da imagem. Para atingir este objetivo, é importante delinear as limitações técnicas que precisam ser superados. Primeiro, a purificação centríolo pode afetar a arquitetura geral, com a estrutura de estrelinha, muitas vezes sendo perdida durante as várias etapas de isolamento9. Em segundo lugar, as dimensões do centríolo estão muito próximos do limite de difração em microscopia óptica. Com efeito, a resolução lateral que pode ser obtida em microscopia confocal é cerca de 200 nm24, semelhante ao diâmetro do centríolo e a resolução no z-axis é sobre 2 – 3 x menor, levando a um volume Anisotrópico. Em terceiro lugar, a heterogeneidade da orientação de rotulagem e centríolo anticorpo poderia limitar a interpretação necessária para localizar uma proteína em uma determinada região sub centriolar. Finalmente, centríolos existem em apenas duas cópias por célula, dificultando a adquirir um grande número de imagens e encontrar uma orientação inequívoca centríolo. Para contornar esses problemas técnicos, desenvolvemos um método que se baseia na aplicação de microscopia de super-resolução em um grande número de centríolos isolados que adotam diversas orientações. Primeiro, nós descreveremos um protocolo para purificar c. reinhardtii centríolos que permite a purificação de centríolos estruturalmente intactos e procentrioles contendo a roda. Em seguida, descreveremos um protocolo passo a passo para concentrar os centríolos lamelas para geração de imagens por convencional ou microscopia fluorescente Super-resolução. Essa etapa importante permite aumentar o número de centríolos fotografada em várias orientações. Finalmente, descreveremos um procedimento para executar uma média de único-partícula em dados adquiridos em microscópios fluorescentes que facilita a detecção de centríolos em diferentes orientações. No total, esse método pode ser aplicado para centríolos de imagem de várias espécies ou outros grandes conjuntos macromoleculares.
Protocolo
1. mídia preparação para c. reinhardtii cultura e isolamento de centríolo
-
Preparação dos meios de comunicação de células de c. reinhardtii cultura
Nota: As etapas abaixo descrevem a preparação de soluções padrão para 1 x médio de torneira (fosfato de Tris-Acetato).- Prepare um tampão fosfato (pH 7), misturando-se 250 mL de 1 M K2HPO4 (174,2 g de K2HPO4 complementado para 1 L com água destilada) com ~ 170 mL de 1 M KH2PO4 (136,09 g de KH2PO4 em 1 L). Ajuste a mistura para atingir pH 7.
- Preparar a solução (40x) misturando 96,8 g de Tris, 40 mL de tampão fosfato (pH 7) e 40 mL de ácido acético e ajustar a solução de 1 L com água destilada.
- Preparar a solução B (40 x) usando 16 g de NH4Cl, 2 g de CaCl2e 4 g de MgSO4. Tenha cuidado para dissolver CaCl2 em água destilada separadamente antes de adicioná-lo aos outros componentes. Ajuste a solução de 1 L com água destilada.
- Prepare-se oligoelementos reserva25 do Hutner como segue.
- Para 1 L de tampão, dissolver cada composto do volume indicado de água: (50 g em 250 mL), de sal dissódico de EDTA ZnSO4.7h2O 22 g em 100 mL, H3BO3 (11,4 g em 200 mL), MnCl2.4h2O (5,06 g em 50 mL) , CoCl2.6h2O (1,61 g em 50 mL), CuSO4.5h2O (1,57 g em 50 mL), (NH4) 6Mo724.4h2OO (1,10 g em 50 mL) e Filipa4.7h2O (4,99 g em 50 mL).
Nota: EDTA deve ser dissolvido em água fervente, e a Filipa4 deve estar preparado última para evitar oxidação. - Misture todas as soluções exceto o EDTA e leve para ferver. Em seguida, adicionar o EDTA, e a solução deve ficar verde. Após dissolver tudo, esfriar a solução a 70 ° C. A esta temperatura, adicione 85 mL de solução KOH 20% quente (20 g em 100 mL). Ajuste a solução de 1 L com água destilada à temperatura ambiente (RT).
- Adicionar um tampão de algodão no balão e deixe a solução repousar 1 ou 2 semanas, sacudindo-1 x por dia. A solução deve ser inicialmente verde e então ficar roxa, deixando um precipitado marrom-ferrugem; Remova o precipitado usando papel de filtro até que a solução é clara. As alíquotas de congelar e armazenar a-20 ° C.
- Para 1 L de tampão, dissolver cada composto do volume indicado de água: (50 g em 250 mL), de sal dissódico de EDTA ZnSO4.7h2O 22 g em 100 mL, H3BO3 (11,4 g em 200 mL), MnCl2.4h2O (5,06 g em 50 mL) , CoCl2.6h2O (1,61 g em 50 mL), CuSO4.5h2O (1,57 g em 50 mL), (NH4) 6Mo724.4h2OO (1,10 g em 50 mL) e Filipa4.7h2O (4,99 g em 50 mL).
- Preparar 1 x TAP médio crescer células de c. reinhardtii misturando os seguintes componentes: 25 mL da solução A (x 40) e 25 mL de solução B (x 40) com 1 mL de oligoelementos do Hutner buffer25e ajustar a mistura para 1 L com água destilada. Esterilize a mistura usando um filtro de 0,4 µm.
-
Preparação de mídia para a purificação de centríolo
- Prepare um buffer de deflagellation usando 5% de sacarose em 10 mM HEPES (pH 7) em um volume final de 500 mL com água destilada.
- Prepare 250 mL de ácido acético de 0,5 M.
- Preparar 250 mL de uma solução stock 1 M K-tubulações (pH 7,2) pelo primeiro adicionar 50 mL de H2O para dissolver o pó de tubos e, em seguida, adicionando 10 KOH N até a solução começa a ficar claro. Titula-se pH 7.2 com 10 N e 1 N KOH e ajustar a solução para um volume final de 250 mL com H2O.
- Prepare 5 soluções de sacarose (w/w) como segue.
Nota: Todas as soluções de sacarose precisam ser filtrado Após solubilização usando um filtro de 0,4 µm conectado a uma seringa. Observe que as soluções de 60% e 70%-sacarose são difíceis de solubilizar e devem ser colocadas em um banho de água pré aquecido a 60 ° C para facilitar a solubilização. Misture a cada 10 min até a sacarose é completamente dissolvida.- Para preparar a 25% de sacarose, pesar 25 g de sacarose e ajustar o peso de 100 g, adicionando 10 mM K-tubulações (pH 7,2).
- Para preparar a 60% de sacarose, pesar 60 g de sacarose e ajustar o peso de 100 g com 10 mM K-tubulações (pH 7,2).
- Prepare soluções de sacarose para o gradiente de sacarose. Prepare-se 40% de sacarose pesando 40 g de sacarose e ajustando a solução de 100g com 10 mM K-tubulações (pH 7,2). Da mesma forma, prepare a 50% (w/w) e 70% (p/p) de sacarose.
- Armazenar as soluções a-20 ° C. Tenha cuidado para Ressuspender as soluções de sacarose corretamente após o descongelamento.
- Preparar 100 mL de tampão de Lise por mistura 1 mM HEPES (pH 7) 0.5 mM MgCl2e 1% NP-40 e mantenha-a 4 ° C. Sempre prepare este fresco de reserva no dia do experimento. Adicione antiproteases comprimidos no dia do isolamento centríolo.
- Preparar 1 x salino de tampão fosfato (PBS) (pH 7,4) misturando 8 g de NaCl, 2 g de KCl, 1,44 g de Na2HPO4e 0,24 g de KH2PO4 em 800 mL de água destilada H2O. ajuste de pH para 7,4 com HCl. Bring o volume da mistura para 1 L com água destilada H2O.
2. isolamento de c. reinhardtii centríolos
Nota: Consulte a Figura 1.
-
Cultura e expansão de células de c. reinhardtii
- À noite, no dia 1, inocular uma cw15 - deformação de uma placa sólida em uma cultura de frasco de Erlenmeyer contendo 10 mL de 1 x TAP. Crescem as células sob luzes fluorescentes brancas (60 µE/m2s) por 2-3 dias a 23 ° C.
- No dia 3, diluir a cultura 10 x (100 mL) em 1 x toque e crescer as células sob luz por 2-3 dias a 23 ° C.
- No dia 6, diluir a cultura 10 x 1 x toque para obter 1 L de cultura. Crescem as células sob luz a 23 ° C, até que a cultura atinja uma cor verde escura que indica uma densidade aproximada de célula de ~ 1 x 107 células/mL26 (dia 9-10).
-
Purificação de c. reinhardtii centríolos
- Centrifugar as células cw15 - a 600 x g por 10 min em tubos de Erlenmeyer de 50 mL. Lave o pellet de células 1 x com 50 mL de 1X PBS e girá-lo a 600 x g durante 10 min. Ressuspender o pellet em 100 mL de tampão de deflagellation de temperatura com uma pipeta.
- Deflagellate as células com um choque de pH, lentamente adicionando gotas de ácido acético de 0,5 M a um pH final de 4,5-4,7 por um agitador magnético e incube as celulas por 2 min. Adicione, lentamente, gotas de 1 N KOH para restaurar o pH a 7,0.
- Centrifugar as células a 600 x g por 10 min remover qualquer flagelos desanexados. Remover o sobrenadante e armazenar a pelota no gelo. Lave o pellet 2 x com 50 mL de 1X PBS pré-resfriado a 4 ° C. Em seguida, girar a pelota a 600 x g durante 10 minutos a 4 ° C.
- Resuspenda o pellet em 30 mL de 1X PBS e carregar lentamente a suspensão sobre uma almofada de sacarose-25% de 20 mL sem mistura (Figura 1B).
- Girar a 600 x g durante 15 min a 4 ° C para remover os restantes flagelos no sobrenadante; as células são espalhadas na 25% de sacarose (Figura 1C). Manter apenas o mais inferior 20ml (seta vermelha, Figura 1C) aspirando cuidadosamente o sobrenadante usando um aspirador.
- Lave os restante 20 mL, adicionando 20 mL de PBS 1x frio. Girar a amostra a 600 x g durante 10 minutos a 4 ° C. Resuspenda o pellet em 10 mL de PBS 1x frio (a 4 ° C). Certifique-se de que não existem não aglomerados para que o seguinte lise atinge todas as células de uma só vez.
- Transferi o ressuspenso para uma nova garrafa de 250 mL. Adicione 100 mL de tampão de Lise suplementado com 5.000 unidades de DNase para as células. É importante adicionar a Lise das células, e não o contrário. Incubar a mistura durante 1 h a 4 ° C e misturar cuidadosamente invertendo-se o frasco a cada 15 min sem formar quaisquer bolhas.
- Centrifugar as células lisadas a 600 x g durante 10 minutos a 4 ° C, em um tubo cônico de 50 mL para remover os detritos de células. Se a Lise foi executada corretamente, a pelota de célula deve ser branca (Figura 1D). Recolher o sobrenadante com uma pipeta e carregá-lo em um tubo de fundo redondo de 30 mL contendo uma almofada 60% de sacarose, colocada no gelo. Em seguida, girar o tubo a 10.000 x g durante 30 min a 4 ° C.
Nota: Vários tubos de fundo redondo (Tabela de materiais) podem ser necessária, dependendo do volume do líquido sobrenadante. - Aspire o sobrenadante de até 1 mL acima da almofada de sacarose. Observe a interface amarela entre a 1ml do sobrenadante restante e o 2 mL da almofada da sacarose. Misture suavemente a sacarose e o sobrenadante restante com uma ponta de corte P1000. Fazer não vórtice neste passo; caso contrário, o procentrioles pode ser perdida nesta fase. Reunir todas as almofadas de sacarose e armazená-los no gelo.
- Prepare um 40% - 70% sacarose gradiente em um tubo de paredes finas 38,5 mL polipropileno, suavemente, adicionar 3 mL de 70% de sacarose (a 4 ° C), seguido de 3 mL de 50% e finalmente, 3 mL de 40% de sacarose. Carregar as interfaces em pool para 40% - 70% sacarose gradiente; Faça isto lentamente, porque o frio de sacarose é muito viscoso. Equilibrar os tubos com o K-tubos de 10 mM de tampão (pH 7,2) e centrifugá-los a 68.320 x g (por exemplo, com um rotor SW32Ti) durante 1 h e 15 min a 4 ° C.
- Colete frações de 12 x 500 µ l a 4 ° C, fazendo um buraco no fundo do tubo com uma agulha de 0,8 mm sem perturbar as camadas diferentes de sacarose. Com uma ponta de pipeta corte P200, prepare alíquotas adicionais de 10 µ l de cada fração que será usado para a seguinte da imunofluorescência. As frações snap-congelamento em nitrogênio líquido.
Nota: Centríolos isolados podem ser analisados por microscopia eletrônica para garantir que seja preservada a ultraestrutura global dos centríolos.
3. quantificação dos centríolos isolados em lamelas: centrifugação e imunofluorescência
Nota: Consulte a Figura 2.
-
Preparar os tubos e as lamelas
- Use 1 tubo de fundo redondo de vidro (15ml) por fração para analisar as frações centriolar (12 tubos no total).
- Colocar um adaptador de suporte personalizado lamela (chamado adaptador daqui por diante) dentro do tubo de fundo redondo. Coloque uma lamela estéril 12 mm no tubo de fundo redondo.
Nota: Aqui usamos as lamelas de 12 mm, mas o protocolo pode ser adaptado para as lamelas de 18 mm utilizando tubos de fundo redondo de 30 ml. - Adicionar 5 ml de pre-cooled 10 mM K-tubulações (pH 7,2) a 4 ° C. Certifique-se que a lamela não é flutuante e fica abaixo do adaptador. Coloque os tubos no gelo.
-
Centrifugação dos centríolos
- Dilua cada 10 fração µ l com 100 µ l de 10mm frio K-tubulações (pH 7,2). Resuspenda diluição bem até o desaparecimento completo da sacarose(Figura 2). Carrega cada fração diluída em um tubo de fundo redondo.
- Girar o tubo em 10.000 x g durante 10 minutos (por exemplo, com um rotor de balde oscilante JS-13.1) a 4 ° C.
- Recuperar a lamela, inserindo um dispositivo artesanal enganchado no orifício presente na extremidade ranhurada do adaptador e levante-a suavemente.
Nota: O dispositivo ligado artesanal pode ser feito com a agulha da seringa manualmente viciado e moldado para um stick caseiro (figuras 2B-2D). - Ao atingir o topo do tubo de fundo redondo, prender a borda do adaptador com um dedo com luva e remover a lamela com uma pinça. Tenha cuidado para se lembrar de que lado da lamela contém os centríolos. Proceda para tratar as lamelas para imunofluorescência.
-
Imunofluorescência, coloração e imagem da isolada c. reinhardtii centríolos
Nota: Consulte a Figura 2.- Prepare o material para a mancha da seguinte maneira.
- Prepare um rack de coloração do vidro de cobertura em uma caixa de laboratório de transmissão de poliestireno cristal (60 mm de comprimento por 50 mm de largura por 43 milímetros de altura). Preenchê-lo com 100% de metanol e armazená-lo a-20 ° C.
- Prepare uma câmara húmida. Por isso, montar a câmara húmida, colocando um tecido umedecido de água ao lado de dentro as bordas de um quadrado de Petri(Figura 2). Adicionar um pedaço de laboratório envoltório de vedação (ver Tabela de materiais) para o meio da caixa de Petri em que as misturas de anticorpo serão colocadas durante o procedimento de imunofluorescência (passos 3.3.2–3.3.3). Cobrir a tampa e a câmara húmida com folha de alumínio para protegê-lo da luz.
- Delgados os centríolos isolados como segue.
- Corrigi as lamelas com os centríolos diretamente após a centrifugação (etapa 3.2.4), incubando-os por 5 min na caixa preenchida com metanol-20 ° C (etapa 3.3.1.1).
- Remova as lamelas com uma pinça e coloque-os em uma caixa transparente de laboratório (ver Tabela de materiais) preenchido com 50 mL de 1X PBS e lavá-los por 5 min à temperatura ambiente.
- Pipete 60 µ l de mistura de anticorpo primário [anticorpos primários, diluídos em 1% albumina de soro bovino (BSA) e 0,05% Tween-20 em PBS] no pedaço de laboratório selagem envoltório em câmara úmida. Cuidadosamente coloque as lamelas em cima a mistura de anticorpos com os centríolos directamente em frente da gota. Incube as lamelas para 45 min com anticorpos primários.
Nota: Os anticorpos primários que foram usados para gerar os resultados representativos são coelho Bld12 polyclonal (1: 300) e rato α-tubulina (DM1A) (1: 300). - Remover as lamelas e lavá-los por 5 min em PBS 1x, conforme descrito na etapa 3.3.2.2. Incubar as lamelas para 45 min com anticorpos secundários em PBS contendo 1% de BSA e 0,05% Tween-20.
Nota: Os anticorpos secundários que foram usados para gerar os resultados representativos são de cabra anti-mouse acoplado a Alexa 488 (1:1, 000) e cabra anticoelho acoplado a Alexa 568 (1:1, 000). - Remover as lamelas e lavá-los por 5 min em PBS 1x, conforme descrito na etapa 3.3.2.2.
- Monte as lamelas em uma lâmina de vidro, adicionando 3 µ l de meio de montagem no slide e colocando cuidadosamente as lamelas no topo (centríolos virado para o meio de montagem). Sele as bordas da lamínula com esmalte.
- Os centríolos isolados em um microscópio confocal um 63 X objetivo de óleo com um N.A. de 1.4 da imagem durante a aplicação de deconvolução27 (ver Tabela de materiais).
Nota: Aqui, as configurações a seguir foram utilizadas: 500 – 545 nm para Alexa 488 e 580 – 635 nm para Alexa 568.
- Prepare o material para a mancha da seguinte maneira.
4. concentração de centríolos no centro das lamelas
Nota: Consulte a Figura 3.
-
Preparação de material
- Preparar um tubo de fundo redondo de vidro de 15 mL no gelo, um adaptador de suporte personalizado lamela (chamado adaptador daqui por diante,. STL arquivo fornecido como arquivo suplementar 1), um concentrador personalizado (. STL arquivo fornecido como arquivo complementar 2) e 10 mM K-tubulações (pH 7.2) a 4 ° C.
- Preparar o poli-D-lisina (PDL)-revestido de lamelas. Diluir 10 x a solução-mãe PDL 1 mg/mL com H2O. Primeiro, lave as lamelas com 70% EtOH, remover o etanol e deixe que secar as lamelas. Revestir as lamelas com PDL e incube-os por 30 min à temperatura ambiente. Lave as lamelas 3 x com água e deixe-os secar.
Nota: Revesti as lamelas com PDL para aumentar o número de isolados centríolos anexado para as lamelas.
-
Centrifugação
- Coloque uma lamela de 12mm estéril para o recesso, extremidade inferior do concentrador, mantendo o PDL casaco virado para baixo. Cap a lamela, colocando o adaptador diretamente no topo. Inverter o tubo de fundo redondo e coloque-o sobre o concentrador, lamela e adaptador.
- Suavemente empurre o conjunto com uma pinça até atingir o fundo do tubo de fundo redondo e inverter o tubo. Adicione 10 mM K-tubos de tampão (pH 7,2) para o tubo de fundo redondo, até chegar ao topo do concentrador. Certifique-se de que não subsistem quaisquer bolhas no cilindro central do concentrador.
- Delicadamente, adicionar 100 µ l de tampão de 10 mM K-PIPES (pH 7,2) para uma alíquota contendo fração centriole enriquecido e misture bem o volume.
- Remova o centro oco do concentrador de 100 µ l de tampão de K-tubos de 10 mM (pH 7,2) e adicionar 100 µ l da fração centriolar enriquecida em 10 mM K-tubos de tampão (pH 7,2) para o centro oco do concentrador, cuidando para que o conteúdo permaneça no centro oco.
- Centrifugar a 10.000 x g durante 10 minutos (por exemplo, com um rotor de balde oscilante JS-13.1) em uma centrífuga pre-refrigeração a 4 ° C.
- Remova o concentrador com uma pinça.
- Recuperar a lamela, inserindo um dispositivo artesanal enganchado no orifício presente na extremidade ranhurada do adaptador e levante-a suavemente. Ao atingir o topo do tubo de fundo redondo, prender a borda do adaptador com um dedo com luva e remover a lamela com uma pinça. Tenha cuidado para se lembrar de que lado da lamela contêm centríolos. Proceda para tratar as lamelas para imunofluorescência.
Nota: O dispositivo ligado artesanal pode ser feito com uma agulha de seringa manualmente viciado e moldado para um stick caseiro (Figuras 2B-D). - Execute a fixação e a mancha da imunofluorescência de centríolos concentrados como feito no passo 3.3.2–3.3.4.
5. single-partícula em média
Nota: Consulte a Figura 4.
- Imagem para uma média de único-partícula
- Monte a lamela em um slide usando um meio de montagem de anti-fading regular. Executar a imagem de microscopia (2D SIM) de iluminação estruturada usando um objectivo de TPI Apochromat TIRF (100 X, at 1,49, WD 0.12 mm) e uma parte traseira iluminada câmera CCD EM.
Nota: O tempo de aquisição foi definido como 100 ms com uma câmera de ler fora de 3 MHz. Utilizou-se uma lente X 2,5 para a imagem latente SIM.
Nota: O conjunto de dados aqui apresentado foi adquirido em um microscópio SIM 3-d (ver Tabela de materiais). - Imagem os centríolos adquirindo uma grande pilha de imagens que inclui o centríolo total do sinal, definindo a posição superior e inferior da Z-pilha acima e abaixo o sinal centríolo, respectivamente. Prosseguir para o projeto da pilha e realizar uma média de único-partícula, conforme as etapas 5.2 e 5.3.
- Monte a lamela em um slide usando um meio de montagem de anti-fading regular. Executar a imagem de microscopia (2D SIM) de iluminação estruturada usando um objectivo de TPI Apochromat TIRF (100 X, at 1,49, WD 0.12 mm) e uma parte traseira iluminada câmera CCD EM.
- Projeção de uma pilha
- Abra a pilha de imagem com ImageJ. Em seguida, clique em '→ pilhas de imagem → projeto Z'. Definir o tipo de projeção comoMax intensidade'.
- Inverter a imagem clicando em 'Editar → invertido'. Salvar a projeção que é gerada (formato TIF).
- Alinhamento da único-partícula com primeira
- Crie um novo projeto na primeira pressionando o vermelho 'Criar projeto' botão na parte superior da página. No painel esquerdo, clique duas vezes em 'micrografias de importação importações →'.
- Preencher o 'diretório de arquivos' e 'padrão ' campos de acordo com o diretório de dados e nomes. Manter os parâmetros padrão. Clique em 'Executar'.
- Clique duas vezes em 'Partículas → colheita → xmipp3 - manual de colheita (etapa 1)'. Clique no ícone da lupa, perto do campo de 'Entrada micrografias' e selecione as micrografias importadas da etapa 5.3.1. Clique em 'Executar'.
- Na janela do recém-inaugurado, selecione partículas as micrografias diferentes clicando sobre eles. Quando terminar com todos os Micrografia, clique no botão vermelho '+ coordena'.
- Clique duas vezes em 'Partículas → extrato → xmipp3 - extrato de partículas'. Clique no ícone da lupa, perto do campo de 'Entrada de coordenadas' e selecione as coordenadas escolhidas passo 5.3.4. Encha o 'Tamanho da caixa de partícula (px)' , de acordo com as dimensões de partículas. Na guia 'Preprocess' , defina remoção de poeira: não (pode gerar artefatos); Inverter contraste: nenhum (fundo de partículas pretas, branco); Inversão de fase: N (ligada à correção CTF); Normalizar: Sim.
- Em seguida, clique em 'Executar'. Quando o trabalho estiver terminado, verifique as partículas extraídas selecionando a caixa do trabalho (fronteiras tornam-se mais espessas) e clique em 'resultados de Analyze (canto inferior esquerdo do menu principal).
- Clique duas vezes em '2D → alinhar → xmipp3 - alinhar com cl2d'. Clique no ícone da lupa, perto do campo de 'Partículas de entrada' e selecione as partículas extraídas da etapa 5.3.5. Não use uma imagem de referência. Clique em 'Executar'.
- Clique duas vezes em ' 2D → alinhar → mais → xmipp3 - aplicar alinhamento 2d'. Clique no ícone da lupa, perto do campo de 'Partículas de entrada' e selecione as partículas alinhadas da etapa 5.3.7.
- Clique em 'Executar' , como na etapa 5.3.6. Os resultados podem ser verificados clicando em 'Resultados de Analyze' após a seleção da caixa de trabalho.
- Clique duas vezes em 'Partículas → máscara → xmipp3 - aplicar máscara 2d'.
- Clique no ícone da lupa, perto do campo de 'Partículas de entrada' e selecione as partículas alinhadas da etapa 5.3.9. A "Fonte máscara" é definida como 'Geometria'. Em seguida, defina os parâmetros da máscara como tipo de máscara: Circular; Raio (px): à procura de uma partícula (um centríolo) sem nada ao seu redor, clique sobre o 'varinha mágica ' ícone da esquerda que abre uma janela para ajudar a encontrar o perfeito valor; Centro de turno: N (se a partícula é perfeitamente centralizada) ou Sim (se a partícula é deslocada); O deslocamento X-center: de acordo com a posição da partícula; O deslocamento Y-centro: de acordo com a posição da partícula. Clique em 'Executar'.
- Use o botão ' analisar resultados ' para verificar se a máscara é aplicada corretamente. Se não, botão direito do mouse no trabalho 'Aplicar máscara 2d' e selecione 'Editar'. Modifica os parâmetros da máscara (tamanho e/ou turnos) e executar ele novamente com o "Executar" botão.
- Clique duas vezes em 'classificar → xmipp3 → 2D - cl2d'.
- Clique no ícone da lupa, perto do campo de 'Partículas de entrada' e selecione as partículas mascaradas da etapa 5.3.11. O número de classes deve ser obter aproximadamente 50 partículas por classe. Clique em 'Executar'.
- Verificar os resultados clicando no botão ' analisar resultados ' . Na janela aberta, clique no ícone 'olho' ao lado de "O que mostrar".
- A nova janela permite a inspeção das classes geradas, selecionando 'Classes2D' no menu 'Bloco' . Confira o conteúdo de cada classe, selecionando 'Class00N_Particles' no menu do mesmo. Inspecione cada classe para identificar quais contêm partículas apenas ruins. Voltar para o modo de exibição de 'Classes2D' e selecione as classes com partículas boas clicando em cada um. É possível selecionar várias classes, mantendo a tecla 'Ctrl' pressionada durante a seleção.
- Quando todas as classes com boas partículas foram seleccionadas, clique em '+ partículas' para criar um subconjunto com essas partículas.
- Na mesma janela, selecione alguns conjuntos de classes que representam diferentes orientações das partículas. Crie um novo subconjunto clicando no '+ médias'.
- Para cada orientação/média selecionada, faça o seguinte.
- Clique duas vezes em '2D → alinhar → xmipp3 - alinhar com cl2d'.
- Clique no ícone da lupa, perto do campo de 'Partículas de entrada' e selecione as partículas boas passo 5.3.17. Defina 'Use uma imagem de referência' para 'Sim'. Clique no ícone da lupa, perto do campo 'Imagem de referência' e clique na seta branca esquerda para o trabalho 'Criar subconjunto' da etapa 5.3.18 e selecione a imagem para usá-lo como uma referência. Clique duas vezes em um objeto para abri-lo em uma janela separada e verificar qual objeto é. Clique em 'Executar'.
- Clique duas vezes em ' 2D → alinhar → mais → xmipp3 - aplicar alinhamento 2d'. Clique no ícone da lupa, perto do campo de 'Partículas de entrada' e selecione as partículas alinhadas da etapa 5.3.19.2.
- Clique em 'Executar'.
- Verifique o resultado do alinhamento ('Analisar resultados '); Ele irá mostrar as partículas alinhadas e a média de suas partículas.
- Se a média é boa e as partículas são todos orientadas da mesma forma, salvar a média clicando no ' Advanced → ImageJ' e salvar a imagem com o ImageJ.
- Se a média pode ser melhorada, selecione todas as imagens bem orientadas e criar um subconjunto de novo com o botão '+ partículas' . Reitere as etapas 5.3.19.1–5.3.19.4 até o subconjunto é limpo (todas as más partículas removidas). Cada vez que o alinhamento é feito (passo 5.3.19.2), a referência é definida como a última média gerada (de iteração para a iteração, os aumentos de qualidade média).
Resultados
C. reinhardtii Centriole isolamento:
Para isolar os centríolos, cw15- c. reinhardtii células foram cultivadas em cultura líquida por vários dias sob a luz e posteriormente peletizadas por centrifugação a 600 x g por 10 min. Pelleted células foram lavadas 1x com PBS e ressuspensão em um deflagellation antes da reserva deflagellation, realizando um choque de pH usando 0,5 M de ácido acético a um pH final de 4,5-4,7 por 2 min(Figura 1). Adição de 1 N KOH foi usada para restaurar o pH a 7,0. Para separar flagelos desanexados de corpos celulares, células deflagellated primeiro foram centrifugadas para remover a maior parte os flagelos. O pellet foi então lavei 2x com PBS e resuspended em 30 mL de PBS antes de carregá-lo lentamente sobre uma almofada de 25%-sacarose (Figura 1B). O tubo foi girado a 600 x g durante 15 min a 4 ° C para remover a maior parte os flagelos de moradia. Após a centrifugação, os corpos celulares foram espalhados na almofada da sacarose (Figura 1C) e recuperados, removendo a cerca de 30 mL do sobrenadante (até a seta vermelha na Figura 1C). A resultante de 20 mL de lavado células foram então resuspended em 20 mL de PBS frio e centrifugadas a 600 x g durante 10 minutos. Em seguida, o sobrenadante foi descartado e as células foram completamente resuspended em 10 mL de PBS. As células foram transferidas para um frasco de 250 mL e o tampão de Lise foi adicionado às células ressuspensa de uma vez. DNase foi adicionado para a Lise e incubado durante 1 h a 4 ° C. Após uma etapa de centrifugação para remover os resíduos de célula (ver a pelota branca em Figura 1D), o sobrenadante foi coletado e cuidadosamente carregado em uma almofada de 60%-sacarose 2ml antes da centrifugação a 10.000 x g durante 30 min a 4 ° C. Note que para 100 mL de Lise, 8 tubos de 15 mL foram usados para executar essa etapa, correspondente a 12,5 mL de tampão de Lise carregado em 2 mL de sacarose por tubo. Após a centrifugação, a maior parte do sobrenadante foi removido até 1 mL acima da almofada. A 1 mL de sobrenadante restante foi então coletado com a almofada de 2ml misturado e agrupado para obter um volume final de 24 mL. A piscina foi então carregada em um 40%, 50%, 70%-sacarose gradiente e fiado a 68.320 x g por 1 h e 15 min a 4 ° C. Finalmente, os centríolos isolados foram coletados, fazendo um furo na parte inferior do tubo de centrifugação utilizando uma agulha e as gotas foram coletadas em fracções de 12 x 500 µ l. Devido à alta densidade de sacarose a diferentes, a gota formada muito lentamente no início (70% de sacarose) e, em seguida, mais rapidamente (40% de sacarose).
Imunofluorescência de centríolos isolados
Para avaliar a qualidade do processo de isolamento, 10 µ l de cada fração gradiente coletada foi então centrifugado em uma lamela usando um adaptador de suporte lamela (Fig. 2A-2D). Importante, para remover com segurança a lamela, foi projetado um dispositivo ligado personalizado (Figura 2B). Em seguida, as lamínulas foram analisadas por imunofluorescência. Anticorpos contra CrSAS-6(Bld12p) foram utilizados neste estudo para indicar a presença da estrutura do carrinho e α-tubulina (DMA1) para destacar a parede centriolar. Pela contagem do número de centríolos que foram positivos para CrSAS-6 e α-tubulina por campo de visão e então calcular o número total de centríolos por fracções, foi possível determinar quais frações foram enriquecidas por centríolos isolados ( Figura 2F-2 H). Curiosamente, 6 fracções foram enriquecidas por centríolos (Figura 2F e 2G, fracções #1 – 6), com um pico de fração #3, enquanto as últimas fracções não foram, indicando que a purificação trabalhou. Observe que, neste experimento particular, 95% dos centríolos totais foram positivas para CrSAS-6 e α-tubulina na fração #3. Isto indica que mais isolados centríolos mantiveram suas piruetas. Se não há enriquecimento de centríolos é observado nas primeiras fracções, o procedimento de isolamento não funcionou e deve ser repetido. Note que algumas peças flagelar podem ser observadas principalmente nas fracções desprovido de centríolos.
Em seguida, para calcular o número total de centríolos por µ l, o número de centríolo por campo de visão deve ser multiplicado pela relação tal como apresentado na Figura 2H. Então, o número resultante deve ser dividido pelo volume da fração usado para a imunofluorescência para obter o número de centríolos por µ l. Neste procedimento de isolamento específico, a fração mais enriquecida continha cerca de 37 centríolos para uma área de 0,00846 mm2 (com um campo de visão de 92 x 92 µm2). A superfície da seção de tubo era 7,5 mm de raio, com uma superfície total de 176 mm2. A relação correspondente foi, então, 176/0.00846 = 20,803.8, então um total de 769.740 centríolos (37 x 20, 803.8) em 10 µ l. Portanto, o número de centríolos em 1 µ l foi 76.974.
Concentração de centríolos isolados em lamelas:
Aumento do número de centríolos por campo aumenta a chance de detecção de orientação centriole inequívoca, bem como aumentando a chance de detectar orientações semelhantes que podem ser usadas para mais procedimentos de cálculo da média das partículas. Como centríolos de frações concentradas são ainda esparsos na lamela, desenvolvemos um acessório de centrifugação para concentrar centríolos no meio a lamela(Figura 3)chamado um concentrador. Observe que um arquivo. STL com as medidas precisas para impressão 3D é fornecido com este manuscrito.
Primeiro, uma lamela de 12mm foi montada sobre o concentrador (Figura 3B). O adaptador foi colocado no topo da lamela e o fundo redondo tubo foi invertido e colocado sobre o adaptador montado e concentrador. O fundo redondo tubo foi então suavemente invertido, permitindo assim que o carregamento da amostra (protocolo passo 4.2). Os centríolos então foram centrifugados a 10.000 x g durante 10 minutos a 4 ° C. Depois disso, os centríolos foram submetidos a imunofluorescência e manchados por CrSAS-6/Bld12p e α-tubulina (Figura 3-3E). Importante, sem o concentrador, cerca de 30 centríolos foram vistos por campo de visão (Figura 3C), Considerando que 183 centríolos foram vistos por campo de visão quando o concentrador foi utilizado (Figura 3D-3F). Observe que os centríolos coberto apenas com um disco de 4 mm de diâmetro no meio da lamela. Este resultado demonstra que a etapa de concentração funciona e permite um 6-fold enriquecimento dos centríolos em uma região definida de lamelas, assim facilitando a sua detecção e de imagem.
Único-partícula fluorescente com média de isolados C. reinhardtii centríolos:
Aqui, usando microscopia SIM que pode chegar a uma resolução de cerca de 120 nm, centríolos manchados para monoglutamylated tubulina (GT335, Figura 4), uma modificação de tubulina presente em microtúbulos centriolar, foram imagem24. C. reinhardtii centríolos são cerca de 500 nm longa, sempre em pares e muitas vezes encontrado com associados, recentemente duplicada corpos probasal (referidos como procentrioles, daqui em diante) e estriada microtubule-associadas fibras19. Portanto, esta montagem final foi grande cerca de 1 µm. Por esta razão, a fim de imagem os centríolos em sua totalidade, recomendamos adquirir uma Z-pilha sobre os centríolos isolados.
Aqui, após a aquisição, a imagem final foi gerada através da realização de uma projeção de intensidade máxima usando o ImageJ28 (projeção de imagem/pilhas/Z projeto/máxima intensidade, Figura 4B). De tais imagens, realizou-se uma análise da único-partícula usando software de microscopia cryo-elétron para fazer aulas de centríolos com orientações semelhantes, e em seguida uma média foi realizada. Para isso, a cor da imagem foi primeiro invertida a fim de Visualizar melhor os objetos (Figura 4C). Centríolos foram escolhidos manualmente em uma caixa centralizada sobre cada partícula usando o livremente disponível primeira software29 que integra vários programas de software de microscopia eletrônica, tais como Xmipp3 (Figura 4-D). Observe que o tamanho da caixa deve ser definido pelo usuário. Aqui, caixas de 50 x 50 pixels para um tamanho de pixel de 31.84 nm foram usados. Em seguida, todas as partículas foram extraídos (Figura 4E) e alinhadas usando Xmipp3 (Figura 4-F). Em seguida, foi aplicada uma máscara circular de 12 pixels de raio para isolar cada centríolo do centriolar-par (Figura 4G). As partículas foram classificadas em seguida, usando o Xmipp3, para gerar várias médias. Só classe homogênea médias foram mantidas, significando que as partículas que divergem da classe médias foram excluídas manualmente. Essa etapa foi repetida a fim de gerar uma média de quase perfeita para cada orientação escolhida. Depois de cinco iterações, duas classes de médias foram geradas: uma vista superior de 63 objetos (Figura 4H) e um lado vista de 98 partículas (Figura 4eu) de centríolos monoglutamylated. As dimensões do objeto foram determinadas medindo a distância entre picos do perfil do enredo de intensidade ao longo do sinal de monoglutamylation.
Importante, o comprimento da média da classe de visão lateral é 260 nm, com um diâmetro de 250 nm, comparável ao sinal medido monoglutamylated tubulina que foi mostrado para localizar a uma região de 286 ± 33 nm de comprimento dentro do núcleo do centríolo17.
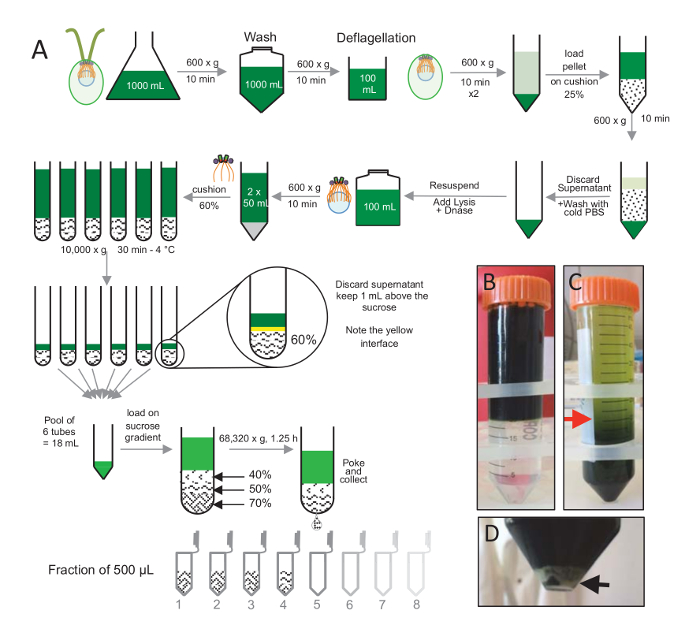
Figura 1 : Purificação de C. reinhardtii centríolos. (A) é uma representação esquemática de cada etapa, levando ao isolamento de c. reinhardtii centríolos. Ele inclui etapas representativas de protocolo (B) antes e (C) após a centrifugação em gradiente de sacarose-25%. A seta vermelha no painel C indica o volume mínimo para manter após a centrifugação. (D), este painel mostra o sedimento branco de lisados células após a centrifugação. A seta preta indica a pelota. Clique aqui para ver uma versão maior desta figura.
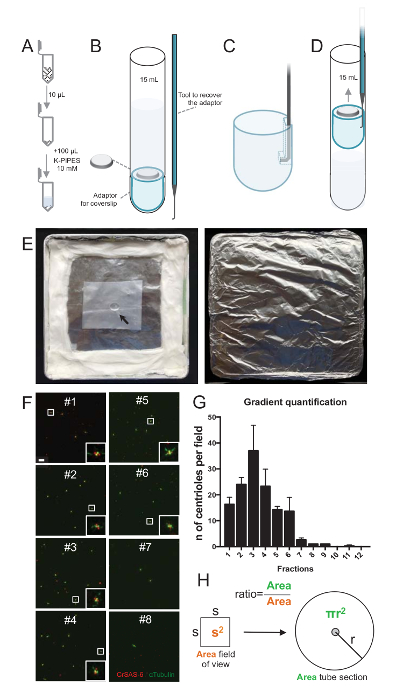
Figura 2 : Configuração de centrifugação para realizar imunofluorescência em isolado centríolos. (A), 10 µ l de cada fração coletada é diluído primeiro em 100 µ l de 10mm K-PIPES (pH 7,2). (B) esta é uma representação esquemática dos dispositivos centrifugação, englobando um tubo de fundo redondo de 15 mL, uma lamela de 12 mm, um adaptador para a lamela e um dispositivo feito por medida enganchado para recuperar a lamela após a centrifugação. Painéis C e D mostram desenhos explicando como recuperar a lamela após a centrifugação. (C) Coloque a ferramenta de gancho no furo presente na extremidade ranhurada do adaptador e (D) Puxe delicadamente. (E) Estas são fotos da câmara úmida, necessárias para realizar a imagem latente de imunofluorescência. A seta indica o sentido do lamela de 12 mm. (F) Estas são imagens confocal representante em 63 X (zoom 2) de fracções gradientes #1-8, coletados durante o processo de purificação e manchado por CrSAS-6 (vermelho) e α-tubulina (verde). As inserções correspondem à região indicado por uma caixa branca nas exibições de baixa ampliação. Barra de escala = 10 µm. (G) este é um gráfico que representa o número de centríolos positivos para CrSAS-6 e α-tubulina por campo de visão em cada fração. Observe o enriquecimento em fracções #1-6. O número médio de centríolos por campo em cada fração: #1 = 16,3 ± 4,7, #2 = 24,0 ± 4,6, #3 = 37,0 ± 17,0, #4 = 23,3 ± 11,4, #5 = 14,3 ± 2,1, #6 = 13,7 ± 9,3, #7 = 2,7 ± 1,2, #8 = 1,0 ± 0,0, #9 = 1,0 ± 0,0, #10 = ± 0.0 0.0, #11 = 0,3 ± 0,6, #12 = ± 0.0 0.0. Para cada fração, 3 campos aleatórios foram fotografados. Observe que, quando contar a fração mais enriquecida #3, encontramos que 95% dos centríolos são positivas para CrSAS-6 e α-tubulina (n = 205 centríolos). (H), A relação entre o número de centríolos presentes na área de medição das micrografias é usada para calcular o número total de centríolos presentes na área do tubo. O número de centríolo por µ l pode ser calculado a partir 10 frações µ l originalmente centrifugado. Clique aqui para ver uma versão maior desta figura.
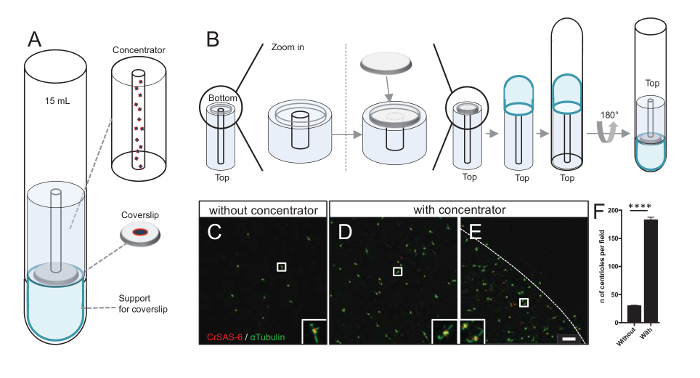
Figura 3 : Centríolos isolados são centrifugados usando concentradores. (A), este painel mostra os dispositivos de centrifugação necessários para concentrar os centríolos em lamelas antes da imunofluorescência, incluindo um tubo de fundo redondo de 15 mL, um concentrador, uma lamela de 12mm e um aparelho de adaptador de suporte. (B), este painel mostra as etapas para montar o dispositivo de centrifugação. Painéis C-E mostram imagens confocal de centríolos manchados por CrSAS-6 (vermelho) e α-tubulina sem (verde) (C) ou (D-E) com o concentrador. As inserções correspondem à região indicado por uma caixa branca nas exibições de baixa ampliação. Barra de escala é de 10 µm. Note que os centríolos estão enriquecidos no meio a lamela (linha pontilhada representa a borda da área concentrada). (F) este gráfico representa o número de centríolos por campo de visão sem e com o concentrador. Foram analisados cinco aleatórios campos de visão. É o número médio de centríolos, sem concentrador, 29,8 ± 2,9 e com o concentrador, 182.6 ± 11,5, P < 0,0001. A significância estatística foi avaliada por um unpaired t-teste. Clique aqui para ver uma versão maior desta figura.
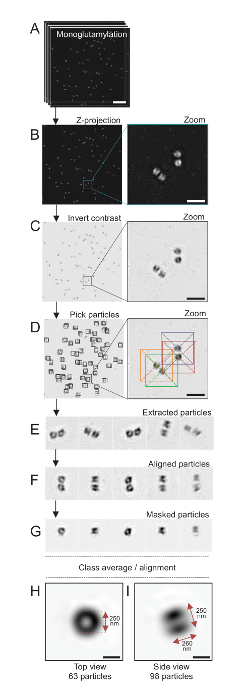
Figura 4 : Único-partícula em média na isolada C. reinhardtii centríolos. (A), este painel mostra Z imagens de pilha de centríolos manchado com GT335 e adquiridos usando um microscópio SIM. (B) estes painéis mostram uma projeção de Z de intensidade máxima das imagens empilhadas. Barra de escala = 1 µm. (C), estes painéis mostram uma imagem representativa com um contraste invertido. O baixo-relevo representa um zoom-in para visualizar melhor os centríolos. (D), partícula de mostrar estes painéis colheita. O baixo-relevo indica como as partículas foram escolhidas. (E) são exemplos de 5 extraído partículas. (F), este painel mostra as partículas após o alinhamento. (G), este painel mostra as partículas depois de aplicar uma máscara. Painéis de H e eu mostram dois classe médias: (H), um top view (63 partículas) e (eu) uma vista lateral (98 partículas). As setas duplas indicam as dimensões do sinal GT335. Barra de escala = 250 nm. Clique aqui para ver uma versão maior desta figura.
Arquivo suplementar 1. Clique aqui para baixar este arquivo.
Arquivo complementar 2. Clique aqui para baixar este arquivo.
Discussão
Um dos desafios em biologia é para decifrar a localização exacta das proteínas no contexto arquitectónico. O centríolo é uma estrutura ideal para aplicar estes métodos, como a sua arquitectura tem sido estudada utilizando tomografia computadorizada do cryo-elétron, revelando características ultra-estruturais interessantes ao longo de seu comprimento. No entanto, devido às suas dimensões próximo do limite de resolução em microscopia óptica, é difícil localizar precisamente uma proteína por imunofluorescência para uma sub-região estrutural do centríolo usando microscópios convencionais30.
A resolução em microscopia óptica é limitada pela difração de luz que dá, aproximadamente, uma lateral resolução máxima de 200 nm em microscopia óptica24. No entanto, esse limite foi contornado por um dos principais avanços dos últimos 20 anos em microscopia óptica: a invenção dos métodos de resolução super. Essas abordagens podem imagem além dos limites de difração em diferentes resoluções: 120 nm para o SIM, cerca de 50 nm para esgotamento de emissão estimulada (STED) e 20-40 nm para localização de único-molécula microscopia (SMLM)24. Com estes novos desenvolvimentos da microscopia de super-resolução, as sub-regiões estruturais do centríolo são atingíveis. No entanto, na prática, é difícil determinar com precisão a localização de uma proteína de um elemento estrutural para a principal razão que os centríolos maduros existem em apenas 2 cópias por célula e tem orientações aleatórias, o que torna a interpretação de localização difícil. Por esta razão, um protocolo foi criado que permite aos investigadores de super-resolução imagem de um grande número de centríolos, aumentando a chance de observar orientações não ambígua. Importante, como esse método se baseia na utilização de centríolos isolados, estamos fornecendo um método para purificar intacto c. reinhardtii centríolos que contêm centríolos maduros e procentrioles.
Finalmente, devido a gama de orientações de centríolo que pode ser fotografada com este protocolo, análise da único-partícula pode ser aplicada usando software de microscopia eletrônica. Isso resulta na geração de classes médias dos centríolos em uma determinada orientação. Importante, essas imagens 2-D resultantes então podem ser usadas para avaliar a localização de uma proteína específica ao longo o centríolo. Na verdade, esse método pode ser aplicado a imagens de super-resolução duplo-cor, e uma cor que pode ser usada para revelar o esqueleto centríolo (por exemplo, tubulina), enquanto a outra cor pode ser atribuído a uma proteína específica centriolar. Subtraindo-se as médias obtidas com uma cor ou duas cores, torna-se mais fácil registrar uma proteína ao longo do centríolo (proximal, central ou distal). Observe que os dois canais devem ser alinhados com precisão para evitar quaisquer interpretações enganosas. Além disso, as médias de pontos de vista superior vão ajudar a decifrar se uma proteína localiza-se no interior do lúmen centriolar, ao longo da parede do microtubule ou fora o centríolo.
Este método tem a vantagem de determinar a localização de proteínas específicas que pode ser difícil de localizar, caso contrário, devido à rotulagem heterogêneos. Observe que outros métodos para mapear as proteínas dentro os centríolos têm sido descritos em correlativo SIM/SMLM 3D com, por exemplo, avaliar as orientações específicas dos centríolos, determinando o perfil elíptico de um marcador, formando um toro em torno da centríolo por imagem SIM. Usando esse parâmetro, é possível localizar a proteína com uma precisão de 4 – 5 nm30. Note também que o método descrito aqui usa centríolos isolados com procentrioles intacta, um sinal de que a arquitetura de centríolo é mais provável em grande parte conservada. No entanto, não podemos excluir que algumas características arquitectónicas são perturbadas durante a purificação, tais como o diâmetro de centríolo variando com a concentração de cátions divalentes como amplificado com o isolamento do centrossoma humano5.
Uma das etapas críticas do protocolo aqui apresentado é a obtenção de centríolos isolados suficientemente concentrados em diferentes orientações passíveis de Fluo-SPA. Para fazer isso, primeiro assegure a pureza e a eficiência do processo de isolamento centríolo. Uma baixa concentração de centríolos isolados impedirá adequada de imagem e processamento de imagem adicional. Para este fim, nós estamos fornecendo um método para enriquecer o número de centríolos por campo de visão. Dependendo do número de centríolos na fração usada, deve ser ajustado o volume carregado no concentrador, com um volume máximo de 250 µ l.
Importante, este método foi desenvolvido por uma parede celular menos células cw15-C. reinhardtii . Este esforço, a fragilidade da parede celular permite uma adequada da lise das células e, assim, a liberação de seu conteúdo. Este protocolo não é eficiente para o selvagem-tipo c. reinhardtii células, como a parede celular impede a Lise adequada. Estratégias alternativas como sonication ou uma pré-incubação das células com autolysin, uma enzima que pode degradar a parede celular31, teria de ser postas em prática para alterar a parede celular antes da aplicação do protocolo de isolamento aqui apresentado.
Esta configuração pode ser usada com diferentes tipos de microscópios, variando de microscópios confocal convencionais para microscópios de super-resolução alto throughput dedicado. Observe que ao fazer SMLM, uma reserva especial é necessária para a imagem latente adequada e, assim, uma câmara adaptada para uma lamela de 12 mm com a reserva em cima da lamela deve ser usada. Imagem latente subsequente será executada com microscópios invertidos. Se a afinação de microscópio não permite uma lamela de 12 mm, o protocolo aqui apresentado pode ser aplicado a lamelas de 18 mm, usando um tubo de fundo redondo de 30 mL e um adaptador modificado e concentrador. Também é importante a nota que a qualidade da reconstrução final em SMLM dependerá da qualidade da coloração e do anticorpo primário usado, bem como o método de fixação.
Em resumo, estamos fornecendo um método que pode ser aplicado a imagem numerosos centríolos seguidos por Fluo-SPA, que irá gerar médias dos centríolos em diferentes orientações, contribuindo assim para localizar a proteína centriolar com precisão. Importante, esse método pode ser aplicado mais geralmente centríolos isolados de outras espécies, para outras organelas ou grandes conjuntos macromoleculares. Finalmente, a abordagem de preparação de amostra aqui apresentada, combinado com o recente desenvolvimento de algoritmo para análise da único-partícula de fluorescente SMLM dados32, poderia abrir mais melhoria na cartografia molecular de grande macromolecular módulos (assemblies).
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a Pierre Gönczy e o BioImaging & plataforma óptica (BIOP) na École Polytechnique Fédérale de Lausanne (EPFL), Lausanne, Suíça, onde as imagens SIM dos centríolos foram adquiridas. Nikolai Klena e Davide Gambarotto são suportados pelo Conselho Europeu de investigação (CEI) Starting Grant (StG) 715289 (sotaque) e Maeva Le Guennec, Paul Guichard e Virginie Hamel por PP00P3_157517 o Swiss National Science Foundation (SNSF). Susanne Borgers é apoiada pela Universidade de Genebra.
Materiais
| Name | Company | Catalog Number | Comments |
| Mouse monoclonal anti-apha tubulin (clone DM1A) | Abcam | ab7291 | dilution 1:300 |
| DNaseI | Roche | 10104159001 | |
| 12 mm coverslips | Roth | YX03.1 | |
| 18 mm coverslips | Roth | LH23.1 | |
| K2HPO4 | Fluka | 60355 | |
| KH2PO4 | Fluka | 60230 | |
| Tris base | Biosolve Chimie SARL | 0020092391BS | |
| acetic acid | Carlo Erba Reagents | 524520 | |
| NH4Cl | Sigma | A-4514 | |
| CaCl2 | Sigma | C-7902 | |
| MgSO4 | Sigma | 63140-500G-F | |
| steritop filter | Millipore | SCGPT05RE | |
| sucrose | Sigma | S7903-1KG | |
| HEPES | AppliChem PanReac | A3724,0250 | |
| PIPES | Sigma | P6757-500G | |
| MgCl2 | ACROS ORGANICS | 197530010 | |
| NP-40 | AppliChem PanReac | A1694,0250 | |
| Round-bottom (Kimble) tubes 15 mL | Fisherscientific | 09-500-34 | |
| Round-bottom (Kimble) tubes 30 mL | Fisherscientific | 09-500-37 | |
| cover glass staining rack | Thomas scientific | 8542E40 | |
| crystal polystyrene transmission lab box | FISHERS | 11712944 | |
| Methanol | VWR | 20864.32 | |
| BSA | Roche | 10735086001 | |
| Triton X100 | Roth | 3051.3 | |
| goat anti-mouse coupled to Alexa 488 | invitrogen | A11029 | dilution 1:1,000 |
| goat anti-rabbit coupled to Alexa 568 | invitrogen | A11036 | dilution 1:1,000 |
| mounting medium | abcam | ab188804 | |
| Tube, thinwall polypropylene | Beckman Coulter | 326823 | |
| Poly-D-Lysine 1 mg/mL | SIGMA | A-003-E | |
| Mouse monoclonal anti-Polyglutamylation modification mAb (GT335) | Adipogen | AG-20B-0020 | dilution 1:1,000 |
| glycerol mounting medium with DAPI and DABCO | Abcam | ab188804 | |
| 50 mL conical tubes | Falcon | 14-432-22 | |
| Eppendorf 5810R centrifuge | Eppendorf | 5811000622 | |
| Beckman JS-13.1 swinging bucket rotor | Beckman Coulter | 346963 | |
| Beckman SW 32Ti rotor | Beckman Coulter | 369694 | |
| parafilm | Bemis | 13-374-10 | |
| Leica TCS SP8 with Hyvolution mode | Leica | ||
| OSRAM L18W/954 LUMILUX | Luxe Daylight/ OSRAM | ||
| Whatman filter paper | Sigma | WHA1001325 | |
| CrSAS-6/Bld12 antibody | dilution 1:300 (Hamel el al., 2014) | ||
| Scipion | http://scipion.i2pc.es/ | ||
| EM CCD camera (Andor iXON DU897) | Andor |
Referências
- Bornens, M. The centrosome in cells and organisms. Science. 335 (6067), 422-426 (2012).
- Nigg, E. A., Holland, A. J. Once and only once: mechanisms of centriole duplication and their deregulation in disease. Nature Reviews Molecular Cell Biology. 19 (5), 297-312 (2018).
- Nigg, E. A., Raff, J. W. Centrioles, centrosomes, and cilia in health and disease. Cell. 139 (4), 663-678 (2009).
- Gönczy, P. Towards a molecular architecture of centriole assembly. Nature Reviews Molecular Cell Biology. 13 (7), 425-435 (2012).
- Paintrand, M., Moudjou, M., Delacroix, H., Bornens, M. Centrosome organization and centriole architecture: their sensitivity to divalent cations. Journal of Structural Biology. 108 (2), 107-128 (1992).
- Winey, M., O'Toole, E. Centriole structure. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Dippell, R. V. The development of basal bodies in paramecium. Proceedings of the National Academy of Sciences of the United States of America. 61 (2), 461 (1968).
- Allen, R. D. The morphogenesis of basal bodies and accessory structures of the cortex of the ciliated protozoan Tetrahymena pyriformis. The Journal of Cell Biology. 40 (3), 716-733 (1969).
- Li, S., Fernandez, J. -. J., Marshall, W. F., Agard, D. A. Three-dimensional structure of basal body triplet revealed by electron cryo-tomography. The EMBO Journal. 31 (3), 552-562 (2012).
- Guichard, P., Chrétien, D., Marco, S., Tassin, A. -. M. Procentriole assembly revealed by cryo-electron tomography. The EMBO Journal. 29 (9), 1565-1572 (2010).
- Guichard, P., et al. Native architecture of the centriole proximal region reveals features underlying its 9-fold radial symmetry. Current Biology. 23 (17), 1620-1628 (2013).
- Hirono, M. Cartwheel assembly. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Bornens, M., Paintrand, M., Berges, J., Marty, M. C., Karsenti, E. Structural and chemical characterization of isolated centrosomes. Cell Motility and the Cytoskeleton. 8 (3), 238-249 (1987).
- Keller, L. C., Romijn, E. P., Zamora, I., Yates, J. R., Marshall, W. F. Proteomic analysis of isolated chlamydomonas centrioles reveals orthologs of ciliary-disease genes. Current Biology. 15 (12), 1090-1098 (2005).
- Kilburn, C. L., et al. New Tetrahymena basal body protein components identify basal body domain structure. The Journal of Cell Biology. 178 (6), 905-912 (2007).
- Bauer, M., Cubizolles, F., Schmidt, A., Nigg, E. A Quantitative analysis of human centrosome architecture by targeted proteomics and fluorescence imaging. The EMBO Journal. 35 (19), 1-15 (2016).
- Hamel, V., et al. Identification of Chlamydomonas Central Core Centriolar Proteins Reveals a Role for Human WDR90 in Ciliogenesis. Current Biology. 27 (16), 2486-2498 (2017).
- Cavalier-Smith, T. basal body and flagellar development during the vegetative cell cycle and the sexual cycle of Chlamydomonas reinhardii. Journal of Cell Science. 16 (3), 529 (1974).
- Geimer, S., Melkonian, M. The ultrastructure of the Chlamydomonas reinhardtii basal apparatus: identification of an early marker of radial asymmetry inherent in the basal body. Journal of Cell Science. 117, 2663-2674 (2004).
- Nakazawa, Y., Hiraki, M., Kamiya, R., Hirono, M. SAS-6 is a cartwheel protein that establishes the 9-fold symmetry of the centriole. Current Biology. 17 (24), 2169-2174 (2007).
- Hamel, V., et al. Correlative multicolor 3D SIM and STORM microscopy. Biomedical Optics Express. 5 (10), 3326 (2014).
- Guichard, P., et al. Cell-free reconstitution reveals centriole cartwheel assembly mechanisms. Nature Communications. 8, 14813 (2017).
- Hiraki, M., Nakazawa, Y., Kamiya, R., Hirono, M. Bld10p constitutes the cartwheel-spoke tip and stabilizes the 9-fold symmetry of the centriole. Current Biology. 17 (20), 1778-1783 (2007).
- Sahl, S. J., Hell, S. W., Jakobs, S. Fluorescence nanoscopy in cell biology. Nature Reviews Molecular Cell Biology. 18 (11), 685-701 (2017).
- Hutner, S. H., Provasoli, L., Schatz, A., Haskins, C. P. Some Approaches to the Study of the Role of Metals in the Metabolism of Microorganisms. Proceedings of the American Philosophical Society. 94 (2), 152-170 (1950).
- Keller, L. C., Marshall, W. F. Isolation and proteomic analysis of chlamydomonas centrioles. Methods in Molecular Biology. 432 (1), 289-300 (2008).
- Borlinghaus, R. T., Kappel, C. HyVolution-the smart path to confocal super-resolution. Nature Methods. 13 (3), (2016).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- de la Rosa-Trevín, J. M., et al. Scipion: A software framework toward integration, reproducibility and validation in 3D electron microscopy. Journal of Structural Biology. 195 (1), 93-99 (2016).
- Gartenmann, L., et al. A combined 3D-SIM/SMLM approach allows centriole proteins to be localized with a precision of ∼4-5 nm. Current Biology. 27 (19), 1054-1055 (2017).
- Jaenicke, L., Kuhne, W., Spessert, R., Wahle, U., Waffenschmidt, S. Cell-wall lytic enzymes (autolysins) of Chlamydomonas reinhardtii are (hydroxy)proline-specific proteases. European Journal of Biochemistry. 170 (1-2), 485-491 (1987).
- Salas, D., et al. Angular reconstitution-based 3D reconstructions of nanomolecular structures from superresolution light-microscopy images. Proceedings of the National Academy of Sciences of the United States of America. 114 (35), 9273-9278 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados